진료현장에서 정밀의료의 적용
Applying Precision Medicine in Clinical Practice
Article information
Trans Abstract
Precision medicine is the modern era version of “personalized medicine”, which integrates data from genomics and clinical information to optimize the care delivered to patients. As next generation sequencing (NGS) revolutionized the speed and cost of genomic sequencing, precision medicine entered clinical practice in 2017 via the national reimbursement of oncology and rare diseases. In parallel, the digitalization of clinical data through electronic health recording (EHR) and hospital information systems has allowed data collection and analysis. This has led to the integration of biomarkers and clinical records, which have introduced precision medicine into clinical practice. Today, many countries and medical institutes are endeavoring to create systems that will enable precision medicine to be applied to clinical practice. These data systems will benefit the patient by providing accurate data based on his/her characteristics rather than the conventional approach of using “average data”. Internal medicine will transform into a data-driven science that enables physicians to translate molecular biomarkers and big data analysis into improved clinical care.
서 론
정밀의료(precision medicine)는 이전에 맞춤치료(personalized medicine)와 동등한 의미로 사용되었던 개념이다. 최근 들어 정밀의료는 암환자의 유전자 변이에 맞는 적절한 표적치료제를 찾아 치료하는 “유전자 맞춤치료”를 지칭하는 개념으로 쓰이고 있다. 하지만 큰 개념에서는 질환과 관련된 유전자정보 뿐 아니라 영상정보를 포함한 다양한 임상정보, 사물 인터넷(Internet of things) 등으로 수집된 환자 보고 성과(patient reported outcomes)를 아우르는 다면적 정보를 조합하여 최적의 치료를 제공하는 것을 말한다.
본 론
정밀의료와 맞춤치료는 그간 용어가 혼용되어 사용되었다. 하지만 정밀의료와 맞춤치료는 데이터의 소스에서 가장 큰 차이를 보인다. 맞춤치료는 유전체와 임상정보를 활용하여 1명의 개인을 대상으로 하지만, 정밀의료는 다양한 오믹스 정보, 생활습관 및 외부 환경정보를 정량화 하여 데이터 기반의 객관적이고 재현가능한 방식으로 1명 또는 그 이상을 대상으로 의료를 제공하는 것이다. 정밀의료는 질병 진단 및 치료를 넘어서 질병 재분류 및 새로운 질병 구분으로 한 개인이 아닌 환자 집단을 대상으로 할 수 있다는 점에서 패러다임 변화를 이끌고 있다[1].
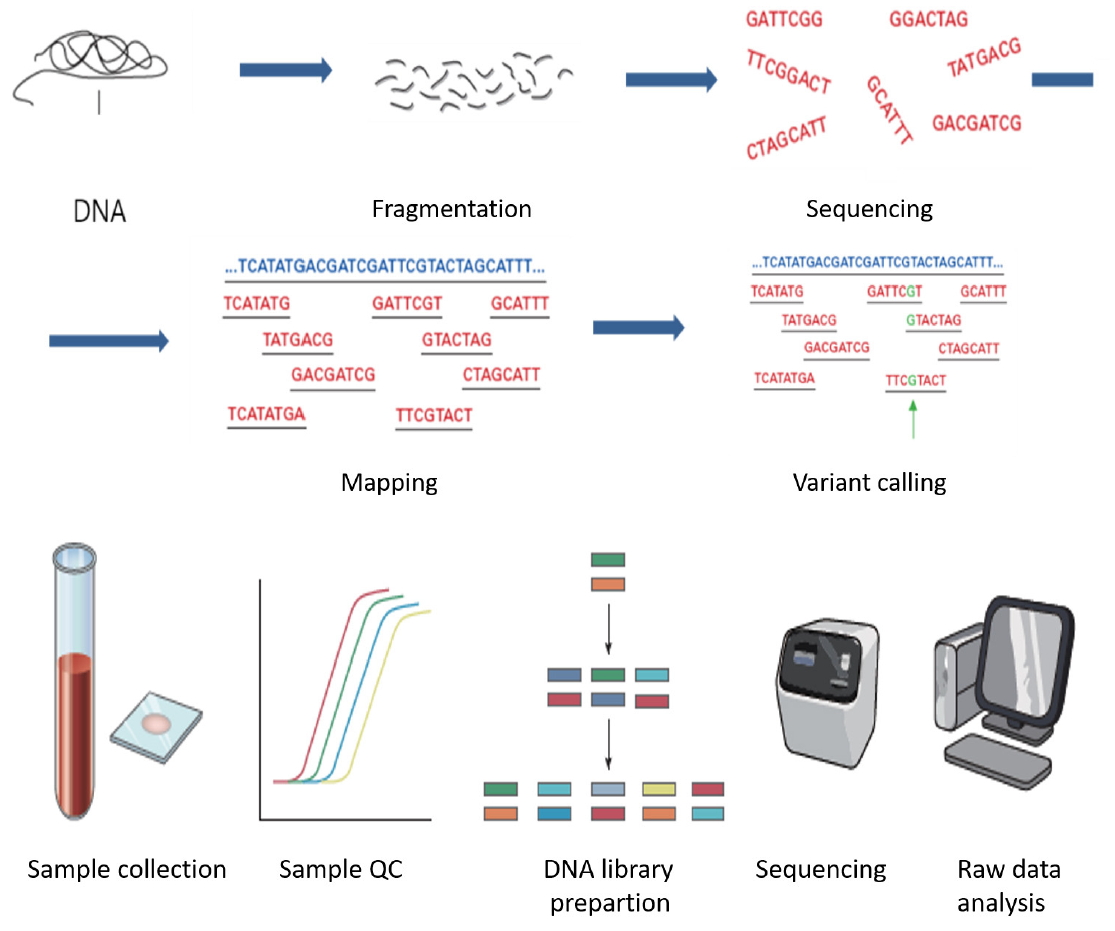
현재 정밀의료 분야에 있어서 빠질 수 없는 분야가 차세대 염기서열 분석(next generation sequencing, NGS) 유전자 검사이다[2]. NGS 유전자 검사는 차세대 유전자 검사기법으로 많은 시간과 비용이 소요되던 기존의 단일 유전자 검사와 달리 병렬분석을 통해 1회의 검사로 수십-수백개의 유전자를 하나의 패널로 구성하여 검사에 걸리는 시간과 비용을 획기적으로 줄인 기법이다. 기존의 직접 염기서열 분석법(direct sequencing)은 분석하고자 하는 부위를 polymerase chain reaction을 통해 증폭해야 하기 때문에 여러 타겟을 분석할 경우, 많은 시간과 노력 및 비용이 소요되어 효율성이 낮은 문제점이 있었다. 이러한 단점을 극복하고자 NGS법이 개발되었으며, 이것은 DNA 가닥을 각각 하나씩 분석하는 방식으로 기존의 직접 염기서열 분석법에 비해 여러 개의 유전자를 매우 빠르고 저렴하게 분석이 가능하다(Fig. 1). 실제 현재 진료에서는 250개의 유전자를 분석하는 데 이전에는 수개월 소요되던 분석이 2-4주로 단축되어 환자의 치료를 결정하는데 도움된다.
실제 NGS 유전자 패널 검사를 진행하는 병원이나 검사기관에서는 1) DNA를 일정한 조각(fragment)으로 분절화하고, 2) 장비가 인식할 수 있는 특정 염기서열을 가진 올리고뉴클 레오티드(oligonucleotide)를 붙여주는 라이브러리(library) 제작, 3) 각 라이브러리 DNA 가닥의 염기서열을 장비에서 읽는 단계, 4) 장비에서 생성된 데이터를 가공하여 알고리즘으로 분석하는 단계로 검사를 수행한다. 이렇게 도출된 NGS 결과는 진료현장에서 다양한 임상정보와 연계되어 환자의 치료제 선택에 유용한 정보로 제공되고, 이는 정밀의료의 청사진으로 자리 잡고 있다.
1990년에 시작하였던 ‘휴먼게놈프로젝트’에서 1명의 인간 유전자 분석에 13년의 시간과 약 4조원의 비용이 들었다. 하지만 오늘날 NGS 유전자 검사기법의 발전으로 인해 1명의 유전자 분석은 수주 정도의 시간과 1백만 원 정도의 비용으로 가능하게 되었다. 이처럼 낮아진 검사비용으로 인해 유전체 정보의 의료 분야 적용이 현실화되었고, 세계 여러 나라에서는 암환자의 유전체 데이터 분석을 지원하고 빅데이터를 구축하기 위해 많은 노력을 쏟고 있다[3,4]. 미국에서는 USA Precision Medicine Initiative를 발표하며 연간 약 2,500억원을 지원하여 100만 명의 유전체 데이터를 확보하고 있다. 또한 프랑스에서는 22만 명, 영국과 일본도 각각 10만 명의 유전체를 분석하는 국가주도의 프로젝트를 추진하고 있다. 주요 선진국, 글로벌 제약사 역시도 유전자 분석 데이터를 취합하는 프로젝트가 추진되고 있으며 대상 질환 또한 암, 희귀 질환을 비롯하여 심혈관 질환, 치매, 뇌졸중, 당뇨 등 다양한 영역으로 확대되고 있다.
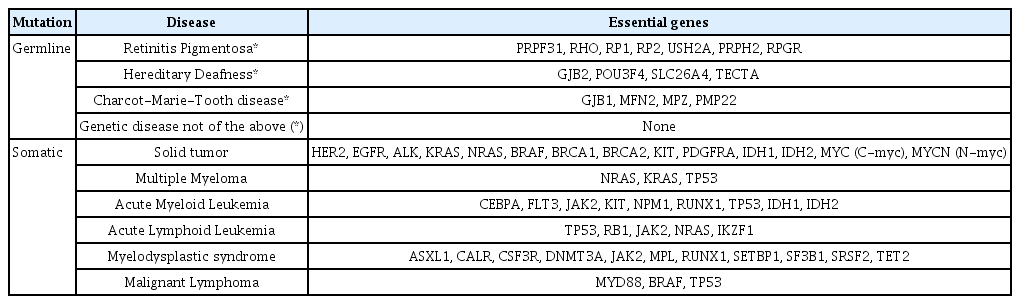
우리나라도 유전자 검사의 제도적 지원을 위해 많은 노력을 하고 있다[5]. 대한민국 정부는 2015년도 국가생명윤리심의위원회를 시작으로 2016년에는 제4차 규제개혁장관회의 ' 바이오헬스산업규제개혁 및 활성화 방안' 발표 및 '신의료기술평가 원스탑 서비스' 시범사업을 통해서 신의료기술평가 절차를 간소화, 신속화하였다. 이러한 제도적 지원을 통해 NGS는 임상현장에 빠르게 진입할 수 있었다. 이후 2016년 6월에는 식품의약안전처에서는 생명윤리 및 안전에 관한 법률을 통해 ‘NGS 임상검사실 인증 지침’을 마련해서 민간 유전자 검사업체의 유전자 검사 허용을 허용하였으며, 2017년 3월부터 암 및 희귀 질환을 시작으로 NGS 유전자 검사의 국민건강보험을 적용하였다(Table 1). 이후 2019년 5월부터는 대상 질환은 10개 주요암에서 전체 고형암으로 확대되었다.
이러한 국가정책에 발 맞추어 의료기관 내에서도 NGS를 처방하는 진료과와 검사를 실제로 수행하는 검사 부서, 진료과와 검사과를 돕는 행정 및 전산 지원 부서가 협업하여 NGS 유전자 검사의 진료 적용이 가능해졌다. NGS가 성공적으로 임상에 정착된 현재 의료기관이 당면한 과제는 1) 어떻게 하면 유전체 빅데이터와 임상정보를 효과적으로 결합하여 활용할 것인지와 2) 각각의 유전자 변이에 효과적인 치료제를 어떻게 하면 효율적으로 찾을 수 있을 지로 수렴되고 있다. 정밀의료의 궁극적 목표가 환자 개개인에게 맞는 최적의 치료를 제시하는 것임을 상기할 때, 환자의 임상정보, 유전자정보 등 다양한 정보를 통합, 분석 및 시각화 하여 환자 및 의료진에게 제공하여 최적의 치료방법을 모색하는 것이야 말로 정밀의료의 로드맵이라고 하겠다. 이러한 다차원 정보를 통합하기 위한 노력의 일환으로 2020년 9월 보건복지부는 민간 병원 중심의 보건의료 데이터 중심 병원을 선정하였다. 선정된 데이터 중심 병원을 통해 보건의료 데이터 전주기(수집→축적→개방→활용)에 걸친 선순환적 생태계가 구축된다면, 데이터 중심 병원이 민간분야의 빅데이터 플랫폼이 되고 중장기적으로 산·학·연·병이 연계되는 데이터 클러스터로 발전할 수 있을 것으로 기대하고 있다. 이러한 보건의료 데이터 통합의 노력은 환자 중심의 빅데이터 플랫폼 기틀을 마련하여 집적된 환자 데이터에 기반한 혁신적 정밀의료가 오늘의 진료실에서 구현되는 마중물이 될 것이다.
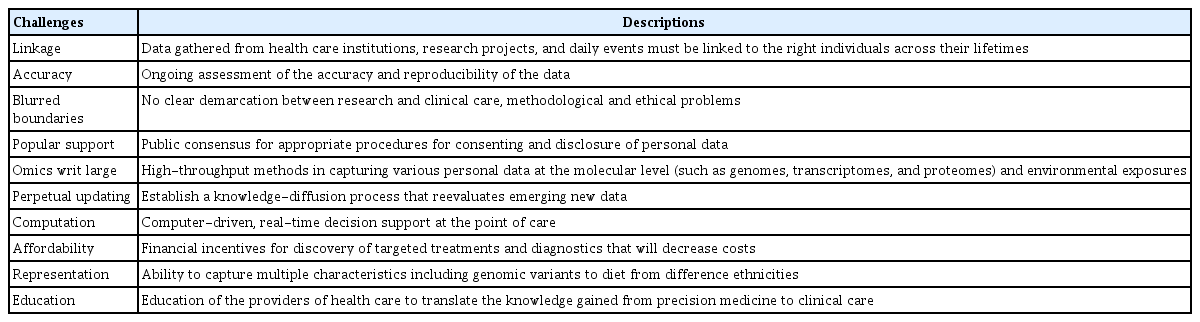
하버드 의과대학의 Isaac S. Kohane 교수[6]에 따르면 정밀의료 실현을 위해 임상과 공공보건의료 실무에 표 2와 같은 10가지 도전과제를 제시하였다. 각 요소들 중에는 데이터의 정확성, 컴퓨터 기반 실시간 의사결정 지원체계, 데이터들 간의 연계성 등과 같이 기술적으로 극복해야 하는 과제들도 있지만, 대부분이 사회적, 정치적, 경제적, 규범적 성질을 가지는 난이도가 상당히 높은 과제들이다. 정밀의료 실현을 위해서는 국가 및 사회적으로 개인정보의 제공과 수집에 대한 문화와 규범에 대한 변화가 필요하며 각각의 정보를 연계하여 정보와 지식으로 변화시키기 위해서는 개인정보에 대한 제3자의 접근, 공유, 처리 재사용 등에 대한 가이드라인이 필수적이라 할 수 있다. 의료기관 단위 내에서는 데이터의 정확성, 데이터 간의 연계성, 컴퓨터 기반 실시간 의사결정 지원체계를 지원하는 데이터 플랫폼의 구축과 건강관련 데이터의 체계적 포괄적 확보, 대표성을 가질 수 있도록 하는 충분한 규모의 대형 코호트 구축, 지속적인 업데이트 체계 구축이 필수적이다.
1996년 미국에서는 Health Insurance Portability and Accountability Act (HIPAA) 즉, 의료관련 행정 및 금융자료의 전자교환을 표준화하는 법률을 제정하였다. 이를 통해 규율면제하여 누구나 자유롭게 이용 및 제공할 수 있는 비식별화된 의료정보(de-identified health information)를 규정하고 보건의료 데이터 기반으로 신약개발 및 정밀의료 실현의 틀을 마련하였다. 우리나라는 2020년 9월 보건의료 데이터의 안전한 활용을 위한 가이드라인을 만들어서 공개하였다. 여기서 보건의료 데이터는 개인정보 처리 기본원칙을 따르되 가이드라인에서 제시하고 있는 방법 및 절차를 준수하여 가명 처리를 진행해야 한다. 의료기관에서는 개인정보처리자가 보건의료 데이터를 가명 처리하여 활용하고자 하는 경우, 그 목적과 적절한 가명 처리 방법, 처리 환경에 대해 데이터 심의위원회 승인을 받아야 한다. 이런 틀이 마련되어 보건의료 빅데이터의 틀을 마련하였다[7]. 보건의료 빅데이터는 신약 개발, 공공의료, 희귀 질환에 대한 연구 등 사용할 수 있는 곳은 무궁무진하다. 하지만 정밀의료를 통해서 보건의료 빅데이터는 정보를 제공하는 주체인 환자에게 맞춤으로 정보를 제공할 수 있어 환자 개별 특성에 맞는 의료를 실현할 수 있다. 이를 위해서는 환자를 중심으로 집적된 서로 다른 자료들을 통합하고 연계하는 구조화 작업이 필요하다.
결 론
국내외 의료기관들은 다양한 방식으로 빅데이터 분석 플랫폼을 구축하여 개인의 진료 및 유전정보 등 데이터를 분석하여 각 환자에게 맞는 정밀의료를 위해 정보를 유기적으로 연결, 통합하고 있다[8,9]. 앞으로 내과의사들은 빅데이터를 진료에 접목할 수 있도록 지속적인 교육이 필요하다. 인공지능, 기계학습 등이 발전함에 따라 내과의사들도 데이터사이언스(data science)에 대한 교육이 강화되어야 한다[10]. 앞으로의 내과학은 “평균적인 환자”에 대한 진료에서 “데이터 중심의 정밀의료”로 옮겨가게 될 것이다. 따라서 “평균적인 환자”가 아닌 오늘의 진료실에서 만난 “이 환자”에게 맞는 최적의 치료방법은 환자개인의 유전체 정보, 환경적 요인, 생활 습관 등이 통합, 분석, 처리된 후 도출되어야 할 것이다.