췌장암 환자의 보조요법의 항암 치료제 결정을 위한 접근
Selection of Optimal Adjuvant Chemotherapeutic Agents for Pancreatic Cancer Treatment
Article information
Trans Abstract
Pancreatic cancer generally has a dismal prognosis, with a 5-year overall survival rate of approximately 10%. At present, surgical resection is the only treatment with a curative aim; however, it is applicable to only 15–20% patients with pancreatic cancer at the time of diagnosis and the median survival following treatment with surgery alone is only 11–20 months. Many trials have shown that adjuvant chemotherapy offers improved outcomes over observation following surgical resection. Recently, modified folinic acid–fluorouracil–irinotecan–oxaliplatin (FOLFIRINOX) treatment following surgical resection in patients with good performance status has shown an impressive 9-month increase in disease-free survival. However, patients included in the study were selected based on a narrow set of criteria, and adverse events during adjuvant chemotherapy remain a limitation. In this article, we review some key trials of adjuvant chemotherapy treatment for pancreatic cancer and discuss future perspectives including neoadjuvant treatment approaches.
서 론
췌장암은 전체 고형암 중 가장 좋지 못한 예후를 보인다. 수술적 절제가 근치를 위한 유일한 방법이나, 췌장암 진단 시 수술적 절제가 가능한 환자가 전체 환자의 10-20%에 불과하며 수술적 치료를 받은 환자들도 5년 생존율이 약 10% 정도로 그 예후가 극히 좋지 못하다[1]. 이를 향상시키고자 보조요법의 항암 치료 또는 방사선 치료가 시도되어 왔다. 그러나 이러한 보조요법의 항암 치료를 시도하더라도 2년 이내 69-75%의 환자들이 재발하게 된다[2]. 따라서 현재까지의 췌장암의 보조 항암 치료의 주목적은 근치를 위한 것도 있으나 무질병 진행 기간의 연장을 통한 생존 기간의 연장이 더 큰 목적이 된다. 췌장암의 수술 후 보조 항암 치료에 대한 접근에 대해 살펴보고자 한다.
본 론
증례
65세 남자 환자로 고혈압/당뇨로 약제 복용 중이었으며 최근 6개월 사이 6 kg의 체중 감소와 복통이 있어 시행한 복부 CT 검사에서 췌장 중간에 3 cm 크기의 종괴가 발견되었다. 영상 검사에서 다른 장기나 주위 림프절 등의 전이는 없었고 상장간막동맥이나 복강동맥 등의 침범은 없었다. 내시경 초음파 검사에서 3 cm 크기의 hypoechoic mass가 있었고 세침 흡입 검사를 통해 췌장의 선암으로 확인되었다. 완전 절제 가능한 병기로 판단되어 근치적 목적의 절제 수술을 시행하였으며 pT2N1의 Stage 2B병기로 확인되었고, 근치적 R0 절제가 된 것으로 확인되었다. 수술 후 6주 경과된 시점에서 현재 전신 상태는 ECOG Performance Status가 1 정도로 비교적 양호하였으나 식욕저하 등의 증상은 남아 있었다. 환자는 수술 이후 보조요법의 항암 치료 상담을 위해 내원하였다. 수술 이후 CA 19-9 level은 정상 범위였으며 수술 후 6주째 시행한 복부 영상 검사에서 재발의 소견은 관찰되지 않았다. 환자는 간/신장 기능은 정상 범위이고 부작용을 감안하더라도 가장 효과적인 항암 치료를 원한다. 다만 회복을 위해 1-2주정도의 보조요법 항암 치료의 시작 지연을 원하고 있다.
췌장암의 보조요법의 역할
수술 후 보조요법의 항암 치료는 미세 잔존암을 없앰으로써 재발을 억제하고 궁극적으로 완치율을 높여 전체 생존 기간의 향상을 목적으로 한다. 췌장암은 아직까지 조기 진단이 가능하지 않은 암종으로 효과적인 수술적 절제를 받게 되더라도 수술적 치료만 받았을 때의 평균적인 기대 여명은 11-20개월 사이에 불과하다[3,4]. 60세 이상의 비교적 고령에서 발생하는 환자가 80%에 이르고, 호발 연령이 70-74세인 부분 역시 좋지 못한 예후에 영향을 미친다[5]. 또한 췌장암 수술 이후 환자의 전신 상태 회복이 오래 걸리거나 수술 후 췌장의 외분비 및 내분비 기능 부전 등으로 인하여 완전히 회복되지 못하여 보조 항암요법의 적용이 쉽지 않은 경우도 많다. 그럼에도 췌장암 수술 이후 환자의 치료 성적 향상을 위하여 전신 상태가 항암 치료를 견딜 수 있는 환자들을 대상으로 많은 약제들이 보조요법의 항암 치료로 시도되어 일부는 그 효과가 입증되었다. 이러한 보조요법의 항암 치료 약제 연구는 전이성 췌장암에서 효과를 보인 약제들을 이용하여 진행되어 왔다.
췌장암의 보조요법 임상 연구
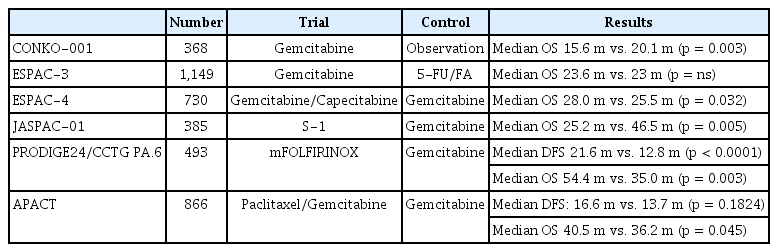
1990년대 Fluoropyrimidine 계열의 약제를 이용한 여러 연구에서 무질병 생존율 및 전체 생존 기간의 연장을 보였다. 대표적인 연구가 European Study Group for Pancreatic Cancer (ESPAC)-1 연구로 5-FU를 투여한 군에서 20.1개월의 전체 생존 기간을 보여 대조군보다 약 4.6개월 정도의 전체 생존 기간 연장을 보였다[4]. CONKO-01 연구는 수술 이후 Gemcitabine으로 치료한 군에서 대조군에 비해 유의한 무질병 생존 기간의 연장을 보였다[3]. 이후 2009년 발표된 ESPAC-3 연구에서 5-FU, leucovorin 투여와 Gemcitabine 투여를 비교하였는데 23.0개월과 23.6개월로 전체 생존 기간에서의 차이는 없었으나 안정성 면에서는 Gemcitabine이 우월한 결과를 보여주었다. 이후 진행된 ESPAC-4 3상 연구는 수술적 절제를 받은 췌장암 환자에서 Gemcitabine/Capecitabine 병합 치료와 Capecitabine 단독 치료로 진행되었으며, 병합요법에서 28.0개월, 단독요법에서 25.5개월로 전체 생존 기간을 개선하는 결과를 보였다.
일본에서 진행된 다기관, 공개로 진행된 JASPAC 01 연구는 Gemcitabine 항암제의 6주기 투여와 S-1 약제의 6주 간격으로 4주기 동안 투여하여 효능을 비교한 연구이다. 이 연구는 비열등성 연구로 디자인되었는데, 그 결과 S-1 치료가 Gemcitabine에 비해 열등하지 않음이 중간 분석에서의 조기 중단 기준을 충족하여 조기 중단되었다. 이 결과를 토대로 Gemcitabine의 독성이 우려될 정도의 환자에게서는 S-1 치료 역시 하나의 대안이 될 수 있으나 현재 우리나라에서는 수술 후 보조요법으로서는 사용이 불가능하다.
가장 최근에 생존 기간의 연장이 입증된 연구는 PRODIGE 24/CCTG PA.6이다[6]. PRODIGE 4/ACCORD 11 연구[7]를 통하여 전이성 췌장암 환자를 대상으로 기존의 Gemcitabine 대비 생존 기간의 연장이 입증된 mFOLFIRINOX의 효과를 수술적 절제 이후의 보조요법으로 투여하여 효과를 확인한 연구이다. PRODIGE 24/CCTG PA.6 연구 결과 mFOLFIRINOX 보조 항암 화학 치료가 Gemcitabine 단독요법에 비해 9개월의 무질병 생존 기간의 연장을 입증하였다. 이 연구는 절제술을 받은 췌장암 환자를 대상으로 mFOLFIRINOX와 Gemcitabine을 무작위 배정하여 6개월간 치료 후 1차 평가변수로 무질병 생존율을 평가한 연구이다. 이 연구에서는 수술 이후의 CA 19-9 가 180 U/mL가 넘는 환자는 제외되었고, ECOG 전신 활동도가 0-1에 해당되는 전신 상태가 좋은 환자만을 대상으로 하였다. 수술 이후 12주 이내에 무작위 배정을 받은 환자493명이 대상으로 mFOLFIRINOX 투여군의 무질병 생존 기간 중앙값은 21.6개월로 재발 위험을 42% 감소시켰고, 전체 생존 기간 중앙값은 54.4개월로 표준 치료군에 비해 36% 감소시기는 것으로 보고되었다. 다만 Grade 3 이상의 중증 이상 반응은 mFOLFIRINOX 군에서 75.9%로 Gemcitabine으로 치료받은 환자들의 이상반응 발생률인 52.9%에 비해 유의하게 높았다. 이러한 중등도 이상의 부작용은 비교적 조절이 되는 경우가 많았으나 그럼에도 계획된 6개월의 치료를 끝까지 받은 환자가 mFOLFIRINOX로 치료받은 환자군에서 66.4%에 그쳐 Gemcitabine으로 치료받은 환자들 79%가 치료를 완료한 것과 차이를 보였다. mFOLFIRINOX 치료군에서는 부작용 등으로 인하여 30% 이상의 항암 용량 감량을 받은 환자들이 절반 이상이었다. 고령인 70세 이상의 환자 101명을 따로 분석하였을 때는 mFOLFIRINOX가 Gemcitabine에 비해 무질병 생존 기간의 우월성을 입증하지는 못하였다[8]. 따라서 mFOLFIRINOX 요법은 현 시점에서 수술 이후 CA 19-9 level 이 매우 높지 않고 전신 상태가 좋은 환자를 대상으로 가장 효과적인 치료제라고 할 수 있으나 약제 부작용이 상당한 치료로 볼 수 있다.
전이성 췌장암에서 1차 요법으로 사용되고 있는 Gemcitabine/Nab-paclitaxel 병합요법을 수술적 절제를 받은 췌장암 환자에서 Gemcitabine 단독요법과의 비교를 시도한 APACT 연구에서는 연구의 1차 endpoint인 무질병 생존율을 입증하지 못하였다[9]. 2차 endpoint인 전체 생존 기간에서는 추적관찰이 필요하나, Gemcitabine/nab-Paclitaxel 병합요법에서 약간의 우월함을 보였다. 그러나 현 시점에서 1차 endpoint 달성에 실패한 약제를 실제 임상에서 바로 적용하기는 쉽지 않을 것으로 보이고 대부분의 권고안에서 제시하지 않고 있다.
이러한 치료 성적 향상을 보고하였음에도 여전히 70% 이상의 환자가 수술 이후 2년 이내 재발을 보인다[6]. 이러한 높은 재발율과 재발 이후 극히 좋지 못한 예후 등으로 인하, 일반적으로 췌장 절제술을 받은 항암 치료의 금기가 되지 않는 전신 상태가 적절한 췌장암 환자들에게 병기에 관계없이 6개월 기간의 보조요법의 항암 치료를 권유하게 된다. 미국임상종양학회는 2019년 췌장암의 치료 권고안을 통해 수술받은 모든 병기의 췌장암 환자는 절제 이후 항암 치료의 금기가 되지 않는 한 6개월간의 보조 항암 치료를 권유하고 있다[10]. 서술한 비교적 큰 규모의 췌장암의 보조 항암 치료에 대한 내용은 표 1에 정리되어 있다.
절제 가능한 췌장암의 선행 항암 치료
절제 가능의 경계점에 있는 췌장암 환자들을 대상으로 수술 전 선행 항암 치료(neoadjuvant chemotherapy)를 시도하는 경우들이 있다. 수술 전 선행 항암 치료의 이론적인 기대는 절제 불가능한 종양을 항암 치료 후 병기를 낮추어 절제가 가능하도록 만들 수 있다는 점, 수술 후 바로 전이가 되는 환자에서는 선행 항암 치료를 통해 조기 전이가 되었는지 여부를 확인할 수 있고 이를 통해 환자에게 불필요한 수술을 줄일 수 있다는 점 등이 있다. 또한 보조 항암 치료의 연구 결과에서 서술하였듯이 상당수의 환자들이 수술 이후 정해진 용량을 받지 못하거나 계획된 치료까지 완료하지 못하는 등의 한계가 있어 이를 극복하기 위한 한 방법으로도 선행 항암 치료를 고려해 볼 수 있다[2,9].
그러나 절제 가능한 췌장암 환자들을 대상으로 한 선행 항암 치료의 대규모 연구는 아직 없으며, 대부분 후향적 또는 2상 연구로 진행이 되었다. 최근 발표된 선행 항암 치료 2상 연구인 SWOG S1505 연구에서는 절제 가능한 췌장암 환자 147명을 대상으로 수술 전 12주 기간의 mFOLFIRINOX 또는 Gemcitabine/Nab-paclitaxel 치료를 하고 수술을 진행하여 그 효과를 분석하였는데, 2년 전체 생존율이 mFOLFIRINOX군에서 43.1%, Gemcitabine/Nab-paclitaxel군에서 46.9%로 처음 설정하였던 58%의 기대치에 미치지 못하였다[11]. NEOPA trial은 절제 가능한 췌장암 환자를 대상으로 Gemcitabine과 방사선 병합요법을 선행 항암 방사선 치료로 투여한 군과 우선적 수술적 치료를 받은 군을 비교하는 3상 연구로 현재 진행 중에 있다. 현재 절제 가능한 췌장암에서 선행 항암 치료의 효과를 명백히 입증한 임상 연구는 없어 실제 임상 현장에 적용하기는 어려움이 있다.
췌장암의 보조요법의 시작 시점과 투여 기간
췌장암의 경우 일부 연구에서는 수술 이후 회복이 지연되어 12주가 지난 시점에서 보조요법의 항암 치료를 시행하더라도 수술만 받은 경우에 비해 이득이 있다는 보고가 있으며[12], 그 외 ESPAC-3에 참여한 환자들을 대상으로 분석을 하였을 때, 수술 이후 보조 항암요법의 시작 시기가 8주 이내인 경우와 그 이후인 경우 그리고 6주기의 보조 항암 치료 완료 여부와 치료 성적을 분석하였는데, 6주기의 보조 항암 치료 완료 여부가 생존 기간의 연장과 밀접한 독립적인 예후 인자로 확인되었다[13]. 위의 결과를 mFOLFIRINOX 보조 항암 치료를 한 경우에 똑같이 적용하기 어렵다 하더라도 수술 후 회복이 완전치 않고 전신 상태가 좋지 않은 상태에서 보조 항암 치료를 시작하는 것보다는 항암 치료의 시작이 지연되더라도 회복 후 항암 치료 진행을 통해 가급적 6주기까지 완료를 하는 것이 치료 성적을 향상시킬 수 있다. 다만 다른 암종의 경우 일반적으로 수술 후 2-3개월 이상의 보조 항암 요법의시작시점의 지연은 치료 성적에 영향을 줄 수 있음이 알려져 있고[14,15], 다른 연구에서는 가능한 조기에 투여하는 것이 성적 향상에 도움이 된다는 보고[16]도 있어, 임상의의 적절한 조율이 필요하다. 환자의 전신 상태가 허락한다면 늦지 않게 항암 치료를 시작하여 부작용을 조절해 가며 계획된 치료를 완료하는 것이 생존율 향상의 측면에서 중요할 수 있다.
기타
그 외 췌장암 환자들은 췌장의 수술적 절제 또는 췌장암의 국소 진행으로 인한 외분비 및 내분비기능 장애를 흔히 겪는다[17]. 이로 인해 탄수화물, 지방, 단백질의 적절한 흡수가 되지 못하여 지방변, 만성 복통, 체중 감소 그리고 영양부족 등이 나타난다. 췌장 수술을 받은 환자의 대부분이 어느 정도의 외분비 기능장애는 겪게 되므로 수술 이후 이러한 부족에 대한 접근 및 치료 역시 필요하다. 그 외 biliary obstruction, gastric outlet obstruction, 암성 통증, 췌장암과 연관된 혈전증 그리고 우울증 등이 잘 수반되므로 다학제 진료가 절실히 요구된다[18,19].
결 론
췌장암에서의 보조요법의 항암 치료는 미세잔존암의 제거를 통한 근치가 궁극적인 목적이나 많은 환자에서 재발을 경험하며 실제적인 치료 목적은 무질병 생존 기간의 연장을 통한 생존 기간의 연장이다. mFOLFIRINOX 치료는 수술 이후 전신 상태가 좋은 경우 보조 요법약제로 우선적으로 고려해 볼 수 있다. 예후가 좋지 못한 췌장암에 있어 항암 치료 외에도 적극적 통증 조절 등을 통한 삶의 질 개선도 매우 중요하다. 이러한 복잡한 치료 과정은 환자 별 다학제 논의를 통한 치료 결정이 매우 중요하다.