전신홍반루푸스의 치료
Treatment of Systemic Lupus Erythematosus
Article information
Trans Abstract
Systemic lupus erythematosus (SLE) is an autoimmune disease characterized by the production of autoantibodies that result in the inflammation of multiple organs, including the skin and musculoskeletal, renal, nervous, cardiovascular, respiratory, and gastrointestinal systems. Treatment includes the use of immunomodulatory and immunosuppressive agents to target specific organ manifestations. The treatment goal in SLE is to reduce disease activity and prevent organ damage and death. Optimal long-term outcomes require not only treatment of the disease, but also the management of comorbidities. This paper reviews treatments of SLE with the aim of improving outcomes.
서 론
전신홍반루푸스(systemic lupus erythematosus, SLE)는 다양한 장기 침범과 더불어 여러 형태의 임상 증상을 보이는 대표적인 자가면역 질환으로 오랫동안 불치의 병으로 알려져 왔으나, 최근에는 지속적인 관리가 필요한 만성 질환으로 인식이 바뀌었다. 전신홍반루푸스의 인구 10만 명당 유병률은 30-150명, 발생률은 2.2-23.1명으로 추정되고 있으며, 국민건강보험 자료(2015년)로 추정한 우리나라의 전신홍반루푸스의 인구 10만 명당 유병률은 35.45명, 연간 발생률은 3.6명이다[1,2]. 전신홍반루푸스의 치료 목표는 질병활성도의 빠른 조절, 치료 부작용의 최소화를 통한 낮은 질병활성도 유지이다. 전신홍반루푸스의 질병 초기에는 높은 질병활성도에 의한 장기 손상, 감염이 주된 사망 원인이나 질병 후기에는 글루코코르티코이드 사용과 관련한 손상, 심혈관계 질환이 주된 사망 원인이므로 질병과 관련한 위험 요인 및 동반 질환의 장기적인 관리도 중요하다.
본 론
전신홍반루푸스의 치료는 질병활성도의 빠른 조절, 치료 부작용 최소화를 통한 낮은 질병활성도 유지를 통해 장기 손상 예방, 삶의 질 향상, 장기적인 생존을 목표로 한다. 전신홍반루푸스의 적절한 치료를 위해서는 질병 활성화 정도를 아는 것이 중요하므로, 환자의 증상, 신체 진찰 및 항dsDNA 항체, 혈중 보체(CH50, C3, C4)를 포함한 혈청학적 검사를 시행하고, Systemic Lupus Erythematosus Disease Activity Index (SLEDAI), British Isles Lupus Assessment Group (BILAG), Systemic Lupus Activity Measure (SLAM) 같은 전신홍반루푸스 질병활성도 평가도구를 함께 이용하여 질병활성도를 측정한다[3]. 이렇게 측정된 질병활성도가 미열, 뺨 발진, 관절통 정도의 경한 상태라면 하이드록시클로로퀸이나 저용량의 글루코코르티코이드를 사용하고, 흉부 단순 방사선 검사상 이상 소견이나 급성 염증물질의 상승이 동반되고 장기 침범이 의심되는 중등도 상태라면 글루코코르티코이드 사용이 추천되며, 높은 항dsDNA 항체와 낮은 혈청 보체를 포함하여 루푸스신염이나 신경정신루푸스처럼 생명을 위협하는 중증도 상태인 경우에는 간헐적인 메틸프레드니솔론 충격요법을 포함한 고용량 글루코코르티코이드와 강력한 면역억제제 투여가 필요하다[4]. 2019년 유럽류마티스학회에서는 전신홍반루푸스에 대한 치료 권고안을 발표하였고, 신장 외 전신홍반루푸스에 대한 치료 약물을 권고 등급별로 제시하였다(Fig. 1) [5].
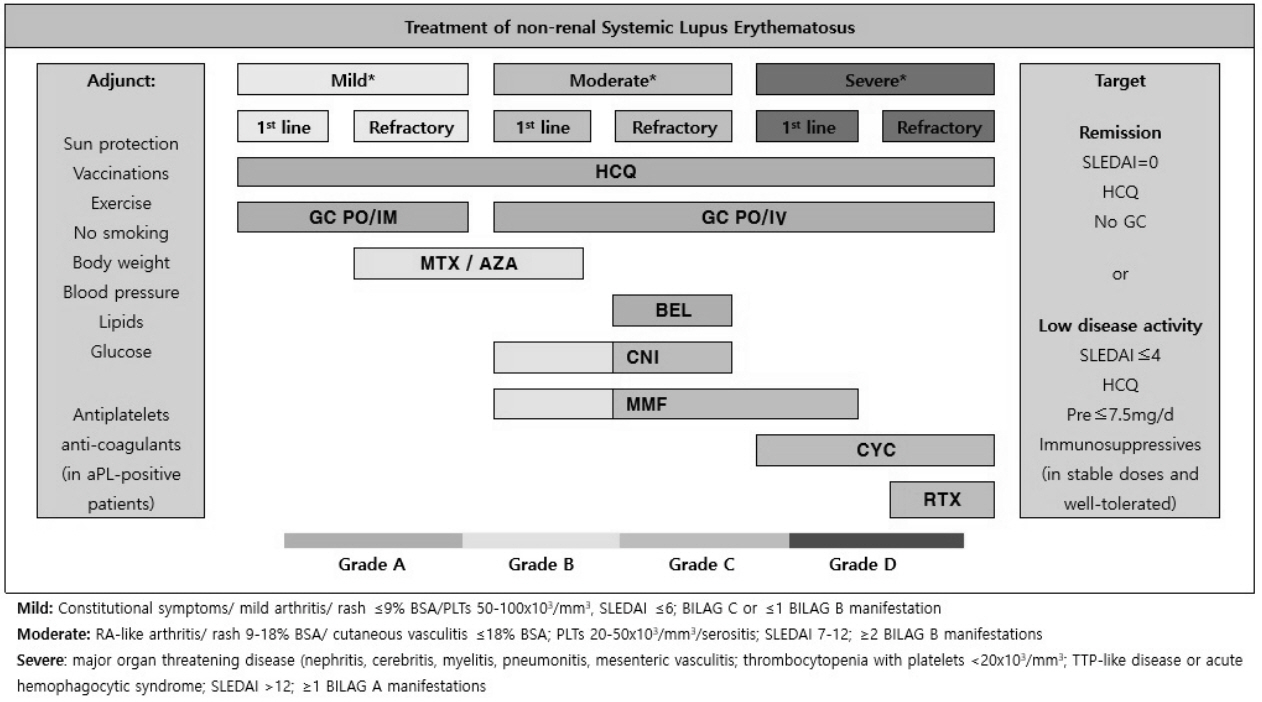
Treatment of non-renal systemic lupus erythematosus-recommended drugs with respective grading of recommendation [5]. aPL, antiphospholipid antibodies; AZA, azathioprine; BEL, belimumab; BILAG, British Isles Lupus Assessment Group disease activity index; CNIs, calcineurin inhibitors; CYC, cyclophosphamide; GC, glucocorticoids; HCQ, hydroxychloroquine; IM, intramuscular; MMF, mycophenolate mofetil; MTX, methotrexate; Pre, prednisone; PO, per os; RTX, rituximab; PLTs, platelets; SLEDAI, Systemic Lupus Erythematosus Disease Activity Index.
환자교육 및 비약물요법
전신홍반루푸스 환자에서 비약물요법은 약물치료만큼 중요한데, 일선에서 간과하는 경향이 있다. 자외선이 전신홍반루푸스의 발병기전과 관련이 있으므로 모든 환자에서 가능한 직접적인 자외선 노출을 피하게 하고 일광 차단크림(자외선 차단지수 ≥ 30, 자외선 A/B 차단제), 일광 차단 의복을 사용하게 한다. 특히, 심혈관 질환 위험이 높은 환자들에게는 체중 감량, 운동, 금연을 권고해야 한다. 또한, 전신홍반루푸스 환자는 질병 및 치료 약물과 관련하여 감염의 위험성이 있으므로 일차 예방에 관심을 두어야 한다. 전신홍반루푸스 환자에서 감염 예방을 위해서는 인플루엔자, 폐렴구균 백신의 투여가 권고되며, 면역억제제를 투약 중인 경우에는 생백신 접종은 일반적으로 금기이다[6]. 젊은 여성 환자에서는 인유두종 바이러스 백신 접종이 추가적으로 권고된다. 전신홍반루푸스 여성 환자는 인유두종 바이러스 감염과 관련된 자궁경부 이형성증, 질암, 외음부암 발생의 고위험군으로 알려져 있으며, 전신홍반루푸스 환자에서 인유두종 바이러스 백신 접종의 안정성 및 효과는 연구를 통해 입증되었기 때문이다[7,8].
전신홍반루푸스의 치료 약물
비스테로이드소염제(non-steroidal anti-inflammatory drugs)
비스테로이드소염제는 전신홍반루푸스 환자에서 관절염, 관절통, 발열, 경한 장막염과 같은 증상 조절을 위해 투여할 수 있다. 다만, 루푸스신염 환자에서는 비스테로이드소염제로 인한 급성 신부전 발생의 위험이 증가되므로 비스테로이드소염제의 장기적인 사용은 피해야 한다. 또한 전신홍반루푸스 환자에서 비스테로이드소염제로 인한 알러지 반응, 무균성 수막염, 피부 부작용 및 간독성이 증가하므로 이러한 부작용 발생에 주의를 요한다[9].
글루코코르티코이드(glucocorticoids)
글루코코르티코이드는 비선택적으로 사이토카인(인터루킨-2, 인터루킨-6, 종양괴사인자-α, 프로스타글란딘) 및 부착 분자의 발현을 감소시켜 강력한 항염 및 면역 억제 효과를 가진다[1]. 특히, 간헐적인 메틸프레드니솔론 충격요법은 글 루코코르티코이드의 DNA 결합을 거치지 않는 기전(non-genomic effect)을 이용하여 경구 글루코코르티코이드의 초기 투여 용량을 낮추고 빠른 감량을 가능하게 한다[10,11]. 2018년 영국류마티스학회 권고에 의하면 근골격계, 피부 침범 등 중증도가 낮은 환자는 저용량 글루코코르티코이드(프레드니솔론 혹은 이에 상응하는 글루코코르티코이드 20 mg/일 이하, 1-2주)를 사용하고 심각한 장기 침범이 있는 중증의 환자에서는 고용량 글루코코르티코이드(프레드니솔론 혹은 이에 상응하는 글루코코르티코이드 0.75-1 mg/kg/일 이하)나 간헐적인 메틸프레드니솔론 충격요법을 사용하도록 권고한다. 그러나 장기간의 글루코코르티코이드 치료는 다양한 부작용을 초래하므로 장기적인 유지 치료는 프레드니솔론을 기준으로 하루 7.5 mg 이하로 최소화하여 투여하거나 끊는 것을 목표로 해야 한다[9]. 면역억제제를 조기에 투여하면 경구 글루코코르티코이드를 빠르게 감량하거나 중단할 수 있다[5].
하이드록시클로로퀸(hydroxychloroquine)
하이드록시클로로퀸은 다양한 기전을 통해 작용하는데, 면역 억제를 일으키지 않고 면역 조절을 중재한다[12,13]. 하이드록시클로로퀸은 모든 전신홍반루푸스 환자에서 금기가 없는 한 투여하도록 권고되고 있는데, 이는 여러 연구를 통해 다양한 치료 효과가 증명되었기 때문이다. 하이드록시클로로퀸은 전신홍반루푸스 환자에서 루푸스 플레어를 막고 장기간 생존율을 증가시켰으며, 비가역적 장기 손상에 보호적인 효과를 보였다. 또한 전신홍반루푸스 관련 피부 증상, 관절염 치료에 흔히 처방되고 있으며, 항염작용뿐만 아니라 항혈전 효과가 있다[14-17]. 그러나 하이드록시클로로퀸에 대한 망막병증 발생 위험은 투여 기간과 투여 용량에 비례하며, 실체중당 5 mg/일 용량으로 투여하였을 때, 5년까지 1% 미만, 10년까지 2% 미만, 20년 이후에는 20%의 망막병증 발생 위험이 있다고 보고되었다. 그러므로 2016년 미국안과학회 권고안에서는 하이드록시클로로퀸의 하루 처방 용량이 실체중당 5 mg/일을 넘지 않도록 하고, 시야 검사(visual field examination)와 빛간섭단층촬영(optical coherence tomography)을 하이드록시클로로퀸을 투여하기 전에 시행하여 망막병증을 평가하고 투여 5년 후부터는 매년 시행하도록 권고하고 있다. 또한, 신장질환, tamoxifen 투여, 이전에 망막 또는 황반 질환의 동반 등 망막 독성에 대한 주요 위험인자가 있는 경우에는 안과 검진을 더 자주 시행할 것을 권고하고 있다[18].
면역억제제(immunosuppressive drugs)
면역억제제는 글루코코르티코이드 용량의 빠른 감량을 가능하게 하고, 루푸스 플레어를 예방한다[19]. 장기를 심각하게 위협하는 전신홍반루푸스가 동반되어 있을 때는 관해의 유도 및 유지를 위해 면역억제제를 투여해야 한다. 면역억제제는 전신홍반루푸스의 우세한 임상 양상, 환자의 나이, 임신 가능성, 안정성 및 비용을 고려하여 선택한다. 메토트렉세이트(methotrexate), 아자티오프린(azathioprine)은 하이드록시클로로퀸 단독 투여 또는 글루코코르티코이드와 하이드록시클로로퀸 병합투여에도 증상 조절이 안되는 환자에서 투여해 볼 수 있다. 두 개의 무작위 대조군 연구에서 메토트렉세이트는 글루코코르티코이드를 감량하는 효과를 보였고 전반적인 질병 활성도를 감소시켰으며, 특히 피부와 관절 증상을 호전시켰다[20,21]. 아자티오프린은 루푸스신염 및 피부와 관절 증상의 치료에 이용되고 있으며 임신 기간 중 상대적으로 안전하므로 특히, 임신 중이거나 임신을 계획하고 있는 환자에게 사용되고 있다. 미코페놀레이트모페틸(mycophenolate mofetil)은 루푸스신염의 관해유도 치료에서 시클로포스파마이드(cyclophosphamide)와 유사한 효과를 보이면서 더 우월한 안정성을 입증하였고, 루푸스신염의 유지 치료로 아자티오프린과 비교하였을 때 장기간의 재발 위험성을 낮추는 데 더 우월함을 입증하였다[22,23]. 또한, 미코페놀레이트모페틸은 루푸스신염 환자의 신장 침범 이외 증상에서도 시클로포스파마이드와 동등하게 효과를 보이는 것을 확인할 수 있었다[24]. 그러나 미코페놀레이트모페틸은 태아 기형 위험이 있어 최소 임신 6주 전 약물 투여 중단이 필요하며, 신장 침범이 없는 가임기 여성에서는 치료 권고에 제한이 있다. 시클로포스파마이드는 장기를 심각하게 위협하는 전신홍반루푸스(특히, 신장, 심폐, 뇌신경 침범)나 난치성 루푸스의 구조 치료로 사용된다. 시클로포스파마이드는 생식선 독성이 있어 불임을 초래할 수 있으므로 가임기 여성에게 투여 시 주의를 요하며, 환자의 생식선 기능 유지를 위해 성선자극호르몬분비호르몬 유도체(gonadotropin-releasing hormone agonist)를 같이 투여한다[5,25]. 타크로리무스(tacrolimus)는 루푸스신염에서 단독 요법 및 미코페놀레이트모페틸에 추가적인 다중 표적 치료로 연구가 진행되어 전신홍반루푸스에서 칼시뉴린(calcineurin) 억제제의 선택적 약물로 제시되고 있다[26,27]. 타크로리무스는 임신 시 처방이 가능하며, 난치성 피부 질환에서도 국소적으로 사용할 수 있다[28].
생물학적제제(biologic agents)
2개의 대규모 3상 다기관 무작위 대조군 연구를 통해 belimumab의 치료 효과가 입증되었다[29,30]. Belimumab은 하이드록시클로로퀸, 글루코코르티코이드 및 면역억제제를 포함한 일차 치료에 질병활성도가 조절되지 않고 글루코코르티코이드의 적절한 감량이 되지 않는 신장 외 전신홍반루푸스 환자에서 투여할 수 있다. Belimumab은 질병 활성도가 높고(SLEDAI > 10), 프레드니솔론을 기준으로 하루 7.5 mg을 초과하여 글루코코르티코이드를 투여받거나 혈청학적 활성도가 높은 환자(낮은 C3/C4, 높은 dsDNA 항체 역가) 및 피부, 관절 증상이 동반된 환자에서 더 효과가 있었다[31,32]. Rituximab은 신장 외 루푸스와 루푸스신염을 대상으로 한 임상시험에서 대조군에 비해 주요 결과 변수를 만족하지 못하였지만, 다른 면역억제제나 belimumab 치료에 반응하지 않는 난치성 신장 외 전신홍반루푸스와 시클로포스파마이드, 미코페놀레이트모페틸과 같은 일차 치료에 실패하거나 재발하는 루푸스신염의 경우에는 사용을 고려할 수 있다[33,34]. 또한 rituximab은 난치성 자가면역혈소판감소증, 자가면역용 혈성빈혈에서 치료 효과를 보였다[35].
1차 진료기관에서 볼 수 있는 전신홍반루푸스의 임상상에 따른 치료
피부 증상
피부 질환의 일차 치료제는 국소치료제(글루코코르티코이드 그리고/또는 칼시뉴린 억제제)와 하이드록시클로로퀸이며 피부 병변의 심한 정도에 따라 전신적 글루코코르티코이드의 처방을 고려해 볼 수 있다[5]. 피부 질환이 동반된 환자의 40% 정도에서는 일차 치료제에 반응하지 않을 수 있는데 이러한 경우에는 금기 사항이 없다면 일반적으로 메토트렉세이트의 처방을 먼저 고려한다[36]. 또한 레티노이드(retinoids) 제제, 댑손(dapsone), 미코페놀레이트모페틸의 투여를 고려할 수 있다. Belimumab도 피부 질환에서 효과를 보였으며 rituximab은 만성 피부홍반루푸스에서는 덜 효과적이었으나 피부 질환에서 효과를 보였다[31,37]. 탈리도미드(thalidomide)는 피부 질환의 다양한 유형에서 효과가 있었지만, 임신 시 투여가 금기 되고, 비가역적 다발신경병증의 발생 및 약제 중단 시 잦은 피부 병변의 재발로 인해 다양한 여러 약제에도 치료 반응이 없는 경우 구조요법으로만 투여한다[38].
근골격계 증상
전신홍반루푸스와 관련된 관절 증상의 범위는 특히, 손가락, 손목 관절과 같은 작은 관절에서 동반되는 관절통부터 활막염까지 다양하다. 관절통의 치료는 하이드록시클로로퀸의 투여로 충분할 수 있다. 반면 활막염이 있는 환자에서는 추가적인 치료가 필요한데, 환자가 신장 질환이 없다면 비스테로이드소염제를 투여할 수 있으며 단기간 동안 글루코코르티코이드를 투여해 볼 수 있다[1]. 하이드록시클로로퀸을 투여하고 있음에도 불구하고 지속적인 활막염이 있는 환자에서는 메토트렉세이트를 투여하는 것이 효과적이다[20]. 이러한 치료에도 효과를 보이지 않는 경우에는 belimumab, rituximab의 투여를 고려한다[29,39].
임신 시 전신홍반루푸스 환자의 약물치료
하이드록시클로로퀸은 임신 전부터 임신 기간 동안에도 투여를 계속 유지하도록 권고되고 있는데, 하이드록시클로로퀸의 투여는 임신 시 전신홍반루푸스의 질병 활성도를 조절하고 루푸스 플레어를 예방하는 데 효과가 있었기 때문이다[40,41]. 루푸스신염, 항인지질항체 양성을 포함한 전자간증 발생의 고위험군 여성 환자에서 임신 전 또는 임신 초기 16주 이전부터 저용량의 아스피린 투여는 전자간증 발생을 감소시키는 효과가 있었다[42]. 임신 시 전신홍반루푸스 질병 활성도를 조절하기 위해서는 경구 글루코코르티코이드, 아자티오프린, 칼시뉴린 억제제(시클로스포린, 타크로리무스)를 투여할 수 있다. 중등도 이상의 루푸스 플레어가 있는 경우에는 메틸프레드니솔론 충격요법을 포함한 고용량 글루코코르티코이드 치료, 정맥 면역글로불린, 혈장 교환술을 추가적으로 고려할 수 있다. 시클로포스파마이드는 임신 1분기 동안은 유산의 위험성 때문에 투여해서는 안되며, 임신 2, 3분기 동안에는 심한, 생명을 위협하는, 난치성 전신홍반루푸스일 경우에만 투여를 고려해야 한다. 미코페놀레이트모페틸, 메토트렉세이트, 레플루노마이드(leflunomide)는 알려진 태아 기형 위험으로 임신 시 투여해서는 안된다[7].
항인지질항체증후군의 약물치료
항인지질항체증후군은 혈전 형성과 관련하여 전신홍반루푸스에서 동반되는 질환으로 항인지질항체증후군 치료의 목표는 혈전증의 예방이다. 관찰 연구에서는 무증상 항인지질항체 양성인 전신홍반루푸스 환자에서 아스피린의 예방적 효과를 제시하고 있으나 무작위 연구에서는 무증상 항인지질항체 양성인 환자에서 저용량 아스피린의 큰 효과가 증명되지 않았다[43,44]. 반면 항인지질항체 양성인 전신홍반루푸스 환자에서 하이드록시클로로퀸은 혈전의 진행을 예방하는 효과를 보여주었다[17]. 2019년 유럽류마티스학회 권고에서는 무증상 항인지질항체 양성인 환자의 항인지질항체 위험도를 분류하여 위험도가 고위험(전신홍반루푸스 항응고인자의 양성, 3개 항인지질항체 중 2개 이상 양성, 지속적으로 높은 항인지질항체 역가)에 속하는 경우에는 일차적 혈전증 예방을 위한 치료로 저용량 아스피린 치료를 권고하고 있다[45]. 혈전증의 과거력이 있는 항인지질항체 증후군 환자에서 이차적 혈전예방을 위한 주된 치료는 항응고 치료이다. 정맥 혈전증 과거력이 있는 환자에게는 international normalized ratio (INR) 2.0-3.0을 목표로 경구 항응고요법을 권장하고, 동맥혈전증 또는 반복적으로 발생하는 경우는 더욱 적극적인 치료가 필요하며 INR 3.0-4.0으로 유지할 것을 목표로 하며, 혼합된 항응고치료가 권장된다. 임신 시 항인지질항체증후군 치료 목표는 산모의 혈전증, 태아 사망, 전자간증, 조산 등의 합병증을 최소화하여 산모와 태아의 예후를 향상시키는 것이고 헤파린과 아스피린이 일차 치료약제이다[45].
동반 질환의 관리
전신홍반루푸스는 여러 동반 질환에 대한 위험이 증가할 수 있어 동반 질환에 대한 관리가 중요하다. 전신홍반루푸스는 심혈관 질환의 독립적인 위험요소인데, 이러한 것은 전통적 위험요소와 지속적인 높은 질병 활성도, 루푸스신염, 항인지질항체의 양성, 글루코코르티코이드 사용과 같은 질병과 관련한 위험 요소인 두가지 측면 모두가 관여한다. 그러므로 전신홍반루푸스 환자에서는 지질, 혈당, 혈압을 감시하고 적절하게 치료하여야 한다[5,6]. 또한, 저용량의 아스피린 투여가 전신홍반루푸스 환자의 심혈관 위험을 낮출 수 있어 심혈관 질환의 일차 예방에 도움이 된다는 연구 결과가 있었다[46]. 전신홍반루푸스와 종양과의 관련성에 대해서는 전신홍반루푸스에서 비호지킨 림프종, 폐암, 간담도암의 발생이 유의하게 증가한다는 보고가 있다[47]. 장기간의 글루코코르티코이드를 투여받은 전신홍반루푸스 환자에서는 글루코코르티코이드제제 유발 골다공증과 골절에 대한 관리가 필요하다. 2017년 미국류마티스학회 권고에 따르면 프레드니솔론 기준으로 2.5 mg/일 이상으로 3개월 이상 투여 받은 모든 환자는 칼슘(1,000-1,200 mg/일)과 비타민 D (600-800 IU/일)를 보충하도록 권고한다. 40세 이상에서는 골밀도 측정에서 골다공증이 있거나 fracture risk assessment tool을 이용한 골절 예측 위험이 주요 골다공증 골절 10% 이상 혹은 고관절 골절 1%를 초과한 경우에는 경구 bisphosphonates를 투여하도록 권고한다. 40세 미만이라도 6개월 이상 프레드니솔론 7.5 mg/일 이상을 투여하고 고관절 및 척추 골밀도 Z 점수가 -3미만 혹은 1년 골밀도의 10% 이상 감소가 있는 환자에서는 경구 bisphosphonates를 투여하도록 권고한다. 골절병력이 있거나 30세 이상에서 고용량 글루코코르티코이드 치료(최근 1년 동안 프레드니솔론 기준으로 30 mg/일 이상 투여하였거나 누적 용량이 5 g을 초과한 경우)를 시행한 경우에도 경구 bisphosphonates를 투여하도록 권고하고 있다[48].
결 론
전신홍반루푸스는 자가항체 형성을 특징으로 하고 전신 장기를 침범하는 자가면역 질환이다. 전신홍반루푸스의 임상 양상은 매우 다양하며 만성, 재발성 질병 경과를 보인다. 전신홍반루푸스의 치료 목표는 낮은 질병 활성도 또는 관해에 도달하고 유지하여 장기 손상을 줄이고 환자의 장기적인 예후를 개선시키는 것이다. 전신홍반루푸스의 치료 약제로는 여러 연구를 통해 전신홍반루푸스에서 다양한 치료 효과가 증명된 하이드록시클로로퀸을 사용한다. 글루코코르티코이드는 강력한 항염 및 면역 억제 효과를 가지므로 루푸스신염이나 신경정신루푸스와 같은 심각한 장기 침범이 있는 환자에서는 고용량 글루코코르티코이드 처방이나 간헐적인 메틸프레드니솔론 충격요법을 사용할 수 있다. 그러나 장기간의 글루코코르티코이드 치료는 다양한 부작용을 초래하므로 글루코코르티코이드 유지 치료는 투여 용량을 최소화하여 투여하거나 끊는 것을 목표로 해야 한다. 장기를 심각하게 위협하는 전신홍반루푸스가 동반되어 있을 때는 관해의 유도 및 유지를 위해 면역억제제를 사용하며 면역억제제 치료에도 질병활성도가 조절되지 않는 경우에는 생물학적 제제의 투여를 고려한다. 전신홍반루푸스의 치료제 개발을 위해 다양한 약물들이 연구 중에 있으므로 이러한 연구 결과들을 주목할 필요가 있다. 또한, 전신홍반루푸스 환자에서는 여러 동반 질환에 대한 위험이 증가할 수 있으므로 환자의 장기적인 예후를 개선시키기 위해서는 적절한 약물치료뿐만 아니라 동반 질환을 관리하고 비약물요법을 병행해야 한다.