16세 청소년에서 발생한 2형 자가면역 췌장염
Adolescent Type 2 Autoimmune Pancreatitis
Article information
Abstract
2형 AIP는 드물지만 소아 청소년에서도 발현할 수 있다. 원인 미상의 췌장염으로 내원한 소아 청소년의 경우, 췌장영상 소견을 주의 깊게 관찰하여 기존에 알려져 있는 급성췌장염의 일반적인 영상 소견과 차이가 있을 때는 2형 AIP를 의심해보는 것이 중요하다. 소아 청소년의 경우 췌장조직 검사를 시행하는 일이 임상에서 매우 드물지만 2형 AIP가 의심된다면 적극적인 췌장조직 검사를 시행함으로써 AIP를 확진할 수 있고, 스테로이드 투여로 효과적인 치료를 기대할 수 있다.
Trans Abstract
There are two forms of autoimmune pancreatitis (AIP). Type 1 is associated with immunoglobulin G4 (IgG4)-related systemic fibro- inflammatory disease, whereas type 2 AIP is localized to the pancreas and not associated with IgG4. The number of children presenting with type 2 AIP has recently increased. Here, we report a case of type 2 AIP in a 16-year-old adolescent who presented with clinical acute pancreatitis and associated pancreatic masses. He was diagnosed with type 2 AIP based on pancreatic biopsy results showing granulocytic epithelial lesions and supportive radiological imaging and steroid responsiveness.
서 론
자가면역 췌장염(autoimmune pancreatitis, AIP)은 자가면역이상과 관련되어 발생하며 스테로이드 치료에 좋은 반응을 보이는 만성췌장염으로 보고되고 있다. 국내에서도 이에 대한 지식과 관심이 높아지며 진단 증례들이 증가하고 있다. AIP는 크게 1형(lymphoplasmacytic sclerosing pancreatitis)과 2형(idiopathic duct-centric chronic pancreatitis)으로 나눌 수 있는데, 1형과 2형은 영상 소견과 스테로이드 치료에 대한 반응은 큰 차이가 없지만 역학이나 임상 양상, 조직 소견, 혈청학적 검사, 재발률에서 차이를 보인다[1].
1형 AIP는 주로 60세 이후에 호발하며, 췌장뿐만 아니라 담도나 침샘, 신장, 후복막을 침범하는 전신 면역글로불린 G4(immunoglobulin G4, IgG4) 연관 질환의 스펙트럼에 속한다[2]. 한편 2형 AIP는 젊은 연령에 발생하며 혈중 IgG4 증가가 없고, 조직 내 IgG4 양성 형질세포 침윤도 관찰되지 않으며, 염증성 장질환 외의 타 장기 침범 소견이 없다. 2형 AIP의 경우 1형과 비교하여 상대적으로 수술 전에 진단하기가 어려운데, 이는 확진을 위해서는 조직 소견이 필요하기 때문이다[3]. 실제로 초기에 서양에서 진단된 2형 AIP의 대부분은 췌장 절제 후에 후향적으로 진단된 경우였다. 하지만 최근에는 AIP에 대한 국제적 합의에 의한 진단 기준(International consensus diagnostic criteria for autoimmune pancreatitis, ICDC)이 도입됨에 따라 이전보다 수술 전 진단이 좀 더 용이해졌다.
최근 서양에서 소아 청소년에서 발생한 AIP의 보고가 증가하고 있다[4]. 이들 환자 대부분은 복통을 동반하고 혈중 IgG4 증가가 없고, 췌장조직 검사를 시행한 환자에서 췌관 내 호중구 침윤이 관찰되어 2형 AIP의 소견을 나타내었다. 저자들은 16세 청소년에서 췌장 종괴를 동반한 급성췌장염 양상의 2형 AIP 환자를 경험하였기에 문헌고찰과 함께 보고하는 바이다. 본 환자는 췌장 영상 소견과 초음파 내시경을 이용한 췌장 생검, 스테로이드 치료 반응을 종합하여 2형 AIP를 확진하고 치료할 수 있었다. 이번 보고는 10대 청소년에서 발생한 2형 AIP의 국내 문헌상 첫 보고이다.
증 례
환자: 16세 남자
주소: 상복부 통증
현병력: 식사 후 심한 상복부 통증을 주소로 응급실에 내원하였다. 환자는 내원 5일 전부터 속 쓰림 및 복부 통증이 시작되었고, 통증이 악화되는 소견으로 응급실을 통해 입원하였다.
과거력: 만삭에 자연분만으로 건강하게 출생 후 자가면역질환을 비롯한 특이한 질병력은 없었고, 입원 및 수술력도 없었다.
가족력: 직계가족으로 부모가 있었고, 모두 췌장염의 병력이나 유사 증상을 보인 가족력 및 췌장암의 가족력은 없었다.
사회력: 음주력, 흡연력은 없었다.
신체 검사 소견: 혈압 126/75 mmHg, 심박수 89회/분, 호흡수 16회/분, 체온 37.4℃였고, 체중 74.8 kg, 신장 179.2 cm였다. 식후 발생한 심와부 통증 이외 환자가 호소하는 다른 증상은 없었다. 신체 진찰상 공막 황달은 없었고, 복부는 부드러우나 팽만되어 있었고, 심와부 압통이 있었으나 반발 압통은 없었다. 장음은 다소 감소한 상태였고 설사, 혈변 등의 증상도 없었다.
검사실 소견: 혈액 검사상 백혈구 10,700/mm³ 아스파르테이트 아미노전이효소 18 IU/L, 알라닌 아미노전이효소 8IU/L, 알칼라인 포스포타아제 133 IU/L, 아밀라아제 153 U/L(30-110 U/L) 리파아제 250 U/L (13-60 U/L), C-반응 단백질은 0.16 mg/dL로 증가되어 있었다. 혈청 칼슘 9.3 mg/dL, 중성지방 51 mg/dL로 정상 범위였다. 혈청 면역글로불린 G 및 G4는 각각 1,390 mg/dL (700-1,600 mg/dL), 79 mg/dL (< 135 mg/dL)로 정상 범위였다.
방사선 및 내시경 영상 소견: 복부 컴퓨터단층촬영(computer tomography, CT)에서 췌장 실질에 전반적인 부종이 관찰되었고, 췌장 주변 지방조직의 염증 침윤 소견이 관찰되었다(Fig. 1A). 복부 CT는 단일 위상 조영증강(single phase contrast)으로 시행되었기 때문에 위상(phase)에 따른 변화를 확인하기 위하여 추가적으로 조영증강 자기공명영상(magnetic resonance imaging/magnetic resonance cholangiopancreatography, MRI/MRCP)을 시행하였다. 자기공명영상의 T1 강조 영상(T1 weighted image)에서 췌장 미부와 두부에 저음영 종괴가 확인되었다(Fig. 1B and 1C). 이들 저음영 종괴는 지연기(delayed phase)에 균일한 조영증강을 보였다(Fig. 1D).
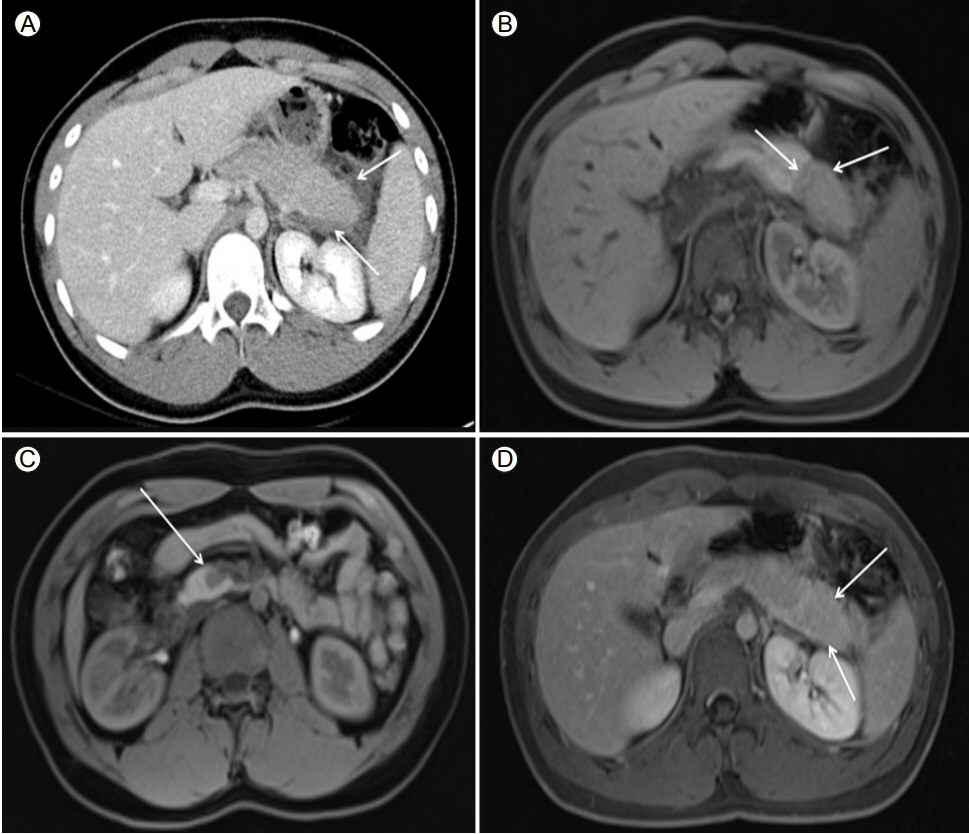
Pancreatic imaging prior to steroid treatment. (A) Single-phase contrast-enhanced abdominal computer tomography findings show diffuse pancreatic enlargement and peripancreatic fat infiltration (arrows). (B) Magnetic resonance imaging (MRI; T1WI) shows a low signal intensity mass in the pancreas tail (arrows) and (C) in the pancreas head (arrow). (D) MRI reveals delayed homogenous enhancement of the pancreas tail mass (arrows).
초음파 내시경 검사에서 췌장이 전반적으로 부어 있었고, MRI에서 관찰된 췌장 미부 종괴와 동일한 위치에 2.7 × 2.6cm 크기의 저음영의 에코성 종괴가 관찰되어, 22G 굵기의 미세침(ProCore®; Cook Medical, Bloomington, IN, USA)을 이용하여 중심부 바늘 생검을 시행하였다(Fig. 2A). 조직 검체에서 헤마토실린-에오신 염색에서 소엽의 위축, 미만성 간질섬유화 그리고 췌관 내 호중구 침윤(granulocytic epithelial lesion, GEL) 소견이 확인되었고(Fig. 2B and 2C), 면역글로불린 G4 면역 염색은 음성이었다(Fig. 2D).
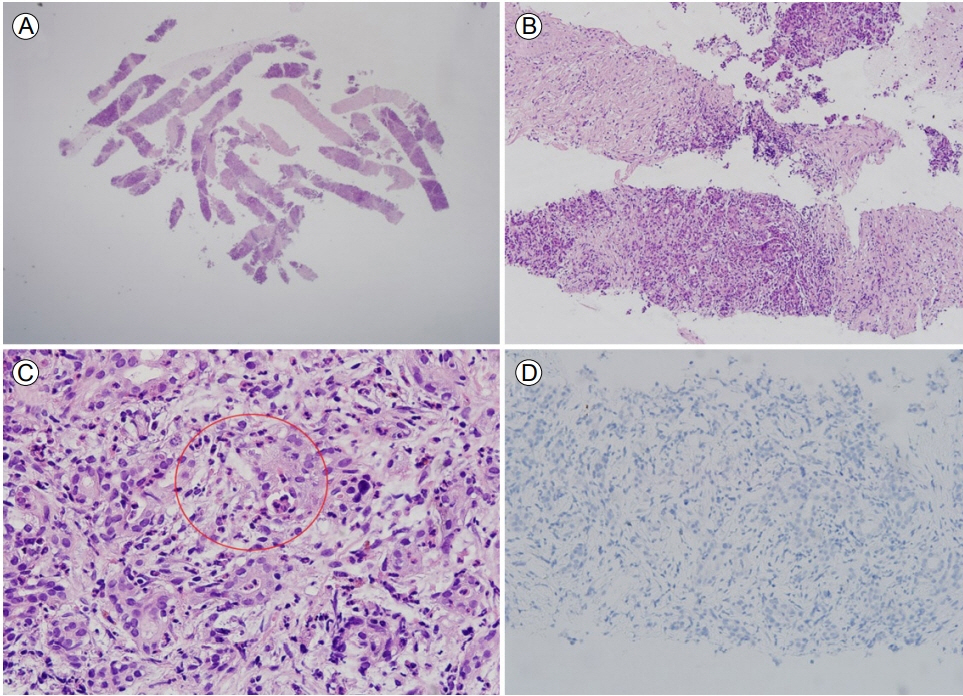
(A) Pancreatic biopsy findings. Full tissue scan (H&E stain, ×12.5). (B) Lobular edema, diffuse interstitial fibrosis, and granulocytic & lymphoplasmatic acinar infiltration (H&E stain, ×40). (C) Neutrophil infiltration in the pancreatic duct (granulocytic epithelial lesions, GELs; circled). Dense mixed inflammatory cell infiltration, consisting of lymphocytes, plasma cells, and eosinophils in the stroma (H&E staining, ×400). (D) Immunoglobulin G4 (IgG4) immunohistochemistry shows no IgG4-positive plasma cells (H&E staining, ×200).
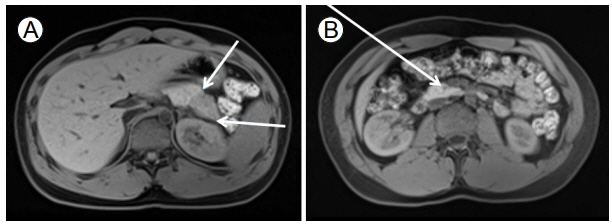
치료 및 경과: 췌장 영상 소견과 생검 조직 소견을 바탕으로 2011년 발표된 국제 진단 기준으로, 2형 AIP로 확진하였으며, 치료를 위해 매일 프레드니솔론 20 mg을 경구 투약하였다. 치료 시작 1개월 뒤 복통이 사라졌으며, 추적 시행한 자기공명영상 소견에서 췌장의 전반적인 부종 및 췌장 종괴가 현저히 감소하였다(Fig. 3). 2형 AIP 진단을 최종 확인할 수 있다. 프레드니솔론은 한 달에 5 mg씩 감량하여 6개월 내 완전히 중단할 예정이다.
고 찰
동양에서는 AIP 환자의 대부분이 1형으로 구성되어 있는 반면에, 서양에서는 2형 AIP가 차지하는 비율이 동양에 비해 상대적으로 의미 있게 높다[5]. 하지만 우리나라에서도 최근 2형 AIP의 보고가 증가하고 있어 각 아형 간의 차이에 대해 아는 것도 필요하다. 평균 발생 연령은 1형의 경우 호발 연령이 60세 전후인데 비하여 2형의 경우는 호발 연령이 대부분 20-40대이다. 1형 AIP는 복통을 동반하지 않는 폐쇄성 황달이 가장 흔한 증상이며, 2형 AIP는 복통 및 급성췌장염의 임상 양상이 가장 흔하다[6,7]. 2형의 경우 1형 AIP와 달리 혈액 내 IgG4는 상승하지 않으며 침샘이나 신장, 후복막 등 타장기 침범 소견도 동반되지 않는다. 한편 1형에 비해 2형에서 염증성 장질환의 동반이 의미 있게 높다[8]. 1형과 2형으로 AIP를 아형분류(subtype)를 하는 임상적 의의는 치료 및 예후 측면에서 차이가 있기 때문이다. 두 군은 모두 스테로이드 치료에 잘 반응하지만 2형 AIP의 경우 1형과 비교하여 재발률이 훨씬 낮아 장기간에 걸친 스테로이드 유지요법이 필요가 없다. 예후 측면에서는 1형과 달리 2형 AIP의 경우 내분비, 외분비 기능 부전(endocrine & exocrine insufficiency)의 발생률이 낮으며, 췌관 결석이나 악성 종양이 발생할 가능성 또한 낮은 것으로 알려져 있다[6,9].
최근 서양에서 소아 청소년에서의 AIP 발생에 대한 보고가 증가되고 있다. 48명의 AIP 소아 청소년을 대상으로 진행한 연구[4]에 따르면, 평균 연령은 13세(2-17세)였다. 임상 양상을 살펴보면, 복통이 나타난 경우는 91%, 폐쇄성 황달은 41%였다. 혈청 IgG4가 증가되어 있는 경우는 22%에서 관찰되었다. 췌장 영상 소견에서 전반적 또는 국소적 종대가 83%에서 확인되었고, 주췌관 이상 소견은 64%였다. 병리 소견으로는 GEL이 72%에서 확인되었고, 스테로이드에 잘 반응하였다. 한편 합병증으로는 외분비 기능 부전(16%), 내분비 기능 부전(11%)을 보였다. 이상 종합해 보았을 때 소아 청소년에서 AIP를 진단받은 다수의 환자가 성인의 2형 AIP와 비슷한 양상을 보인다고 이 연구는 결론짓고 있다.
급성췌장염 양상을 보이는 10대 청소년에서 췌장 생검을 시행하는 것은 쉽지 않은 결정이지만 저자들은 아래에 기술한 근거를 토대로 췌장조직 생검을 시행하여 2형 AIP를 확진하였다. 첫째, 복통을 동반한 급성췌장염의 임상 양상으로 내원하였으나, 기존에 잘 알려져 있는 급성췌장염의 원인(예: 음주, 담석 등)이 관찰되지 않았다. 성인과 달리 소아에서의 급성췌장염은 외상, 전신 질환(예: 유행성 이하선염, 엔테로 바이러스 등) 등 다양한 원인들이 보고되고 있는데, 이 환자의 경우 외상력이 없었고, 전신 질환과 연관된 증상도 보이지 않았다. 대사 원인을 감별하기 위해 시행한 혈청칼슘과 중성 지방 역시 정상 범위였다. 또한 췌관의 선천성 기형도 MRCP 소견으로 배제할 수 있었다. 둘째, CT에서 경도의 급성 간질성 췌장염(mild acute interstitial pancreatitis) 소견을 보인데 반하여 MRI/MRCP에서는 췌장 종괴가 관찰되어 일반적인 급성췌장염 환자의 영상 소견과 차이를 보였다. 특히, MRI에서 관찰된 췌장의 저음영 종괴는 지연기에 균질적으로 조영증강(Fig. 1D) 되었는데, 이는 섬유화를 동반한 염증성 가성 종괴를 시사하는 소견이다. 위에서 열거한 소견들을 토대로 AIP를 의심할 수 있었으며, 혈청 IgG4는 정상이었고, 1형에서 동반되는 타 기관 침범이 관찰되지 않는 점 그리고 연령과 증상을 고려하였을 때 1형보다는 2형 AIP를 강력히 의심하여 확진을 위해 초음파 내시경 유도하 췌장 생검을 시행하였다.
ICDC는 2011년에 도입되었다[10]. ICDC 도입 이전에는 2형 AIP를 진단하기 위해서 췌장조직에서 GEL을 보는 것이 필수였다. 여기서 문제는 초음파 내시경을 이용한 췌장 생검의 경우 비록 중심부 생검(core biopsy)을 하더라도 획득한 췌장조직이 충분하지 않아서 췌관 구조가 생검 조직에서 포함되지 않을 수 있다는 것이다. ICDC 도입으로 비록 GEL을 관찰하지 못하더라도 호중구 선방 침윤(acinar neutrophil infiltration)이 있는 경우 염증성 장질환(Inflammatory bowel disease)이 동반되고, 스테로이드에 반응을 보이면 2형 AIP를 확진할 수 있다. 뿐만 아니라 염증성 장질환이 있고 스테로이드에 대한 반응이 있을 경우, 조직 소견이 없어도 2형 AIP로 추정진단(probable type 2 AIP)할 수 있다. 따라서 ICDC의 도입으로 2형 AIP 진단에 있어서 췌장조직 소견에 대한 의존도가 줄었고, GEL을 관찰하지 않고도 2형 AIP를 확진할 수 있게되었다[5]. 본 증례는 췌장 생검에서 GEL을 관찰할 수 있어서 2형 AIP로 확진할 수 있었고, 스테로이드 투여 후 췌장실질과 췌관 이상 소견의 현저한 호전을 관찰하여 2형 AIP를 최종 확인하였다(Figs. 1 and 3).
본 증례의 경우 급성췌장염의 임상 양상을 보이는 2형 AIP로, 음주력이나 담석 등의 흔한 췌장염 발생인자가 관찰되지 않았고, 청소년의 급성췌장염 원인이 될 수 있는 외상 및 다른 전신 질환이 없어 원인 미상의 췌장염으로 분류될 수 있었다. 청소년에서 AIP를 진단하기 위해서는 이에 대한 의심이 선행되어야 하고, 이를 위해서는 AIP의 특징적인 췌장 영상 소견을 평소에 숙지하고 있는 것이 필요하다. 즉 복통이나 급성췌장염으로 발현한 환자의 췌장 영상 소견이 일반적으로 알려져 있는 급성췌장염의 영상 소견과 맞지 않을 때 AIP에 대한 감별 진단이 필요하겠다. 소아 청소년에서 2형 AIP와 비슷한 임상 소견을 보이지만 성인과 같은 임상 경과(예를 들어 낮은 재발률)를 보일지에 대해서는 장기간에 걸친 추적 검사가 필요하다. 소아 청소년에서 조기 발현한 2형 AIP의 경우 성인과 달리 발병기전에 유전자 이상 등이 관여 하는지에 대한 연구도 추가적으로 필요하다.
이상을 요약하면 본 증례는 청소년에서 췌장 종괴를 동반한 급성췌장염의 임상 양상을 보이는 2형 AIP로 췌장 생검조직 소견과 영상 소견 그리고 스테로이드 치료 반응을 종합하여 수술을 시행하지 않고 2형 AIP를 확진 및 치료한 증례 이다.