혈전미세혈관병증의 감별 진단과 치료
Differential Diagnosis and Treatment of Thrombotic Microangiopathy Syndrome
Article information
Abstract
TMA는 다양한 원인에 의하여 발생하므로 감별 진단이 중요하며 신속한 초기 대처와 함께 전문적인 검사 결과들을 종합하여 확진해야 하는 질환이다. 최근 진단 검사법과 치료제의 발전이 두드러지는 질환군으로 정확한 진단과 그에 따른 올바른 치료법의 설정으로 치료 성적을 향상시킬 수 있다.
Trans Abstract
Diagnosis of thrombotic microangiopathy (TMA) is challenging due to its close association with other forms of microangiopathic hemolytic anemia, such as malignant hypertension and disseminated intravascular coagulation, and because other manifestations including cytopenia and acute kidney injury are manifestations of other medical comorbidities. Further challenges for accurate diagnosis include distinguishing between primary and secondary TMA, as well as between hemolytic uremic syndrome (HUS) and thrombotic thrombocytopenic purpura (TTP). TTP is typically differentiated from HUS by the presence of more severe thrombocytopenia, along with a higher frequency of altered mental status with relatively preserved renal function. However, the clinical course can vary among patients, requiring polymerase chain reaction testing of patient stools for enterohemorrhagic Escherichia coli and a disintegrin and metalloproteinase with thrombospondin type 1 motif 13 (ADAMTS13) assay. To reduce the mortality rate, prompt initiation of plasmapheresis is important in cases where TPP cannot be excluded. Future advances enabling more rapid testing for ADAMTS13 levels will reduce the need for unnecessary plasmapheresis, so that treatment strategy can be more optimized.
증 례
34세 여자가 의식 저하로 왔다. 3주 전부터 피로, 발열을 호소하였고 3일 전부터 증상이 심해지며 황달과 함께 처지는 모습을 보이더니 내원 당시에는 의식이 혼미(stupor)한 상태였다. 혈액 검사에서 혈색소 8.1 g/dL, 백혈구 8,100/μL, 혈소판 4,000/μL였으며 혈중요소질소 33.4 mg/dL, 크레아티닌 1.4 mg/dL, 총 빌리루빈 7.4 mg/dL, 직접빌리루빈 1.6 mg/dL, aspartate aminotransferase와 alanine aminotransferase는 각각 55, 60 IU/L였다. 최근 혈성 설사의 병력은 없었다. 직접 및 간접 쿰스 검사는 음성이었고, 혈액펴바른표본에서 분절적혈구(schistocytes)가 전체 적혈구의 5%에서 관찰되었다. 혈전성혈소판감소자반증(thrombotic thrombocytopenic purpura, TTP)을 의심하였다. 장출혈성대장균에 대한 분변 다중 polymerase chain reaction (PCR) 검사와 a disintegrin and metalloproteinase with thrombospondin type 1 motif 13 (ADAMTS13) 효소 활성도 검사를 시행하고 즉시 혈장교환술을 시작하였다.
혈전미세혈관병증(thrombotic microangiopathy syndrome, TMA)은 미세혈관용혈빈혈(microangiopathic hemolytic anemia, MAHA), 혈소판감소증 그리고 그로 인한 장기 손상에 기반한 임상 증후군이다. 소동맥과 모세혈관 수준에서 혈전증을 동반한 미세혈관 손상이 병리학적인 공통 소견이다. 원인은 다양하여 1차성으로는 대개 후천적인 자가면역 기전에 의한 ADAMTS13 효소의 결핍 혹은 활성 저하로 발생하는 TTP, 장출혈대장균 감염에 합병하는 시가독소에 의한 용혈요독증후군(Shiga toxin-producing Escherichia Coli [E. Coli]-hemolytic uremic syndrome; STEC-HUS), 유전적 요인 등으로 인한 지나친 보체 활성화에 의한 용혈요독증후군(complement-mediated HUS 혹은 atypical HUS [aHUS])이 있으며 2차성 요인으로는 악성종양, 약제, 임신, 이식 등에 합병하는 TMA가 있다. 좋은 치료 결과를 얻기 위하여 신속하고 정확한 진단이 중요하지만 환자마다 다양하고 복잡한 임상 양상을 동반하는 경우가 많아 감별 진단이 어려운 경우가 많다.
TMA의 의심과 원인 진단을 위한 첫 단계
환자가 적어도 MAHA와 혈소판감소증을 동반하고 있다면 TMA 가능성을 고려해야 한다. MAHA는 1) 진행하는 빈혈과 함께 망상적혈구와 젖산탈수효소의 증가, 합토글로빈 감소 등 용혈을 시사하는 검사 결과를 보이고, 2) 면역 기전에 의한 적혈구 용혈을 시사하는 쿰스 검사가 음성이며, 3) 혈액펴바른표본에서 미세혈관 손상에 특징적인 분절적혈구가 관찰되는 경우로 정의할 수 있다. 혈액펴바른표본에서 종종 보고되는 소수의 분절적혈구는 TMA 이외의 경우에도 드물지 않게 관찰되며 대부분 적혈구계 조혈 기능의 재생 등을 반영하는 비특이적 소견이다. International Council for Standardization in Hematology에서는 최적의 광학현미경 분석 조건에서 적어도 1,000개의 적혈구를 관찰한 후 분절적혈구의 비율을 %로 표기하도록 권고하고 있으며 TMA를 의심하기 위해서는 분절 적혈구가 적혈구의 가장 주된 형태학적 이상이면서 1%를 초과해야 한다고 제안하였다[1].
전통적으로 MAHA, 혈소판감소증 그리고 급성 신손상을 HUS의 3대 증상 및 징후로 보고, 발열과 신경학적 이상을 더하여 TTP의 5대 증상 및 징후로 간주하지만 반드시 각각 3가지 혹은 5가지를 모두 발현하는 것은 아니며, 각 증례마다 증상과 증후의 발현이 매우 다양하여 정확한 진단이 쉽지 않은 경우가 많다. 우선 TMA 이외의 다른 원인으로 MAHA를 동반하는 경우를 감별해야 하는데 가장 대표적인 경우는 파종혈관내응고(disseminated intravascular coagulation, DIC)이다. TMA에서는 DIC와 달리 응고인자 결핍이 없어 정상 프로트롬빈과 활성부분프롬보플라스틴 시간을 보이는 것으로 대체로 감별이 가능하다. 악성 고혈압의 경우 미세혈관의 손상으로 인한 MAHA 소견을 보이는데 문헌에 따라 TMA의 한 종류로 포함하기도 하고 TMA 이외의 원인으로 따로 분류하기도 한다. TTP와 거의 동일한 임상 양상을 보이나 발현시 심한 고혈압을 동반하며 혈압을 조절하면 MAHA가 소실되는 것으로 감별이 가능하다. 이후에는 악성종양, 면역억제제 등의 약제, 임신, 고형장기이식, 조혈모세포이식, 각종 바이러스 감염이나 폐렴구균 감염 등 다양한 원인들에 합병하는 2차성 TMA 여부를 확인해야 한다. 약제에 의한 TMA는 quinine계 약물, gemcitabine과 oxaliplatin 등의 항암제, 일부 항생제 및 면역조절제 사용 후 면역학적인 기전으로 발생하는 경우와 주로 cyclosporine, tacrolimus 등 면역억제제들에 의한 용량의존 독성 기전에 의한 TMA로 세분할 수 있다. 임신에 의한 TMA는 기존에 TMA의 발생 요인을 가지고 있던 환자에서 임신이 유발 인자로 작용하여 발생하는 경우가 많다. 악성종양에 의한 TMA는 미세 순환의 장애, 종양에 의한 미세혈전증 등 여러 가지 기전에 의하여 발생한다.
TMA의 원인에 따른 증상과 징후, 검사 결과의 차이
DIC와 악성 고혈압 그리고 2차성 TMA들이 배제된 후에는 TTP와 STEC-HUS 그리고 aHUS 간의 감별이 필요하다. 혈성 설사를 동반하고 있거나 근래의 병력이 있으면서 급성 신손상이 심하고 혈소판감소증은 비교적 경미하다면 STEC-HUS를 먼저 의심할 수 있다. 반면 혈성 설사 병력이 없으면서 HUS에 더 가까운 임상 양상이라면 aHUS의 가능성을 염두에 두어야 한다. 크게 보아, TTP의 경우 혈소판감소증이 심하나 급성 신손상은 대부분 경증에 그치는 데에 반하여 HUS 환자는 급성 신손상에 의한 신기능 저하가 심하지만 혈소판감소증은 경미한 편이다. 그러나 92명의 TTP 환자를 대상으로 한 후향 연구에서는 15%의 환자가 신대체 요법이 필요했다고 보고하였다[2]. 또한 46명의 aHUS 환자들 가운데 17%에서는 증상 발현시 혈청 크레아티닌이 정상 범위였다는 보고도 있어[3] 혈소판 수치와 신기능 손상 정도에 따라 TTP와 HUS를 온전히 구분하는 것은 무리이다. 신경학적 증상 역시 TTP에 보다 흔하나 STEC-HUS 혹은 aHUS 환자에서도 10-30%는 동반이 가능하므로 이를 통하여 둘을 구분하기는 어렵다.
TMA의 감별 진단을 위한 검사들
TMA가 의심되는 환자에게 우선 시행해야 하는 검사는 1) STEC-HUS 여부 확인을 위한 혈성 설사 원인균들에 대한 분변 다중 PCR 검사와 2) 후천성 TTP 진단을 위한 ADAMTS13 활성도 검사이다(Fig. 1). 분변 다중 PCR 검사는 패널의 형태로 제작되어 O157을 포함한 혈성 설사의 원인이 되는 E. coli 균들의 감염 여부를 확인할 수 있는 검사이다. ADAMTS13은 비정상적으로 긴 길이로 생성되어 혈장 내에 존재하는 von Willebrand factor (vWF) 다중합체(unusually large vWF; UL-vWF multimer; UL-vWF)를 적절한 크기로 잘라 분해하는 metalloproteinase계의 효소이다. UL-vWF는 혈소판 접착능이 매우 크기 때문에 ADAMTS13 효소의 활성이 저하될 경우 미세혈관 내의 심대한 혈소판 응집으로 인한 심각한 장기 손상을 초래한다. 이와 같은 이유로 TTP는 치료하지 않으면 결국 거의 대부분이 장기부전으로 사망하는 치명적인 질환이며, TTP가 강력히 의심될 경우 치료인 혈장교환술을 신속히 시행해야 한다. ADAMTS13 활성도 검사는 SDS 아가로스 겔 전기영동법이나 fluorescence resonance energy transfer (FRET)법을 통하여 시행하는데 국내에서는 실제 검사가 가능한 곳이 제한되어 있어 대부분의 의료기관에서 외주 검사로 시행하고 있다. 대부분 진단 초기에는 환자가 어떤 형태의 TMA인지 알지 못하지만 TTP의 진행으로 인한 치명적인 결과를 막기 위하여 우선 혈장교환술을 시행하게 된다.
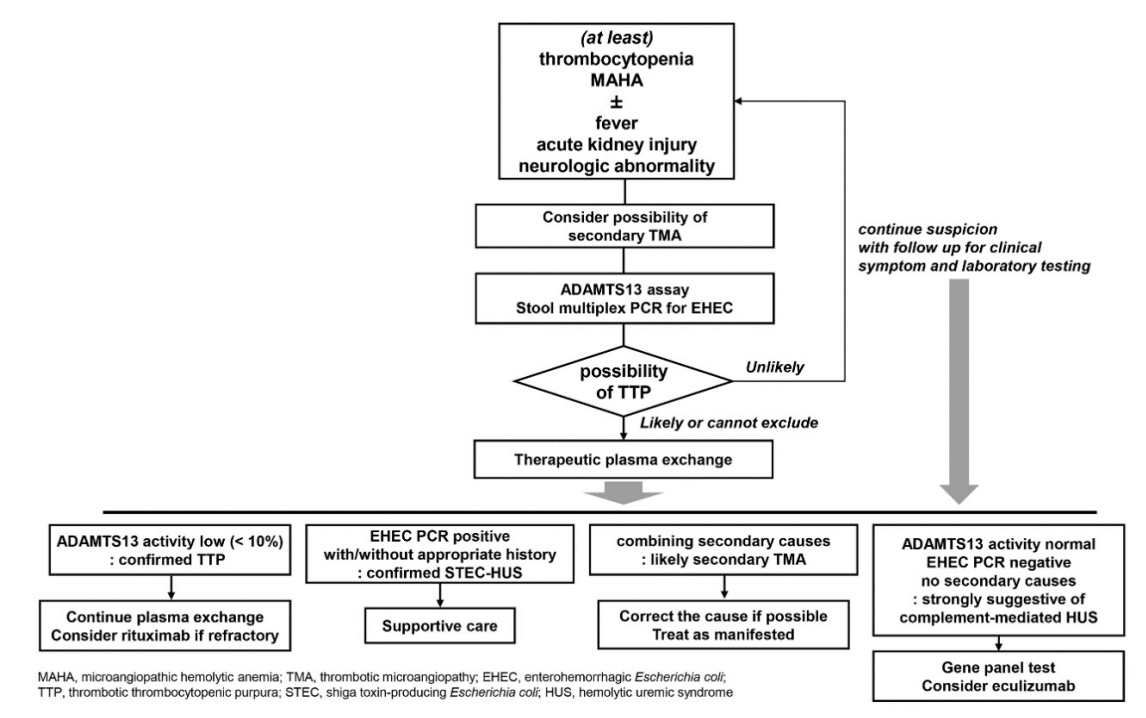
Suggested diagnostic algorithm for thrombotic thrombocytopenic purpura in adults. MAHA, microangiopathic hemolytic anemia; TMA, thrombotic microangiopathy; ADAMTS13, a disintegrin and metalloproteinase with thrombospondin type 1 motif 13; PCR, polymerase chain reaction; EHEC, enterohemorrhagic Escherichia Coli; TTP, thrombotic thrombocytopenic purpura; STEC-HUS, Shiga toxin-producing Escherichia Coli-hemolytic uremic syndrome.
TMA의 2차성 요인이 없으면서 분변 검체의 장출혈대장균 PCR 검사와 ADAMTS13 효소 활성도 검사 결과가 정상이라면 보체의 만성적이고 비정상적인 활성화로 인한 aHUS를 의심해야 한다. aHUS는 대개 유전적 요인에 의하여 보체 기능을 조절하는 단백질들을 발현하는 유전자들이 돌연변이를 일으켜 비정상적으로 활성화 또는 억제되어 발생한다. 해당 유전자들의 이상으로 인한 단백 활성의 변화가 매우 저명한 경우 소아 때부터 발생하지만 발현도가 상대적으로 낮은 경우 감염, 임신, 출혈 등의 특정 유발 인자들(triggers)에 의하여 촉발되어 성인기에 나타난다. 대략 1/3에서 첫 발병 후 사망 혹은 영구적인 신기능 손상을 겪게 된다. 유발 인자가 해소되면서 증상이 호전된 환자들도 여전히 유전적 취약성은 있기 때문에 대략 2/3에서는 궁극적으로 사망 혹은 영구적인 신대체 요법을 겪게 된다[4]. C3, C4, CH50 등 혈중 보체들의 감소를 확인하는 혈청학적 검사는 보조적인 역할을 하나 다른 비특이적 요인들에 의한 변동이 크기 때문에 진단적이지 않다. 따라서 정확한 진단을 위하여 보체 활성 관련 유전자 이상을 확인해야 하며 해외는 물론 국내의 진료 지침에서도 다른 원인이 없는 모든 경우의 aHUS 의심 환자에서 포괄적인 유전자 분석을 권고하고 있다[5]. CFH, CFI, MCP, C3, CFB, THBD 그리고 DGKE 등의 주요 유전자들의 이상을 차세대염기분석법 등으로 확인하는 유전자 패널 검사가 필요하다. 그 외 MCP (CD46)에 대한 말초혈액단핵구를 이용한 유세포분석법과 후천적 요인으로 aHUS를 유발할 수 있는 항H인자 자가항체 생성 여부를 확인하는 검사가 도움이 된다. 다만 끝까지 aHUS에 합당한 임상 소견을 보이는 환자들의 약 절반에서만 이와 같은 유전자 중 하나의 이상이 확인되기 때문에, 유전자 이상이 없다는 이유로 aHUS를 배제 진단할 수는 없다[6].
주요 TMA의 치료
2차성 요인에 의한 TMA의 경우 해당 원인을 적절히 제거하는 것이 필요하다. 약제에 의한 TMA는 적절한 초기 대처와 함께 유발 약제의 사용 중단이 중요하다. 악성종양에 의한 TMA의 경우 90% 이상의 환자들이 진단시 전이암을 동반하여 원인 인자 제거가 현실적으로 어려운 경우가 많다. 2차성 TMA라도 환자의 유전적 혹은 면역학적 요인에 따라 ADAMTS13의 결핍을 초래하여 TTP의 형태로 나타날 수도 있고, aHUS의 형태로 나타날 수도 있으므로 TMA에 대한 일반적인 검사와 적절한 초기 대처가 필요하다.
과거 TTP는 대부분의 환자들이 장기 부전 등으로 사망하는 치명적인 질환이었으나 1990년대 이후 혈장교환술이 TMA의 치료에 도입됨으로써 TTP의 치료 성적이 획기적으로 향상되었다. 혈장교환술을 통하여 환자 혈장 내의 UL-vWF를 제거하고, 정상 기능을 하는 ADAMTS13 효소를 공급할 수 있다. 현재 TTP의 표준 치료법은 의심이 되는 즉시 혈장교환술을 혈액학적 이상과 증상이 소실될 때까지 매일 시행하는 것이다. 하루에 최대 2회까지 혈장교환술을 권고하는데 현실적으로 하루 2회가 어려울 경우 1회당 교환하는 혈장의 양을 가능한대로 늘려 볼 수 있다. 스테로이드는 단독 사용으로는 역부족이나 혈장교환술에 보조적으로 사용할 수 있다. TTP 외의 다른 TMA에서 혈장교환술의 역할은 효과가 없거나 보조적인 데에 그치는데 이는 혈장교환술 자체로는 발병의 원인을 해결할 수 없기 때문이다. 따라서 TTP라면 우선 시행하지 않을 경우 치명적인 결과를 가져올 것을 우려하여 확정 진단 전까지 우선 혈장교환술을 시행하더라도, ADAMTS13 검사 결과 효소의 억제 소견이 없는 대부분의 경우 혈장교환술을 중단해야 한다. HUS에서는 혈장내 과활성화된 보체를 제거하거나 이를 유발하는 독소를 제거하는 일시적이고 보조적인 역할을 기대할 수 있으나 치료 지속의 근거는 없다.
혈장교환술에 반응하지 않거나 의존적인 일부 TTP 환자에서는 CD20에 대한 키메릭 단클론 항체제인 리툭시맙이 효과적인 치료제이다. Froissart 등[7]은 혈장교환술에 불응인 TTP 환자 22명을 대상으로 리툭시맙을 사용하는 2상 임상시험을 시행하였는데 조기 사망한 1명을 제외한 21명 모두에서 35일 이내에 혈소판 수치의 회복을 보였고 1년 이내의 재발이 보고되지 않았다. 다만 리툭시맙 치료는 투약 후 바로 효과가 나타나지는 않아 Froissart 등[7]의 연구에서는 첫 투약 후 혈소판 수치 상승까지 평균 12 ± 6, 7일의 시간이 필요했으며, 1년 이후의 늦은 재발이 종종 발생하였다. 최근에는 혈소판의 GP1b와 UL-vWF 간의 결합을 방해하는 항 vWF 항체인 카플라시주맙(caplacizumab)이 개발되어 TTP 환자에서 관해에 이르는 기간을 효과적으로 단축시켰다[8].
STEC-HUS 환자의 대부분이 적절한 수액 치료 등의 보존적 요법으로 호전되는데 반하여(Table 1) [9] aHUS는 상대적으로 예후가 불량한 것이 문제이다. C5a에 대한 항체제제인 에쿨리주맙(eculizumab)이 발작야간혈색소뇨증(paroxysmal nocturnal hemoglobinuria)에 이어 aHUS에서 좋은 효과를 보여 현재 1차 표준 치료로 인정받고 있다. 대다수의 환자에서 혈액학적 호전을 얻을 수 있고, 조기에 사용할 경우 신기능 보전에도 도움이 된다[10].
고 찰
악성 고혈압과 DIC를 비롯, 다른 여러 원인들에 의한 급성 신손상이나 혈구 수 이상 등이 매우 다양하게 나타날 수 있기 때문에 TMA는 내과계 질환 중 경과가 역동적이면서 섬세한 감별 진단이 필요한 증후군 중 하나이다. 초기 사망률을 줄이기 위하여 가장 중요한 점은 TMA 가능성이 있는 환자를 의심하고 중증 TTP의 가능성을 배재할 수 없다고 판단 시 신속하게 혈장교환술을 시행하는 것이다. 장래에는 ADAMTS13 검사 결과를 보다 신속히 얻게 됨으로써 불필요한 혈장교환술의 시행을 줄이고 최적의 치료를 조기에 시행할 수 있을 것으로 기대된다. TTP와 같은 심각한 경과를 밟는 경우 외에 환자가 TMA가 맞는지 불확실한 상황을 맞게 되는 경우도 종종 있는데 한두 번의 검사 결과로 단정하기 보다는 임상경과와 혈액 검사 결과, 분절적혈구 수의 시간에 따른 변화를 종합하여 판단해야 하고, 임상의와 검사의학 의사 간의 긴밀하고 지속적인 의사소통이 필요하다. 물론 악화 의심시 신속한 혈장교환술 시행을 고려해야 한다.
실제 국내에서 TMA를 진단하고 치료하는 과정에서는 필수적인 검사들의 전문성 및 치료제에 대한 접근의 어려움과 경제적 문제가 장애물이 되는 경우가 많다. 연구자들의 꾸준한 노력과 에쿨리주맙의 등장 등으로 인하여 TMA에 대한 의료인의 인식은 향상되었고 ADAMTS13 검사도 이전보다 대중화되었으나 아직도 실제 검사를 진행할 수 있는 기관은 제한되어 있는 것이 실정이며 aHUS에 대한 유전자 패널 검사가 가능한 곳도 드물고 긴 검사 소요 시간도 문제이다. 연간 수억 원에 이르는 고가의 약제비로 인하여 급여 사용에 대한 심사를 사전에 받아야 하는 에쿨리주맙의 경우를 차치하더라도 혈장교환술에 반응하지 않는 TTP 환자에서 리툭시맙을 사용하기 위해서는 허가 초과 사용에 대한 심의를 각 기관별로 받고 환자 전액 본인 부담으로 사용해야 한다. 이후에 등장할 다른 항보체제제나 항 vWF 항체 등과 관련된 사회경제적 문제도 계속 대두될 것으로 예상되므로 TMA의 진단과 치료에 대한 연구와 함께 희귀 난치 질환 전반에 대한 사회적 인식 향상을 위한 노력이 필요하다. 현실적으로는 해당 질환을 전문적으로 연구하고 치료하는 의사와 적극 교류하며 진단과 치료를 진행하고 필요 시 적절한 시점에 환자를 의뢰하는 방법과 TMA 관련 신약 임상시험에 적극적으로 환자들을 등록하는 것이 도움이 될 수 있다.
