2018 대한부정맥학회 심방세동 환자에서 NOAC 사용 지침: 출혈의 대처와 수술 전후 복약관리
The 2018 Korean Heart Rhythm Society Practical Guidelines on the use of Non-Vitamin K-Antagonist Oral Anticoagulants: Bleeding Control and Perioperative Management
Article information
Trans Abstract
Although non-vitamin K-antagonist oral anticoagulants (NOACs) reduce major bleeding events in patients with atrial fibrillation more effectively than does warfarin, a significant bleeding risk remains. Patients exhibiting current bleeding and those who are expected to bleed require appropriate management, because NOAC discontinuation may increase the thromboembolic risk. This article details general management principles for patients experiencing current bleeding and those undergoing invasive surgery while on NOACs.
서 론
심방세동 환자에서 혈전색전증을 예방하기 위해서는 항응고 치료가 필수적이다. 비-비타민K 길항 항응고제(non-vitamin K antagonist oral anticoagulant [NOAC], 다비가트란, 아픽사반, 리바록사반, 에독사반)는 비판막성 심방세동 환자들을 대상으로 시행한 여러 무작위 대조군 연구에서 비타민K 길항제(와파린)에 비하여 우월한 안전성을 보여주었다[1-4]. 이를 바탕으로 2015년 국내 보험 급여가 인정된 후부터 국내 NOAC 사용은 빠르게 증가하는 추세이며, 이에 따라 전체적인 비판막성 심방세동 환자들의 항응고 치료율도 고무적으로 높아지고 있다[5]. NOAC가 와파린보다 안전한 이유는 뇌출혈의 발생 위험을 와파린에 비하여 크게 줄여서이다[6]. 하지만 위장관 출혈 위험은 NOAC 사용군이 오히려 와파린 사용군보다 다소 높은 것으로 알려져, NOAC는 사용함에 있어서 여전히 주의가 필요하다[6].
임상에서 출혈이 발생한 NOAC 환자들과 현재 출혈은 없으나 향후 출혈이 예상되는 NOAC 환자들을 적절히 처치하는 것은 매우 중요하다. 불필요하게 NOAC를 오랫동안 중지하면 오히려 혈전색전증의 발생 위험이 높아지기 때문이다. 대한부정맥학회는 최신 지견 및 진료 지침을 종합하여; 1) NOAC 복용 중 출혈이 발생한 환자들을 치료할 때 적절한 치료 지침, 2) 수술/시술 전후 NOAC 복용 방법에 대한 지침, 3) 응급 수술이 필요한 상황, 4) NOAC의 항응고 치료 효과 측정 및 복용 중 발생할 수 있는 기타 상황에 대하여 소개하고자 한다.
본 론
NOAC 복용 중 출혈의 대처
NOAC에 대한 3상 임상연구들은 NOAC이 와파린에 비하여 뇌출혈과 생명을 위협하는 중요 출혈을 감소시킨다는 것을 보여주었다. 하지만 앞으로 더욱 많은 환자들이 NOAC로 항응고 치료를 받을 것을 고려하면, NOAC 관련 출혈은 점점 증가할 것으로 예상된다. 따라서 출혈과 관련하여 NOAC의 올바른 선택과 투약의 기준을 설정하고 적절한 혈압 조절, 불안정한 international normalized ratio (INR; 와파린의 경우)의 교정 그리고 교정 가능한 다양한 출혈 위험인자를 평가하는 것이 중요하다. 그러기 위해서는 다양한 의료진의 다학제적 접근이 필요하며, 출혈에 관한 포괄적인 관리가 필요하다. 이러한 포괄적인 관리 체계에서는 혈액응고 검사를 포함하여 비특이적 또는 특이적 역전 약물의 사용에 관한 규정도 포함하고 있어야 한다. 이러한 약물의 사용과 검사들은 병원내 의료진이 쉽게 접근할 수 있어야 하며, 필요시 즉각적인 사용이 가능해야 한다.
출혈과 관련한 적절한 대처를 하기 위해서는 다음과 같은 임상 상황을 따져보아야 한다; 1) 출혈의 유형: 경미한 출혈, 생명을 위협하지 않는 중대한 출혈, 생명을 위협하는 중대한 출혈, 2) 환자 치료력: 마지막 NOAC 복용량, 복용한 용량, 신장 기능, 혈장 농도에 영향을 미치는 다른 인자 및 지혈에 영향을 미치는 기타 요인(항혈소판제제의 병용 사용).
일상적인 응고 검사와 NOAC의 혈장 농도를 구체적으로 측정하는 검사는 NOAC 관련 출혈의 평가에서 매우 중요하다. 정상적인 diluted thrombin time (dTT)/ecarin clotting assay (ECA)를 보이고 항 FXa 활성도(anti-FXa 치료 환자의 경우)가 정상인 경우 항응고약물의 농도가 높지 않음을 알 수 있으며, 특정 분석법을 통해 항응고약물의 혈장 수준을 정량화할 수 있다. 그러나 응고의 회복이 반드시 임상 결과의 향상을 가져오는 것은 아니라는 점을 명심해야 한다. 반대로, 종래의 응고 검사는 NOAC 그 자체의 효과뿐만 아니라 환자의 상태와 관련된 다양한 이유로 (특히 심한 출혈의 상황에서는) 비정상적으로 나타날 수 있다.
임상 양상에 따라 NOAC를 사용하면서 발생한 출혈 환자의 항응고제 효과는 다음과 같은 전략으로 해결할 수 있다. 1) NOAC의 자연적 제거: 항응고 효과가 약물의 자연적 제거로 인하여 정상화되기를 기다린다. 이러한 효과는 환자의 이뇨를 유지함으로써 더욱 촉진된다. 2) 역전제의 사용: 이다루시주맙(idarucizumab)은 다비가트란과 특이적으로 결합하는 항체로 다비가트란의 역전제로 유일하게 상용된 약제이며, 다비가트란으로 인한 치명적인 출혈에 매우 효과적으로 사용할 수 있다[7]. Xa 억제제의 역전제로 안덱사네트 알파(andexanet alpha)가 있으며, ciraparantag는 좀 더 폭넓은 길항작용을 갖는 작은 합성 분자이나 이 두 가지 약제는 아직 상용화되지는 않았다. 3) 비특이적 응고 인자 농축물의 사용: NOAC를 복용하면서 발생한 출혈 환자 연구에서 프로트롬빈 복합 농축물(prothrombin complex concentrate [PCC])의 효과에 대한 긍정적인 결과들이 보고되고 있다. 하지만 국내에는 현재 PCC가 허가되지 않아 사용할 수 없는 실정이다. 한편 신선한 냉동혈장(fresh frozen plasma)은 출혈의 치료를 위하여 새로 투여된 응고 인자들의 희석 효과 및 많은 혈장량의 증가로 인하여 유용한 역전 전략으로 간주되지 않는다. 비타민 K와 프로타민의 투여는 NOAC 복용 중 발생한 출혈을 조절하는데 아무런 역할을 하지 않지만, 비타민 K 결핍이 의심되는 경우, 또는 헤파린이 병용된 경우에 유용할 수 있다.
경미한 출혈
NOAC 치료에 따른 소화기 불편감과 경미한 출혈은 NOAC 사용 중단의 빈번한 원인이기 때문에 과소 평가되어서는 안 된다. 환자는 그러한 출혈의 징후와 증상을 인지하고, 출혈이 발생했을 때 의료인에게 즉시 알려야 한다. 의사의 판단 없이 임의로 중단할 경우, 혈전색전증의 위험이 증가할 수 있다. 경미한 출혈은 일반적으로 NOAC를 최대 1회 복용량만큼 중단시킴으로써 조절할 수 있다. 출혈의 원인을 파악한 후 적극적인 치료가 필요할 수 있다. 위궤양의 경우 프로톤 펌프 억제제(proton pump inhibitor), 요로감염의 경우 항생제 등이 도움이 되며, 코피 및 잇몸 출혈은 국소 항섬유소용해제(anti-fibrinolytics)로 치료할 수 있다. 만약 원인을 발견하기 힘든 경미한 출혈이 재발하는 경우에는 다른 종류의 NOAC로 변경을 고려해야 한다.
생명을 위협하지 않는 중대한 출혈
생명을 위협하지 않는 중대한 출혈의 치료에서 가장 중요한 것은 표준화된 보존적치료이다(기계적 압박, 내시경 또는 외과적 지혈, 수액, 수혈 등등). 모든 NOAC의 반감기가 비교적 짧은 것을 고려한다면, 항응고제 활성은 비교적 짧은 시간 안에 회복될 것으로 예상된다(Table 1, Fig. 1). 그리고 NOAC의 체내 빠른 배출을 위해서는 적절한 이뇨가 권장되지만, 약물이 신장으로 배출이 많은 다비가트란의 경우, 특히 심각한 신부전증이 동반된 환자의 경우라면 투석이 적절한 치료 방침이 될 수 있다. 그러나 Xa 억제제로 치료받은 환자는 약제의 특성상 단백질과 결합력이 높아 투석은 지혈에 큰 도움을 주지 못한다. 항섬유소용해제(tranexamic acid) 또는 데스모프레신이 특수 상황에서 도움이 될 수 있다. 특히 Tranexamic acid는 외상으로 인한 출혈에서 지혈을 안정적으로 유도하는 것이 입증되었다.
생명을 위협하는 중대한 출혈
NOAC를 복용하는 도중 발생한, 생명을 위협하는 중대한 출혈의 경우, 위에서 요약한 표준 조치 이외에 역전제가 도움이 될 수 있다[8,9]. 역전제의 투여 후에도 일부 환자에서는 NOAC 활성 농도가 다시 나타나기 때문에 재발성 또는 지속적인 출혈(특히 안덱사네트 알파 투여 이후 일부에서 보고됨, 이다루시주맙의 경우에는 드물다)이 발생할 수 있어, 지속적인 임상 증후 및 혈액 검사의 모니터링이 필요하다[8,9]
이다루시주맙
이다루시주맙은 Reversal effects of idarucizumab in patients on active dabigatran (REVERSE-AD) 연구에서 생명을 위협하는 중대한 출혈이나 응급 수술이 필요한 환자(다비가트란을 복용 중인)에게 사용되었다. 이다루시주맙은 거의 모든 환자에서 다비가트란의 항응고제 활성을 수 분 만에 완전히 회복시켰다. 따라서, 이러한 응급 상황에서는 1차 요법으로 권장되며, 총 5 g의 이다루시주맙이 투여된다. 정맥 내로 2.5 g의 2 바이알을 각각 15분 이내의 간격으로 투여한다. 5 g 용량의 이다루시주맙이 예외적으로 다비가트란을 완전히 중화시키지 않을 수 있기 때문에(예: 과다 복용 또는 신기능 저하 환자의 경우) 임상 증후 및 혈액 검사를 통한 모니터링을 계속하는 것이 좋다. 환자의 상태가 안정되었다면, 24시간 후 다비가트란은 다시 시작할 수 있다.
아픽사반, 에독사반, 리바록사반(FXa 억제제)의 역전제
현재 진행 중인 Andexanet alfa, a novel antidote to the anticoagulation effects of fxa inhibitors study-4 (ANNEXA-4)의 연구를 바탕으로, 안덱사네트 알파는 생명을 위협하는 Xa 억제제에 의한 출혈을 치료하는데 첫 번째 선택이 될 수 있다[8]. 그러나 이 약제의 사용 허가 및 출시는 아직 미정이다. ANNEXA-4 연구에서 약물은 15-30분에 걸쳐 정맥으로 투여되고, 이어서 2시간 동안 정맥으로 주입되었다. 투여량은 NOAC 종류와 마지막 복용 후 시간에 따라 달라진다. 리바록사반(역전시도 전 마지막 복용이 7시간이 넘을 경우) 또는 아픽사반의 경우 400 mg 초기 투여와 480 mg의 유지 용량(4 mg/min)이 투여된다. 리바록사반(역전시도 전 마지막 복용이 7시간 미만이거나 알 수 없는 경우) 및 에독사반의 경우 800 mg의 초기 투여와 960 mg의 유지 용량(8 mg/min)이 주입된다. 하지만 일부 환자에서 투여를 멈춘 후에 항응고제 활성이 다시 나타날 수 있으며, 어느 시점에서 항응고제 효과가 다시 나타나는지는 아직 확실치 않기 때문의 임상 증후 및 혈액 검사를 통한 모니터링을 계속하는 것이 필요하다.
응고 인자
NOAC에 대한 임상 시험 및 등록 연구에서 출혈로 인한 응고 인자의 투여는 거의 필요하지 않았다. 실제로 NOAC의 역전 효과로 인하여 잠재적 혈전증의 부작용이 발생할 수 있음을 항상 고려해야 한다. 지혈 효과를 응고 인자 정상화 관점에서 본다면 1상 및 2상 임상연구를 통하여 PCC와 activated PCC (aPCC)의 잠재적 유용성을 보여주었다. PCC/aPCC는 국내에 허가되지 않아 사용할 수 없는 실정이나 3상 임상 시험에서 와파린이나 NOAC로 인한 출혈 모두에서 비슷한 지혈 효과를 보여주었다[10-12]. PCC/aPCC는 NOAC으로 인한 활성 출혈 환자에서 지혈 효과가 무작위 연구에서 확고히 입증되지는 않았으나 많은 관찰 연구에서 지혈을 유도하는데 효과적이었던 것으로 나타났다[13]. PCC/aPCC의 투여는 즉각적인 지혈 보조가 필요하고, 역전제를 사용할 수 없는 경우(Table 1), 생명을 위협하는 중대한 출혈이 발생한 환자에서 고려할 수 있다. PCC와 aPCC 사이의 선택은 치료 센터의 경험과 가용성 여부에 달려 있다. 특히 aPCC는 강력한 응고 응집 효과를 유도하기 때문에 사용 경험이 있는 전문 의사에 의하여 신중하게 사용되어야 한다.
외과적 출혈 이후 항응고 치료
경미한 출혈의 경우, 항응고 치료를 다시 시작할 수 있다. 때로는 1회 투여를 중단한 이후 다시 사용할 수 있다. 생명을 위협하는 중대한 출혈의 경우, 항응고를 재개할 때 위험성과 이점을 면밀히 재평가해야 한다. 2차적 원인(외상 후 출혈 등) 또는 가역적 원인(암으로 인한 비뇨생식기 출혈 등)으로 인한 출혈은 출혈의 원인이 제거되면 항응고 치료를 재개할 수 있다. 가장 빈번하게 발생하는 출혈 중 하나인 위장관 출혈에 대해서는 예시된 바와 같이, 많은 추가 인자를 고려해야 한다(Fig. 2). 특히 명확한 이차적 또는 치료 가능한 가역적 원인이 없는 생명을 위협하는 중대한 출혈의 경우, 항응고 치료 재개의 위험이 이점보다 클 수 있다. 이러한 경우 좌심방이 폐쇄술(left atrial appendage occlusion)이 장기간의 항응고 치료를 대체할 수 있을 것으로 보인다.
침습적 시술 및 수술을 받을 계획이 있는 환자
NOAC를 언제 중지해야 할 것인가?
통계적으로 항응고 치료를 받는 환자들의 약 1/4이 향후 2년 이내에 중재 시술로 인하여 일시적으로 항응고 치료를 중단해야 하는 것으로 알려져 있다[14]. 현재 다양한 학회에서 수술 혹은 중재 시술 이전 NOAC의 중단 시점에 대하여 별도의 진료 지침을 제시하고 있는 실정이다.
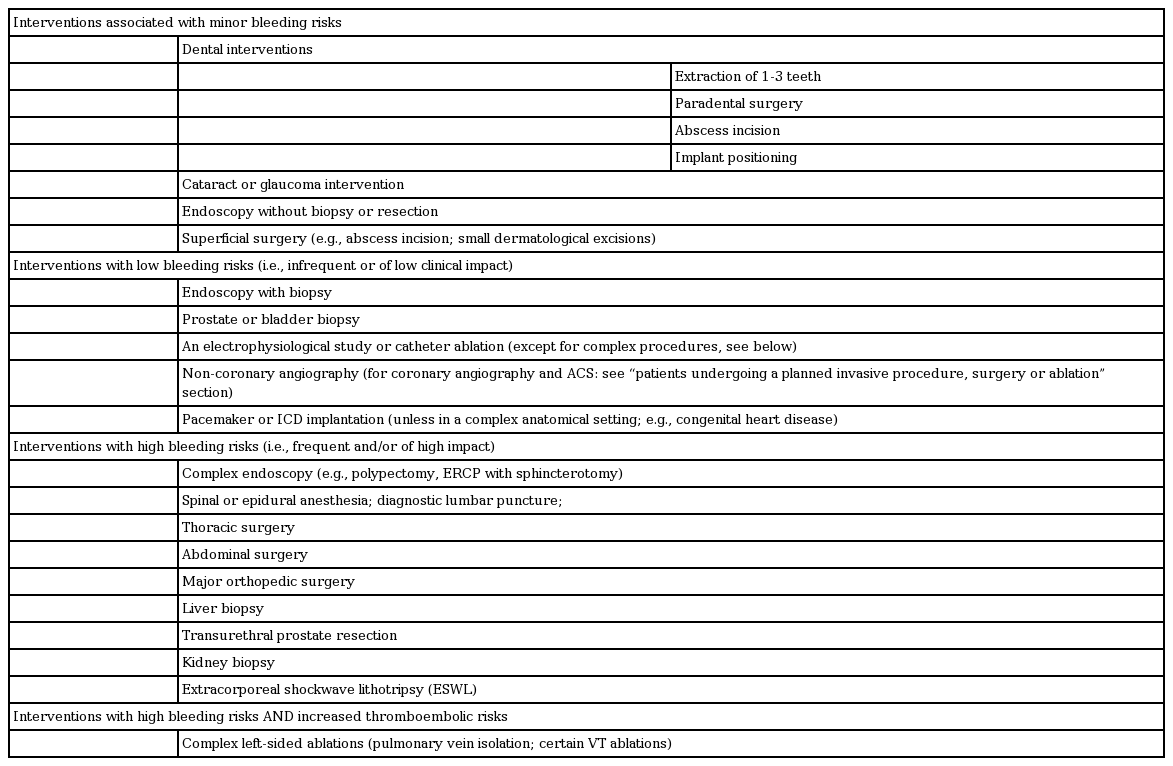
NOAC를 언제 끊고 시작할지를 결정할 때는 반드시 수술의 종류와 환자의 특성을 고려해야 한다(Table 2). 침습적인 수술적 중재 시술은 NOAC를 일시적으로 중단해야 하지만, 경우에 따라 덜 침습적인 시술은 상대적으로 출혈의 위험이 적기 때문에 꼭 NOAC를 중단할 필요는 없다(Table 3, Fig. 3). NOAC를 복용하는 환자뿐만 아니라 일차 진료를 담당하는 의사들 역시 미리 계획된 시술을 하기 전에 시술이 예정된 날짜, 시술 시간 그리고 언제 NOAC를 중단해야 하는지에 대한 안내문을 제공받아야 한다.

Timing of last non-vitamin K-antagonist oral anticoagulant intake prior to commencement of elective interventions

Perioperative management of non-vitamin K-antagonist oral anticoagulant therapy in patients undergoing elective surgery. Edo, edoxaban; Riva, rivaroxaban; h, hours.
출혈 위험이 미약한 경우
대부분의 출혈 위험이 미약한 수술과 시술의 경우, 항응고 치료를 중단하는 것은 추천하지 않는다(Fig. 3). 일반적으로, 이런 수술 및 시술은 마지막 NOAC를 복용한 후 12-24시간 뒤에 시행할 수 있다. 마지막 NOAC를 복용한 후 18-24시간 지나 시술을 받고 그 뒤로 6시간 후에 재개할 수 있다(다비가트란, 아픽사반은 1회 투약 중지, 에독사반, 리바록사반은 투약 중지 필요 없음). 만약 시술 이후 지혈이 완전히 되었다면 환자는 퇴원해도 보통 무리가 없다. 다만 환자는 퇴원 전에 향후 발생할 수 있는 출혈에 대한 조처에 대하여 교육을 받아야 하며, 출혈이 발생했을 경우 의료인에게 쉽게 연락할 수 있어야 한다.
출혈의 위험이 적은 경우
출혈의 위험이 적은 중재 시술의 경우(Table 2), 정상적인 신장 기능을 가지고 있는 환자라면 24시간 전에 NOAC를 중단해야 한다. 다비가트란을 복용하고 크레아틴 청소율이 < 80 mL/min인 환자는 신기능 정도에 따라 그보다 더 이른 시기에 NOAC를 중단해야 한다. FXa 억제제(아픽사반, 리바록사반, 에독사반)를 복용하며 크레아틴 청소율이 15-29 mL/min인 경우 최소 수술 36시간 전에는 NOAC를 중지해야 한다. 만약 드로네다론, 아미오다론 혹은 베라파밀을 함께 복용하고 있고, 혈전색전증의 위험이 적다면(CHA2DS2VASc ≤ 3) 추가적으로 24시간을 더 중지하는 것을 고려해야 한다[15]. 반대로 일부 시술의 경우(심박동기 삽입술 등)에는 아침 용량만 중단하는 등 좀 더 짧게 중단할 수 있다. 향후 Perioperative anticoagulant use for surgery evaluation (PAUSE) 연구는 이에 대한 총괄적인 정보를 제공할 수 있을 것이다[16].
출혈의 위험이 높은 경우
주요 출혈의 발생 위험이 높은 침습적 시술을 할 때에는 수술 전 48시간 혹은 그 이상 NOAC를 중지하도록 권유된다. 긴 시간 동안 NOAC를 중지하는 경우에는 환자의 혈전색전증 발생 위험과 출혈의 위험성을 모두 고려해야 한다. 또한 환자가 신기능 장애가 있다면 다비가트란의 경우 더 긴 시간동안 중지해야 한다(Table 2, Fig. 3). NOAC의 지속 효과 시간의 예측이 불확실하다면 혈장내 NOAC 농도를 체크하는 방법이 있지만, 안전한 NOAC 농도에 대한 근거가 부족하며, 또한 혈전색전증의 발생 위험을 감수하면서까지 특정 농도로 감소될 때까지 기다려야 하는지에 대해서도 그 근거가 부족한 실정이다.
가교 요법(bridging therapy)
NOAC는 항응고효과를 예측하여 단기간 동안 중지할 수 있기 때문에 이를 복용하고 있는 환자들에게 수술 전 헤파린으로 가교 요법을 하는 것은 추천되지 않는다. Bridging anticoagulation in patients who require temporary interruption of warfarin therapy for an elective invasive procedure or surgery (BRIDGE) 연구에서 발표하였듯이 와파린을 헤파린으로 가교 요법을 하는 것은 출혈의 위험을 높이는 반면 여러 심혈관계 사건을 줄이지 못했다[17].
치과 수술
치과 수술은 대체적으로 경미한 출혈 위험이 있는 것으로 생각되며 또한 출혈이 발생하더라도 국소 지혈을 잘 할 수 있는 수술이다. 치과 수술에 대하여 대부분의 치료 지침은 NOAC를 중단하지 말라고 권유하고 있고, 비스테로이드성 항염증제의 복용을 피하라고 권유하고 있다[18]. 하지만 근거는 부족하고, 대부분 약물학적 정보에 근거하여 추천된 경우가 많다[19]. 발치의 경우는 대부분 외래에서 NOAC를 중단하지 않거나 혹은 시술 당일 오전만 중지하고 시술 후 국소 지혈을 하며 안전하게 시행할 수 있다[20-23]. 국소 지혈 방법의 종류에는 oxidized cellulose나 흡수되는 젤라틴 스폰지, 봉합, tranexamic acid 구강 세척 혹은 tranexamic acid를 묻힌 거즈로 압박하는 방법 등이 있다.
심장이식전자장치 시술
심박동기 및 제세동기 등의 심장이식 전자장치 시술은 일반적으로 출혈의 위험이 낮은 시술로 여겨진다. 최근 무작위 대조군 연구에서 와파린을 복용 중인 환자들이 심장이식 전자장치 시술을 할 때 와파린을 그대로 유지하며 시술을 진행하더라도 출혈이나 혈전색전증의 위험이 낮은 것이 밝혀졌다[24]. NOAC를 복용하는 환자들을 대상으로 진행한 무작위 대조군 연구에서는 시술 당일 오전 NOAC를 중지한 그룹과 48시간 이전에 중지한 그룹(다비가트란은 신기능 장애 정도에 따라 조절) 간에 비슷한 출혈과 혈전색전증의 발생 위험을 보였다[25]. 따라서 출혈의 위험이 낮은 시술의 표준적인 접근 방법은 시술하는 날 오전 약은 중지하고 시술을 한 뒤에 다음날 투약을 시작하는 것이 추천된다(Table 3, Fig. 3).
국부 마취와 진통제
척수 마취나 경막 외 마취, 요추 천자의 경우 출혈이 발생하면 치명적일 수 있기 때문에, 항응고 효과가 완전히 없어졌을 때 시술을 해야 한다. 유럽뿐만 아니라 북미 진료 지침에서도 신경마취 전에 반드시 NOAC를 중지하도록 권유하고 있으며, 각각 복용 중인 NOAC의 5배 반감기를 지난 후에 시행하라고 권유하고 있다[26,27]. 시술이 끝나면 일반적으로 24시간 이후에 NOAC를 다시 복용할 수 있다. 반대로 말초신경 통증 차단이나 말초 관절 근육 주사의 경우에는 NOAC의 복용 중단이 필요하지 않으며, 필요하다고 하더라도 약 2배 정도의 반감기만큼 짧게 중단하면 된다[28].
시술 후 언제 NOAC를 다시 시작할 것인가?
완전한 지혈이 이루어졌다면 NOAC는 일반적으로 시술 후 6-8시간 지나고 복용을 해도 된다. 하지만 일부 수술의 경우 48-72시간 이내에 다시 NOAC를 복용하는 경우 출혈의 위험이 심방세동으로 인한 혈전색전증 발생의 위험보다 높은 경우가 있다. 이런 경우에는 6-8시간 후에 비약물적 항혈전 예방 요법을 하고 NOAC를 48-72시간 이후에 재투여해야 한다. 저용량 NOAC는 정맥 혈전증의 예방 효과에 대해서는 입증되었으나, 심방세동이 있는 수술 후 환자들에게 뇌졸중 예방 효과와 안정성이 입증되지는 않았다. 각각 기관의 특수성에 맞춘 진료 지침을 만들고 여러 다른 수술적 환경을 고려한 기관별 항응고치료 전략을 세우는 것이 요구된다.
심방세동 고주파 전극도자 절제술에서 특별히 고려해야 할 점
좌심방 전극도자 절제술과 관련된 출혈의 빈도는 줄어들고 있는 추세이나, 여전히 심방중격 천자, 심방내 광범위한 카테터 조작, 고주파 절제술로 인하여 심각한 출혈의 위험이 높은 시술이다[30]. 또한 서혜부 천자 부위의 합병증으로 인한 주요 출혈 위험도 적지 않다. 다른 한편으로 혈전의 생성을 촉진하여 시술로 인한 혈전색전증의 위험을 높일 수 있다[30,31]. 최근 국제 진료 지침은 좌심방에서의 전극도자 절제술은 항응고 치료를 중지하지 않고(목표 INR 2-2.5) 시행하는 것을 권유하고 있다[30,32]. 리바록사반, 다비가트란, 아픽사반이 각각 무작위 임상연구에서 와파린과 비교된 바 있다[33-35]. 위의 연구들은 공통적으로 NOAC와 와파린을 모두 중지하지 않고 시술을 하였고, 혈전색전증의 위험은 두 그룹 모두 비슷하였다. 한편 위의 연구들에서 리바록사반은 시술 전날 저녁에 마지막으로 투약이 되었고, 다비가트란과 아픽사반은 시술 당일 오전까지 투약이 되었다. ActiVe-controlled multi-cENTer stUdy with blind-adjudication designed to evaluate the safety of uninterrupted Rivaroxaban and uninterrupted vitamin K antagonists in subjects undergoing cathEter ablation for non-valvular Atrial Fibrillation (VENTURE-AF) 연구와 Apixaban During Atrial Fibrillation Catheter Ablation: Comparison to Vitamin K Antagonist Therapy (AXAFA-AFNET 5) 연구에서 리바록사반과 아픽사반은 와파린과 비슷한 주요 출혈의 위험성을 보여주었다. Randomized Evaluation of Dabigatran Etexilate Compared to Warfarin in Pulmonary Vein Ablation: Assessment of an Uninterrupted Periprocedural Anticoagulation Strategy (RE-CIRCUIT) 연구에서 다비가트란은 와파린대비 주요 출혈의 위험을 의미 있게 감소시켰다. 에독사반은 현재 이와 비슷한 무작위 연구를 진행 중이며 레지스트리 연구와 The Effective Anticoagulation with Factor Xa Next Generation in Atrial Fibrillation-Thrombolysis in Myocardial Infarction 48 (ENGAGE-AF TIMI 48) 연구 하위 집단 분석에서 심방세동 전극도자 절제술을 시행할 때 에독사반이 와파린에 비하여 출혈이나 뇌졸중의 위험을 높이지 않았다[36,37].
NOAC를 복용하고 있는 환자들이 심방세동 전극도자 절제술을 시행받을 때 일관성 있는 항응고 치료를 받을 수 있도록 각각의 기관에 맞는 프로토콜을 만들어야 한다. 시술전 마지막 NOAC 투약 시기를 결정할 때는 신장 기능, CHA2DS2VASc 점수, 시술자의 경험, 심방중격 천자 이전에 헤파린을 투약하는지 등의 여러 요소들을 고려해서 정해야 한다[30,38]. 만약 심방중격 천자를 시술 이전에 영상 검사 없이 시행한다면, 시술 시작 12시간 전에 마지막 NOAC를 투약하는 것은 합리적이다. 특히 시술 수 주일 전부터 NOAC를 잘 복용했는지 확실치 않은 경우에는 시술 이전에 좌심방에 혈전이 있는지 확인해야 한다. 마지막 NOAC가 36시간 이전에 투약되었고, 이전에 적절한 항응고 치료를 수 주간 받지 않은 환자와 혈전색전증의 위험이 높은 환자들에게도 시술 전 좌심방의 혈전 유무를 확인해야 한다. 시술 동안에는 헤파린 정맥 주사로 활성응고시간(activated clotting time, ACT)을 300-350초로 유지해야 한다[39]. NOAC나 와파린을 복용중인 환자들 모두 이와 비슷하게 ACT를 조절하는 것이 합리적이다. 일부 NOAC를 복용하던 환자들이 와파린을 복용하던 환자들에 비하여 목표 ACT 범위로 조절하기까지 더 많은 양의 헤파린이 요구되기도 한다[33,40,41]. 이는 NOAC와 ACT 검사의 관계보다는 NOAC를 마지막으로 언제 중단했는지가 중요하게 작용할 것이다. 시술을 마치고 적절히 지혈이 되었고, 심낭 삼출이 없다면 sheath를 제거한 후에 약 3-5시간이 경과하면 NOAC를 다시 투약할 수 있다[42].
응급 수술이 필요한 환자
응급 수술과 같은 처치가 필요한 경우 즉시 NOAC를 중단해야 한다. 구체적인 환자 관리는 응급 수술의 긴급한 정도(즉각적, 긴급, 신속)에 따라 달라 질 수 있다(Fig. 4).
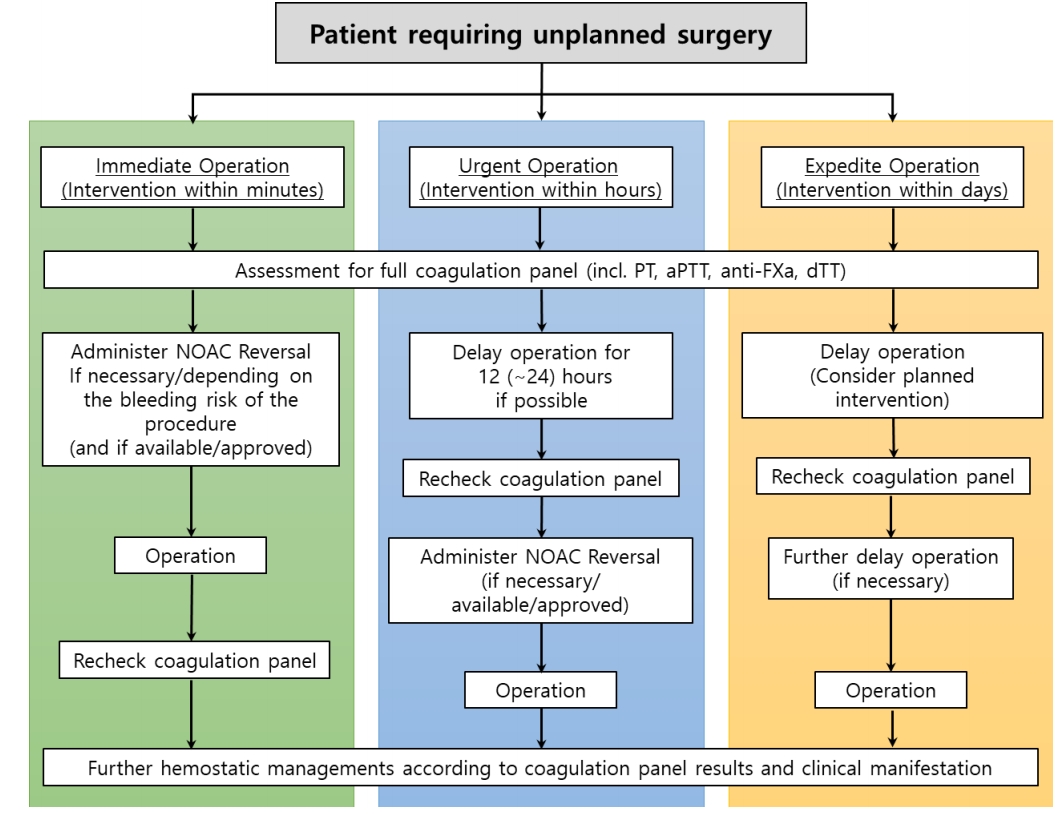
Management of non-vitamin K-antagonist oral anticoagulant therapy in patients undergoing unplanned surgery. PT, prothrombin time; aPTT, activated partial thromboplastin time; anti-FXa, anti-Factor Xa; dTT, diluted thrombin time; NOAC, non-vitamin K antagonist oral anticoagulants.
즉각 수술
즉각 수술(예, 즉각적인 생명/사지/장기를 구하는 수술적 중재, 일반적인 심장/혈관/신경외과적 응급 수술)은 수분 이내에 결정해서 실행되어야 하며, 지체되어서는 안 된다. 이러한 경우 특히 중등도-중증의 출혈 위험이 있는 경우에는 다비가트란의 역전제인 이다루시주맙이 고려되어야 한다[7]. 이다루시주맙은 REVERSE-AD 연구에서 출혈 환자뿐만 아니라 응급 수술이 필요한 환자도 연구 대상자로 등록되어 효과를 인정받았으나, FXa 억제제 역전제인 안덱사네트 알파와 관련된 전향적 개방 3상 임상연구에서는 수술적 중재가 필요한 환자는 연구 대상자에서 제외되었고, 급성 주요 출혈 환자만 등록되었다[8]. 따라서 안덱사네트 알파와 관련된 연구의 전체 결과 발표와 약물 허가 후, 이러한 수술 환자에서의 약물 효용성은 재평가되어야 할 것이다. 만약, 특정 역전제가 사용 가능하지 않다면, 효과와 안전성 데이터는 부족하지만 PCCs 또는 aPCC 투여가 고려될 수 있다[13,27,43]. 특정 역전제가 사용 가능하지 않다면, 경막 외 두개강내 혈종의 위험을 줄이기 위해서 척수 마취보다는 일반적인 전신 마취로 즉각적인 수술을 진행하는 것이 좋다.
긴급 수술
긴급수술(예, 잠재적으로 생명을 위협하는 상태의 급성 발병 또는 임상적 악화에 의한 중재적 수술, 사지/장기의 생존 및 골절의 교정, 통증 완화 또는 기타 증상을 위협할 수 있는 상태)은 결정 후 수 시간 이내에 실행되어야 한다. 이러한 경우에 수술 또는 중재적 치료는 가능하다면 적어도 12시간(바람직하게는 마지막 NOAC 투여 후 24시간)까지 연기할 것을 권장한다. 또한, 역전제 또는 PCC의 사용 필요성 여부를 결정하기 위하여 혈액응고 검사 결과를 기다릴 수 있다.
신속 수술
신속 수술(생명/사지/장기 생존에 위협이 되지 않는 조기 치료가 필요한 경우)은 결정 후 수일 이내에 실행되어야 한다. 이러한 경우, NOAC의 중단은 예정 수술(elective surgery) 기준을 따른다.
위와 같은 모든 상황에서는 사전 투여된 항응고제 종류에 관계 없이 지혈제 투여 전에 환자의 혈액응고 상태를 평가하기 위하여 혈액응고 검사(prothrombin time [PT], activated partial thromboplastin time [aPTT], anti-FXa assay, dTT/ECA 등)가 반드시 실시되어야 한다. 그렇다고 이런 검사로 인하여 응급 상황에서 지혈제 사용을 연기해서는 안된다. 다만 이러한 초기 혈액응고 검사 결과는 추후 치료 결정에 영향을 미칠 수 있기 때문에 꼭 시행해야 한다. 혈액응고 검사 중 aPTT의 정상 범위내 수치 결과는 다비가트란 복용 환자에서 혈중 약물 농도가 높지 않다고 예측할 수 있고, PT의 정상 범위내 수치 결과는 리바록사반 복용 환자(에독사반의 경우 낮은 정도의 예측력을 보임)에서 혈중 약물 농도가 높지 않다고 예측할 수 있다. 하지만 이러한 혈액응고 검사의 정상 범위내 수치 결과가 모든 NOAC의 높은 혈중 약물 농도가 아니라고 단정지을 수 없다. 특이적 항응고 검사(다비가트란의 dTT 또는 ECA, FXa 억제제의 anti-FXa chromogenic assay)와 혈장 약물 농도 검사는 항응고 인자의 효과 상실의 해석뿐 아니라, 특히 항응고 인자 농도가 높아질 수 있는 상황(예를 들어, 고령, 신기능 장애, 특정 병용 약물)에서 항응고 인자의 현재 활동 상태를 파악하는 데 크게 도움을 줄 수 있다.
NOAC의 항응고 효과 측정 방법
NOAC의 항응고 효과는 통상적인 응고 검사(PT, aPTT)로는 정확하게 평가할 수 없다. 하지만, NOAC 혈장 농도를 정량적으로 측정하기 위하여 개발된 특수 응고 검사로 평가할 수 있다. 대부분의 응고측정기는 NOAC 혈장 농도를 30분 이내에 측정할 수 있다[44-46]. 응급 상황을 대비하여 이러한 검사기를 항시 사용할 수 있도록 각 기관이 구비하도록 권장한다.
국내 대부분의 의료기관에서 가능한 검사는 아니지만, anti-FXa chromogenic assay를 통하여 응고 인자 Xa (FXa) 억제제 농도를 측정할 수 있다. 낮거나 높은 혈장 농도를 상당히 높은 실험실 간 정밀도로 측정할 수 있다. 검사에서 anti-FXa 활성도가 측정이 되지 않는 경우 임상적으로 의미 있는 약물 농도를 배제할 수 있다. 반대로 dTT 검사는 물론 ECA 검사는 다비가트란 농도와 직선의 상관관계를 보이므로 다비가트란 농도의 정량적 평가에 사용 가능하다.
적절한 측정방법을 사용하면 모든 NOAC의 혈장 농도를 측정할 수 있다. 임상연구에서 high performance liquid chromatography/mass spectrometry를 사용하여 약제 농도를 측정하긴 하였으나, 다비가트란은 dTT/ECA 검사를 통하여, FXa 억제제는 anti-FXa 색소 검사를 통하여 측정할 수 있다. 그러나 NOAC 농도를 정량적으로 측정하려면 anti-FXa 검사 또는 dTT를 측정하기보다는 혈장 농도를 직접 측정하는 것을 추천한다. NOAC를 투약 중인 환자들의 예상 최고 및 최저 농도는 표 4에 기술되어 있다. NOAC를 투약 중인 환자에서 응고 검사를 할 때에는 NOAC 복용 시점과 채혈 시점을 아는 것이 중요하다. 응고 검사에서 NOAC의 최고 효과가 나타나는 시점은 대략 약을 복용한지 2-3시간 뒤이다. 중요한 점은 NOAC는 통상적인 응고 검사(PT 및 aPTT)에 영향을 주고 특수한 검사(예를 들면 루프스 항응고 검사 및 응고 인자)에도 영향을 줄 수 있다는 점이다.
특정 고려 사항
다비가트란
aPTT는 다비가트란의 혈중 농도 및 항응고 효과를 정성적으로 평가할 수 있는 지표이다. 다비가트란 농도와 aPTT는 곡선 관계를 보여준다[47]. aPTT가 정상 범위라 하더라도 다비가트란의 농도는 치료 범위에 있을 가능성을 배제하지는 못하는 반면, 민감한 분석 방법을 사용하면 치료 범위에 있을 가능성을 배제할 수 있다. 다비가트란은 치료 범위에서도 PT 및 INR에 미치는 영향이 미미하므로 PT와 INR은 다비가트란의 항응고 효과를 측정하기 위한 용도로는 적합하지 않다[47,48].
트롬빈 시간(thrombin time, TT)은 다비가트란에 대하여 매우 민감하여 정상 TT일 경우 매우 낮은 농도의 다비가트란도 배제할 수 있다. 그렇지만 TT는 임상적 사용 범주의 다비가트란 혈장 농도를 정량적으로 측정하기에는 적합하지 않다. 반면, dTT와 ECA는 임상적으로 유의한 범주의 다비가트란 농도를 측정하는데 활용할 수 있다.
FXa 억제제(리바록사반, 아픽사반 및 에독사반)
여러 FXa 억제제들은 PT와 aPTT에 다양한 영향을 미칠 수 있다. aPTT는 FXa 억제 효과를 측정하는데 사용할 수 없는데 이는 aPTT 연장 효과가 제한되어 있고, 평가 결과 변이가 크며, 저농도에서 역설적으로 높은 결과가 보이기도 하기 때문이다[48]. FXa 억제제들은 농도에 비례하여 PT가 연장되긴 하나, 측정 방법과 FXa 억제제의 종류에 영향을 받는다. PT는 특이적이지 않고 다른 많은 요인들에 영향을 받을 수 있다(예, 간장애, 비타민 K 결핍 등) [48]. 아픽사반의 경우 항응고 효과 평가에 PT를 사용할 수 없다. 리바록사반 및 에독사반도 어느 정도는 PT 측정을 통하여 정량적인 정보를 얻을 수 있으나, PT 측정 시약에 따라 민감도가 중대하게 다를 수 있고, FXa 억제 효과 측정에 민감하지 않을 수도 있다[46]. 따라서 도입된 PT 측정 시약의 FXa 억제제에 대한 민감도 평가가 강력히 요구된다.
중요한 것은 PT를 INR로 변환하더라도 변이를 교정할 수 없을 뿐 아니라 오히려 변이성을 더 키울 수 있다는 점이다. INR은 FXa 억제 효과 측정에 신뢰할 만한 검사가 아니다. 게다가, NOAC에서 와파린으로 전환시 NOAC에 의한 PT/INR 연장은 오해의 소지가 있다. 따라서, 약제 전환은 약동학적 기준에 맞추어 진행해야 한다.
NOAC의 다른 응고 검사에 대한 효과
NOAC는 혈전 성향 검사 및 응고 인자 측정에 영향을 주게 된다. 따라서, 응고관련 지표들을 정확히 측정하기 위해서는 NOAC를 마지막으로 복용한 후 최소 24시간 이후에 검사를 시행할 것을 추천한다. 루프스 항응고 인자 측정의 경우 더 긴 시간이 지난 후(≥ 48시간) 측정해야 한다.
ACT 검사는 고농도의 헤파린이 투여되었거나, aPTT 검사가 너무 민감할 때(예, 관동맥 우회 수술, 관동맥 중재술, 도자 절제술 등) point-of-care 검사로 사용될 수 있다. 이 검사는 전혈을 이용하며 접촉 활성화를 기반으로 측정한다. 다비가트란은 aPTT와 유사하게 ACT를 곡선 형태로 증가시킨다[47]. 임상에서 다비가트란의 항응고 효과를 ACT로 측정하는 연구는 진행된 바 없다. 아픽사반, 에독사반 및 리바록사반과 ACT 수치 사이에는 작은 용량 의존적 효과가 존재한다[49,50]. NOAC로 치료받던 환자들이 중재술을 받을 때 헤파린 농도 조절을 위하여 동일한 ACT 목표치를 이용하는 것은 합리적인 것으로 생각된다. 그러나 ACT는 표준화된 검사가 아니므로, ACT 목표치는 센터 검증이 필요하다. ACT는 FXa의 항응고 효과를 측정하는데 사용되어서는 안된다.
NOAC의 혈청농도 측정: 적응증, 주의할 점과 가능한 함정들
NOAC는 혈액응고 모니터링이 필요하지 않다. 만약 현재 환자가 약제의 적응증에 따라 제대로 복용하고 있다면 혈액응고 지표의 변화에 따라 그 약제의 용량이나 투여 간격을 변경할 필요는 없다. 하지만 약제노출과 항응고효과에 대한 실험실적 평가는 특수한 상황뿐 아니라 응급 상황에서 임상의에게 도움을 줄 수 있다. 특별한 특성을 지닌 예외적인 환자들에게 장기적인 약제 사용에 대한 지침을 위한 실험실적인 모니터링이 고려될 수 있다. 하지만 이 역시 확고한 임상 데이터가 없으며 혈액응고 분야의 전문가 지도감독 하에 이루어져야 한다.
응급 상황에서의 측정
출혈, 긴급한 시술들, 혹은 급성 뇌졸중 같은 응급 상황에서 정기적인 혈액응고 검사는 쉽게 행해질 수 있고, 최근의 약제 노출에 대한 정보를 임상의에게 빠르게 제공할 수 있다. 특수분석은 혈청농도에 대한 정확한 평가를 제공할 수 있다.
심각한 출혈의 경우 혈액응고 검사는 임상의가 지혈을 유도하는데 도움을 줄 수 있다. 혈액응고 검사는 또한 연관된 출혈성 질환을 밝혀낼 수도 있다. 예외적으로 출혈의 위험성이 높은 계획된 수술뿐 아니라 긴급 수술인 경우에도 혈액응고 검사는 임상의가 수술 시기를 정하는 데 도움을 줄 수 있다.
약제 노출에 대한 정보는 특히나 혈전용해 치료가 고려되는 급성 허혈성 뇌졸중 환자에게서 치료 방침을 결정하는 데 도움을 제시할 수 있다. 항응고작용에 대한 평가가 유용한 다른 응급 상황으로는 과다복용이나 중독이 의심되는 경우이다.
계획된 시술 전 측정
일반적으로 계획된 시술 전에 항응고효과를 정기적으로 측정하는 것은 권고되지 않는다. 마지막 복용 시점을 모르거나 특별한 환자 특성(약제 상호작용이 가능한 경우, 신기능 혹은 간기능의 변화)으로 인하여 약제 배설에 대한 염려가 있는 경우, 특수 분석이 가능하다면 임상적으로 관련 있는 혈청 농도를 체크하는 것은 합리적이다[15]. 하지만 아직까지 계획된 혹은 긴급 수술 시기를 정하는 데 가이드를 제시할 수 있는 혈액응고 검사의 절단치(cut-off value)에 대한 확고한 임상 결과를 지닌 전향적 연구가 없는 실정이다[51].
장기간 약제 노출 기간 중 모니터링
임상연구에서 약물 치료 중 예측되는 약제의 혈청 농도는 표 4에 기술되어 있다. 하지만 중요한 것은 실험실 혈액응고 지표들을 기준으로 예측한 농도보다 측정한 약제 농도가 높은 경우 약제를 감량하거나 반대로 예측한 농도보다 약제의 실제 농도가 낮은 경우에 용량을 증량해서 출혈이나 혈전색전증과 같은 합병증을 줄일 수 있는지에 대한 연구는 아직 없다는 것이다. 그러므로 정기적인 혈청농도를 측정하거나 그것을 바탕으로 용량을 조절하는 것은 일반적으로 추천되지 않는다. 투여된 NOAC의 약물 역동학적 특성에 영향을 주는 여러 요인들(예들 들어 매우 비만한 경우; 암치료를 받고 있는 조절되지 않은 암환자들; 확립되지 않은 약물 역동학적 작용을 지닌 항암약물 치료 등)을 가진 환자들에게 합리적인 전략은 최고 농도 혹은 최저 농도(Table 4)에서 채취된 혈액 샘플에 대한 각기 다른 치료 범위를 고려해서 ‘치료 농도’ 범위의 혈청 농도를 검증하는 것이다. 하지만, 이러한 것들은 환자의 치료뿐 아니라 이러한 분석들의 수행과 해석에서 충분한 경험을 지닌 혈액응고 전문가를 통해서 이뤄져야 한다. 그렇지 않다면, 특별한 경우에 따라 와파린(비타민 K 길항제) 치료로 전환하는 것이 선택이 될 수 있겠다.
과체중 혹은 저체중 환자들
극단적인 체중(예를 들어 50 kg 미만, 120 kg 초과)을 가진 환자들은 임상연구에서 NOAC의 효과가 충분히 검증되지 않았고, 이러한 환자들에게 NOAC의 사용은 문제가 될 수도 있다. 만약 NOAC 치료가 이러한 환자에게서 선택이 되면, 혈청 최저 농도(trough level)의 평가를 고려해야 한다.
용법대로 약을 복용하지 못한 경우의 대처
약물의 효과를 극대화하려면 용법에 맞게 약을 잘 복용하는 것이 중요하며, 이를 위하여 휴대용 약통이나 휴대폰 알람 등을 이용할 수 있다. 그러나 실제 임상에서 용법대로 약을 복용하지 못하는 경우가 흔하게 발생하므로, 각 상황에 대한 대처법을 환자에게 미리 주지시킬 필요가 있다.
정해진 시간에 약을 복용하지 못한 경우
다음 복용 시각까지 투약 간격 시간의 50% (즉, 하루 2번 투약하는 아픽사반, 다비가트란은 6시간, 하루 1번 투약하는 리바록사반, 에독사반은 12시간) 이상 남은 경우라면 생각난 즉시 약을 복용한 후 다음 예정 스케줄부터 원래 용법대로 약을 복용한다. 50% 미만으로 남은 경우는 빠진 약은 건너뛰고 이후 예정된 시각부터 원래 용법대로 약을 복용하도록 한다. 그러나 환자가 혈전 위험은 높으나 출혈 위험이 낮다면 50% 미만으로 남은 경우라도 즉각 투약을 고려할 수 있다.
약을 2배 용량으로 복용한 경우
한 번에 2배 용량을 복용한 경우, 하루 2번 복용하는 아픽사반, 다비가트란은 12시간 뒤의 투약은 건너뛴 후 다음 12시간 뒤, 즉 2배 용량을 복용한 시간으로부터 24시간 뒤부터 원래 용법대로 재복용을 시작한다. 하루 1번 복용하는 리바록사반, 에독사반은 투약을 건너뛸 필요 없이 24시간 뒤부터 원래 용법에 따라 재복용을 하도록 한다.
약복용 여부가 불분명한 경우
하루 2번 복용하는 아팍사반, 다비가트란은 일반적으로 재투약 없이 다음 정해진 시각부터 재복용을 하도록 권유하며, 하루 1번 복용하는 리바록사반, 에독사반은 CHA2DS2-VASc 3점 이상의 혈전 고위험군은 알게된 즉시 재투약 후 원래 스케줄을 따르고 2점 이하인 경우는 재투약 없이 다음 스케줄에 따라 투약을 권고하나, 환자의 출혈 위험성에 따라 개별화하여 결정할 필요가 있다.
현재 출혈은 없으나 NOAC를 과복용하거나 의심되는 경우
혈중 NOAC 농도가 상승할 경우 출혈 위험이 높아지게 된다. 이는 NOAC 약제를 의도적으로 과용량을 복용한 경우에도 발생할 수 있지만, 급성 신부전(특히 다비가트란의 경우)이나 약물 상호작용에 의한 영향에 의해서도 NOAC의 혈중 농도가 상승할 수 있다. 과복용을 하였을 경우 출혈 합병증이 있는 경우와 그렇지 않은 경우를 구분하여 치료하는 것이 중요하다.
NOAC 과복용이 의심될 경우, 응고 검사는 과복용의 정도를 평가하는데 도움이 될 수 있다. 다비가트란을 복용한 경우 aPTT 수치가 정상이고 리바록사반이나 에독사반 복용한 경우 PT 수치가 정상이라면 약제의 혈중 농도가 심각하게 매우 높지 않다는 것을 의미한다. 하지만 이러한 응고 검사를 약물농도의 양적 평가를 위하여 정규검사로 시행하는 것은 적절하지 못하다.
NOAC의 혈중 약물농도의 반감기는 상대적으로 짧은 편이기 때문에 급성 출혈이 없는 대부분의 경우에는 다른 조치 없이 경과 관찰을 하며 기다린다. 체내에서 약물이 배출되는 반감기는 나이나 신장 기능에 따라 달라진다. 리바록사반의 경우 장내 흡수가 제한적이기 때문에 리바록사반을 50 mg 이상 과복용하게 될 경우에는 혈중 농도가 거의 상승하지 않는 천장 효과가 나타났다[52]. 아픽사반의 경우 건강한 성인에서 하루 50 mg의 용량을 3-7일간 복용하였을 때 임상적으로 유의한 부작용은 나타나지 않음을 보고한 바 있다[53]. 하지만 과복용의 결과에 대한 연구 결과는 부족한 편이다.
어떤 종류의 NOAC라 하더라도 수시간 이내(특히 2시간 이내)에 과복용한 경우 활성탄소 차콜(성인 용량 30-50 g)이 도움이 될 수 있다. 하지만 이에 대한 근거는 부족하다[10,54,55]. 만약 혈중농도를 빠르게 정상화시켜야 하거나, 혹은 심한 신장 기능 저하 등의 이유로 혈중 농도 정상화가 요원할 경우 역전제를 사용하는 등 다른 치료법을 고려할 수 있다[56]. 출혈이 없는 환자에서 비선택적인 방법으로 지혈을 돕는 치료법은 자칫하면 강한 응집 효과(prothrombic effect)를 야기할 수 있기에 이득과 위험을 따져 특수한 경우에만 시행해야 한다.
결 론
위 가이드라인은 NOAC로 항응고 치료를 받는 환자들이 출혈이 발생하였을 때와 향후 응급 수술 혹은 계획된 수술을 앞두고 있을 때 어떻게 대처해야 하는지 면밀히 다루고 있다. 뿐만 아니라 NOAC를 복용하며 발생할 수 있는 여러 임상 상황들에 대해서도 구체적인 해결책을 제시하고 있다. 이에 저자들은 본 가이드라인이 일선에서 진료하는 많은 의사들에게 많은 도움이 될 수 있을 것이라고 생각한다.
Acknowledgements
자료 수집에 도움을 주신 한국비엠에스 제약 채송화, 바이엘 코리아 최종원, 보령 제약 이승연, 한국 다이찌산쿄 박원님께 감사를 드립니다