만성 신질환 환자에서 새로운 경구용 빈혈 치료제: Prolyl Hydroxylase Inhibitor
New Oral Agent for Treatment of Anemia in Patient with Chronic Kidney Disease: Prolyl Hydroxylase Inhibitor
Article information
Trans Abstract
Hypoxia inducible factor (HIF)-stabilizers are being developed for the renal anemia treatment. This small molecules inhibit prolyl hydroxylase domain (PHD)-containing enzymes, causing HIF activation instead of degradation under the state of normoxia, finally increase production of intrinsic erythropoiesis. Current treatment guidelines suggest that renal anemia should be treated mainly with iron and erythropoiesis stimulating agents (ESAs). But there are several complications and concerns such as hypertension, ESA refractory anemia and increased cardiovascular mortality in using ESAs. Advantages of HIF stabilizers over ESAs are orally available, no dose-up requirement for inflammation. So far new HIF stabilizers showed efficacy and safety in renal anemia treatment. This new therapeutic agent may emerge as a standard treatment option for renal anmia treatment.
서 론
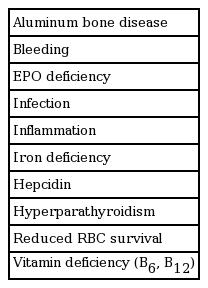
만성 콩팥병 환자에서 발생하는 빈혈은 사구체여과율이 60 mL/min 이하로 감소하면서 발생하는 매우 흔한 합병증으로 투석이 필요한 시점에서 발생하는 대부분의 요독증의 증상을 초래하는 주요 원인이 된다. 대표적인 증상으로는 식욕부진, 피곤함, 우울증, 호흡곤란, 운동능력 감소 등의 전반적인 활력 감소를 초래하고 심혈관질환과 연관된 유병률과 사망률을 증가시키고, 입원 가능성을 증가시키며 입원기간을 늘리는 중요 원인이 되는 합병증이다[1,2]. 따라서 만성 콩팥병 환자에서 빈혈이 동반되어 있는지 확인하는 빈혈 검사는 합병증 확인에 반드시 필수적인 과정이고 빈혈의 주요 원인이 되는 문제를 확인하고 교정하여야 한다. 만성 콩팥병 환자의 일반적인 빈혈의 원인은 다음과 같다(Table 1). 만성 콩팥병 환자의 빈혈에서 가장 중요한 원인 기전으로는 조혈인자의 부족이며 만성 콩팥병 환자의 빈혈 치료에 있어서 철분과 조혈제(erythropoiesis-stimulating agents, ESA)의 사용은 환자의 빈혈과 관련된 증상 개선과 함께 환자의 삶의 질을 향상시키는 대표적인 치료제가 되었다. 하지만 최근 US Food and Drug Administration (FDA)에서는 조혈제 사용에 따른 심혈관계 합병증과 사망률 증가에 대한 주의를 환기시켰다[3]. 또한 10-20%의 일부 만성 콩팥병 환자의 빈혈 치료에서 ESA를 사용함에도 불구하고 효과적이지 않음이 보고되고 있다[4]. 이에 새로운 빈혈 치료제의 필요성이 대두되고 있다. 본 논문은 만성 콩팥병 환자의 빈혈에서 새로운 치료제로 부상하고 있는 prolyl hydroxylase inhibitor에 관하여 소개하고자 한다.
본 론
저산소 유도성 인자(hypoxia inducible factor, HIF) stabilizer의 작용기전
만성 콩팥병 환자의 빈혈 치료에 대한 새로운 약제로 대두되고 있는 prolyl hydroxylase inhibitor는 HIF를 분해시키는 단백질의 작용을 억제하여 결국 정상 산소 분압에서 분해되는 과정을 거치지 않고 HIF를 안정화시켜서 내인성 조혈 과정을 활성화시키는 작용을 통하여 적혈구 생산을 활성화시킨다[5].
적혈구를 생산하는 작용 이외에 당전달체-1, 혈관 내피세포 성장인자와 pyruvate 탈수소 효소 활성 효소(pyruvate dehydrogenase kinases) 1, 4 등의 활성화도 초래하며 HIF-1α의 증가에 따른 항염증 cytokine 생산을 증가시키고 윤활막섬유아세포, T 세포, B 세포의 상호작용을 지속시켜 자가항체 생산을 증가시키는 부수적인 효과도 나타난다. 그러므로 HIF-1α를 목표로 삼는 약제는 만성 질환의 잠재적 치료제로서의 가능성이 있다[6].
Hepcidin과 신성 빈혈
신기능이 감소하면서 빈혈이 발생하는 기전으로는 여러 가지의 원인이 있는데 이 중에서 가장 중요한 원인이 되는 기전으로 hepcidin의 증가와 이에 따른 철분의 이용 장애에 따른 철분의 결핍과 erythropoietin (EPO)의 감소가 가장 중요한 원인이다. Hepcidin은 철분의 부하가 있거나 염증 반응이 있을 경우 간에서 생산이 증가되며 신기능이 감소될 경우에는 신장으로의 제거도 감소되어 신기능이 저하되면서 혈중 농도가 증가하게 된다. Hepcidin의 기능은 소장에서 철분의 흡수를 억제하고 혈액 내의 대식세포에서 철분의 재사용 과정을 억제하여 철분의 활용성을 억제하여 상대적 철분 결핍(relative iron deficiency)을 통하여 빈혈이 초래되게 된다[7].
HIF stabilizer의 임상적 효과
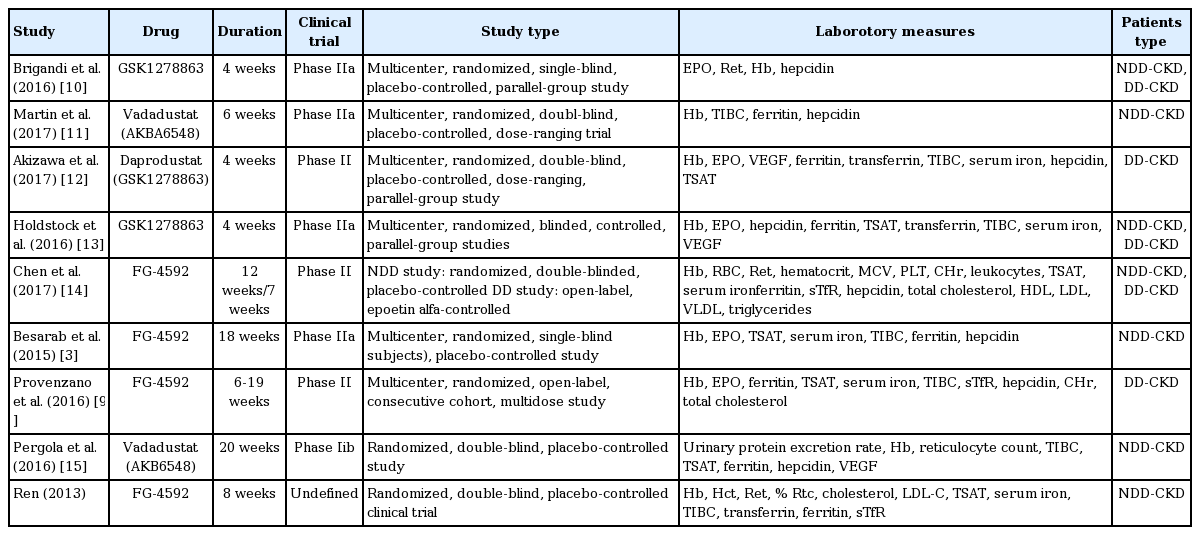
Zhong 등[8]이 HIF stabilizer들의 임상적 효과에 대한 연구들을 종합하여 메타분석을 시행하였다. 표 2는 이들이 분석한 연구들에 관한 특성에 관한 자료이다. 이들은 연구에서 HIF stabilizer로 roxadustat, vadadustat, daprodustat, molidustat를 사용한 중재적 치료에 대한 결과를 무작위 방법으로 연구한 논문을 대상으로 메타분석을 시행하였다. 총 9개의 연구가 포함되었고 353명의 증례가 참여하였고, 대조군으로 234명이 포함되었다.
ΔHb
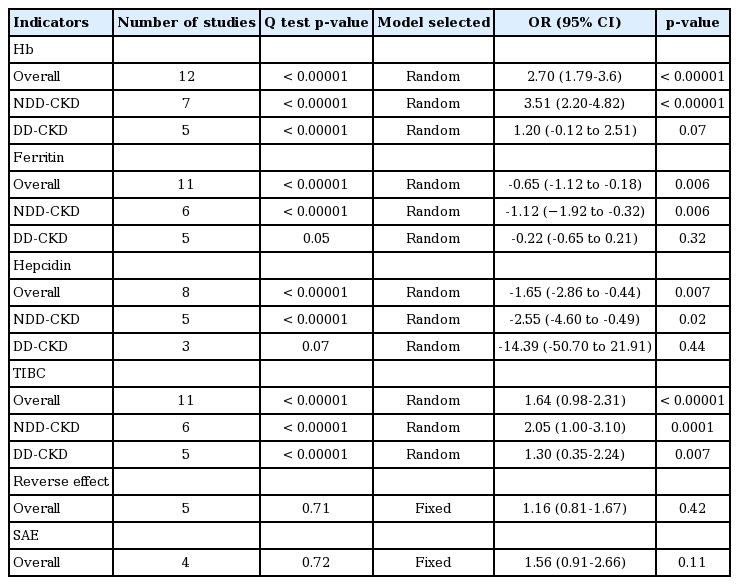
혈색소 수치의 변화는 투석 전 만성 콩팥병 환자에서는 의미 있는 증가를 보여 차이를 보였지만 투석 의존성 만성콩팥병 환자에게서는 의미 있는 차이를 보이지 않았다.
ΔFerritin
Ferritin 값의 변화도 투석 전 만성 콩팥병 환자에게서 의미 있는 감소가 있었지만 투석 의존성 만성 콩팥병 환자에게서는 의미 있는 차이를 보이지 않았다.
ΔHepcidin
Hepcidin 값의 변화 양상도 투석 전 만성 콩팥병 환자에게서 의미 있는 감소 소견이 있었지만 투석 의존성 만성 콩팥병 환자에게서는 의미 있는 차이를 보이지 않았다.
ΔTIBC
총 철분 결합 능력은 투석 전 만성 콩팥병 환자에게서 의미 있게 증가하였지만 투석 의존성 만성 콩팥병 환자에게서는 의미 있는 차이를 보이지 않았다.
부작용
가장 흔한 부작용으로는 소화기계 장애, 고칼륨혈증, 오심, 어지럼증, 두통, 감염 등이었고 한 개 이상의 부작용을 보인 비율은 치료군과 비교군에서 비슷하였다. 양 군 간의 부작용에서는 유의미한 차이는 없었다. 심각한 부작용으로 혈관 접근로 합병증과 대퇴골두골절, 비흉부적 흉통, 호흡곤란이 있었다고 하였다. 그러나 부작용 측면에서도 양 군 간에 의미 있는 차이를 보이지는 않았다. 다음은 상기 결과를 보여주는 표이다(Table 3).
결론적으로 본 연구에서 HIF stabilizer는 투석전 환자에게서 안전성에는 문제가 없었고 대조군에 비하여 신기능 감소에 따라 나타나는 철분 대사 관련 지표들을 호전시키면서 빈혈을 유의미하게 개선시키는 결과를 보여주었다. 다만 투석을 받는 말기신부전 환자를 대상으로는 유의한 차이를 확인할 수는 없었다.
ESA와 비교한 HIF stabilizer의 장점
만성 콩팥병 환자에서 ESA를 투여하여 빈혈을 치료할 경우 치료 초기에는 소량의 ESA에 대해서도 빈혈이 개선되어 ESA에 반응성이 대부분 매우 좋다. 그러나 신기능이 악화되면서, ESA에 노출이 축적되면서 목표 혈색소 수치를 유지하기 위해 좀 더 많은 ESA 요구량을 보이는 환자가 많아지는데 이런 현상을 ESA 저반응성(hyporesponsiveness)이라 한다. 이렇게 ESA에 반응이 무뎌지는 현상을 초래하는 가장 주요한 원인은 철분 결핍과 염증 반응으로 알려졌다. 그러나 HIF stabilizer의 경우 ferritin의 감소와 hepcidin의 감소를 초래하여 철분대사 지표를 호전시킨다. 더불어 염증 반응의 지표인 C반응성단백(CRP) 수치가 증가할 경우 ESA의 요구량이 증가하는 반면 HIF stabilizer의 경우 CRP 값에 관계 없이 약물요구량은 커다란 변동이 없는 것이 증명이 되었다[9]. 또한 약물역동학적 검사에서 ESA 투여시 초기농도는 매우 높게 측정되면서 3-4시간이 지나면 초기 농도의 절반으로 급격히 혈중 농도가 낮아지는 소견을 보이는 반면 HIF stabilizer의 경우 서서히 증가하여 투여 10시간이 지난 시점에서 최고농도를 보이고 이후 서서히 낮아지는 양상을 보여 차이가 나는 것을 알 수 있다. 이러한 약물역동학적인 차이는 추후에 나타나는 ESA 저반응성과 연관이 있을 것으로 생각되며 이외 HIF stabilizer의 경우 항염증 반응이나 항산화 효과 등의 부수적인 효과도 기대할 수 있다. 더불어 주사가 필요 없이 경구 투여가 가능하며 생산 비용 단가도 저렴하고 혈중 농도도 저농도로 유지면서 단백질 성분의 ESA와 달라 자가면역 반응에 따른 문제가 될 가능성도 낮고, 약물 안정성도 높다.
결 론
만성 콩팥병 환자의 빈혈 치료에 있어 HIF stabilizer는 만성 콩팥병 환자에서 발생하는 철분 대사 장애의 주요 원인인 hepcidin의 증가를 감소시키며 철분 대사 지표를 개선시키면서 염증 반응의 지표와 상관 없이 요구량의 변화가 없으며 경구로 투여 가능한 여러 장점을 가지고 있다. 현재까지 2상, 3상 연구를 통하여 투석전 만성 콩팥병 환자의 빈혈 치료 개선에는 유의한 효과를 보이고 있으나 투석의존성 만성 콩팥병 환자에서의 효과는 투석 전 환자에 비하여 아직 의미 있는 효과를 보이지 않는 것으로 보고되고 있다. 향후 이에 대한 더 많은 임상적인 연구가 필요하며, 만성 콩팥병 환자의 새로운 빈혈 치료제로 기대해 볼 수 있을 것으로 생각된다.