서 론
최근 산업화, 도시화, 온실효과 등에 따른 기후 변화로 이상 기후 현상이 전 세계적으로 나타나고 있으며[1], 특히 세계보건기구(World Health Organization)에서는 지구 온난화로 인한 생물의 종과 개체수의 변화가 감염병 전반에 영향을 미치고, 모기나, 진드기와 같은 감염병 매개체의 활동 시기와 분포에 직접적인 영향을 준다고 보고하였다[2].
기상청 자료에 따르면 1900년 이후, 우리나라 6개 도시의 평균 기온은 1.5℃ 상승하여, 지구 평균 기온 상승률(전 지구 평균 기온: 0.74℃)보다 훨씬 컸다. 또한 우리나라 연평균 강수량은 수십 년의 큰 변동 폭을 보이나 장기적으로 증가 추세를 보이고 있으며 전반적으로 강수일수는 감소하고, 강우 강도가 증가함에 따라 강수량이 증가하는 추세를 보였다.
기온 상승에 따라 계절에도 변화가 있을 것으로 전망하고 있는데, 실제 1920년대에 비하여 1990년대에는 봄과 여름이 10일가량 빨리 시작되고 가을 시작일은 일주일 정도 늦어지면서 여름 지속 기간이 16일 증가하였다. 반면 겨울은 시작시기가 늦어지고 봄이 빨리 시작되어 겨울 지속 기간은 19일 감소하였다. 2040년대와 2090년대 전망 자료에 의하면 여름철의 시작은 5월 초순으로 빨라지고 종료일은 10월 중순까지 늦어질 것으로 예측되며, 겨울철 시작일은 12월 말로 늦어지고 봄 시작일이 2월 중순으로 빨라질 것으로 예측되면서 여름은 한 달 정도 길어지고, 겨울은 한 달 반 이상 짧아져 일 년 중 거의 반 정도가 여름이 될 것으로 전망하고 있다[3]. 우리나라의 감염병의 발생률은 위생 관리 향상, 백신 접종, 건강관리시스템의 향상 등으로 감소하고 있지만 기후 변화와 관련이 있을 것으로 추정되는 쯔쯔가무시병, 말라리아, 이질, 신증후군출혈열 등은 1990년대 이후로 꾸준히 증가하고 있는 추세이다[4]. 온도 변화에 따른 전염병 발생을 예측한 연구 결과에서도 우리나라의 온도가 섭씨 1도 상승할 경우 쯔쯔가무시병, 렙토스피라증, 말라리아, 장염 비브리오, 세균성 이질 순으로, 다섯 가지 전염병의 평균 발생이 4.27% 증가할 것으로 예측되었다[5].
이처럼 지구 온난화로 인한 기온상승으로 따뜻한 겨울이 초래되고 곤충이나 설치류의 생존을 유리하게 하며, 진드기의 산란율, 활동률에도 영향을 주어 앞으로도 진드기 매개체 질환이 증가할 가능성은 매우 높을 것으로 예상된다[6,7]. 진드기는 크게 참진드기(tick)와 털 진드기(mite)로 나뉘는데, 참진드기는 1-3 mm 정도 크기의 진드기로 인체 감염 질환으로는 라임병(Lyme disease), 중증열성혈소판감소증후군(severe fever with thrombocytopenia syndrome, SFTS), 아나플라즈마증(anaplasmosis), 에를리키아증(ehrlichiasis), Q열(Q fever), 야생토끼병(야토병; tularemia), 일본홍반열(Japanese spotted fever), 바베시아증(babesiosis) 등을 일으키며, 털진드기는 0.1-0.3 mm 크기로 좀진드기라고도 하며, 쯔쯔가무시병(scrub typhus), 리켓치아폭스(rickettialpox) 등의 질환을 매개한다.
본 논문에서는 한국에서 흔한 대표적인 참진드기 매개 질환인 중증열성혈소판감소증후군과 털진드기 매개 질환인 쯔쯔가무시병에 대해 알아보고자 한다.
본 론
중증열성혈소판감소증후군(SFTS)
중증열성혈소판감소증후군(SFTS)은 중증열성혈소판감소증후군 바이러스(SFTS virus, SFTSV)에 감염된 참진드기에 물려 발생하는 급성 발열성 진드기 매개 감염병이다[8]. SFTSV는 single-stranded negative sense RNA segment인 큰 분절(large [L] segment), 중간 분절(medium [M] segment) 그리고 작은 분절(small [S] segment)인 3개의 유전자를 가진다[9].
우리나라의 경우는 2012년 강원도 춘천시에 거주하던 환자에서 발열, 백혈구감소증, 혈소판감소증 등의 증상이 발생하여 다발성 장기 부전으로 사망한 SFTS 사례가 처음 보고된 이후 환자 발생수가 지속적으로 증가하고 있다[10]. 또한 시골의 거주민을 대상으로 한 SFTS 항체 양성률이 4.1% (50/1228명)를 보여[11], 무증상 감염이나 경미한 감염도 가능하리라 사료된다. SFTS의 감염 경로는 주로 작은소참진드기(Haemaphysalis longicornis)가 매개하여 바이러스에 감염되는 것으로 알려져 있으나[8,12] 뭉뚝참진드기(Amblyomma testudinarium), 일본 참진드기(Ixodes nipponensis) 등에서도 SFTS 바이러스가 검출되어 SFTS의 매개 진드기로서의 가능성이 제시되었다[13,14]. 실제 한국에서 진드기에 물려 내원한 환자에서 진드기와 환자 혈액 및 뇌척수액에서 동일한 SFTS 바이러스가 검출되었으며, SFTS를 일으킨 진드기가 작은소참진드기임이 확인되어 우리나라에서 작은소참진드기가 주된 SFTS 매개체로 여겨진다[15]. 바이러스에 노출된 후 4-15일의 잠복기를 거치며, 고열, 피로감, 두통, 근육통, 복통, 구토, 설사, 기침 등 비특이적인 증상들이 나타난다[8,16]. 또한 혈소판감소증, 백혈구감소증, 림프절비대, 위장관 출혈 등의 징후가 특징이다[8,17]. SFTS 바이러스는 증상 발생 후 약 7-10일경에 혈중에 가장 높은 copy 수를 보인다[18].
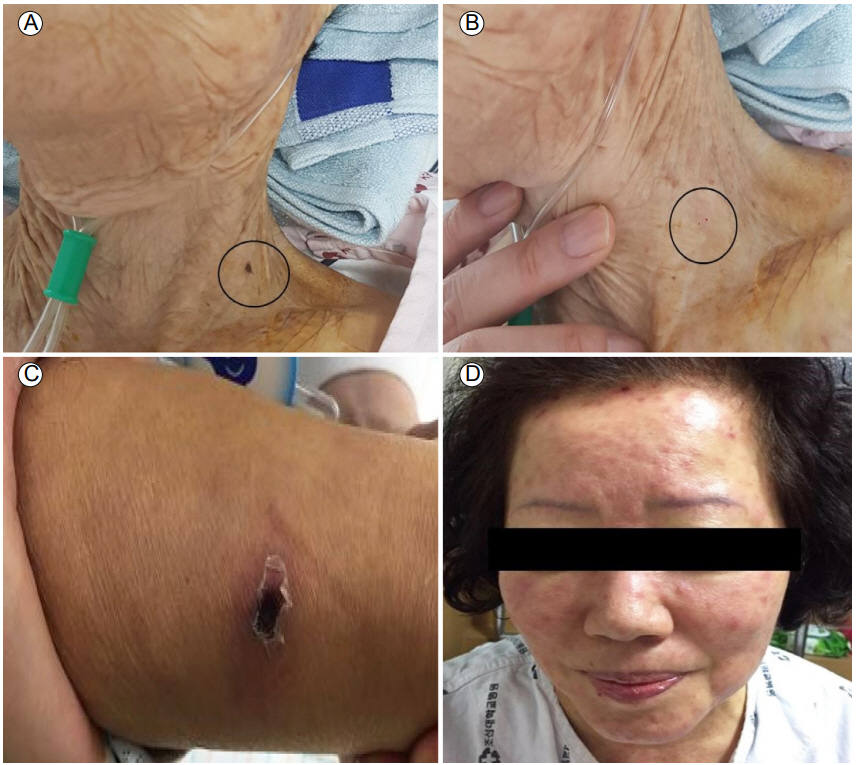
우리나라의 SFTS 확진 환자 172명에 대하여 발표한 자료에 의하면[19], SFTS는 전국에 걸쳐 발병하고 있으며 특히 우리나라 동부와 동남부 지방의 산간 구릉지 그리고 제주도가 환자 발생률이 높았다. 또한 서부, 남서부 지역의 논농사 지역에서 SFTS 발병률이 상대적으로 낮았는데, 같은 지역에서 쯔쯔가무시병은 높은 발병률을 보여 쯔쯔가무시병과 SFTS 발병률이 대비되는 결과를 보였다. 시기적으로는 5월에서 10월에 주로 발생하며 임상적 경과는 고열로 시작하여 다장기부전으로 진행하다가 회복되는 양상을 보였으며, 사망과 관련된 위험 인자로는 의식 저하, C-reactive protein (CRP)의 상승, activated partial thromboplastin time (aPTT) 연장(> 60 sec), 빈혈, alkaline phosphatase의 상승, aspartate aminotransferase의 증가(AST > 400 IU/L), alanine aminotransferease의 증가(ALT > 200 IU/L)였다. 발병부터 병원 내원까지는 평균 4일이 걸렸으며, 발병 첫 주에 발열(93.5%), 근육통(63.3%), 설사(54.3%), 식욕부진(53.8%), 구역(37.4%), 두통(34.1%), 착란(25.6%), 출혈 경향(21.5%) 등의 임상 소견을 보였다. SFTSV의 감염 여부에 대한 검사로는 reverse transcription polymerase chain reaction (RT-PCR)을 이용하여 SFTSV RNA의 target 유전자인 L, M, S분절 특이 유전자를 검출하거나, immunofluorescence assay나 enzyme-linked immunosorbent assay (ELISA)를 이용하여 SFTSV에 대한 항체를 검출하는 혈청 검사가 있다. 한 보고에 의하면 170건의 SFTS 사례 중에서 단지 26명(22.0%)이 진드기에 물린 적이 있다고 기억하였고 36명(30.3%)만이 첫 내원시 물린 자국이 있었다(Fig. 1) [19]. 그러므로 진드기에 물린 병력이 없는 환자에서도 야외 활동력이 있는 환자에서는 SFTS를 감별 진단으로 고려하여야 한다. 현재 SFTSV에 대한 항바이러스제 또는 백신은 아직 개발되지 않은 상태이며[20], ribavirin, plasma exchange, intravenous immuoglobulin + steroid, convalescent serum therapy 등의 치료가 시도되고 있으나 아직 효과가 증명된 치료법은 없다[21]. 그러므로 야외 활동시 진드기에 물리지 않도록 예방하는 것이 중요하다[22].
쯔쯔가무시병(scrub typhus)
쯔쯔가무시병은 Orientia tsutsugamushi에 감염된 털진드기의 유충이 사람을 물어 감염을 일으킨다[23]. O. tsutsugamushi는 다양한 혈청형을 가지고 있는데 길리암(Gilliam), 카프(Karp), 카토(Kato)와 같은 표준 혈청형 외에도 30종 이상의 다양한 혈청형이 존재하는데 우리나라에서는 보령(Boryong)형이 전국적으로 분포된 주요 혈청형으로 알려져 있다[24].
국내 털진드기 14속 51종 중 O. tsutsugamushi 병원균을 매개하는 것은 총 7종으로 대잎털진드기(Leptotrombidium pallidum), 활순털진드기(L. scutellare), 수염털진드기(L. palpale), 동양털진드기(L. orientale), 반도털진드기(L. zetum), 사륙털진드기(Neotrombicula japonica), 조선방망이털진드기(Euschoengastia koreaensis)가 있다[22].
호발 시기는 10-12월로 털진드기의 유충 번식기와 일치하며, 털진드기의 유충 시기에만 숙주에 붙어 체액을 섭취하며 이러한 체액 섭취 과정에서 사람이 감염된다. 2001년에서 2013년도 사이에 발생한 쯔쯔가무시병의 지역적, 계절적인 특징에 대한 연구에 따르면[23], 제주도를 제외한 모든 지역에서 일 년 중 10월에 쯔쯔가무시병의 발생률이 가장 높았다. 한국의 북부 지방과 중부 지방에서는 10월 4-5째 주에 가장 높은 발생률을 보였으며, 12월에는 발생이 드물었다. 남부 지방에서는 10월 다섯째 주에서 11월 첫째 주에 발생률이 가장 높았다. 제주 지역에서는 11월 둘째 주에서 셋째 주 사이에 발생률이 가장 높았으며, 다른 지역에 비하여 12월의 발생률이 높았다. 즉 위도가 낮아질수록 쯔쯔가무시병의 발생 시기가 연말로 늦춰지는 경향을 보였으며, 해를 거듭할수록 11월과 12월의 발생률이 증가하는 경향을 보였다. 이는 지구 온난화로 인하여 땅이 얼기 시작하는 시기가 늦춰지게 되면서 진드기 유충이 사람을 물 수 있는 기간 역시 지연되는 것과 관련이 있으리라 사료된다[23]. 쯔쯔가무시병의 잠복기는 6-18일이며 주요 임상 증상으로는 발열, 두통, 오한, 근육통과 같은 감기 유사 증상으로 시작하는 경우가 많다[22]. 발열은 치료받지 않은 환자에서 9-19일간 지속될 수 있으며(평균 14.4일), 질병의 경과는 가벼운 증상에서부터 다장기부전과 사망에 이를 수 있을 만큼 다양하다.
환자에서 반점 또는 반구진성 발진이 동반되며(Fig. 1), 전형적으로 복부에서 시작하여 사지와 얼굴까지 퍼지는 양상을 보이며 드물게 점상 출혈 양상으로 진행하기도 한다[25]. 진드기 유충에 물렸을 때 통증을 느끼지는 않으며 체액은 3-4일 정도 섭취를 지속하게 되고 이때 생긴 상처가 아물면서 가피(eschar)가 형성되는데, 진드기가 물린 부위에 무통성 구진이 나타나고 중심부로 괴사가 진행되면서 검정색 딱지 모양의 특징적인 가피가 형성되며(Fig. 1), 대개 전신 증상이 나타나기 전에 가피가 형성된다. 한 개 또는 다수로 생길 수 있으며 가피 모양이 전형적이지 않을 때도 있다[26].
O. tsutsugamushi가 인체에 감염된 경우 혈관내피세포에서 증식하여 전신 혈관염을 일으킴으로써 질병을 유발하게 되고 병리 검사상 주로 모세혈관이나 소동맥의 혈관내피에 염증이 관찰된다[24]. 이렇게 전신 혈관염을 일으키므로 전신 기관을 침범할 수 있어 심근염, 폐렴, 간염, 위장관 궤양, 중추신경계 침범 등을 초래하며, 다기관 기능부전, 파종성혈관내응고, 심한 경우 사망을 초래한다. 쯔쯔가무시병 환자 중에서 뇌내출혈, 경막하출혈, 뇌경색을 동반되기도 하며, 특히 이들은 증상 발생부터 항생제 투여 시까지의 기간이 지연된 경우가 흔하여 신속한 진단과 치료가 중요하다[27].
쯔쯔가무시병 환자에서 구역, 구토, 설사 등의 소화기 증상이 동반될 수 있는데, 한 연구에서 쯔쯔가무시병으로 진단받은 환자들 중에서 소화기 증상이 있는 256명 중 58명에서 위내시경을 시행한 결과 33-56% 환자에서 표재성 궤양, 출혈성 궤양, 미란 등의 소견을 발견하였다. 또한 이런 상부위 장관 병변의 존재가 병의 중증도와 연관성을 보였다[28]. 127명의 환자를 대상으로 한 전향적 연구에서도, 환자의 76.4%에서 소화불량, 구역, 복통, 구토, 혈변 등의 소화기 증상을 호소하였으며, 상부위장관 내시경을 시행한 결과 63%에서 궤양과 미란이 발견되었다. 심지어 소화기 증상이 없는 환자에서도 내시경적 병변을 가지고 있었으며 이들 중 26%에서는 점막미란이나 궤양, 위장관 출혈도 동반되었다[29]. 위궤양을 흔히 일으키는 감염 질환인 헬리코박터 감염 환자의 궤양은 주로 단일 병변으로 전정부, 체부, 소만에 위치하며 원형과 타원형에 가까우며 경계가 균일한 반면, 쯔쯔가무시병 환자에서는 주로 전정부와 대만에 위치해 있으면서 다발성 병변으로 경계가 불규칙한 특징을 가지고 있다[30]. 그 외 상대 서맥(relative bradycardia)도 쯔쯔가무시병 환자에서 종종 나타나며[31], 균이 중추신경으로 침투할 경우 뇌수막염을 일으킬 수 있고 급성 청력소실이나 이명을 일으킬 수 있다[32,33].
쯔쯔가무시병으로 doxycycline 복용 중에도 뇌수막염이 진행된 증례가 있는데, 환자는 쯔쯔가무시병을 진단받고 doxycycline을 4일째 복용 중에 지남력 장애, 의식 저하 등의 소견을 보여 이에 뇌척수액 검사를 시행하였으며, 뇌수막염 의심 소견을 보였다. Doxycycline 복용 중임에도 뇌수막염이 발생하였기 때문에 혈액과 뇌척수 액에서의 doxycycline 농도를 측정하였으며, 낮은 혈중 및 뇌척수액 농도를 확인하였다. 복용 중인 다른 약물도 함께 조사한 결과 환자는 상복부 통증과 구역감을 동반하여 doxycycline에 ranitidine과 almagate를 병행하여 복용하고 있었다. Tetracycline 계열 항생제는 제산제와 같이 복용할 경우 킬레이션(chelation)을 형성하여 흡수가 잘 안 되기 때문에 almagate와 doxycycline의 약물 상호작용에 의한 치료 실패 가능성을 염두하여 제산제 없이 doxycycline 단독으로 처방하였으며 이후 환자는 의식의 호전을 보였고 혈중 및 뇌척수액 doxycycline 농도도 상승하였다. 이처럼 쯔쯔가무시병 환자에서 doxycycline을 제산제와 함께 복용할 경우 혈중 농도가 낮게 유지될 수 있기에 처방에 주의해야 하겠다[34].
치료받지 않은 19,644명의 쯔쯔가무시병 환자를 대상으로한 연구에서 치사율은 0-70% (평균 6%)로 보고되었고, 치사율은 지역에 따라 다양한 양상을 보였으며 주로 고령에서 높았다[35,36]. 또한 심근염, 섬망, 간질성 폐렴이 치명적 예후와 관련이 있는 것으로 나타났으며 성별과 가피 유무와는 관련이 적은 것으로 조사되었다.
쯔쯔가무시병으로 진단받은 18세 이상의 환자 중에서 89명의 치명적 합병증을 동반한 집단과 합병증을 동반하지 않은 119명의 대조군을 대상으로 한 전향적 연구에서 증상 발생 시점에서 항생제 투여에 걸리는 기간이 두 집단 간의 차이가 없었다. 주요 합병증으로는 폐렴, 신부전, 뇌수막염, 위장관 출혈, 심근염 등이 있었으며 이 중 심각한 합병증과 관련 있는 위험인자는 60세 이상의 고령, 가피가 없을 때, WBC 10,000/mm³ 이상일 때, albumin 3g/dL 이하일 때로 보고하였다[37]. 그 외 혈액속의 O. tsutsugamushi DNA copy 수도 치사율에 영항을 주는 것으로 나타났다[38]. 고령의 환자들이 좀 더 위중한 질병 경과를 보이며 합병증도 더 많이 일으키는 것으로 나타났는데 16세 이상의 615명의 우리나라 환자를 대상으로 한 후향적 연구에서 65세 이상에서는 46%에서 합병증이 동반되었으며 그보다 젊은 연령에서는 23%에서만이 합병증이 동반되었다. 급성 신부전, 의식 저하, 호흡곤란이 고령에서 더 흔한 반면 발열, 발진, 가피의 유무는 젊은층과 큰 차이 없었다[25].
쯔쯔가무시병 확진을 위해서는 검체에서 O. tsutsugamushi 특이 유전자 검출, 회복기 혈청의 항체가가 급성기에 비하여 4배 이상 상승하거나, 검체에서 균을 분리해야 한다. 쯔쯔가무시병의 치료로 doxycycline, chloramphenicol, azithromycin 등의 항생제를 투약하며[22], 현재 doxycycline이 가장 흔히 사용되는 약제이다. 하지만 1990년대부터 태국 북부 지방에서 doxycycline에 감수성을 보이지 않는 O. tsutsugamushi 감염이 보고되었으며, 이러한 균주에 대해 rifampin이 효과가 있음이 보고된 바 있다. 특히 중추신경계 감염이 동반된 경우 뇌척수액내에 적절한 치료 농도를 유지하는데 효과적이어서 유용할 수 있다. 하지만 rifampin 은 간독성, 뇌경색, 뇌출혈 등을 일으킬 수 있는 부작용을 가지고 있어 사용에 주의하여야 한다. 또한 우리나라는 결핵 이환율이 높은 나라로 rifampin의 단독 사용이 내성 결핵 균주의 발생 가능성을 높일 수 있어 이에 대한 주의도 필요하다[39]. 쯔쯔가무시병은 아직 이에 대한 예방접종 백신이 없으므로 야외 활동시 최대한 털진드기의 노출을 피하는 것이 중요하다[22].
두 질환의 감별
쯔쯔가무시병과 SFTS는 발열, 두통, 근육통과 같은 비슷한 임상 양상을 가진다. 특히 우리나라는 가을철에도 SFTS 환자가 발생하기 때문에 두 질환의 감별이 중요하며, 게다가 농업에 종사하거나, 풀숲 같은 야외 노출력 등은 두 질환의 동일한 노출 위험인자이므로 두 질환을 감별하는 것이 중요하다[21].
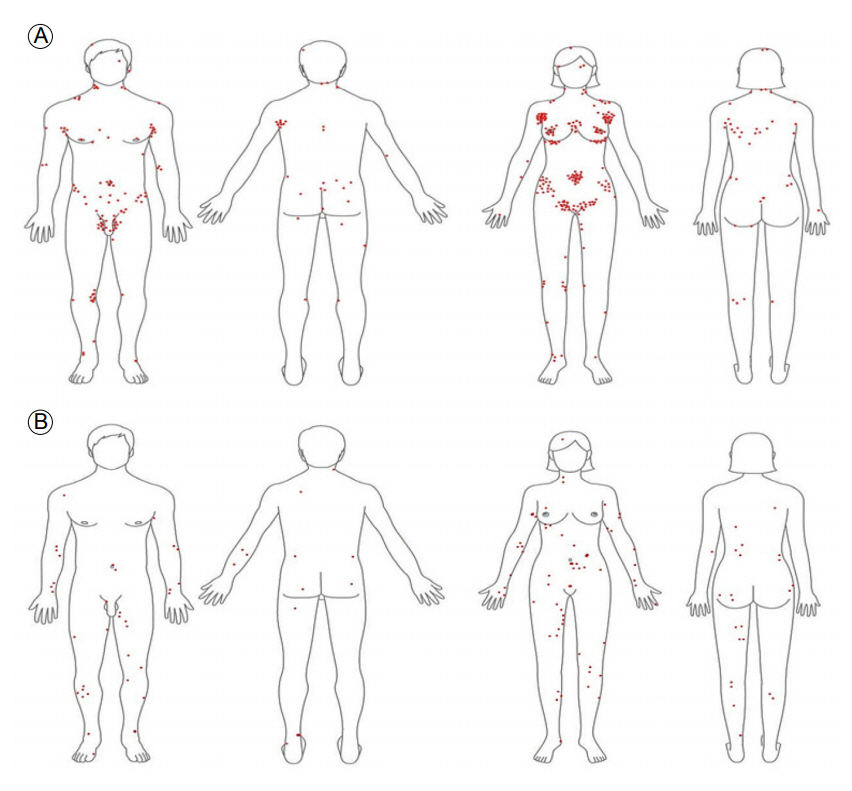
진드기 매개 질환이 의심되는 경우 진드기에 물린 부위를 확인하는 것이 중요한데 털진드기와 참진드기에 물린 부위는 서로 차이를 보였다. 2004년에서 2008년 동안 506명의 털진드기에 물려 생긴 가피의 발생 부위를 분석한 결과 전방 흉부와 액와부 복부와 서혜부에 특히 집중되어 있었으며 남자의 경우 복부와 서혜부에, 여자의 경우 전방 흉부와 액와부에 집중되어 있었는데 이는 털진드기가 따뜻하고 습한 부위를 좋아하는 습성 때문인 것으로 보이며 여성의 경우 유방 하부나 브래지어 속옷 등과 관련이 있을 것으로 보인다. 반면 91명의 참진드기에 물린 경험이 있는 농촌 거주민을 대상으로 서면 조사해본 결과 하지와 상지 복부, 서혜부에 빈도가 많았으며 남성과 여성 사이에 큰 차이를 보이지 않았다(Fig. 2).
쯔쯔가무시병과 SFTS는 폐, 신장, 뇌 등을 침범하는 치명적인 다장기 기능부전으로의 진행이 가능하기 때문에 빠른 진단이 필요하다. 한 연구에서 쯔쯔가무시병과 SFTS의 임상적 특징을 평가하여 두 질환을 구별하는 진단점수체계(scoring system)를 제시하였다. 다중로지스틱 회귀분석을 통하여 SFTS 환자에서 쯔쯔가무시병 환자에 비하여 의식 저하, 백혈구 감소증, aPTT의 연장, 정상 CRP 소견과 더 밀접하게 연관되어 있어 각각 1점의 점수를 주어 1점 이상인 경우 SFTS 가능성이 높으며 이 진단 점수 체계의 민감도가 100%, 특이도가 97%임을 보고하였다. 하지만 이는 3차병원에 내원한 환자를 대상으로 조사된 것이라는 한계점을 가지고 있다. 따라서 이러한 진단점수체계의 적용을 위해서는 더 많은 연구가 필요하리라 사료된다[21].
결 론
기후 변화 및 진단 기술의 발달로 국내 포함 전 세계적으로 진드기 매개 질환의 발생률이 점차 증가하고 있다. 진드기 노출 위험이 있는 야외 활동력과 함께 발열, 두통, 오심, 구토 등 비특이적인 증상 및 발진, 가피, 진드기 물린 부위 등의 소견을 보이는 환자의 경우 진드기 매개 질환을 반드시 의심해보아야 한다. 진단을 위해서 혈액을 이용한 진드기 매개 질환 특이 유전자를 타깃으로 한 PCR을 시행하거나 급성기 및 회복기의 혈청학적 검사를 시행하여 신속히 진단하여야 한다. 대부분의 진드기 매개 질환이 초기에 진단하여 치료한 경우 예후가 좋으므로 신속한 진단과 치료가 중요하리라 사료된다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






