아가미-귀-콩팥증후군 환자에서의 신부전 증례
Renal Failure with Branchio-Oto-Renal Syndrome
Article information
Abstract
BOR 증후군 환자는 일반적으로 평균 수명과 차이 없으나 신기능이 감소되어 다양한 합병증이 발생하고 수명이 단축되므로, 본 증례처럼 청력 소실, 외이 기형 등으로 BOR 증후군이 의심된다면 혈액 검사, 요 검사 및 영상 검사 등을 통하여 콩팥 이상을 확인하는 것이 필요하다.
Trans Abstract
Branchio-oto-renal (BOR) syndrome is a rare autosomal dominant disorder that is characterized by preauricular pits, branchial fistula, branchial cyst, hearing impairment, and kidney anomalies. Hearing impairment is the single most common feature of BOR syndrome, affecting 89% of patients. Preauricular pits (77%), kidney anomalies (66%), branchial fistula (63%), external auditory canal anomalies (41%) are also common. For most patients, BOR syndrome does not affect life expectancy. The major life-threatening feature of this condition is kidney dysfunction, which occurs with about 6% of kidney anomalies. Therefore, once BOR syndrome is recognized in a patient, careful evaluation to detect renal anomalies and treatment of any kidney involvement are necessary. No case reports of BOR syndrome involving adult-onset end-stage kidney disease have been published in the Korean medical literature. We report a case of end-stage kidney disease in a 19-year-old male patient with BOR syndrome, together with a review of the pertinent literature.
서 론
아가미-귀-콩팥(branchio-oto-renal, BOR)증후군은 전이개누공(preauricular pits), 새열누공(brachial fistula), 새열낭종(brachial cyst), 청력 소실, 콩팥 이상을 특징으로 하는 선천성 질환으로 상염색체가 우성 유전되고 있다. 발생 빈도는 신생아 40,000명 중 1명의 빈도로 추정하고 있으며 남성과 여성에게 같은 비율로 나타나고 있고 심한 청력 장애 아동의 2-3%에서 BOR 증후군이 발견되고 있다. 임상 증상 중 특징적인 5가지는 아가미 결손(brachial defect), 청력 소실, 전이개누공, 이개(pinna) 기형, 콩팥 기형이며, 흔히 관찰되는 임상증상을 빈도순으로 보면, 청력 소실이 89%로 가장 많고 다음으로 전이개누공 77%, 콩팥 기형 66%, 아가미 결손 63%의 발생률을 보이고 이외에 외이의 기형이 41%로 보고되고 있다[1]. 콩팥 기형은 콩팥의 집합계(collecting system)가 중복되거나 콩팥의 양쪽 또는 한쪽이 결여 또는 기능이 상실되고, 심한 예에서는 신부전이 발생하기도 하는데 신부전으로 발생하는 경우는 흔하지 않아 콩팥 기형의 6%에서 경험하게 된다[2]. 하지만 신기능 저하증을 동반한 BOR 증후군에 대한 국내 보고는 없는 실정이다. 저자들은 신부전이 발생하여 혈액투석을 시행하고 있는 BOR 증후군 환자를 경험하였기에 이를 문헌고찰과 함께 보고하는 바이다[3].
증 례
환 자: 19세 남자
주 소: 식욕 저하와 전신부종
과거력 및 현병력: 환자는 2주 전부터 지속되는 전신부종을 주소로 내원하였다. 출생시 40주 2,900 g이었으며 분만 당시 양수흡인이 있었고 동맥관개존증으로 인한 신생아 폐고혈압을 진단받아 동맥관개존 폐쇄 수술을 받았고 두 달간 입원 치료를 하면서 우측 외이 기형과 콩팥 크기 감소를 진단받았으나 별다른 치료없이 지내왔다. 27개월에 발달 장애로 소아청소년과에 내원하여 시행한 혈액 검사에서 혈청 크레아티닌이 1.4로 상승되어 있어 신기능 저하가 확인되었고 청력 소실과 전이개누공이 확인되어 BOR 증후군이 진단되었다. 진단 후 청력 소실에 대하여 좌측 보청기를 착용 중이고 반복적인 이루, 좌측 외이농양으로 증상 발생 시마다 항생제 치료를 받았었다. 내원 2주 전부터 악화되는 전신부종, 호흡곤란, 구역감을 주소로 내원하였다.
가족력: 환자는 2남 1녀 중 둘째로서 보육시설에서 가족 없이 생활하였고, 환자의 어머니와 여동생에게 청각 장애가 있었다고 하나 병원 진료 기록이 없었고, 형은 BOR 증후군으로 인한 말기 신부전이 있었다고 하며 15세경 사망하였다.
사회력: 흡연력과 음주력은 없었다.
이학적 소견: 환자는 27개월 내원 당시 신장 80.7 cm, 체중 9.65 kg, 두위 44.3 cm로 표준 성장 곡선이 3% 미만이었고 의식은 명료하였으며 혈압, 체온, 맥박 및 호흡수는 정상이었다. 17세 본원 신장내과 내원시 신장 151 cm, 체중 36 kg으로 표준 성장 곡선이 3% 미만이었으며 우측 작은 외이, 우측 전이개누공이 확인되었고 양측에 보청기를 착용 중이었다. 우측 전이개누공, 외이도폐쇄, 저위귀(low set ear)가 관찰되었으며(Fig. 1) 비강 및 인후부 이상 소견은 없었으나 짧은 구개열, 하악후퇴증이 확인되었다. 심폐 청진은 정상이었다. 복부 진찰 소견상 복부는 편평하였고 경직은 없었으며 장음은 들리지 않았다. 간과 비장의 비대 소견은 없었고 신경학적 검사에서도 이상 소견은 없었다.
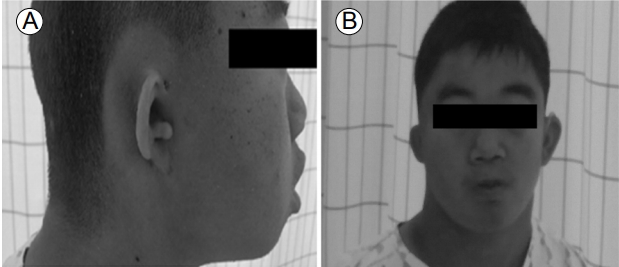
(A) External auditory canal stenosis, with preauricular pits on the right side. Short palate and retrognathia were also observed in this patient. (B) Patient with low set "lop-ear" and microtia.
검사 소견: 19세 6개월에 식욕 저하, 얼굴 및 다리부종으로 내원시 시행한 혈액 검사에서 백혈구 7,500/mm3 (중성구 75.1%, 림프구 14.9%, 단핵구 8.8%, 호산구 0.6%), 혈색소 8.0 g/dL, 혈소판 171,000/μL, 혈액요소질소 187.6 mg/dL, 크레아티닌 31.8 mg/dL, 나트륨 140 mmol/L, 칼륨 5.8 mmol/L, 염소 103 mmol/L, 총 이산화탄소 10 mmol/L, 칼슘 7.8 mg/dL, 인 9.2 mg/dL, 총 단백질 6.0 g/dL, 알부민 3.4 g/dL, 아스파르테이트아미노 전이효소 6 U/L, 알라닌아미노 전이효소 5 U/L, 알칼라인포스파테이트 53 U/L, 총 콜레스테롤 104 mg/dL, 소변 검사에서 비중 1.014, 산도 6.5, 단백뇨 3+, 혈뇨 약양성(trace), RBC 26/HPF, WBC 8/HPF이 검출되었다. 복부 단층촬영에서 우측 콩팥 4.4 cm, 좌측 콩팥 4.2 cm로 양측 콩팥의 크기 감소가 확인되었다(Fig. 2).

Abdominal CT: small kidneys (right 4.8 cm, left 4.2 cm), with a simple cyst in the right kidney (right arrow; left kidney, left arrow; right kidney in each picture).
생후 27개월에 혈액요소질소 34.2 mg/dL, 크레아티닌 1.3 mg/dL, 소변 검사에서 비중 1.010, 산도 5.5, 단백뇨 1+, 혈뇨 약양성(trace), RBC 0/HPF, WBC 0/HPF이 검출되었다(Fig. 3). 시행한 흉부 방사선촬영에서 이상 소견이 없었고 복부 방사선촬영에서 외반고(coxa valga)가 있었고 복부 초음파에서 양측 콩팥의 크기 감소, 신피질 고에코 소견을 보이며 좌측 0.5 cm/우측 0.2 cm 크기의 콩팥낭종이 있었다. 핵의학 신장스캔(DMSA scan)에서 우측 신 중간극과 좌측 신 하극의 결핍이 있었고 좌우 콩팥 섭취비는 0.58:0.42로 확인되었다. 콩팥 조직 검사를 시행하였고 신장 피질이 주로 생검된 조직 소견상 사구체는 경미한 메산지움 기질의 확장과 국소 분절성 메산지움의 증식이 관찰되었으며 면역형광염색 결과는 음성이었고 전자 현미경 상 사구체 기저막 및 족세포돌기의 형태학적 이상 소견은 관찰되지 않았다. 세뇨관은 소수가 확장되어 있었고 세뇨관 위축, 간질의 염증세포는 보이지 않았다. 이형성의 소견은 없었으나 저형성이 관찰되었다(Fig. 4). 순음 청력 검사에서는 좌측 전음성 난청을 보였으며(Fig. 5) 우측은 외이도폐쇄증으로 이간감쇠를 시행하지 못하였고 청성 뇌간 반응 검사에서는 우측 70 dB, 좌측 55 dB로 확인되었다. 측두골 전산화단층촬영에서 우측 외이도폐쇄증, 우측 중이 구조발육 장애를 보였고 양측 내이와 반고리관 정상이었다. BOR 증후군으로 인한 말기 신부전으로 15세경 사망한 형이 있었던 가족력과 청력 소실, 신기능 저하 소견을 통하여 BOR 증후군을 진단하였다.
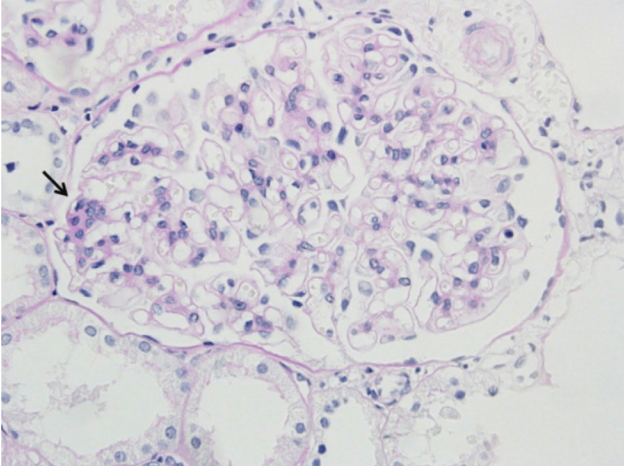
Renal biopsy showing segmental areas of increased mesangial matrix and cellularity (arrow) (PAS stain, ×400).
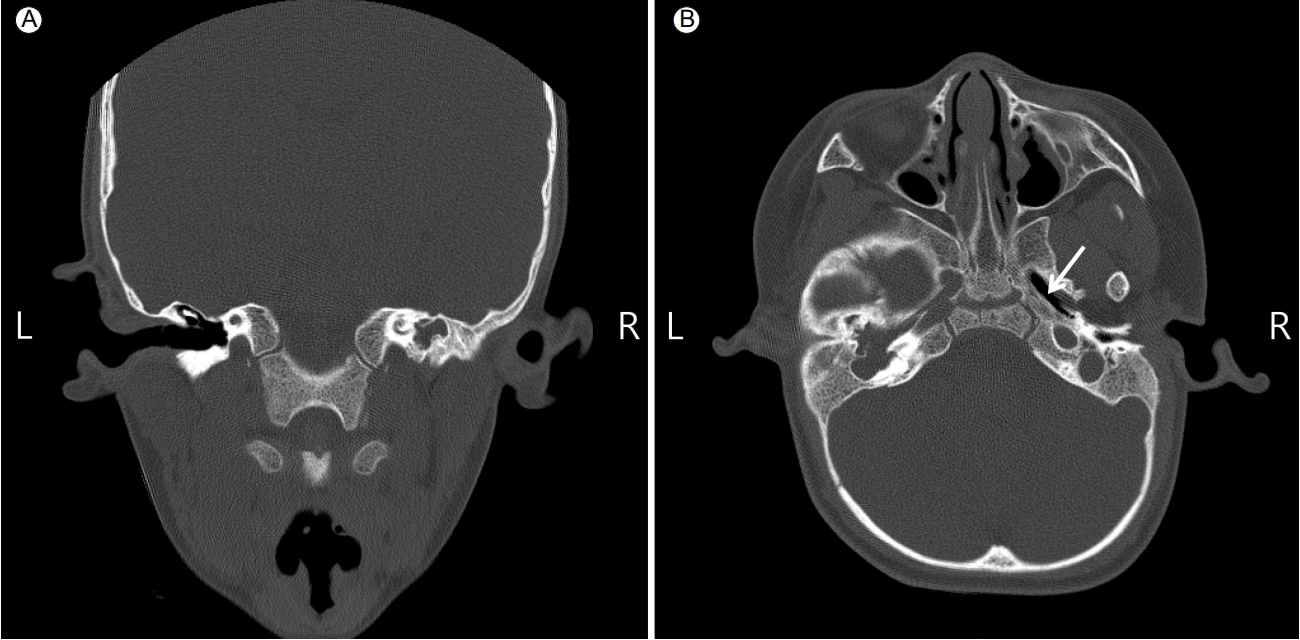
Computed tomography of the temporal bone. (A) Right external auditory canal atresia. (B) Patulous eustachian tube (arrow).
경 과: 환자는 청력 저하에 대하여 좌측 보청기 착용 중이고 신기능 저하는 안지오텐신전환효소억제제를 복용하며 정기적인 추적 관찰을 하던 중 식욕 저하, 부종으로 내원하여 시행한 혈액 검사에서 사구체여과율 1.78 mL/min (혈액요소질소 187.6 mg/dL, 크레아티닌 31.75 mg/dL)로 말기 신부전이 진행하여 19년 6개월 혈액투석을 시작하였다.
고 찰
BOR 증후군은 신생아에서 0.0025%의 비율로 발생하는 흔하지 않은 질환이며 이 중 66%에서 콩팥 기형을 동반하고 있으나 신기능 저하에 이르는 경우는 6%에 불과하다[2]. 국내에서는 신기능 저하증이 동반된 BOR 증후군의 증례가 보고되지 않아 혈액투석을 시행하게 된 본 증례는 국내에서 보고하는 첫 증례라는 점에 의미가 있다.
BOR 증후군은 1864년 Heusinger [4]에 의하여 인두와 청력 장애의 동반 질환이 보고된 이후 1975년 Melnick 등[3]이 청력 소실과 함께 아가미의 형성 이상, 귀와 콩팥의 기형이 동반된 질환을 보고하면서 명명되었다. 이 증후군은 상염색체 우성으로 유전되는 질환으로, Abdelhak 등[5]은 두 점 연쇄 분석법(two point linkage analysis)을 통하여 8번 염색체 장완(8q13.3)에 위치하는 EYA1 유전자가 원인임을 규명하였다. 환자의 40%에서 EYA1 유전자 돌연변이가 관찰되며 태생 4주에서 10주 사이에 귀 기원판(otic placode)과 신원기(renal anlage)의 발달에 중요한 역할을 한다. 또한 Ruf 등[6]은 BOR 증후군을 진단받은 환자를 대상으로 배아 발달 과정에서 콩팥단위(nephron)와 관련된 SIX1, SIX5 유전자가 관여됨을 밝혔고 환자의 2.5%에서는 19번 장완 q13.3에 위치한 SIX5 유전자 돌연변이를 가지고 있으며, 2% 환자에서는 14번 장완 q23에 위치한 SIX1 유전자에 돌연변이를 가지는 것이 밝혀졌다[7].
상염색체 우성 유전 질환은 한 쌍의 유전자 중 어느 한쪽이라도 질병 유전자를 포함하고 있으면 질병을 나타내는 병으로, 질병을 가진 부모로부터 자녀가 태어날 경우 성별에 관계없이 각 임신 때마다 질병이 발생할 확률이 50%이다. 본 증례에서는 환자의 형이 같은 질병을 진단받았고 어머니와 여동생에게는 신장 장애는 나타나지 않았으나 가족들이 유전자 검사를 원치 않아 시행하지 못하였다. 이는 유전자 검사를 시행할 경우 어머니와 여동생에서는 BOR 증후군이 아닌 아가미-귀-안면증후군 등 다른 유전자의 이상에 의하여 발생하는 질환이 진단되었을 가능성도 존재한다는 의미이다. Ruf 등[6]에 의하면 16번 장완 q12에 위치한 SALL1 유전자에 돌연변이가 있는 아가미-귀-안면증후군이 있으며 이는 BOR 증후군과는 다른 유전자의 이상에 의하여 발생하는 다른 질환으로 알려져 있다[3,5]. 상염색체 우성 유전 질환이 있는 가족에서 남자 가족에게만 질환이 나타났으나 유전자 검사를 시행하지 못하였다는 점은 이번 증례의 아쉬운 점으로 남는다. 유전자의 이상에 의하여 발생하는 질환이 진단되는 경우 유전자형에 대한 검사가 필수적으로 진행되어야 질환에 대한 연관 연구가 가능할 것이다.
이 질환은 전이개누공(preauricular pit), 새열누공(branchial fistula), 새열낭종(branchial cyst), 청력 소실, 콩팥 이상이 흔히 관찰되는 이상 소견으로, 임상적인 특징을 통하여 진단하게 된다[8]. Chang 등[8]이 제시한 임상적 진단기준에서는 가족력이 있는 경우 주 진단기준인 아가미 결손, 청력 소실, 전이개누공, 콩팥 기형 중 1가지 이상의 이상 소견이 있는 경우 진단할 수 있다. 가족력이 없는 경우 3가지 이상의 특징이 있거나, 2개의 주 진단기준에 부 진단기준인 외이, 중이, 내이의 이상 소견 혹은 귓바퀴 주위(preauricular tags) 중 2가지 이상의 이상 소견이 관찰될 때 진단할 수 있다[8]. 본 증례는 가족력이 있으며 청력 소실, 전이개누공, 콩팥 기형이 동반되어 있어 BOR 증후군으로 증명할 수 있었다.
청력 소실은 가장 흔히 관찰되는 이상 소견으로 혼합성 난청이 50%, 전음성 난청이 30%, 감각신경성 난청이 20%를 차지하며 양측 귀에서 서로 다르게 나타날 수 있다. 제1 아가미궁과 제2 아가미궁의 이상에 의하여 새열누공, 전이개누공, 소이증 등 외이 이상이 발생할 수 있고 인두 또는 피부로의 연결 여부에 따라 누공 외에 낭, 동을 형성하기도 한다[7,9].
콩팥의 이상 소견은 신배구조의 변화, 수신증, 콩팥황폐증(nephronophthisis), 이형성, 저형성, 무형성등의 발달 장애, 요관신우 접합부 폐쇄, 방광요관역류 등 다양하게 나타나는데 콩팥 이상 환자의 6%에서는 생명에 지장을 줄 정도의 심각한 신비뇨기계 장애를 초래한다[10]. BOR 증후군 환자는 일반적으로 평균 수명과 차이가 없으나 말기 신부전이 진행된 경우 투석이나 이식을 하지 않으면 살 수 없게 될 뿐만 아니라 심, 뇌혈관계 등의 동반 질환으로 인하여 수명이 감소하게 된다. 신기능 감소에 따른 고혈압과 전해질 이상 등의 발생을 최소화하기 위하여 식이 조절과 약제 투여를 적절한 시기에 시행하는 것이 환자의 예후에 좋은 영향을 미칠 것으로 판단되므로 정기적인 신기능 평가가 필요하다[10]. 본 증례와 같이 BOR 증후군 진단 당시 복부 초음파를 통하여 콩팥 발육부전을 확인한다면 혈압과 혈당, 콜레스테롤의 조절, 식이요법관리 등의 신기능 관리를 통하여 신기능 저하 속도를 늦추거나, 신기능 감소에 따른 합병증 발생을 억제하는 것이 좋겠다.
하지만 새열누공, 청력 장애 등의 임상 증상이 동반되어 BOR 증후군이 의심되는 경우 혈액 검사, 소변 검사를 통하여 일부에서 신기능 저하가 확인되지만 발달 장애 등의 기형, 구조 변화는 발견되지 않을 수 있다. 문진 및 가족력 등의 철저한 조사와 함께 청력 검사, 측두골 전산화단층촬영 등을 시행하고 이상 소견이 관찰될 경우 복부 초음파, 복부 전산화단층촬영 또는 경정맥성 요로조영술 등의 추가적인 검사를 통하여 적절한 평가가 시행해야 할 필요가 있다[9,10].
이 질환은 EYA1 등의 유전자에 의해서 발생하는 상염색체 우성 유전 질환으로, 최근 콩팥 발생학에 영향을 미치는 유전자형과의 관련성에 대한 연구가 진행되고 있는 만큼 가족력과 산전 유전자 검사를 통하여 조기 진단이 가능할 것으로 예측된다[9]. 앞으로 유전자형과 임상 증상과의 연관성을 분석한다면 적절한 검사를 통한 진단 비율이 증가할 것이며 조기 진단에 따라 적절한 치료가 진행되어 생존율이 향상될 것이라 기대된다.
