 |
 |
| Korean J Med > Volume 92(3); 2017 > Article |
|
мҡ”м•Ҫ
лӘ©м Ғ
нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCмҷҖ кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ” к°„мқҳ мғҒкҙҖкҙҖкі„ л°Ҹ AMiC мң л¬ҙк°Җ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ м—җ лҜём№ҳлҠ” мҳҒн–Ҙмқ„ мЎ°мӮ¬н•ҳмҳҖлӢӨ.
л°©лІ•
2011л…„ 4мӣ”л¶Җн„° 2015л…„ 5мӣ”к№Ңм§Җ нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ кіј CACS кІҖмӮ¬лҘј мӢңн–үн•ң 119лӘ…мқҳ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң н•ҳмҳҖлӢӨ. нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCлҠ” мҲҳмҲ мӨ‘ нҡҚл“қн•ң лҸҷл§Ҙ н‘ңліёмқҳ von Kossa м—јмғүмңјлЎң 진лӢЁн•ҳмҳҖлӢӨ. лӘЁл“ нҷҳмһҗлҠ” 비조мҳҒ мҰқк°• лӢӨмӨ‘ кІҖм¶ң м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒмқ„ мӢңн–үн•ҳм—¬ CACSлҘј кі„мӮ°н•ҳмҳҖлӢӨ. лҢҖмғҒ нҷҳмһҗм—җм„ң AMiCмҷҖ CACSмқҳ мғҒкҙҖкҙҖкі„лҘј мЎ°мӮ¬н•ҳмҳҖлӢӨ. лҳҗн•ң 2017л…„ 2мӣ”к№Ңм§Җ 추м Ғ мЎ°мӮ¬н•ҳмҳҖкі нҷҳмһҗлҘј AMiC мң л¬ҙм—җ л”°лқј л‘җ кө°мңјлЎң лӮҳлҲ„м–ҙ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқ„ 비көҗн•ҳмҳҖлӢӨ.
кІ°кіј
лӮЁл…Җ лҢҖмғҒмһҗ мҲҳлҠ” к°Ғк°Ғ 76лӘ…(64%)кіј 43лӘ…(36%)мқҙм—Ҳкі нҸүк· лӮҳмқҙлҠ” 64.3 Вұ 13.0м„ёмҳҖлӢӨ. 67лӘ…(56%)мқҳ нҷҳмһҗм—җм„ң von Kossa м—јмғүм—җм„ң нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCк°Җ кҙҖм°°лҗҳм—Ҳкі нҸүк· CACSлҠ” 430.4 Вұ 720.2мҳҖмңјл©° 99лӘ…(83%)мқҳ нҷҳмһҗм—җм„ң кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ”к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. лӢӨмӨ‘ лЎңм§ҖмҠӨнӢұнҡҢк·Җ분м„қ кІ°кіј CACS(OR: 1.002, 95% CI: 1.001-1.004, p< 0.05)лҠ” AMiCмҷҖ мң мқҳн•ң мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ. 추м Ғ кҙҖм°° кё°к°„ лҸҷм•Ҳ м „мІҙ мӮ¬л§қмқҖ 26лӘ…мқҙм—Ҳкі к·ёмӨ‘ 17лӘ…мқҙ мӢ¬нҳҲкҙҖ мӮ¬л§қмқҙм—ҲлӢӨ. Kaplan-Meier мғқмЎҙ분м„қм—җм„ң AMiC м–‘м„ұмқё кө°м—җм„ң мқҢм„ұмқё кө°м—җ 비н•ҙ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ (log rank = 9.0, p< 0.05)мқҙ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ.
Abstract
Background/Aims
The aim of this study was to explore the relationship between arterial micro-calcification (AMiC) and coronary artery calcification, and to determine the impact of AMiC on cardiovascular mortality in incident hemodialysis patients.
Methods
One hundred and nineteen hemodialysis patients who received vascular access surgeries between April 2011 and May 2015 were included in this study. AMiC was diagnosed by pathologic examination of arterial specimens acquired during surgery, using von Kossa stain. All patients underwent multi-detector computed tomography imaging, and coronary artery calcium scores (CACS) were calculated. We evaluated the association between AMiC and CACS in these patients, and examined the incidence of cardiovascular death (through Febraury 2017) in patients with and without AMiC.
Results
The mean age of the patient group was 64.3 Вұ 13.0 years, and 64% were male (n = 76). Of 119 patients, 67 (56.3%) were positive for AMiC of the vascular access. The mean CACS was 430.4 Вұ 720.2 (0-3,954), and 99 patients were considered positive for CAC (83.1%). By multivariate logistic regression analysis, CACS was independently associated with AMiC. The mean follow- up period was 35.5 Вұ 17.8 months. During this time there were 26 all-cause deaths, of which 17 were cardiovascular. Kaplan-Meier survival analysis revealed that AMiC was associated with cardiovascular mortality (log rank = 9.0, p < 0.05).
нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мӢ¬нҳҲкҙҖ м§ҲнҷҳмқҖ мЈјмҡ” мӮ¬л§қ мӣҗмқёмқҙл©°, мқјл°ҳ мқёкө¬м§‘лӢЁм—җ 비н•ҙ мқҙнҷҳмңЁ л°Ҹ мӮ¬л§қлҘ мқҙ лҶ’мқҖ кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[1,2]. л”°лқјм„ң нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҳ л°ңмғқмқ„ мЎ°кё°м—җ мҳҲмёЎн•ҳкі м§„лӢЁн•ҳлҠ” кІғмқҙ мһ„мғҒм Ғ мҳҲнӣ„м—җ мӨ‘мҡ”н•ҳлӢӨ. к·ёлҹ¬лӮҳ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗлҠ” мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҙ л°ңмғқн• л•Ңк№Ңм§Җ л¬ҙмҰқмғҒмқё кІҪмҡ°к°Җ л§Һкі мқјл°ҳ мқёкө¬м§‘лӢЁм—җм„ң мһҳ м•Ңл Ө진 мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҳ мһ„мғҒм Ғ мң„н—ҳ мқёмһҗл“Өл§ҢмңјлЎңлҠ” мҳҲмёЎмқҙ м–ҙл Өмҡ°л©° мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқмқҳ л°”мқҙмҳӨл§Ҳм»Ө(homocysteine, brain natriuretic peptide л“ұ) лҳҗн•ң м Ғмҡ©мқҙ м–ҙл ӨмӣҢ мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқмқҳ мҳҲмёЎкіј мЎ°кё° 진лӢЁмқҙ м–ҙл өлӢӨ[3]. л”°лқјм„ң нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқмқҳ мҳҲмёЎкіј мЎ°кё° 진лӢЁмқ„ мң„н•ң м§Җн‘ңм—җ лҢҖн•ң м—°кө¬к°Җ н•„мҡ”н•ҳлӢӨ.
мЈјлЎң мҳҒмғҒн•ҷм Ғ кІҖмӮ¬лЎң нҷ•мқёлҗҳлҠ” кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ”лҠ” мЈҪмғҒкІҪнҷ”мҰқ(atherosclerosis)мқҳ мқјнҷҳмңјлЎң лӮҳнғҖлӮҳкё° л•Ңл¬ём—җ мЈјлЎң лӮҙл§үмёөм—җ мЈјлЎң л°ңмғқн•ҳлӮҳ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ңлҠ” лӮҙл§ү мҷём—җлҸ„ мӨ‘л§үмёөк№Ңм§Җ нҷ•мӮ°лҗҳм–ҙ лӮҳнғҖлӮҳкё°лҸ„ н•ңлӢӨ[4]. кҙҖмғҒлҸҷл§Ҙ м№јмҠҳмҲҳм№ҳ(coronary artery calcium score, CACS)лҠ” кҙҖмғҒлҸҷл§Ҙ м§Ҳнҷҳмқҳ 비침мҠөм Ғмқё м§Җн‘ңлЎң кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ” м •лҸ„лҘј м •нҷ•н•ҳкі м •лҹүм ҒмңјлЎң нҸүк°Җн• мҲҳ мһҲлҠ” кІҖмӮ¬мқҙлӢӨ. нҳҲкҙҖ м„қнҡҢнҷ”лҠ” мқјл°ҳмқёкіј нҳҲм•ЎнҲ¬м„қ нҷҳмһҗ лӘЁл‘җм—җм„ң мӢ¬нҳҲкҙҖ мӮ¬л§қмқҳ лҸ…лҰҪ мң„н—ҳ мқёмһҗлЎң м•Ңл Өм ё мһҲлӢӨ[5-8]. мқҙм—җ л°ҳн•ҙ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗмқҳ нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ мӢңм—җ мҲҳмҲ л¶Җмң„ лҸҷл§Ҙм—җм„ң мЎ°м§Ғн•ҷм ҒмңјлЎң мЎ°мӮ¬н•ң лҸҷл§ҘлҜём„ём„қнҡҢнҷ”(arterial micro-calcification, AMiC)лҠ” лҸҷл§ҘкІҪнҷ”мҰқ(arteriosclerosis)мқҳ мЈјмҡ” мҶҢкІ¬мқҙлӢӨ. нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ мӢңм—җ мүҪкІҢ лҸҷл§ҘмЎ°м§Ғмқ„ нҡҚл“қн• мҲҳ мһҲкё° л•Ңл¬ём—җ лі‘лҰ¬н•ҷм Ғ ліҖнҷ”м—җ лҢҖн•ң м—°кө¬к°Җ ліҙкі лҗҳкі мһҲлӢӨ. м Җмһҗл“ӨмқҖ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCк°Җ мӢ¬нҳҲкҙҖ м§Ҳнҷҳ мӮ¬л§қлҘ мҰқк°ҖмҷҖ кҙҖл Ёмқҙ мһҲлӢӨкі ліҙкі н•ң л°” мһҲлӢӨ[9]. нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCк°Җ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқ„ мҰқк°ҖмӢңнӮӨлҠ” кё°м „м—җ лҢҖн•ҙм„ңлҠ” нҳ„мһ¬к№Ңм§Җ мһҳ м•Ңл Өм ё мһҲм§Җ м•ҠлӢӨ. м Җмһҗл“ӨмқҖ лҜём„ём„қнҡҢнҷ”к°Җ лҢҖлҸҷл§Ҙ л“ұмқҳ лӢӨлҘё л¶Җмң„мқҳ лҸҷл§ҘкІҪнҷ”мҰқкіј мң мӮ¬н•ҳкІҢ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқҳ мң„н—ҳ мқёмһҗмқё лҸҷл§ҘкІҪм§Ғмқ„ мҰқк°ҖмӢңнӮЁлӢӨкі ліҙкі н•ң л°” мһҲлӢӨ[10].
нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCмҷҖ CACSлҠ” м„қнҡҢнҷ”мқҳ л°ңмғқ кё°м „мқҙ лӢӨлҘҙлӮҳ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нқ”н•ҳкІҢ л°ңмғқн•ҳлҜҖлЎң кҙҖл Ём„ұмқҙ мһҲмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ. мқҙм—җ м Җмһҗл“ӨмқҖ мІ«м§ё, нҳҲм•ЎнҲ¬м„қмқ„ мғҲлЎңмқҙ мӢңмһ‘н•ҳлҠ” нҷҳмһҗм—җм„ң AMiC, CACSмҷҖ лҶ’мқҖ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ кіјмқҳ кҙҖл Ём„ұмқ„ нҷ•мқён•ҳкі , л‘ҳм§ё, м„ңлЎң лӢӨлҘё кё°м „мқҳ м„қнҡҢнҷ”к°Җ кҙҖл Ём„ұмқҙ мһҲлҠ”м§ҖлҘј мЎ°мӮ¬н•ҳм—¬ мқҙлҘј нҶөн•ҙ нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCк°Җ м–ҙл–Ө кё°м „мңјлЎң лҶ’мқҖ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ кіј кҙҖл Ёмқҙ мһҲлҠ”м§ҖлҘј к·ңлӘ…н•ҳкё° мң„н•ҙ ліё м—°кө¬лҘј мӢңн–үн•ҳмҳҖлӢӨ.
ліё м—°кө¬лҠ” нӣ„н–Ҙм Ғ, лӢЁмқјкё°кҙҖ м—°кө¬лЎң 2011л…„ 4мӣ”л¶Җн„° 2015л…„ 5мӣ”к№Ңм§Җ мқҳм •л¶Җм„ұлӘЁлі‘мӣҗм—җ лӮҙмӣҗн•ң л§җкё° мӢ л¶Җм „ нҷҳмһҗ мӨ‘ нҳҲм•ЎнҲ¬м„қмқ„ мӢңмһ‘н•ҳкі 1к°ңмӣ” мқҙлӮҙм—җ нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ кіј CACS кІҖмӮ¬лҘј мӢңн–үн•ң 119лӘ…мқҳ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң н•ҳмҳҖлӢӨ. лҢҖмғҒнҷҳмһҗл“Өмқҳ мқҳл¬ҙкё°лЎқ 분м„қмқ„ нҶөн•ҳм—¬ м—°л №, м„ұлі„, нқЎм—°л Ҙ, лҸҷл°ҳ м§Ҳнҷҳ л°Ҹ кҙҖмғҒлҸҷл§Ҙ м§Ҳнҷҳ, лҮҢнҳҲкҙҖ м§Ҳнҷҳ л“ұмқҳ лі‘л Ҙмқ„ мЎ°мӮ¬н•ҳмҳҖмңјл©° мӢ мһҘкіј мІҙмӨ‘мқ„ мёЎм •н•ҳм—¬ мІҙм§Ҳлҹүм§ҖмҲҳ(body mass index, BMI)лҘј кө¬н•ҳмҳҖлӢӨ. ліё м—°кө¬лҠ” к°ҖнҶЁлҰӯмӨ‘м•ҷмқҳлЈҢмӣҗ мһ„мғҒм—°кө¬мӢ¬мӮ¬мң„мӣҗнҡҢ(Institutional Review Board UC13RISSI0137)мқҳ м—°кө¬ мҠ№мқёмқ„ л°ӣм•ҳлӢӨ.
нҳҲкҙҖ м§Ҳнҷҳмқҳ 진лӢЁмқҖ мһ„мғҒм Ғ кё°мӨҖкіј 진лӢЁ кІҖмӮ¬лҘј кё°мҙҲлЎң н•ҳмҳҖлӢӨ. кҙҖмғҒлҸҷл§Ҙ м§ҲнҷҳмқҖ мҠӨнҠёл ҲмҠӨ кІҖмӮ¬м—җм„ң м–‘м„ұмқҙм—Ҳкұ°лӮҳ кёүм„ұ кҙҖмғҒлҸҷл§Ҙ мҰқнӣ„кө°мқҙлӮҳ мӢ¬к·јкІҪмғүмқ„ мқјмңјмј°кұ°лӮҳ кІҪн”јм Ғ кҙҖмғҒлҸҷл§ҘмӨ‘мһ¬мҲ лҳҗлҠ” кҙҖмғҒлҸҷл§Ҙ мҡ°нҡҢ мҲҳмҲ мқ„ л°ӣмқҖ кІҪмҡ°лЎң м •мқҳн•ҳмҳҖлӢӨ. лҮҢнҳҲкҙҖ м§Ҳнҷҳмқҳ 진лӢЁмқҖ н—ҲнҳҲм„ұ лҳҗлҠ” м¶ңнҳҲм„ұ лҮҢмЎёмӨ‘мқҙлӮҳ мқјмӢңм Ғмқё н—ҲнҳҲм Ғ л°ңмһ‘мқҙ мһҲм—Ҳкұ°лӮҳ лҮҢ м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒ лҳҗлҠ” мһҗкё°кіөлӘ…мҳҒмғҒмҙ¬мҳҒм—җм„ң лҮҢкІҪмғүмқҙ л°ңкІ¬лҗң кІҪмҡ°лЎң м •мқҳн•ҳмҳҖлӢӨ. л§җмҙҲлҸҷл§Ҙ м§Ҳнҷҳмқҳ 진лӢЁмқҖ нҢ”лӢӨлҰ¬ нҢҢн–ү, н—ҲнҳҲм„ұ к¶Өм–‘, м ҲлӢЁмҲ мқҳ лі‘л Ҙ, нҳҲкҙҖ мһ¬к°ңнҶөмҲ лҳҗлҠ” мҙҲмқҢнҢҢлӮҳ нҳҲкҙҖмЎ°мҳҒмҲ м—җм„ң мқҙм „мқҳ нҸҗмғү 진лӢЁмқҙ мһҲлҠ” кІҪмҡ°лЎң м •мқҳн•ҳмҳҖлӢӨ.
лҢҖмғҒ нҷҳмһҗмқҳ н—ӨлӘЁкёҖлЎңл№Ҳ, м•Ңл¶ҖлҜј, м№јмҠҳ, мқё, мҷ„м „н•ң л¶Җк°‘мғҒм„ нҳёлҘҙлӘ¬(intact PTH, iPTH), C-л°ҳмқ‘м„ұ лӢЁл°ұм§Ҳ(C-reative protein, CRP) л°Ҹ мҙқ мҪңл ҲмҠӨн…ҢлЎӨ, мӨ‘м„ұм§Җл°©, кі л°ҖлҸ„ мҪңл ҲмҠӨн…ҢлЎӨ л°Ҹ м Җл°ҖлҸ„ мҪңл ҲмҠӨн…ҢлЎӨ л“ұмқҖ нҳҲм•ЎнҲ¬м„қмқ„ мӢңмһ‘н•ҳкё° м „ мҲҳмҲ лӢ№мӢңмқҳ кІҖмӮ¬ кІ°кіјлҘј мЎ°мӮ¬н•ҳмҳҖлӢӨ.
нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ мӨ‘ лҸҷл§Ҙ кІҖмІҙлҠ” мқҙм „м—җ ліҙкі н•ң л°©лІ•кіј лҸҷмқјн•ң л°©лІ•мңјлЎң м–»м—ҲлӢӨ[11]. мҡ”кіЁлҸҷл§Ҙ лҳҗлҠ” мғҒмҷ„лҸҷл§Ҙмқҳ 5 mm кёёмқҙ л°©н–Ҙ м ҲнҺёмқ„ м Ҳк°ң л¶Җмң„м—җм„ң нғҖмӣҗнҳ•мңјлЎң м Ҳм ңн•ҳмҳҖлӢӨ. мЎ°м§Ғ м ҲнҺёмқҖ hematoxylin-eosinлЎң м—јмғүн•ҳкі м„қнҡҢнҷ” мң л¬ҙлҠ” von Kossa м—јмғүмқ„ н•ҳм—¬ 진лӢЁн•ҳмҳҖлӢӨ. нҷҳмһҗмқҳ мһ„мғҒ м •ліҙлҘј м•Ңм§Җ лӘ»н•ҳлҠ” м „л¬ё лі‘лҰ¬н•ҷмһҗк°Җ н‘ңліёмқ„ 분м„қн•ҳмҳҖлӢӨ. AMiC м–‘м„ұмқҖ von Kossa м—јмғүм—җм„ң л¶үмқҖ мғүмқҳ мЈјмң„ мЎ°м§Ғм—җ к°Ҳмғү лҳҗлҠ” кІҖмқҖмғүмңјлЎң лӮҳнғҖлӮҳлҠ” м№јмҠҳ м№Ём „л¬јмқҙ кҙҖм°°лҗ л•ҢлЎң м •мқҳн•ҳмҳҖлӢӨ.
кҙҖмғҒлҸҷл§Ҙ м№јмҠҳмҠӨмә”мқҖ лІ нғҖм°ЁлӢЁм ңлЎң л§Ҙл°•мҲҳ 60нҡҢ лҜёл§ҢмңјлЎң мң м§Җн•ң нӣ„ 128мұ„л„җ 비조мҳҒ мҰқк°• лӢӨмӨ‘ кІҖм¶ң м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒ(GE Imatron, South San Francisco, CA, USA)мқ„ мӢңн–үн•ҳмҳҖлӢӨ. кҙҖмғҒлҸҷл§ҘмқҖ 15мҙҲмқҳ лӢЁмқј нҳёнқЎ лҸҷм•Ҳ мӢ¬м „лҸ„м—җм„ң мӢ¬мһҘ мқҙмҷ„кё°мқј л•Ң 5 mm л‘җк»ҳмқҳ 30-40к°ңмқҳ м—°мҶҚ мқҙлҜём§ҖлЎң мҳҒмғҒнҷ”лҗҳм—ҲлӢӨ. кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ”лҠ” л°ҖлҸ„к°Җ 130 hounsfield лӢЁмң„ мқҙмғҒмқё мөңмҶҢ 3к°ң мқҙмғҒмқҳ м—°мҶҚ н”Ҫм…Җмқҳ н”ҢлқјнҒ¬к°Җ мһҲлҠ” кІҪмҡ°лЎң м •мқҳлҗңлӢӨ. CACSлҠ” Agatston л“ұ[12]мқҙ кё°мҲ н•ң л°”мҷҖ к°ҷмқҙ кі„мӮ°н•ҳмҳҖлӢӨ. CACSлҠ” 4к°ңмқҳ мЈјмҡ” кҙҖмғҒлҸҷл§Ҙ к°Ғк°Ғмқҳ к°ңлі„ лі‘ліҖ м җмҲҳлҘј н•©мӮ°н•ҳм—¬ лӮҳнғҖлӮҙм—ҲлӢӨ. CACSм—җ л”°лҘё мӮ¬л§қлҘ 비көҗлҘј мң„н•ҙ нҷҳмһҗл“ӨмқҖ Rumberger л“ұ[13]мқҳ м ңм•Ҳмқ„ ліҖнҳ•н•ҳм—¬ CACSм—җ л”°лқј 0, 1-100, 101-400, > 400мқҳ 4кө°мңјлЎң лӮҳлҲ„м—ҲлӢӨ.
лҢҖмғҒмһҗмқҳ 추м Ғ мЎ°мӮ¬лҠ” 2017л…„ 2мӣ”к№Ңм§Җмқҳ мқҳл¬ҙкё°лЎқ 분м„қмңјлЎң мЎ°мӮ¬н•ҳмҳҖлӢӨ. 추м Ғ мҶҢмӢӨлҗң кІҪмҡ° мң м„ мңјлЎң нҷҳмһҗ ліёмқёмқҙлӮҳ к°ҖмЎұмқ„ нҶөн•ҙ мһ…мӣҗ м№ҳлЈҢ м—¬л¶ҖлӮҳ мӮ¬л§қ м—¬л¶ҖлҘј мЎ°мӮ¬н•ҳмҳҖлӢӨ. мӢ¬нҳҲкҙҖ м§Ҳнҷҳ мӮ¬л§қмқҖ кёүм„ұ мӢ¬к·јкІҪмғү, мӢ¬л¶Җм „, лҮҢнҳҲкҙҖ м§Ҳнҷҳ л°Ҹ кёүм„ұ мӢ¬мһҘмӮ¬лЎң м •мқҳн•ҳмҳҖлӢӨ. лҢҖмғҒмһҗмқҳ 추м Ғ мў…лЈҢ мӢңм җмқҖ мӮ¬л§қ, 추м Ғ мҶҢмӢӨ, ліөл§үнҲ¬м„қмңјлЎң м „нҷҳ, мӢ мһҘмқҙмӢқ к·ёлҰ¬кі м—°кө¬ мў…лЈҢмӢңм җмқё 2017л…„ 2мӣ”к№Ңм§ҖлЎң н•ҳмҳҖлӢӨ. нҷҳмһҗлҘј AMiC мң л¬ҙм—җ л”°лқј л‘җ кө°мңјлЎң лӮҳлҲ„м–ҙ м—°кө¬ кё°к°„ лҸҷм•Ҳ нҷҳмһҗ м „мІҙ мӮ¬л§қлҘ кіј мӢ¬нҳҲкіј мӮ¬л§қлҘ мқ„ 비көҗн•ҳмҳҖлӢӨ.
мёЎм •м№ҳлҠ” ліҖмҲҳм—җ л”°лқј нҸүк· Вұ н‘ңмӨҖнҺём°ЁлЎң н‘ңмӢңн•ҳмҳҖкі AMiC мң л¬ҙм—җ л”°лҘё л‘җ кө°мқҳ мһ„мғҒм§Җн‘ңлҘј 비көҗн•ҳкё° мң„н•ҙ лҸ…лҰҪн‘ңліё TкІҖм •кіј м№ҙмқҙм ңкіұкІҖм •мқ„ мқҙмҡ©н•ҳмҳҖлӢӨ. AMiCм—җ мҳҒн–Ҙмқ„ мЈјлҠ” мқёмһҗл“Өмқҳ 분м„қмқ„ мң„н•ҙ лЎңм§ҖмҠӨнӢұнҡҢк·Җ분м„қмқ„ мқҙмҡ©н•ҳмҳҖлӢӨ. AMiC мң л¬ҙмҷҖ CACS 4кө°м—җ л”°лҘё мғқмЎҙмңЁ м¶”м •мқ„ мң„н•ҙ Kaplan-Meier мғқмЎҙ분м„қмқ„ мқҙмҡ©н•ҳмҳҖкі мғқмЎҙмңЁ 비көҗлҘј мң„н•ҙ лЎңк·ёмҲңмң„лІ•мқ„ мқҙмҡ©н•ҳмҳҖлӢӨ. лӘЁл“ нҶөкі„мқҳ мң мқҳм„ұ нҢҗм •мқҖ p< 0.05 мқј л•Ң нҶөкі„н•ҷм ҒмңјлЎң мң мқҳн•ң кІғмңјлЎң нҢҗм •н•ҳмҳҖлӢӨ.
лӮЁл…Җ лҢҖмғҒмһҗ мҲҳлҠ” к°Ғк°Ғ 76лӘ…(64%)кіј 43лӘ…(36%)мқҙм—Ҳкі нҸүк· лӮҳмқҙлҠ” 64.3 Вұ 13.0м„ёмҳҖлӢӨ. л§җкё° мӢ л¶Җм „мқҳ мӣҗмқё м§ҲнҷҳмқҖ лӢ№лҮЁ 74лӘ…(62.2%), кі нҳҲм•• 28лӘ…(23.5%), л§Ңм„ұ мӮ¬кө¬мІҙмӢ м—ј 16лӘ…(13.4%), лӢӨлӮӯм„ұ мӢ м§Ҳнҷҳ 1лӘ…(0.8%)мқҙм—ҲлӢӨ. кҙҖмғҒлҸҷл§Ҙ м§Ҳнҷҳмқҳ лі‘л Ҙмқҙ мһҲлҠ” нҷҳмһҗлҠ” 4лӘ…(3.4%), лҮҢнҳҲкҙҖ м§Ҳнҷҳмқ„ кІҪн—ҳн•ң нҷҳмһҗлҠ” 14лӘ…(11.8%), л§җмҙҲнҳҲкҙҖ м§Ҳнҷҳмқ„ к°Җ진 нҷҳмһҗлҠ” 1лӘ…(0.8%)мқҙм—ҲлӢӨ. нҳҲм•Ў кІҖмӮ¬ кІ°кіј м№јмҠҳ, мқё, л¶Җк°‘мғҒм„ нҳёлҘҙлӘ¬ мҲҳм№ҳлҠ” 7.7 Вұ 1.0 mg/dL, 5.8 Вұ 2.1 mg/dL, 203.0 Вұ 139.6 pg/mLмҳҖлӢӨ(Table 1).
нҸүк· CACSлҠ” 430.4 Вұ 720.2мҳҖкі 0л¶Җн„° 3,954к№Ңм§Җ 분нҸ¬н•ҳмҳҖлӢӨ. CACSм—җ л”°лҘё 4кө°мқҳ нҷҳмһҗ мҲҳлҠ” к°Ғк°Ғ 20лӘ…, 32лӘ…, 27лӘ…, 40лӘ…мқҙм—Ҳкі нҸүк· CACSлҠ” к°Ғк°Ғ 0, 33.2 Вұ 5.3, 192.0 Вұ 13.6, 1,124.3 Вұ 142.1мқҙм—ҲлӢӨ. 119лӘ…мқҳ нҷҳмһҗ мӨ‘ 67лӘ…(56%)мқҳ нҷҳмһҗм—җм„ң von Kossa м—јмғүм—җм„ң нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCк°Җ кҙҖм°°лҗҳм—ҲлӢӨ. AMiCлҠ” von Kossa м—јмғүмңјлЎңл§Ң кІҖм¶ңлҗҳм—Ҳкі мЈјлЎң лҸҷл§Ҙ мӨ‘к°„л§үм—җ мң„м№ҳн•ҳкұ°лӮҳ мҶҚнғ„л Ҙмёө л°”лЎң м•„лһҳм—җ м„ нҳ•мңјлЎң м№Ём°©лҗҳм–ҙ мһҲм—ҲлӢӨ(Fig. 1). м„қнҡҢнҷ”лҠ” мЎ°м§Ғ м „мІҙм—җ 분мӮ°лҗҳм–ҙ мһҲм—Ҳкі мқјл¶Җмқҳ кІҪмҡ°м—җлҠ” м„қнҡҢнҷ”лҗң м№ҳл°Җн•ң н”ҢлқјнҒ¬к°Җ лҸҷл§Ҙ лӮҙл§үм—җм„ң кҙҖм°°лҗҳм—ҲлӢӨ.
н‘ң 1м—җм„ң AMiC мң л¬ҙм—җ л”°лҘё л‘җ кө° к°„ нҷҳмһҗл“Өмқҳ мһ„мғҒм Ғ мҡ”мқёкіј кІҖмӮ¬ кІ°кіјлҘј м •лҰ¬н•ҳмҳҖлӢӨ. AMiC м–‘м„ұмқё кө°мқҖ мқҢм„ұмқёкө°кіј 비көҗн•ҳм—¬ кі л №(67.6 Вұ 10.6 vs. 60.0 Вұ 14.6, p< 0.05)мқҙм—Ҳкі лӮЁмһҗ нҷҳмһҗмқҳ 비мңЁ(73.1% vs. 51.9%, p< 0.05)мқҙ лҶ’м•ҳмңјл©° лӢ№лҮЁлі‘мқҳ мң лі‘лҘ (79.1% vs. 50.0%, p< 0.05)мқҙ лҶ’м•ҳлӢӨ. нҳҲм•ЎкІҖмӮ¬ кІ°кіјлҠ” м№јмҠҳ(7.8 Вұ 0.8 vs. 7.5 Вұ 1.1, p< 0.05) мҲҳм№ҳл§Ңмқҙ AMiC м–‘м„ұмқё кө°мқҙ мқҢм„ұмқё кө°м—җ 비н•ҙ нҶөкі„н•ҷм ҒмңјлЎң мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ. мһ„мғҒм Ғ мҡ”мқё мӨ‘ нқЎм—° мғҒнғң, BMI, кі нҳҲм•• мң лі‘лҘ , мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҳ кіјкұ°л ҘмқҖ л‘җ кө° к°„м—җ мң мқҳн•ң м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ. мӮ¬кө¬мІҙм—¬кіјмңЁ, м§Җм§Ҳ н”„лЎңн•„, нҳҲмІӯ мқё л°Ҹ iPTH, CRP л“ұ нҳҲм•Ўн•ҷм Ғ кІҖмӮ¬ кІ°мӮ¬ лҳҗн•ң л‘җ кө° к°„м—җ мң мқҳн•ң м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ.
лӢЁліҖмҲҳ 분м„қм—җм„ң AMiC м–‘м„ұмқё кө°мқҖ кі л №(odds ratio [OR]: 1.020, 95% confidence interval [CI]: 1.018-1.083, p< 0.05), лӮЁм„ұ(OR: 2.521, 95% CI: 1.171-5.426, p< 0.05), лӢ№лҮЁлі‘(OR: 3.786, 95% CI: 1.699-8.438, p< 0.05) л°Ҹ нҳҲмІӯ м№јмҠҳ мҲҳм№ҳ(OR: 1.544, 95% CI: 1.027-2.321, p< 0.05)мҷҖ мң мқҳн•ң мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ(Table 2). мң„мқҳ мң„н—ҳ мқёмһҗм—җ лҢҖн•ң лӢӨліҖмҲҳ мЎ°м • нӣ„м—җлҸ„ кі л №(OR: 1.039, 95% CI: 1.002-1.087, p< 0.05)кіј лӢ№лҮЁ(OR: 2.997, 95% CI: 1.184-7.584, p< 0.05)лҠ” AMiCмҷҖ мң мқҳн•ң мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ(Table 2).
AMiC м–‘м„ұмқё кө°мқҖ мқҢм„ұмқё кө°кіј 비көҗн•ҙ CACS (569.9 Вұ 836.5 vs. 134.7 Вұ 369.2, p< 0.05)к°Җ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ(Table 1).
CACSм—җ л”°лҘё 4кө°м—җм„ң AMiC м–‘м„ұмқё нҷҳмһҗ мҲҳмқҳ 비мңЁмқҖ к°Ғ к°Ғ 10.0%, 34.4%, 66.7%, 90.0%лЎң CACSк°Җ лҶ’мқҖ кө°мқјмҲҳлЎқ нҳҲкҙҖм ‘к·јлЎңмқҳ AMiC м–‘м„ұмқҳ л№ҲлҸ„к°Җ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ(p< 0.05, Fig 2).
лӢЁліҖмҲҳ 분м„қм—җм„ң AMiC м–‘м„ұмқё кө°мқҖ CACS (OR: 1.003, 95% CI: 1.001-1.004, p< 0.05)мҷҖ мң мқҳн•ң м–‘мқҳ мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖмңјл©°, AMiCмқҳ мң„н—ҳ мқёмһҗм—җ лҢҖн•ң лӢӨліҖмҲҳ мЎ°м • нӣ„м—җлҸ„ CACS (OR: 1.002, 95% CI: 1.001-1.004, p< 0.05)лҠ” AMiCмҷҖ мң мқҳн•ң мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ(Table 2).
нҸүк· 35.5 Вұ 17.8к°ңмӣ”мқҳ 추м Ғ кҙҖм°° кё°к°„ лҸҷм•Ҳ 119лӘ…мқҳ нҷҳмһҗ мӨ‘ м „мІҙ мӮ¬л§қмқҖ 26лӘ…, мӢ¬нҳҲкҙҖ мӮ¬л§қмқҖ 17лӘ…м—җм„ң л°ңмғқн•ҳмҳҖлӢӨ(Table 3). Kaplan-Meier мғқмЎҙ분м„қм—җм„ң AMiC м–‘м„ұмқё кө°мқҙ мқҢм„ұмқё кө°ліҙлӢӨ м „мІҙ мӮ¬л§қлҘ (log rank = 5.7, p< 0.05; Figure 3A)кіј мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ (log rank = 9.0, p<0.05; Figure 3B) лӘЁл‘җ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ. лҳҗн•ң, CACSк°Җ лҶ’мқҖ кө°мқјмҲҳлЎқ м „мІҙ мӮ¬л§қлҘ (log rank = 8.0, p< 0.05; Figure 4A)кіј мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ (log rank = 11.5, p<0.05; Figure 4B) лӘЁл‘җ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ.
нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎң AMiCлҠ” нҳҲкҙҖм ‘к·јлЎң кё°лҠҘ мқҙмғҒлҝҗл§Ң м•„лӢҲлқј мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ кіјлҸ„ кҙҖл Ёмқҙ мһҲлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[7,8,14]. нҳҲкҙҖм ‘к·јлЎң AMiCк°Җ м–ҙл–Ө кё°м „мңјлЎң лҶ’мқҖ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ кіј кҙҖл Ёмқҙ мһҲлҠ”м§Җм—җ лҢҖн•ң м—°кө¬лҠ” м•„м§Ғ мһҳ м•Ңл Өм ё мһҲм§Җ м•ҠлӢӨ. ліё м—°кө¬лҠ” нҳҲм•ЎнҲ¬м„қмқ„ мӢңмһ‘н•ҳлҠ” нҷҳмһҗм—җм„ң нқ”н•ҳкІҢ кҙҖм°°лҗҳлҠ” нҳҲкҙҖм ‘к·јлЎң AMiCмҷҖ мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқлҘ кіј мӮ¬л§қлҘ мқҳ мҳҲмёЎ мқёмһҗлЎң м•Ңл Ө진 кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ”мҷҖмқҳ мғҒкҙҖкҙҖкі„ л°Ҹ AMiC мң л¬ҙмҷҖ CACSм—җ л”°лҘё м „мІҙ мӮ¬л§қлҘ л°Ҹ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқ„ м•Ңм•„ліҙкі мһҗ н•ҳмҳҖлӢӨ. м—°кө¬ кІ°кіј AMiC м–‘м„ұмқё кө°м—җм„ң CACSк°Җ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ. лҳҗн•ң AMiC м–‘м„ұмқё кө°кіј CACSк°Җ лҶ’мқҖ кө°м—җм„ң м „мІҙ мӮ¬л§қлҘ кіј мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқҙ мң мқҳн•ҳкІҢ мҰқк°Җн•ҳмҳҖлӢӨ. к·ёлҹ¬лҜҖлЎң нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎң AMiCлҠ” лҸҷл§ҘкІҪм§Ғлҝҗл§Ң м•„лӢҲлқј кҙҖмғҒлҸҷл§Ҙ м„қнҡҢнҷ”лҘј нҶөн•ҳм—¬ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқ„ мҰқк°ҖмӢңнӮӨлҠ” кІғмңјлЎң мӮ¬лЈҢлҗңлӢӨ.
көӯлӮҙмқҳ мөңк·ј ліҙкі м—җ мқҳн•ҳл©ҙ, нҳҲм•ЎнҲ¬м„қ нҷҳмһҗмқҳ 48.3%м—җм„ң нҳҲкҙҖ м§Ҳнҷҳмқ„ лҸҷл°ҳн•ҳкі мһҲмңјл©° 36%м—җм„ң мӢ¬нҳҲкҙҖ м§ҲнҷҳмңјлЎң мӮ¬л§қн•ңлӢӨ[15]. л”°лқјм„ң нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҳ м Ғм Ҳн•ң мҳҲл°©кіј мЎ°кё° 진лӢЁмқҙ мһ„мғҒм Ғ мҳҲнӣ„м—җ мӨ‘мҡ”н• кІғмңјлЎң ліҙмқҙлӮҳ кі л №кіј лӢ№лҮЁлҘј лҸҷл°ҳн•ң нҷҳмһҗмқҳ 비мңЁмқҙ л№ лҘҙкІҢ мҰқк°Җн•ҳлҠ” 추세лЎң м§Ҳнҷҳмқҙ 진н–үн• л•Ңк№Ңм§Җ л¬ҙмҰқмғҒмқё кІҪмҡ°к°Җ л§Һкі мқјл°ҳ мқёкө¬м§‘лӢЁмқҳ мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқ мң„н—ҳ мқёмһҗлҘј к·ёлҢҖлЎң м Ғмҡ©н•ҳм—¬ м§Ҳнҷҳ л°ңмғқмқ„ мҳҲмёЎн•ҳлҠ” кІғлҸ„ м–ҙл өлӢӨ. л”°лқјм„ң м—ӯн•ҷмЎ°мӮ¬лҘј нҶөн•ң нҳҲм•ЎнҲ¬м„қ нҷҳмһҗмқҳ мӢ¬нҳҲкҙҖкі„ м§Ҳнҷҳмқҳ мң„н—ҳ мқёмһҗ 분м„қмқҙлӮҳ л°ңмғқмқ„ лҜёлҰ¬ мҳҲмёЎн• мҲҳ мһҲлҠ” кІҖмӮ¬лІ•мқ„ м°ҫкё° мң„н•ң м—°кө¬л“Өмқҙ мһҲм—ҲлӢӨ.
Adragao л“ұ[16]мқҖ 123лӘ…мқҳ мң м§Җ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң кіЁл°ҳкіј мҲҳл¶Җмқҳ лӢЁмҲң л°©мӮ¬м„ мҙ¬мҳҒмқ„ мӢңн–үн•ҳм—¬ нҳҲкҙҖ м„қнҡҢнҷ” м •лҸ„лҘј м җмҲҳнҷ”н•ң л°©лІ•мңјлЎң 비көҗн•ң м—°кө¬м—җм„ң нҳҲкҙҖ м„қнҡҢнҷ” м җмҲҳк°Җ лҶ’мқҖ кө°мқҙ лӮ®мқҖ кө°м—җ 비н•ҙ мӢ¬нҳҲкҙҖ л°ңмғқлҘ л°Ҹ мӮ¬л§қлҘ мқҙ лҶ’м•ҳлӢӨкі ліҙкі н•ҳмҳҖлӢӨ.
нҳҲкҙҖ м„қнҡҢнҷ”лҘј кІҖмӮ¬н•ҳлҠ” лӢӨлҘё л°©лІ•мңјлЎң 2001л…„ Blacher л“ұ[17]мқҖ 110лӘ…мқҳ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мҙҲмқҢнҢҢлҘј мқҙмҡ©н•ҳм—¬ кІҪлҸҷл§Ҙ, ліөл¶Җ лҢҖлҸҷл§Ҙ, мһҘлҢҖнҮҙкіЁ лҸҷл§Ҙ, н•ҳм§Җ лҸҷл§Ҙ 4л¶Җмң„мқҳ нҳҲкҙҖ м„қнҡҢнҷ”лҘј кІҖмӮ¬н•ҳм—¬ м җмҲҳнҷ”н•ң нӣ„ 비көҗн•ҳмҳҖлҠ”лҚ° м„қнҡҢнҷ” м җмҲҳк°Җ 1м җ мҰқк°Җн• л•Ң м „мІҙ мӮ¬л§қлҘ кіј мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқҙ к°Ғк°Ғ 1.9мҷҖ 2.6л°° мҰқк°Җн•ңлӢӨкі л°ңн‘ңн•ҳмҳҖлӢӨ.
нҳҲкҙҖ м„қнҡҢнҷ”лҘј нҸүк°Җн•ҳлҠ” л°©лІ•мңјлЎң лӢЁмҲң л°©мӮ¬м„ мҙ¬мҳҒ, м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒ, мҙҲмқҢнҢҢ, л§Ҙл°•нҢҢ м „нҢҢмҶҚлҸ„(pulse wave velocity) л“ұмқҙ мһҲлӢӨ. мҙҲмқҢнҢҢлҠ” л°©мӮ¬м„ л…ём¶ңмқҙ м—Ҷкі кІҪлҸҷл§ҘмқҙлӮҳ н•ҳм§Җ лҸҷл§ҘлҸ„ кІҖмӮ¬к°Җ к°ҖлҠҘн•ҳлӢӨлҠ” мһҘм җмқҙ мһҲмңјлӮҳ нҸүк°Җк°Җ мЈјкҙҖм ҒмқҙлқјлҠ” лӢЁм җмқҙ мһҲмңјл©°, л°ҳл©ҙ лӢЁмҲң л°©мӮ¬м„ мҙ¬мҳҒмқҖ 비мҡ©мқҙ м ҒкІҢ л“Өкі мүҪкІҢ кІҖмӮ¬к°Җ к°ҖлҠҘн•ҳлӮҳ м„қнҡҢнҷ” м •лҸ„лҘј м •лҹүнҷ”н•ҳлҠ” нҸүк°Җ л°©лІ•мқҙ мІҙкі„нҷ”лҗҳм–ҙ мһҲм§Җ м•ҠлӢӨ[18].
AMiCлҘј лі‘лҰ¬н•ҷм ҒмңјлЎң 진лӢЁн•ҳлҠ” кІғмқҖ м№ЁмҠөм Ғмқё кІҖмӮ¬лЎң лҸҷл§Ҙ мЎ°м§Ғмқ„ нҡҚл“қн•ҙм•ј н•ҳкё° л•Ңл¬ём—җ мһ„мғҒм ҒмңјлЎң м Ғмҡ©н•ҳлҠ” кІғмқҖ м–ҙл Өмҡҙ мқјмқҙлӢӨ. к·ёлҹ¬лӮҳ л§җкё° мӢ л¶Җм „ нҷҳмһҗлҠ” нҳҲм•ЎнҲ¬м„қмқ„ мң„н•ҙ нҳҲк·јм ‘к·јлЎң мҲҳмҲ мӢңм—җ лҸҷл§Ҙ мЎ°м§Ғмқ„ нҡҚл“қн•ҳлҠ” кІғмқҙ 추к°Җ мӢңмҲ м—Ҷмқҙ мқҙлЈЁм–ҙм§Ҳ мҲҳ мһҲм–ҙ AMiC м—¬л¶ҖлҘј 진лӢЁн•ҳлҠ” кІғмқҙ м–ҙл өм§Җ м•Ҡмңјл©° мҳҒмғҒн•ҷм Ғ кІҖмӮ¬лІ•м—җ 비н•ҙ мҙҲкё° лӢЁкі„мқҳ м„қнҡҢнҷ”лҘј 진лӢЁн• мҲҳ мһҲм–ҙ нҳҲм•ЎнҲ¬м„қмқ„ мӢңмһ‘н•ҳлҠ” нҷҳмһҗм—җм„ң мһ„мғҒм Ғ мҳҲнӣ„лҘј мҳҲмёЎн•ҳлҠ” кІҖмӮ¬лЎң кі л Өн• мҲҳ мһҲлӢӨ.
нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң CACSк°Җ м „ мӣҗмқё мӮ¬л§қлҘ л°Ҹ мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқҳ мҳҲмёЎ мқёмһҗмһ„мқ„ ліҙкі н•ң м—¬лҹ¬ м—°кө¬л“Өмқҙ мһҲлӢӨ. Matsuoka л“ұ[7]кіј Shantouf л“ұ[19]мқҖ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң CACSлҘј мёЎм •н•ҳм—¬ мһ„мғҒ кІҪкіјлҘј 추м Ғн•ң кІ°кіј CACSк°Җ м „мІҙ лҳҗлҠ” мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ мқҳ лҸ…лҰҪм Ғмқё мҳҲмёЎ мқёмһҗлқјкі ліҙкі н•ҳмҳҖлӢӨ. мҳҒмғҒкІҖмӮ¬лҘј мқҙмҡ©н•ң CACS мёЎм •мқҖ лҜјк°җлҸ„мҷҖ нҠ№мқҙлҸ„к°Җ лҶ’мқҖ кІҖмӮ¬лЎң мҡҙлҸҷл¶Җн•ҳ кІҖмӮ¬лӮҳ мӢ¬к·јкҙҖлҘҳмҠӨмә”, мӢ¬мһҘ мҙҲмқҢнҢҢ л“ұ лӢӨлҘё 비침мҠөм Ғмқё мӢ¬мһҘ кІҖмӮ¬м—җ 비н•ҙ м •нҷ•лҸ„м—җм„ң мң лҰ¬н•ҳкі к°„лӢЁн•ҳкІҢ мӢңн–үн• мҲҳ мһҲлҠ” кІҖмӮ¬лЎң нҳҲм•ЎнҲ¬м„қмқ„ мӢңмһ‘н•ҳлҠ” нҷҳмһҗм—җм„ң нҲ¬м„қ мӢңмһ‘ лӢ№мӢң мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқ„ лҸҷл°ҳн•ҳкі мһҲмқ„ к°ҖлҠҘм„ұмқҙ лҶ’кі кі л №, лӢ№лҮЁ л“ұ мӢ¬нҳҲкҙҖ м§Ҳнҷҳмқҳ мң„н—ҳ мқёмһҗлҘј лҸҷл°ҳн•ҳкі мһҲлҠ” кІҪмҡ°к°Җ л§Һкё° л•Ңл¬ём—җ мһ„мғҒм Ғ мҳҲнӣ„лҘј мҳҲмёЎн•ҳлҠ” кІҖмӮ¬лЎң мң мҡ©н• кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎң мҲҳмҲ м—җ к°ҖмһҘ нқ”н•ҳкІҢ мӮ¬мҡ©н•ҳлҠ” лҸҷл§Ҙмқё мҡ”кіЁлҸҷл§ҘмқҖ 진н–үлҗң кҙҖмғҒлҸҷл§Ҙ м§Ҳнҷҳ нҷҳмһҗм—җм„ң лі‘лҰ¬мЎ°м§Ғн•ҷм Ғ кІҖмӮ¬лҘј мӢңн–үн•ң кІ°кіј мҶҚмң м„ лҸҷл§ҘмқҙлӮҳ ліөмһ¬м •л§ҘліҙлӢӨ мҡ”кіЁлҸҷл§Ҙм—җм„ң мӨ‘к°„л§ү м„қнҡҢнҷ”мқҳ л°ңмғқлҘ мқҙ лҶ’мқҖ кІғмңјлЎң ліҙкі лҗң л°” мһҲлӢӨ[20]. Deshpande л“ұ[21]мқҖ кҙҖмғҒлҸҷл§Ҙ мҡ°нҡҢлЎң мҲҳмҲ мқ„ мӢңн–үн•ң 130лӘ…мқҳ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң нҶөлЎңлЎң мӮ¬мҡ©н•ң мҡ”кіЁлҸҷл§Ҙмқҳ лі‘лҰ¬мЎ°м§Ғн•ҷм Ғ кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖкі , мқҙ м—°кө¬м—җм„ң 130лӘ… мӨ‘ 4лӘ…мқҳ нҷҳмһҗм—җм„ң м„қнҡҢнҷ”к°Җ кҙҖм°°лҗҳм—Ҳмңјл©° 4лӘ… лӘЁл‘җ кё°м Җ м§ҲнҷҳмңјлЎң лӢ№лҮЁмҷҖ мӢ¬н•ң мӢ кё°лҠҘ м Җн•ҳк°Җ мһҲлҚҳ нҷҳмһҗмҳҖлӢӨ. мқҙ м—°кө¬л“ӨмқҖ 진н–үлҗң кҙҖмғҒлҸҷл§Ҙ м§Ҳнҷҳкіј мҡ”кіЁлҸҷл§Ҙ м„қнҡҢнҷ” к°„м—җ мғҒкҙҖкҙҖкі„к°Җ мһҲмқҢмқ„ мӢңмӮ¬н•ңлӢӨ.
нҳҲкҙҖ м„қнҡҢнҷ”мқҳ мң„н—ҳ мқёмһҗлЎң кі л №, лӢ№лҮЁ, кі нҳҲм••, кі м§ҖнҳҲмҰқ л“ұмқҳ кі м „м Ғмқё мң„н—ҳ мқёмһҗ мҷё лҶ’мқҖ нҳҲмІӯ м№јмҠҳ л°Ҹ мқё мҲҳм№ҳ, м—јмҰқ, мӮ°нҷ” мҠӨнҠёл ҲмҠӨ л“ұмқҙ м•Ңл Өм ё мһҲлӢӨ[22]. к·ёлҹ¬лӮҳ ліё м—°кө¬м—җм„ңлҠ” AMiCк°Җ кі л №, лӮЁм„ұ, лӢ№лҮЁ, м№јмҠҳ мҲҳм№ҳмҷҖ мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖмңјлӮҳ мқҙм „ м—°кө¬м—җм„ң мғҒкҙҖкҙҖкі„к°Җ мһҲлӢӨкі ліҙкі лҗң м Ғ мһҲлҠ” м§Җм§ҲлҢҖмӮ¬ мқҙмғҒмқҙлӮҳ нҳҲмІӯ мқё, м№јмҠҳ Г— мқё мҲҳм№ҳ л°Ҹ CRPмҷҖлҠ” мғҒкҙҖкҙҖкі„лҘј ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ. мқҙлҹ¬н•ң м—¬лҹ¬ м—°кө¬л“Өмқҳ мғҒл°ҳлҗң кІ°кіјл“Ө л°Ҹ мқјл°ҳ мқёкө¬м§‘лӢЁкіј лӢӨлҘё м–‘мғҒмңјлЎң мқён•ҙ нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖ м„қнҡҢнҷ”мқҳ мң„н—ҳ мқёмһҗк°Җ нҷ•мӢӨнһҲ м •лҰҪлҗҳм§Җ м•Ҡм•„ н–Ҙнӣ„ ліҙлӢӨ л§ҺмқҖ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң 추к°Җ м—°кө¬к°Җ н•„мҡ”н• кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
ліё м—°кө¬лҠ” лӢӨмқҢкіј к°ҷмқҖ м ңн•ңм җмқҙ мһҲлӢӨ. мІ«м§ё, лҢҖмғҒкө°мқҳ мҲҳк°Җ м Ғм—Ҳкі л‘ҳм§ё, нҳҲм•ЎнҲ¬м„қмқ„ л°ӣлҠ” л§җкё° мӢ л¶Җм „ нҷҳмһҗл§Ңмқ„ лҢҖмғҒмңјлЎң н•ҳмҳҖкё° л•Ңл¬ём—җ нҲ¬м„қ м „ л§Ңм„ұ мӢ л¶Җм „ лӢЁкі„м—җ л”°лҘё AMiCмҷҖ CACS, нҳҲкҙҖ м„қнҡҢнҷ”мқҳ мң„н—ҳ мқёмһҗл“Ө к°„мқҳ м—°кҙҖкҙҖкі„лҘј м—°кө¬н•ҳм§Җ лӘ»н•ҳмҳҖлӢӨ.
кІ°лЎ м ҒмңјлЎң, нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң нҳҲкҙҖм ‘к·јлЎңмқҳ AMiCмҷҖ CACSлҠ” мӢ¬нҳҲкҙҖ мӮ¬л§қмқҳ мң„н—ҳ мқёмһҗмқҙл©° м„ңлЎң мң мқҳн•ң мғҒкҙҖкҙҖкі„к°Җ мһҲм—ҲлӢӨ. л§җкё° мӢ л¶Җм „ нҷҳмһҗм—җм„ң мӢ¬нҳҲкҙҖ м§Ҳнҷҳ л°ңмғқмқҳ мҳҲмёЎмқҙлӮҳ мЎ°кё° 진лӢЁмқ„ мң„н•ң мң„н—ҳ мқёмһҗ л°Ҹ кІҖмӮ¬лІ•м—җ лҢҖн•ң м—°кө¬к°Җ н•„мҡ”н• кІғмңјлЎң мғқк°ҒлҗңлӢӨ.
REFERENCES
2. Park JT, Oh HJ, Kang SW. Cardiovascular disease in end-stage renal disease. J Korean Med Assoc 2013;56:576вҖ“582.

3. Desai AA, Nissenson A, Chertow GM, et al. The relationship between laboratory-based outcome measures and mortality in end-stage renal disease: a systematic review. Hemodial Int 2009;13:347вҖ“359.


4. Schwarz U, Buzello M, Ritz E, et al. Morphology of coronary atherosclerotic lesions in patients with end-stage renal failure. Nephrol Dial Transplant 2000;15:218вҖ“223.


5. Kramer CK, Zinman B, Gross JL, et al. Coronary artery calcium score prediction of all-cause mortality and cardiovascular events in people with type 2 diabetes: systematic review and meta-analysis. BMJ 2013;346:f1654.


6. Detrano R, Guerci AD, Carr JJ, et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. N Engl J Med 2008;358:1336вҖ“1345.


7. Matsuoka M, Iseki K, Tamashiro M, et al. Impact of high coronary artery calcification score (CACS) on survival in patients on chronic hemodialysis. Clin Exp Nephrol 2004;8:54вҖ“58.


8. Block GA, Raggi P, Bellasi A, Kooienga L, Spiegel DM. Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients. Kidney Int 2007;71:438вҖ“441.


9. Yun YS, Choi SJ, Lee JY, et al. Impact of arterial microcalcification of the vascular access on cardiovascular mortality in hemodialysis patients. Hemodial Int 2014;18:54вҖ“61.


10. Kim HG, Park SC, Kim YO, et al. Arterial micro-calcification of vascular access is associated with aortic arch calcification and arterial stiffness in hemodialysis patients. Semin Dial 2013;26:216вҖ“222.


11. Kim YO, Song HC, Yoon SA, et al. Preexisting intimal hyperplasia of radial artery is associated with early failure of radiocephalic arteriovenous fistula in hemodialysis patients. Am J Kidney Dis 2003;41:422вҖ“428.


12. Agatston AS, Janowitz WR, Hildner F, Zusmer NR, Viamonte M Jr, Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol 1990;15:827вҖ“832.


13. Rumberger JA, Brundage BH, Rader DJ, Kondos G. Electron beam computed tomographic coronary calcium scanning: a review and guidelines for use in asymptomatic persons. Mayo Clin Proc 1999;74:243вҖ“252.


14. Choi SJ, Yoon HE, Kim YO, et al. Pre-existing arterial micro-calcification predicts primary unassisted arteriovenous fistula failure in incident hemodialysis patients. Semin Dial 2015;28:665вҖ“669.


15. Jin DC, Yun SR, Lee SW, Han SW, Kim W, Park J. Current characteristics of dialysis therapy in Korea: 2015 registry data focusing on elderly patients. Kidney Res Clin Pract 2016;35:204вҖ“211.



16. Adragao T, Pires A, Lucas C, et al. A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients. Nephrol Dial Transplant 2004;19:1480вҖ“1488.


17. Blacher J, Guerin AP, Pannier B, Marchais SJ, London GM. Arterial calcifications, arterial stiffness, and cardiovascular risk in end-stage renal disease. Hypertension 2001;38:938вҖ“942.


18. Karohl C, D'Marco GascГіn L, Raggi P. Noninvasive imaging for assessment of calcification in chronic kidney disease. Nat Rev Nephrol 2011;7:567вҖ“577.


19. Shantouf RS, Budoff MJ, Ahmadi N, et al. Total and individual coronary artery calcium scores as independent predictors of mortality in hemodialysis patients. Am J Nephrol 2010;3:419вҖ“425.

20. Kane-Toddhall SM, Taggart DP, Clements-Jewery H, Roskell DE. Pre-existing vascular disease in the radial artery and other coronary artery bypass conduits. Eur J Med Res 1999;4:11вҖ“14.

Histologic findings at the vascular access (Г—200). (A) No calcification. (B) Diffuse brown, von Kossa staining of calcification observed in the medial layer of the vascular access.

FigureВ 1.
The proportion of patients positive for arterial micro-calcification, by coronary artery calcium score category.

FigureВ 2.
Kaplan-Meier survival curves for all-cause mortality and cardiovascular mortality of patients with and without arterial micro-calcification of the vascular access. (A) All-cause mortality (log rank = 5.7, p < 0.05), (B) cardiovascular mortality (log rank = 9.0, p < 0.05). AMiC, arterial micro-calcification.
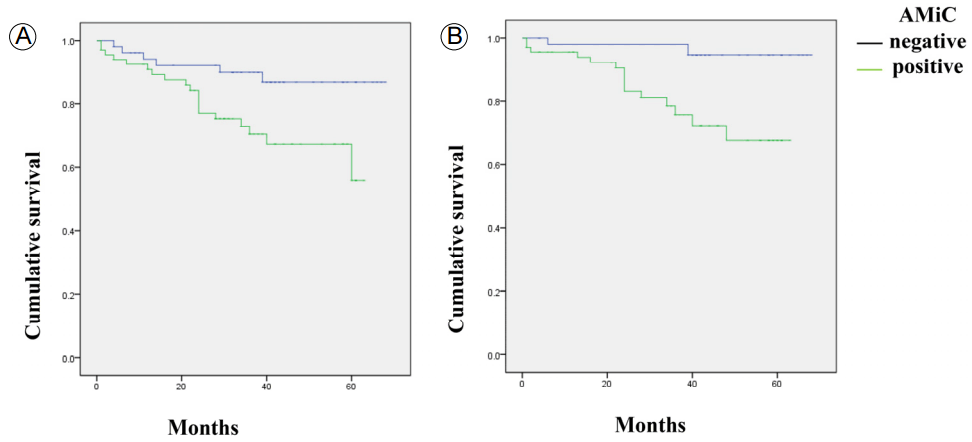
FigureВ 3.
Kaplan-Meier survival curves for all-cause mortality and cardiovascular mortality across the four groups defined by coronary artery calcium scores (0, 1-100, 101-400, > 400). (A) All-cause mortality (log rank = 8.0, p < 0.05), (B) cardiovascular mortality (log rank = 11.5, p < 0.05). CACS, coronary artery calcium score.
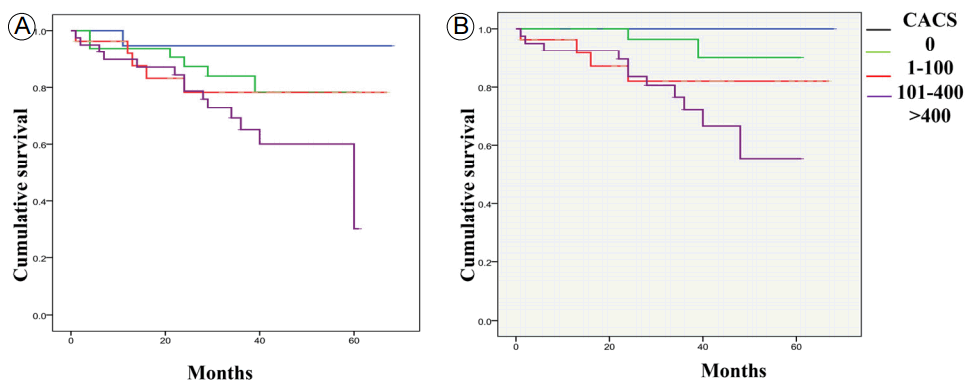
FigureВ 4.
TableВ 1.
Baseline characteristics of the patients
| Characteristics | Total (n = 119) | AMiC (+) (n = 67) | AMiC (-) (n = 52) | p value |
|---|---|---|---|---|
| Age, yr | 64.3 Вұ 13.0 | 67.6 Вұ 10.6 | 60.0 Вұ 14.6 | < 0.05* |
| Male gender | 76 (63.9) | 49 (73.1) | 27 (51.9) | < 0.05* |
| Current smoker | 21 (17.6) | 11 (16.4) | 10 (19.2) | 0.690 |
| BMI, kg/m2 | 23.8 Вұ 4.8 | 23.7 Вұ 4.5 | 23.9 Вұ 5.1 | 0.853 |
| CACS | 430.4 Вұ 720.2 | 569.9 Вұ 836.5 | 134.7 Вұ 369.2 | < 0.05* |
| Cobormid condition | ||||
| вҖғDM | 79 (66.4) | 53 (79.1) | 26 (50.0) | < 0.05* |
| вҖғHypertension | 110 (92.4) | 64 (95.5) | 46 (88.5) | 0.148 |
| вҖғCAD | 4 (3.4) | 4 (6.0) | 0 (0) | 0.073 |
| вҖғCVD | 14 (11.8) | 10 (14.9) | 4 (7.7) | 0.224 |
| вҖғPAD | 1 (0.8) | 0 (1.5) | 0 (0) | 0.376 |
| Laboratory findings | ||||
| вҖғHemoglobin, g/dL | 9.3 Вұ 1.4 | 9.5 Вұ 1.3 | 9.1 Вұ 1.5 | 0.123 |
| вҖғMDRD-eGFR, mL/min | 7.9 Вұ 2.9 | 8.4 Вұ 2.9 | 7.4 Вұ 2.9 | 0.058 |
| вҖғAlbumin, g/dL | 3.4 Вұ 1.0 | 3.4 Вұ 1.2 | 3.3 Вұ 0.7 | 0.912 |
| вҖғTotal cholesterol, mg/dL | 167.7 Вұ 50.0 | 169.4 Вұ 47.4 | 165.5 Вұ 53.7 | 0.695 |
| вҖғTriglyceride, mg/dL | 135.0 Вұ 76.8 | 132.3 Вұ 56.3 | 138.8 Вұ 98.6 | 0.686 |
| вҖғHDL-cholesterol, mg/dL | 38.9 Вұ 26.4 | 37.0 Вұ 11.5 | 41.4 Вұ 38.0 | 0.471 |
| вҖғLDL-cholesterol, mg/dL | 102.8 Вұ 38.1 | 106.8 Вұ 36.9 | 97.5 Вұ 39.5 | 0.239 |
| вҖғCalcium, mg/dL | 7.7 Вұ 1.0 | 7.8 Вұ 0.8 | 7.5 Вұ 1.1 | < 0.05* |
| вҖғPhosphorus, mg/dL | 5.8 Вұ 2.1 | 5.8 Вұ 1.7 | 6.3 Вұ 2.5 | 0.058 |
| вҖғCa Г— P product | 44.0 Вұ 13.5 | 42.8 Вұ 12.9 | 45.4 Вұ 14.2 | 0.317 |
| вҖғiPTH, pg/mL | 203.0 Вұ 139.6 | 191.6 Вұ 143.0 | 217.9 Вұ 135.5 | 0.394 |
| вҖғCRP, mg/dL | 1.0 Вұ 2.1 | 1.1 Вұ 2.3 | 0.9 Вұ 1.8 | 0.521 |
| вҖғHbA1c, % | 6.6 Вұ 1.4 | 6.6 Вұ 1.4 | 6.5 Вұ 1.5 | 0.731 |
Values are presented as mean Вұ standard deviation or n (%).
AMiC, arterial micro-calcification; BMI, body mass index; CACS, coronary artery calcium score; DM, diabetes mellitus; CAD, coronary arterial disease; CVA, cerebrovascular accident; PAD, peripheral arterial disease; MDRD-eGFR, modification of diet in renal disease -estimated glomerular filtration rate; LDL, low density lipoprotein; iPTH, intact parathyroid hormone; CRP, C-reactive protein.
TableВ 2.
Association between arterial micro-calcification and other parameters
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 8,155 View
- 227 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



