 |
 |
| Korean J Med > Volume 92(2); 2017 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü
ņŖżĒŗ░ļĖÉņŖż-ņĪ┤ņŖ© ņ”ØĒøäĻĄ░(SJS) ļ░Å ļÅģņä▒Ēæ£Ēö╝Ļ┤┤ņé¼ņÜ®ĒĢ┤(TEN)ļŖö ņżæņ”Ø Ēö╝ļČĆņĢĮļ¼╝ņØ┤ņāüļ░śņØæņØ┤ļ®░, ņ╣śļ¬ģņĀü Ļ▓░Ļ│╝ļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż. ĒĢ£ ņ¦ĆņŚŁ ĻĖ░ļ░śņØś ļīĆĒĢÖļ│æņøÉņŚÉņä£ Ļ▓ĮĒŚśĒĢ£ ņé¼ļĪĆļź╝ ļČäņäØĒĢśņśĆļŗż.
ļīĆņāü ļ░Å ļ░®ļ▓Ģ
2008ļģäļČĆĒä░ 2014ļģäĻ╣īņ¦Ć ņĀäļ¼ĖĻ░ĆņŚÉ ņØśĒĢ┤ ņ¦äļŗ©ļÉ£ SJS/TEN ņé¼ļĪĆņØś ņ×äņāü ņ¢æņāü, SCORTEN ļō▒ņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņłśņ¦æĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
7ļģäĻ░ä SJS 56ņé¼ļĪĆ, TEN 14ņé¼ļĪĆ ļō▒ ņ┤Ø 70ņé¼ļĪĆĻ░Ć ļ░£ņāØĒĢśņśĆļŗż. 40ļīĆņŚÉņä£ 60ļīĆ(ļé©ņä▒ ĒÅēĻĘĀ 55ņäĖ, ņŚ¼ņä▒ ĒÅēĻĘĀ 54ņäĖ)ņŚÉ ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢśņśĆņ£╝ļ®░, ĒØöĒĢ£ ņøÉņØĖ ņĢĮņĀ£ļŖö ĒĢŁņĀäĻ░äņĀ£(42.8%), Ēāäņé░ĒāłņłśĒÜ©ņåīņĀĆĒĢ┤ņĀ£(20.0%), ĒĢŁĻĘĀņĀ£(15.7%), ņĢīļĪ£ĒæĖļ”¼ļåĆ(7.1%), ņ¦äĒåĄņåīņŚ╝ņĀ£(7.1%) ļō▒ņØ┤ņŚłļŗż. ļÅģņä▒Ēæ£Ēö╝Ļ┤┤ņé¼ņÜ®ĒĢ┤ 7ņé¼ļĪĆ(50%)Ļ░Ć ņé¼ļ¦ØĒĢśņśĆļŗż. ņé¼ļ¦Ø ņé¼ļĪĆņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 67ņäĖņśĆĻ│Ā, ļé©ņä▒(20%)ļ│┤ļŗż ņŚ¼ņä▒(67%)ņŚÉņä£ ĒØöĒĢśņśĆļŗż. ņ╣śļ¬ģļźĀņØĆ SCORTENņ£╝ļĪ£ ņśłņĖĪļÉśņŚłļŗż. ņāØņĪ┤ ņé¼ļĪĆņÖĆ ņ╣śļŻī ļ░®ļ▓ĢņŚÉļŖö ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż.
Abstract
Background/Aims
Stevens-Johnson syndrome (SJS) and toxic epidermal necrolysis (TEN) are severe cutaneous adverse reactions that frequently result in fatal outcomes. We investigated cases of SJS and TEN in a regional hospital.
Methods
From 2008 to 2014, SJS and TEN cases were enrolled retrospectively by allergy and dermatology specialists, and their clinical features and severity-of-illness score for TEN (SCORTEN) were assessed.
Results
During the 7-year study period, 56 SJS and 14 TEN cases were recruited. The majority (71%) were 40-70 years of age (mean age of male and female patients, 55 and 54 years, respectively). Regarding drugs, anticonvulsants (42.8%) were the most frequently causative, followed by carbonic anhydrase inhibitors (20.0%), antimicrobials (15.7%), allopurinol (7.1%), and non-steroidal anti-inflammatory drugs (7.1%). No fatal case of SJS was seen. However, 7 of the 14 patients with TEN died (50%; mean age, 67 years; 1 of 5 [20%] males and 6 of 9 females [66.7%]). The mortality rate was reflected in the SCORTEN values. Vancomycin, allopurinol, methazolamide (two cases each) and megestrol (one case) were the causative drugs in the seven fatal TEN cases. Treatment modality did not affect the likelihood of death due to TEN.
Conclusions
The causative drugs of, and frequency of mortality due to, SJS and TEN should be recognized by physicians. Elderly females with TEN are at high risk of mortality. SCORTEN values reflect the mortality rate of TEN patients. Early recognition and proper management of SJS and TEN may reduce the mortality rate.
ņĢĮļ¼╝ņØ┤ņāüļ░śņØæ(adverse drug reaction)ņØĆ ņ¦äļŗ©, ņ╣śļŻī, ņśłļ░® ļ¬®ņĀüņ£╝ļĪ£ ņĀüņĀĢņÜ®ļ¤ēņØś ņĢĮļ¼╝ņØä Ēł¼ņŚ¼ĒĢśņśĆņ£╝ļéś ņĢĮļ¼╝ņŚÉ ņØśĒĢ┤ ņØśļÅäĒĢśņ¦Ć ņĢŖņØĆ ĒĢ┤ļĪ£ņÜ┤ ļ░śņØæņØ┤ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░ļź╝ ņØ╝ņ╗½ļŖöļŗż. ļŗżņ¢æĒĢ£ ņןĻĖ░ņŚÉņä£ ļŗżņ¢æĒĢ£ ņ”Øņāü ļ░Å ņ¦ĢĒøäļĪ£ ļéśĒāĆļéĀ ņłś ņ׳ņ£╝ļ®░, Ēö╝ļČĆ Ēś╣ņØĆ ņĀÉļ¦ēņŚÉ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░ļŖö ĒÖśņ×É Ēś╣ņØĆ ņØśļŻīņ¦äņŚÉ ņØśĒĢ┤ ļ╣äĻĄÉņĀü ņēĮĻ▓ī ņØĖņ¦ĆļÉ£ļŗż. Ēö╝ļČĆ ņĀÉļ¦ēņØś ņĢĮļ¼╝ņØ┤ņāüļ░śņØæ ņżæ ļō£ļ¼╝Ļ▓ī ņ╣śļ¬ģņĀüņØĖ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ļź╝ ņżæņ”Ø Ēö╝ļČĆņĢĮļ¼╝ņØ┤ņāüļ░śņØæ(severe cutaneous adverse reaction, SCAR)ņØ┤ļØ╝ ļČäļźśĒĢśļ®░, ņŖżĒŗ░ļĖÉņŖż-ņĪ┤ņŖ© ņ”ØĒøäĻĄ░(Stevens-Johnson syndrome, SJS), ļÅģņä▒Ēæ£Ēö╝Ļ┤┤ņé¼ņÜ®ĒĢ┤(toxic epidermal necrolysis, TEN), ņĢĮļ¼╝Ļ│╝ļ»╝ļ░śņØæņ”ØĒøäĻĄ░(drug hypersensitivity syndrome) ļō▒ņØ┤ ĒĢ┤ļŗ╣ļÉ£ļŗż[1].
SJS/TENņØĆ ļīĆĒæ£ņĀüņØĖ ņ¦ĆņŚ░ņä▒ ņĢĮļ¼╝ņØ┤ņāüļ░śņØæņ£╝ļĪ£, ņøÉņØĖņĢĮļ¼╝ Ēł¼ņŚ¼ Ēøä ņłśņØ╝ņŚÉņä£ ņłśņŻ╝ Ēøä Ēö╝ļČĆņØ┤ņāü ņåīĻ▓¼ņØ┤ ļéśĒāĆļé£ļŗż. ņŻ╝ļĪ£ ņ×ģņłĀ, ĻĄ¼Ļ░Ģ, Ļ▓░ļ¦ē ļō▒ņØś ņĀÉļ¦ē ņ╣©ļ▓öņØ┤ ĒØöĒ׳ Ļ┤Ćņ░░ļÉśĻ│Ā, Ēö╝ļČĆ ļ░śņĀÉ, ņłśĒż, Ēö╝ļČĆļ░Ģļ”¼Ļ░Ć ļéśĒāĆļé£ļŗż. ņ▓┤Ēæ£ļ®┤ņĀüņŚÉ ļö░ļźĖ Ēö╝ļČĆļ░Ģļ”¼Ļ░Ć 10% ļ»Ėļ¦īņØ┤ļ®┤ SJS, 10-30%ļŖö SJS-TEN ņżæņ▓®ļ░śņØæ(overlap SJS-TEN), 30% ņØ┤ņāüņØ┤ļ®┤ TENņ£╝ļĪ£ ĻĄ¼ļČäĒĢ£ļŗż[2]. Ēö╝ļČĆļ░Ģļ”¼ņØś ņĀĢļÅä, ļéśņØ┤, ĻĖ░ņĀĆ ņ¦łĒÖś ļō▒ņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢ£ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤ļéś, SJSņØś Ļ▓ĮņÜ░ ņé¼ļ¦ØļźĀ 1-5%, TENņØś Ļ▓ĮņÜ░ ņé¼ļ¦ØļźĀņØ┤ ņĄ£Ļ│Ā 38%ļĪ£ ņĢīļĀżņ¦ä ņ╣śļ¬ģņĀüņØĖ ņ¦łĒÖśņØ┤ļŗż[3].
SJS/TENņØś ļ│æņØĖĻĖ░ņĀäņØ┤ ļČäļ¬ģĒ׳ ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖņĢä ņ×ÉņäĖĒĢ£ ļ│æļĀź ņ▓ŁņĘ©ņŚÉ ļö░ļØ╝ ņØśņŗ¼ļÉśļŖö ņøÉņØĖ ņĢĮņĀ£ļź╝ ņĪ░ĻĖ░ņŚÉ ņżæļŗ©ĒĢśļŖö Ļ▓ā ņÖĖņŚÉ ļīĆņ”Ø ņ╣śļŻīĻ░Ć ņżæņŗ¼ņØ┤ ļÉ£ļŗż. ļö░ļØ╝ņä£, ĒśĖļ░£ ņĢĮņĀ£ļōżĻ│╝ ņ┤łĻĖ░ ņ”Øņāü ļ░Å ņ¦ĢĒøä ļō▒ņØä ņłÖņ¦ĆĒĢśņŚ¼ SJS/TEN ļ░£ņāØņØä ņżäņØ┤Ļ│Ā, ņĪ░ĻĖ░ņŚÉ ņ¦äļŗ©ĒĢśņŚ¼ ļīĆņ▓śĒĢśļŖö Ļ▓āņØ┤ ņ╣śļ¬ģņĀü Ļ▓ĮĻ│╝ļź╝ ļ░®ņ¦ĆĒĢśļŖö ļŹ░ ĒĢäņłśņĀüņØ┤ļŗż.
ņ¦ĆņŚŁ ĻĖ░ļ░śņØś ņØ╝Ļ░£ ļīĆĒĢÖļ│æņøÉņŚÉņä£ ņłśļģäĻ░äņØś SJS/TEN ņé¼ļĪĆļōżņØä ļČäņäØĒĢśņŚ¼ ņøÉņØĖņĢĮļ¼╝Ļ│╝ Ļ▓ĮĻ│╝ļź╝ ļČäņäØĒĢśņŚ¼ Ē¢źĒøä ļ░£ņāØ ņé¼ļĪĆ ļīĆņ▓śļź╝ ņ£äĒĢ£ ĻĖ░ļ│Ė ņ×ÉļŻīļĪ£ ĒÖ£ņÜ®ĒĢśĻ│Āņ×É ļ│Ė ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņĀ£ņŻ╝ĒŖ╣ļ│äņ×Éņ╣śļÅä ļé┤ ņ£ĀņØ╝ĒĢ£ ļīĆĒĢÖļ│æņøÉņØĖ ņĀ£ņŻ╝ļīĆĒĢÖĻĄÉļ│æņøÉ(2014ļģä ĻĖ░ņżĆ 608ļ│æņāü)ņŚÉņä£ 2008ļģä 1ņøöļČĆĒä░ 2014ļģä 12ņøöĻ╣īņ¦Ć 7ļģäĻ░ä SJS ļśÉļŖö TENņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ņé¼ļĪĆļź╝ ļō▒ļĪØĒĢ£ Ēøä, ĒøäĒ¢źņĀüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ĒåĄĒĢ┤ ņ×äņāü Ļ▓ĮĻ│╝ ĻĖ░ļĪØņØä ņłśņ¦æĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ņĀ£ņŻ╝ļīĆĒĢÖĻĄÉļ│æņøÉ ņØśĒĢÖņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī ņŗ¼ņØśļź╝ ĒåĄĻ│╝ĒĢśņśĆļŗż(IRB #2013-12-007).
Ēö╝ļČĆĻ│╝ ņĀäļ¼ĖņØś Ēś╣ņØĆ ņĢīļĀłļź┤ĻĖ░ļé┤Ļ│╝ ļČäĻ│╝ ņĀäļ¼ĖņØśĻ░Ć ņ¦üņĀæ ņ¦äļŻī Ēś╣ņØĆ ņ¦äļŻī ņØśļó░ļź╝ ĒåĄĒĢ┤ ņ¦äļŗ©ļÉ£ SJS/TEN ņé¼ļĪĆļź╝ ņĀäņłś ņłśņ¦æĒĢśņśĆņ£╝ļ®░, ĒŖ╣ņ¦ĢņĀüņØĖ Ēö╝ļČĆ ļ░Å ņĀÉļ¦ē ļ│æļ│ĆĻ│╝ ņ×äņāü ņ¢æņāüņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż. ņØ╝ļČĆ ņé¼ļĪĆņŚÉņä£ļŖö ņĢĮļ¼╝ ņÖĖ ļŗżļźĖ ņøÉņØĖļōżņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Ēö╝ļČĆ ņĪ░ņ¦üĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņä▒ļ│ä, ņŚ░ļĀ╣, ļÅÖļ░ś ņ¦łĒÖś, ņĢĮļ¼╝ ļ│ĄņÜ®ļĀź, ņ╣śļŻī ĻĖ░Ļ░ä, ņ╣śļŻī ļ░®ļ▓Ģ, ņśłĒøä(ņé¼ļ¦Ø Ēś╣ņØĆ ņāØņĪ┤) ļō▒ņØä ņłśņ¦æĒĢśņśĆļŗż. TEN ņé¼ļĪĆņØś ņżæņ”ØļÅäļŖö score for severity-of-illness of TEN (SCORTEN) [4]ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņŚ░ĻĄ¼ĻĖ░Ļ┤Ć ļ░®ļ¼Ė ļŗ╣ņŗ£ ĒÅēĻ░ĆĒĢśņśĆļŗż. SJS/TEN ņØśņŗ¼ ņ”Øņāü Ēś╣ņØĆ ņ¦ĢĒøäĻ░Ć ļ░£ņāØĒĢśĻĖ░ 1ņŻ╝ņŚÉņä£ 4ņŻ╝ ņØ┤ņĀäņŚÉ ņāłļĪ£ Ēł¼ņĢĮĒĢ£ ņĢĮņĀ£ ņżæ ĻĖ░ņĪ┤ ļ│┤Ļ│ĀĻ░Ć ņ׳ļŖö ņĢĮņĀ£ļź╝ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņøÉņØĖņĢĮļ¼╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆņ£╝ļ®░[1], ņØ╝ļČĆņŚÉņä£ļŖö ĻĖ░ņĪ┤ ļ│┤Ļ│ĀĻ░Ć ņŚåļŹöļØ╝ļÅä ņØśņŗ¼ ņøÉņØĖņĢĮļ¼╝ņØä ņ░Šņ¦Ć ļ¬╗ĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņøÉņØĖņĢĮļ¼╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
2008ļģäļČĆĒä░ 2014ļģäĻ╣īņ¦Ć 7ļģä ļÅÖņĢł SJS/TENņØĆ ļ¦żļģä ļ░£ņāØĒĢśņśĆņ£╝ļ®░, SJSņØĆ 56ņé¼ļĪĆ(8Ļ▒┤/ļģä), TENņØĆ 14ņé¼ļĪĆ(2Ļ▒┤/ļģä)Ļ░Ć ļ░£ņāØĒĢśņŚ¼ ņ┤Ø 70ņé¼ļĪĆ, ņŚ░ ĒÅēĻĘĀ 10ņé¼ļĪĆĻ░Ć ļō▒ļĪØļÉśņŚłļŗż(Fig. 1). ņä▒ļ│äļĪ£ļŖö ļé©ņä▒ SJS 23ņé¼ļĪĆ, TEN 5ņé¼ļĪĆļĪ£ ņ┤Ø 28ņé¼ļĪĆ(40%), ņŚ¼ņä▒ SJS 33ņé¼ļĪĆ, TEN 9ņé¼ļĪĆļĪ£ ņ┤Ø 42ņé¼ļĪĆ(60%)Ļ░Ć ļ░£ņāØĒĢśņśĆļŗż.
ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ ļé©ņ×É 55ņäĖ(┬▒ 14ņäĖ), ņŚ¼ņ×É 54ņäĖ(┬▒ 16ņäĖ)ņśĆļŗż. 50ļīĆņØś ļ╣äņ£©ņØ┤ 28.6%ļĪ£ Ļ░Ćņן ļåÆņĢśņ£╝ļ®░, 40ļīĆņŚÉņä£ 60ļīĆĻ░Ć ņĀäņ▓┤ ņé¼ļĪĆ ņżæ 71%ļź╝ ņ░©ņ¦ĆĒĢśņśĆļŗż(Table 1).
SJS/TENņØś ņøÉņØĖņĢĮļ¼╝ĻĄ░ņØĆ ĒĢŁĻ▓ĮļĀ©ņĀ£(anticonvulsants)Ļ░Ć ņ┤Ø 30ņé¼ļĪĆ(42.8%)ļĪ£ Ļ░Ćņן ĒØöĒĢśņśĆņ£╝ļ®░, carbonic anhydrase inhibitors (14ņé¼ļĪĆ, 20%), ĒĢŁņāØņĀ£(11ņé¼ļĪĆ, 15.7%), allopurinol (5ņé¼ļĪĆ, 7.1%), ņ¦äĒåĄņåīņŚ╝ņĀ£(5ņé¼ļĪĆ, 7.1%) ļō▒ņØś ņł£ņØ┤ņŚłļŗż. ņä▒ļČäļ│äļĪ£ļŖö carbamazepine, phenytoin, acetazolamide, oxcarbazepine, methazolamide, allopurinol, lamotrigine ļō▒ņØś ņł£ņ£╝ļĪ£ ļ░£ņāØĒĢśņśĆļŗż(Table 2).
ņĀäņ▓┤ 70ņé¼ļĪĆ ņżæ 7Ļ▒┤ņØś ņé¼ļ¦Ø ņé¼ļĪĆĻ░Ć ļ░£ņāØĒĢśņśĆĻ│Ā, ņé¼ļ¦ØļźĀņØĆ 10%ņśĆļŗż. 56Ļ▒┤ņØś SJS ņé¼ļĪĆņŚÉņä£ ņé¼ļ¦Ø ņé¼ļĪĆļŖö ņŚåņŚłĻ│Ā, ņé¼ļ¦Ø ņé¼ļĪĆļŖö ļ¬©ļæÉ TENņŚÉ ĒĢ┤ļŗ╣ļÉśņ¢┤ 14ņé¼ļĪĆ ņżæ 7ļ¬ģņØ┤ ņé¼ļ¦ØĒĢśņŚ¼ TENņŚÉņä£ ņé¼ļ¦ØļźĀņØĆ 50%ņŚÉ ļŗ¼ĒĢśņśĆļŗż. ņä▒ļ│äņŚÉ ļö░ļźĖ ņé¼ļ¦ØļźĀņØĆ ļé©ņ×É 20% (1/5ņé¼ļĪĆ), ņŚ¼ņ×É 66.7% (6/9ņé¼ļĪĆ)ņśĆĻ│Ā, ņé¼ļ¦Ø ņé¼ļĪĆņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 67ņäĖņśĆļŗż. SCORTENņ£╝ļĪ£ ĒīīņĢģĒĢ£ TENņØś ņżæņ”ØļÅäņŚÉ ļö░ļØ╝ ĻĖēĻ▓®ĒĢ£ ņé¼ļ¦ØļźĀ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆļŗż.
SCORTEN 2ņĀÉ ņØ┤ĒĢśņŚÉņä£ļŖö ņé¼ļ¦ØļźĀ 0% (0Ļ▒┤/4ņé¼ļĪĆ)ļź╝ ļ│┤ņśĆņ£╝ļéś, 3ņĀÉņŚÉņä£ļŖö 25% (1Ļ▒┤/4ņé¼ļĪĆ), 4ņĀÉ ņØ┤ņāüņŚÉņä£ļŖö 100% (6Ļ▒┤/ 6ņé¼ļĪĆ)ļź╝ ļ│┤ņśĆļŗż. Ļ░ü ņé¼ļĪĆņØś SCORTEN ņĀÉņłśņŚÉ ļö░ļźĖ ņśłņĖĪņé¼ļ¦Ø Ļ▒┤ņłśļŖö 6.256Ļ▒┤ņ£╝ļĪ£, ņŗżņĀ£ ņé¼ļ¦ØĻ▒┤ņłśņÖĆ ņ£Āņé¼ĒĢśņśĆļŗż (Table 3). ņøÉņØĖņĢĮļ¼╝ļĪ£ļŖö vancomycin, allopurinol, methazolamide ļō▒ņØ┤ Ļ░ü 2ņé¼ļĪĆ, megestrol acetate 1ņé¼ļĪĆņśĆļŗż. Megestrol acetateņŚÉ ņØśĒĢ£ SJS/TENņØś ĻĖ░ņĪ┤ ļ│┤Ļ│ĀļŖö ņŚåņ£╝ļéś ĒŖ╣ņ¦ĢņĀüņØĖ ĒåĄņ”ØņØä ļÅÖļ░śĒĢ£ Ēö╝ļČĆ ļ░śņĀÉ, ņĀÉļ¦ē ĻČżņ¢æ ļō▒ņØ┤ ļéśĒāĆļéśĻĖ░ ņŗ£ņ×æĒĢ£ ņŗ£ņĀÉ 7ņØ╝ ņĀäņŚÉ ņāłļĪ£ ņČöĻ░ĆļÉ£ ņĢĮļ¼╝ņØ┤ megestrolņØ┤ ņ£ĀņØ╝ĒĢśņśĆņ£╝ļ®░, ĻĘĖņÖĖ ļ│æņÜ®ĒĢśļŹś ņĢĮļ¼╝ņØ┤ ņŚåņ¢┤ ņøÉņØĖņĢĮļ¼╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
TENņØś ņ╣śļŻīņŚÉ 3ņØ╝ ņØ┤ņāü ņé¼ņÜ®ļÉ£ ņĢĮņĀ£ļĪ£ļŖö ņĀäņŗĀ ĻĖĆļŻ©ņĮöņĮöļź┤Ēŗ░ņĮöņØ┤ļō£, cyclosporin, ņĀĢņŻ╝ ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░(intravenous human immunoglobulin), ļ│┤ņĪ┤ņĀü ņ╣śļŻī ļō▒ņØ┤ ņ׳ņŚłļŗż. ņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉ£ ņĢĮņĀ£ļŖö ņé¼ļ¦ØĻĄ░Ļ│╝ ņāØņĪ┤ĻĄ░ņŚÉņä£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 4).
SJS, SJS-TEN ņżæņ▓®ļ░śņØæ, TEN ļō▒ņØś ĻĄ¼ļČäņØĆ ņ▓┤Ēæ£ļ®┤ņŚÉ Ēö╝ļČĆĒæ£Ēö╝ļ░Ģļ”¼Ļ░Ć ļéśĒāĆļéśļŖö ļ╣äņ£©ņŚÉ ļö░ļźĖ ļČäļźśņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀĆņ×ÉļōżņØĆ Ļ░ü ļČäļźśĻ░Ć ļ│äļÅäņØś ļ│æĒā£ņāØļ”¼ņŚÉ ļö░ļźĖ ņ”Øņāü ļ░Å ņ¦ĢĒøäļØ╝ĻĖ░ļ│┤ļŗżļŖö ļÅÖņØ╝ Ēś╣ņØĆ ņ£Āņé¼ĒĢ£ ļ│æĒā£ņāØļ”¼ņŚÉ ļö░ļźĖ ņżæņ”ØļÅä ņŖżĒÄÖĒŖĖļ¤╝ņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśņŚ¼ SJS/TENņØä ĻĖ░ņłĀĒĢśņśĆļŗż.
SJS/TENņØĆ ļ│æĒā£ņāØļ”¼Ļ░Ć ļ¬ģĒÖĢĒ׳ ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ĒśĖņĀäņŗ£ĒéżĻ│Ā, ņŗżļ¬ģ, Ēī©Ēśłņ”Ø, ņé¼ļ¦Ø ļō▒ ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”ØņØä ņżäņØ┤ĻĖ░ ņ£äĒĢ£ ļ│æĒā£ņāØļ”¼ ĒŖ╣ņØ┤ņĀü ņ╣śļŻīļŖö ņĀĢļ”ĮļÉ£ ļ░öĻ░Ć ņŚåļŗż. ņĢĮļ¼╝ Ēł¼ņĢĮļĀźĻ│╝ ņ”Øņāü ļ░£ņāØ ņŗ£ņĀÉņØä ĒīīņĢģĒĢśņŚ¼ ņøÉņØĖņĢĮļ¼╝ņØä ņ░ŠņĢä ņ”ēņŗ£ ņżæļŗ©ĒĢśĻ│Ā, ņĀüĻĘ╣ņĀüņØĖ ļīĆņ”ØņĀü ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ĒśĖņĀäņŗ£ĒéżĻ│Ā, ņśłĒøäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņżæņÜöĒĢ£ ņÜöņØĖņØ┤ļØ╝ļŖö Ļ▓¼ĒĢ┤Ļ░Ć ņ¦Ćļ░░ņĀüņØ┤ļŗż. ĻĖēņä▒ĻĖ░ Ēś╣ņØĆ ĻĖēņä▒ĻĖ░ ņØ┤ĒøäņŚÉļÅä ņĀĢĒÖĢĒĢ£ ņøÉņØĖņĢĮļ¼╝ņØä ĒÖĢņ¦äĒĢĀ ņłś ņ׳ļŖö Ļ▓Ćņé¼ ļ░®ļ▓ĢņØ┤ ņĀ£ĒĢ£ņĀüņØ┤ļŗż. ļö░ļØ╝ņä£, SJS/TEN ņé¼ļĪĆĻ░Ć ļ│┤Ļ│ĀļÉ£ ņĢĮļ¼╝ņØä ņłśņØ╝ņŚÉņä£ ņłśņŻ╝ņé¼ņØ┤ņŚÉ ņāłļĪ£ Ēł¼ņĢĮļÉśņŚłļŖöņ¦Ć ĒÖĢņØĖĒĢśļŖö ņĀäļ¼ĖĻ░ĆņŚÉ ņØśĒĢ£ ņĢĮļ¼╝ Ēł¼ņĢĮļĀźņŚÉ ļīĆĒĢ£ ņ▓ĀņĀĆĒĢ£ ņĪ░ņé¼Ļ░Ć ĒĢäņłśņĀüņØ┤ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ņ¦ĆņŚŁĻĖ░ļ░śņØś ļīĆĒĢÖļ│æņøÉņŚÉņä£ Ļ▓ĮĒŚśĒĢ£ ņé¼ļĪĆņŚÉ ļīĆĒĢ£ ĻĖ░ņłĀņØ┤ļŗż. ļÅÖņØ╝ ĻĖ░Ļ┤ĆņŚÉņä£ ņÖĖļל ņČöņĀü Ļ┤Ćņ░░ Ēś╣ņØĆ ņ×ģņøÉ ņ╣śļŻīĒĢśņśĆļŹś ņé¼ļĪĆļŖö ļ¬ģĒÖĢĒĢ£ Ēł¼ņĢĮļĀźņØä ĒÖĢļ│┤ĒĢĀ ņłś ņ׳ņ¢┤ ņøÉņØĖņĢĮļ¼╝ ņČöņĀĢņØ┤ ļ╣äĻĄÉņĀü ņÜ®ņØ┤ĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī, ņØ╝ļČĆ ĒāĆ ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ SJS/TEN ņ¦äļŗ© ĒĢśņŚÉ ņ╣śļŻī ņżæ ņĀäņøÉļÉ£ Ļ▓ĮņÜ░, ņ×ÉĻ░Ć, ņĢĮĻĄŁ, ĒāĆ ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ņØś Ēł¼ņĢĮļĀźņØĆ ĒÖśņ×É ļ│ĖņØĖņØś ĻĖ░ņ¢ĄņŚÉ ņØśņĪ┤ĒĢĀ ņłśļ░¢ņŚÉ ņŚåņ¢┤ ņøÉņØĖņĢĮļ¼╝ ņČöņĀĢņŚÉ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż. ņĢĮļ¼╝ ņÖĖņŚÉļÅä ņäŁņĘ© Ēś╣ņØĆ ņĀæņ┤ēņ£╝ļĪ£ļÅä SJS/TENņØś ņøÉņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŗż. Kim ļō▒[5]ņØĆ SJS/TEN 82ņé¼ļĪĆ ņżæ 39ņé¼ļĪĆ(47.6%)ļź╝ ņĢĮļ¼╝ ņÖĖ ņøÉņØĖņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ņĢĮļ¼╝ ņżæņŚÉņä£ļÅä ņāØņĢĮ(herbal remedies), ņŚ╝ņāēņĢĮ ļō▒ļÅä ņøÉņØĖņ£╝ļĪ£ ņ¦Ćļ¬®ĒĢśņśĆļŗż. ļÅÖņØ╝ ĻĖ░Ļ┤ĆņØś 10ņŚ¼ ļģä ņĀä ņŚ░ĻĄ¼ņŚÉņä£ļŖö 15ņé¼ļĪĆ ņżæ 5ņé¼ļĪĆņŚÉņä£ ņ▓śļ░®ņĢĮ ņÖĖņØś ņøÉņØĖņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż[6]. ļö░ļØ╝ņä£, SJS/TEN ņØśņŗ¼ ņ”Øņāü ļ░Å ņ¦ĢĒøä ļ░£ņāØĒĢśĻĖ░ ņĀä ņłśņŻ╝ļé┤ ņāłļĪ£ ņĀæņ┤ēĒĢ£ Ļ▓āļōżņŚÉ ļīĆĒĢ£ ņ▓ĀņĀĆĒĢ£ Ļ▓Ćņ”ØņØ┤ ĒĢäņÜöĒĢśļŗż. ņĢĮļ¼╝ ņÖĖ ĒāĆ ņøÉņØĖņØ┤ ņØśņŗ¼ļÉśņ¢┤ļÅä ņØ┤ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ£ Ēś╣ņØĆ ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ£ ņ¦äļŗ©ņĀü Ļ▓Ćņé¼Ļ░Ć ņŚåĻ│Ā, SJS/TENĻ│╝ Ļ░ÖņØ┤ ņ╣śļ¬ģņĀü Ļ▓ĮĻ│╝Ļ░Ć ņśłņĖĪļÉśļŖö Ļ▓ĮņÜ░ ņ£Āļ░£ Ļ▓Ćņé¼Ļ░Ć ņĀ£ĒĢ£ņĀüņØ┤ļŗż. ņŚ░ĻĄ¼ ļīĆņāü ņżæ ņØ┤ņĀä ļ│┤Ļ│ĀĻ░Ć ņŚåļŖö ņĢĮļ¼╝(Megace┬«, megestrol acetate)ņØä ņāłļĪ£ ļ│ĄņÜ®ĒĢ£ Ēøä 7ņØ╝ņ¦ĖļČĆĒä░ ĻĄ¼Ļ░ĢĻČżņ¢æņØ┤ ļéśĒāĆļéśĻĖ░ ņŗ£ņ×æĒĢśņśĆĻ│Ā, 10ņØ╝ņ¦ĖļČĆĒä░ ņåīņ¢æĻ░É ļ░Å ĒåĄņ”ØņØä ļÅÖļ░śĒĢ£ ņĀäņŗĀ Ēö╝ļČĆ ļ░£ņ¦äņØ┤ ļ░£ņāØĒĢśņŚ¼ ņØæĻĖēņŗżļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. Ļ│╝Ļ▒░ļĀźņāü ĒŖ╣ļ░£ņä▒ ĒśłņåīĒīÉĻ░Éņåīņä▒ ņ×Éļ░śņ”ØņØ┤ ņ׳ņŚłņ£╝ļéś, Ļ░üņóģ ņ╣śļŻīņŚÉ ĒśłņåīĒīÉņłśĻ░Ć ĒśĖņĀäļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░ Ēö╝ļČĆ ņĀÉļ¦ē ņ”ØņāüņØ┤ ļéśĒāĆļéśĻĖ░ ņŗ£ņ×æĒĢ£ ņŗ£ņĀÉ ņØ┤ņĀä ņłśĻ░£ņøöĻ░ä ņāłļĪ£ ņČöĻ░ĆļÉ£ ņĢĮļ¼╝ņØĆ ņ”Øņāü ņŗ£ņ×æ ņŗ£ņĀÉ 7ņØ╝ ņĀäņŚÉ Ēł¼ņŚ¼ĒĢ£ megestrolņØ┤ ņ£ĀņØ╝ĒĢśņśĆņ£╝ļ®░, ņĢĮļ¼╝ ņÖĖ ĒāĆ ņøÉņØĖļōżņØś Ļ░ĆļŖźņä▒ņØä ļ¼Ėņ¦äņ£╝ļĪ£ ļ░░ņĀ£ĒĢ£ Ēøä ņøÉņØĖņĢĮļ¼╝ļĪ£ ņ¦Ćļ¬®ĒĢśņśĆļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ņØ┤ņĀä ļ│┤Ļ│ĀĻ░Ć ņŚåļŖö ņĢĮļ¼╝ļÅä ņøÉņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ņ¢┤ SJS/TENņØ┤ ņØśņŗ¼ļÉśļŖö ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ ņé¼ņÜ® ņżæņØĖ ļ¬©ļōĀ ņĢĮļ¼╝ņØä ņżæļŗ©ĒĢśļŖö ļ░®ļ▓ĢļÅä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĒśĖņĀä ĒøäņŚÉļÅä ņØśņŗ¼ ņĢĮļ¼╝ņØä ņØ┤ņÜ®ĒĢ£ Ēö╝ļé┤ņŗ£ĒŚśņØś ņ¦ĆņŚ░ĒīÉļÅģ Ēś╣ņØĆ ņ▓®Ēżņŗ£ĒŚś ļō▒ņØä ņŗ£Ē¢ēĒĢ┤ ļ│╝ ņłś ņ׳ņ£╝ļéś, ļ»╝Ļ░ÉļÅäĻ░Ć ĒśäņĀĆĒ׳ ļé«ņĢä Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ĒĢ┤ņäØņŚÉ ņ£ĀņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ļ╣łļ▓łĒĢ£ ņøÉņØĖ ņĢĮņĀ£ļĪ£ļŖö ĒĢŁņĀäĻ░äņĀ£, ĒĢŁņāØņĀ£, ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£, allopurinol, ļ╣äņŖżĒģīļĪ£ņØ┤ļō£ņä▒ ĒĢŁņŚ╝ņ”ØņĀ£(non-steroidal anti-inflammatory drugs) ļō▒ņØ┤ļŗż[7]. ņøÉņØĖņĢĮļ¼╝ņØĆ ņŚ░ĻĄ¼ ņŗ£ĻĖ░, ņŚ░ĻĄ¼ ļīĆņāü ļō▒ņŚÉ ļö░ļØ╝ ļ░£ņāØ ļ╣łļÅäņŚÉ ļŗżņ¢æĒĢ£ ņ░©ņØ┤ļź╝ ļéśĒāĆļé╝ ņłś ņ׳ņ£╝ļéś ļ│Ė ņŚ░ĻĄ¼ņØś ņøÉņØĖņĢĮļ¼╝ļōżņØĆ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżĻ│╝ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļŖö ņøÉņØĖņĢĮļ¼╝ ĒÖĢņ¦ä ļ░®ļ▓ĢņØś ņĀ£ĒĢ£ņĀÉ ļĢīļ¼ĖņØ┤ļŗż. Ēśäņ×¼Ļ╣īņ¦Ć SJS/TENņØś ņøÉņØĖņĢĮļ¼╝ņØä ĒÖĢņ¦äĒĢśĻĖ░ ņ£äĒĢ£ Ļ▓Ćņé¼ ļ░®ļ▓ĢņØ┤ ņŚåĻ│Ā, ņ×¼Ēł¼ņŚ¼ļĪ£ ņØĖĒĢ£ ņ╣śļ¬ģ Ļ░ĆļŖźņä▒ ļĢīļ¼ĖņŚÉ ņĢĮļ¼╝ ņ£Āļ░£ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ĒÖĢņ¦äļ│┤ļŗżļŖö ņ”Øņāü ļ░£ņāØ ņłśņØ╝ņŚÉņä£ 4ņŻ╝ ņØ┤ļé┤ ņāłļĪ£ Ēł¼ņĢĮĒĢ£ ņĢĮļ¼╝ņØä Ļ▓ĆņāēĒĢśĻ│Ā, ņØ┤ļōż ņĢĮļ¼╝ļōż ņżæ ĻĖ░ņĪ┤ ļ│┤Ļ│ĀĻ░Ć ņ׳Ļ▒░ļéś ļŗżņłś ļ│┤Ļ│ĀļÉ£ ņĢĮļ¼╝ļōżņØä ņäĀļ│äĒĢśņŚ¼ ņøÉņØĖņĢĮļ¼╝ļĪ£ ņ¦Ćļ¬®ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņøÉņØĖņĢĮļ¼╝ ņ¦äļŗ©ņØś ņśżļźśĻ░Ć ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. Ēö╝ļČĆ ņĀÉļ¦ē ņ”ØņāüņŚÉ ņäĀĒ¢ēĒĢśļŖö ņØĖĒøäĒåĄ, ļ░£ņŚ┤Ļ░É, ĻĘ╝ņ£ĪĒåĄ ļō▒ņØś ņĀäĻĄ¼ ņ”ØņāüņŚÉ ļīĆĒĢ┤ ņ▓ĀņĀĆĒĢ£ ļ│æļĀźņ▓ŁņĘ©ļź╝ ĒåĄĒĢ┤ ļ░£ļ│æ ņŗ£ņĀÉņØä ņ×¼Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļ╣äĒŖ╣ņØ┤ņĀü ņ”ØņāüņŚÉ ļīĆĒĢ┤ ļīĆņ”ØņÜöļ▓Ģņ£╝ļĪ£ Ēł¼ņĢĮĒĢ£ ņĢĮļ¼╝ņØä ņøÉņØĖņĢĮļ¼╝ļĪ£ ņČöņĀĢĒĢśņŚ¼ Ēł¼ņĢĮ Ēøä ņłśņŗ£Ļ░ä Ēś╣ņØĆ ņłśņØ╝ļé┤ SJS/TEN ļ░£ļ│æ ņé¼ļĪĆļĪ£ ņØĖņ¦ĆĒĢśļŖö ņśżļźśļŖö ņĢäļŗī ņ¦Ć ņ×¼Ļ│ĀĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĒŖ╣ņĀĢ ņĢĮļ¼╝Ļ│╝ ļ░śņØæĒĢśļŖö HLA ņ£ĀņĀäņ×ÉĒśĢņØ┤ Ļ▓Ćņé¼Ļ░Ć ņøÉņØĖņĢĮļ¼╝ ĒÖĢņ¦ä ļ░Å Ē¢źĒøä ņĢĮļ¼╝ ņäĀĒāØņŚÉ ņżæņÜöĒĢ£ ņĀĢļ│┤ļź╝ ņĀ£Ļ│ĄĒĢĀ ņłśļÅä ņ׳ļŗż. ņśłļź╝ ļōżļ®┤, ņØśņŗ¼ ņøÉņØĖņĢĮļ¼╝ĻĄ░ņŚÉ ņĢīļĪ£ĒæĖļ”¼ļåĆņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳Ļ│Ā, ĒÖśņ×ÉņØś ņ£ĀņĀäņ×ÉĒśĢņØ┤ HLA-B*58:01ņØĖ Ļ▓ĮņÜ░ ņĢīļĪ£ĒæĖļ”¼ļåĆņØä ņøÉņØĖņĢĮļ¼╝ļĪ£ ņ¦Ćļ¬®ĒĢĀ ņłś ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ĒĢ┤ļŗ╣ļÉ£ļŗż. Ē¢źĒøä ņĢĮļ¼╝ņ£ĀņĀäņ▓┤ ņĀĢļ│┤Ļ░Ć ņøÉņØĖņĢĮļ¼╝ ņ¦äļŗ©ņŚÉ Ēü░ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢ£ļŗż[8]. Ļ░ü ņĢĮļ¼╝ņŚÉ ļö░ļźĖ SJS/TEN ļ░£ņāØļźĀņØĆ ņĢĮļ¼╝ ņé¼ņÜ® ļ¬©ņ¦æļŗ© ņłśļź╝ ņĢīĻĖ░ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņŚåļŗż.
SJS/TENņØś ņ╣śļŻīļŖö ļ│æņØĖĻĖ░ņĀä ĒŖ╣ņØ┤ ņ╣śļŻīĻ░Ć ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖņĢä ņé¼ļ¦Ø Ļ░ÖņØĆ ņ╣śļ¬ģņĀüņØĖ ĒĢ®ļ│æņ”ØņØä ņżäņØ┤ĻĖ░ ņ£äĒĢ£ ļīĆņ”ØņĀü ņ╣śļŻīĻ░Ć ņżæņŗ¼ņØä ņØ┤ļŻ¼ļŗż. ņĀäņŗĀ ņŖżĒģīļĪ£ņØ┤ļō£ Ļ░ÖņØĆ ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśļ®┤ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņĪīņ£╝ļéś, ļīĆņ”ØņĀü ņ╣śļŻī ņé¼ļĪĆņÖĆ ļ╣äĻĄÉĒĢ£ ļīĆĻĘ£ļ¬© ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼ņŚÉņä£ ĒåĄĻ│äĒĢÖņĀü ņÜ░ņøöĒĢ£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ņ¦Ć ļ¬╗ĒĢśņśĆļŗż[9]. ļ░£ļ│æ ņ┤łĻĖ░ņŚÉ ņĀĢļ¦ź ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ņØ┤ ņØ╝ļČĆ ņé¼ļ¦ØļźĀņØä ņżäņØ╝ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś[10,11], ļīĆņĪ░ņŗ£ĒŚśņØ┤ ņŗ£Ē¢ēļÉśņ¦Ć ņĢŖņĢśĻ│Ā, ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ ļ░Å ļīĆņ”ØņĀü ņ╣śļŻīņÖĆņØś ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼ņŚÉņä£ ņ╣śļ¬ģļźĀņØä ņżäņØ┤ņ¦Ć ļ¬╗ĒĢśņśĆļŗż[9,12]. ņ╣śļ¬ģļźĀņØä ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ņä£ ĒÖöņāü ņ¦æņżæ ņ╣śļŻīĻ░Ć Ļ░ĆļŖźĒĢ£ ĻĖ░Ļ┤Ćņ£╝ļĪ£ ņĪ░ĻĖ░ ņĀäņøÉĒĢśļŖö Ļ▓āņØ┤ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż[3,13,14].
SCORTENņØĆ TENņŚÉ ĒŖ╣ĒÖöļÉ£ ņżæņ”ØļÅäļź╝ ļéśĒāĆļé┤ĻĖ░ ņ£äĒĢśņŚ¼ Ļ░£ļ░£ļÉśņŚłļŗż[4]. ļéśņØ┤, ņŗ¼ļ░Ģņłś, ņóģņ¢æ ļÅÖļ░ś ņ£Āļ¼┤, ņ▓½ņ¦Ė ļéĀ Ēö╝ļČĆļ│æļ│Ć ļ╣äņ£©, blood urea nitrogen, ņżæĒāäņé░ņŚ╝, Ēśłļŗ╣ ļō▒ 7Ļ░Ćņ¦Ć ņØĖņ×ÉļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ¢┤ ņ×äņāüņŚÉņä£ ņēĮĻ│Ā ņ£ĀņÜ®ĒĢśĻ▓ī ņĀüņÜ®ĒĢĀ ņłś ņ׳Ļ│Ā, ĒŖ╣Ē׳ ņé¼ļ¦Ø ņ£äĒŚśļÅäļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢśļŗż. SCORTENņØĆ ļ│Ė ņŚ░ĻĄ¼ņØś ņé¼ļĪĆļōżņŚÉ ņĀüņÜ®ĒĢ£ Ļ▓░Ļ│╝ ņé¼ļ¦ØĻ▒┤ņłś ņśłņĖĪņŚÉ ņ£ĀņÜ®ĒĢ©ņØä ĒÖĢņØĖĒĢśņŚ¼ ĻĄŁļé┤ĻĖ░Ļ┤ĆņŚÉņä£ļÅä SJS/TENņØś ņśłĒøä ņśłņĖĪ ņ¦ĆĒæ£ļĪ£ ņåÉņēĮĻ▓ī ĒÖ£ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļ”¼ļØ╝ ņāØĻ░üĒĢ£ļŗż.
REFERENCES
2. Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical classification of cases of toxic epidermal necrolysis, stevens-johnson syndrome, and erythema multiforme. Arch Dermatol 1993;129:92ŌĆō96.


3. Weinand C, Xu W, Perbix W, et al. 27 years of a single burn centre experience with Stevens-Johnson syndrome and toxic epidermal necrolysis: analysis of mortality risk for causative agents. Burns 2013;39:1449ŌĆō1455.


4. Bastuji-Garin S, Fouchard N, Bertocchi M, Roujeau JC, Revuz J, Wolkenstein P. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol 2000;115:149ŌĆō153.


5. Kim HI, Kim SW, Park GY, et al. Causes and treatment outcomes of Stevens-Johnson syndrome and toxic epidermal necrolysis in 82 adult patients. Korean J Intern Med 2012;27:203ŌĆō210.



6. Kim JW, Kim ST, Song DH. A clinical observation of the patients with Stevens-Johnson syndrome and toxic epidermal necrolysis in Jeju island. Korean J Dermatol 2004;42:579ŌĆō591.
7. Barvaliya M, Sanmukhani J, Patel T, Paliwal N, Shah H, Tripathi C. Drug-induced Stevens-Johnson syndrome (SJS), toxic epidermal necrolysis (TEN), and SJS-TEN overlap: a multicentric retrospective study. J Postgrad Med 2011;57:115ŌĆō119.


8. Kang HR, Jee YK, Kim YS, et al. Positive and negative associations of HLA class I alleles with allopurinol-induced SCARs in Koreans. Pharmacogenet Genomics 2011;21:303ŌĆō307.


9. Schneck J, Fagot JP, Sekula P, Sassolas B, Roujeau JC, Mockenhaupt M. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: a retrospective study on patients included in the prospective EuroSCAR Study. J Am Acad Dermatol 2008;58:33ŌĆō40.


10. Prins C, Kerdel FA, Padilla RS, et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive cases. Arch Dermatol 2003;139:26ŌĆō32.


11. Trent JT, Kirsner RS, Romanelli P, Kerdel FA. Analysis of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis using SCORTEN: The University of Miami Experience. Arch Dermatol 2003;139:39ŌĆō43.


12. Bachot N, Revuz J, Roujeau JC. Intravenous immunoglobulin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis: a prospective noncomparative study showing no benefit on mortality or progression. Arch Dermatol 2003;139:33ŌĆō36.


Number of cases of SJS and TEN from 2008 to 2014. SJS, Stevens-Johnson syndrome; TEN, toxic epidermal necrolysis.
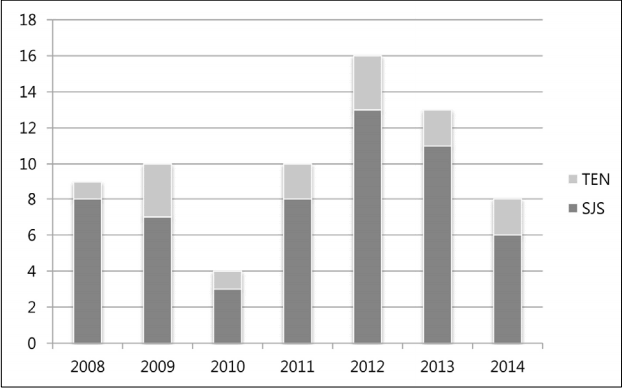
Figure┬Ā1.
Table┬Ā1.
Demographic characteristics of patients with SJS and TEN
Table┬Ā2.
Classification and generic names of the causative agents of SJS and TEN
Table┬Ā3.
Association between SCORTEN values and mortality
| SCORTEN score | Total, no. | Expected mortality rate, % | Expected deaths, no. | Actual deaths, no. | SMRa |
|---|---|---|---|---|---|
| 1 | 1 | 3.2 | 0.032 | 0 | 0 |
| 2 | 3 | 12.2 | 0.363 | 0 | 0 |
| 3 | 4 | 35.3 | 1.412 | 1 (M: 0, F: 1) | 0.708 |
| 4 | 3 | 58.3 | 1.749 | 3 (M: 1, F: 2) | 1.715 |
| > 5 | 3 | 90.0 | 2.7 | 3 (M: 0, F: 3) | 1.111 |
| Total | 14 | 6.256 | 7 | 1.118 |
Table┬Ā4.
Causative drugs, hospital stay duration, comorbidities, therapeutics and disease severity according to the SCORTEN score in patients who died
MI, myocardial infarction; HTN, hypertension; CVA, cerebrovascular attack; CRF, chronic renal failure; ITP, immune thrombocytopenic purpura; DM, diabetes mellitus; IVIG, intravenous human immunoglobulin; GC, systemic glucocorticoids, SCORTEN, score for severity-of-illness of toxic epidermal necrolysis.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




