철결핍빈혈 진단과 최신 치료 경향
Iron Deficiency Anemia: Diagnosis and Treatment
Article information
서 론
철결핍(iron deficiency)은 체내로의 철 흡수에 비하여 철의 요구량이나 소실이 많아 체내 철의 양이 감소된 것을 말하며, 철결핍이 계속 진행되어 적혈구 생성이 떨어져 빈혈이 생기는 경우 철결핍빈혈(iron deficiency anemia)이라 한다. 철결핍빈혈은 국내 남자의 2%, 여자의 22% 정도에서 발생하는 발생 빈도가 가장 높은 빈혈이다[1]. 흔하고 치료가 쉬운 질환이지만, 잘못된 진단을 하거나 정확한 원인 규명 없이 치료를 하는 경우 잘못된 치료를 하게 되거나 빈혈을 증상으로 나타내는 숨겨진 질환을 놓칠 수 있으니 진단에 신중하여야 한다. 종종 위장관 출혈로 인한 빈혈을 모두 철결핍빈혈로 진단하는 경우가 있는데, 위장관 출혈이 있더라도 철결핍이 없는 경우 철결핍빈혈이 아니며 철 투여가 필요 없거나 투여하여도 효과를 기대하기 어렵다. 원인에 대한 치료와 더불어 시행되는 철 보충은 경구 또는 정맥 주사 투여로 이루어진다. 경구 투여는 가격이 싸고 심각한 부작용이 없다는 점에서 더 선호되고 있지만 위장관 부작용의 빈도가 높고 장기간 복용을 해야 한다는 단점이 있다. 반면에 혈관 천자를 해야 하는 단점이 있지만 위장관 부작용이 없고 몇 차례의 투여만으로 부족한 철을 단시간에 보충할 수 있는 주사 철 제제가 최근 적극적으로 이용되고 있다[2]. 이 글에서는 주로 철결핍빈혈의 진단시 유의할 점, 특수한 상황에서의 환자접근법, 주사 치료의 장단점과 방법을 다루고자 한다.
진단 및 원인
철결핍빈혈 의심과 검사 결과의 해석
빈혈 환자 중 망상적혈구(reticulocyte)가 증가되지 않는 소구성 빈혈(microcytic anemia) 환자는 철결핍빈혈 가능성이 높기 때문에 반드시 철결핍을 의심하여야 한다. 그 외 성장기 청소년, 임산부, 하지불안증후군(restless leg syndrome), 만성 신부전, 용혈 빈혈, 출혈 환자의 경우는 소구성 빈혈이 아니더라도 철결핍을 의심하여 철 관련 검사를 하는 것이 추천된다.
철 관련 검사는 혈청 페리틴(serum ferritin), 혈청 철(serum iron), 총철결합능(total iron binding capacity), 트랜스페린(transferrin)을 포함하여야 하며, 전형적인 철결핍빈혈은 혈청 페리틴과 혈청 철이 감소하면서 총철결합능과 트랜스페린은 증가한다(Table 1). 반면에 감염이나 염증, 만성 신부전과 같은 질환에 의한 빈혈은 혈청 페리틴이 정상 또는 상승하고 총철결합능과 트랜스페린은 감소한다. 철결핍빈혈을 진단하는데 가장 중요하고 믿을 만한 검사는 혈청 페리틴이며, 감소된 경우 철결핍을 진단하는데 무리가 없다. 하지만 혈청 페리틴이 정상인 경우 철결핍빈혈의 진단이 어려워지는데, 페리틴은 감염이나 염증으로 인해 상승하는 급성 기반응물질(acute phase reactant)이기 때문에 철결핍이 있더라도 혈청 페리틴이 정상이거나 상승할 수 있기 때문이다. 따라서 감염, 염증, 간질환, 심부전, 악성 질환이 있는 경우나 적혈구생성인자(erythropoietin)를 투여 중인 만성 신부전 환자와 같은 기능적 철결핍(functional iron deficiency)이 있는 경우는 혈청 페리틴이 정상이더라도 철결핍이 없다고 단정할 수 없어 다른 검사 결과나 임상적 특징을 살펴보고 종합적으로 판단할 수밖에 없다.
철결핍과 만성 질환 빈혈(anemia of chronic disease or inflammation)과 같은 다른 빈혈이 동반되었을 경우 철결핍 진단이 어렵다. 철결핍의 진단을 위한 첫 번째 방법으로는 골수 검사를 통하여 철 염색(iron stain)을 하여 저장철의 부족을 확인하면 진단할 수 있다. 확실하고 정확한 방법이지만 실제로 적용하는 경우는 많지 않다. 두 번째 방법으로는 보편화된 검사는 아니지만 혈청 트랜스페린 수용체(serum transferrin receptor)를 측정하여 만성 질환 빈혈과 감별을 할 수 있다. 혈청 트랜스페린 수용체는 적혈구생성능(erythropoiesis)을 간접적으로 시사하는 검사로 철결핍의 경우 증가하며 만성 질환 빈혈에서는 감소한다. 혈청 트랜스페린 수용체와 페리틴 결과를 이용하여 트랜스페린 수용체-로그 페리틴 지수(serum transferrin receptor-log ferritin index)를 계산하면 만성 질환 빈혈이 있더라도 철결핍빈혈이 동반되어 있다고 판단할 수 있다[3]. 세 번째는 트랜스페린 포화도(transferrin saturation)와 페리틴을 이용한 방법이다. 만성 신질환 환자의 경우 트랜스페린 포화도가 낮으면서(< 30%) 혈청 페리틴이 100 ng/mL 미만, 심부전 환자의 경우 낮은 트랜스페린 포화도와 혈청 페리틴이 300 ng/mL 미만인 경우 철결핍빈혈이 동반되었다고 추정할 수 있다고 하였다[3-5]. 이 세 가지 방법은 시행하기 어렵거나 정확도가 높지 않기 때문에 현실적으로는 철결핍의 감별이 매우 어려우며 임상적인 판단이 오히려 중요하다.
원인 규명을 위한 병력 청취 및 검사
철결핍빈혈은 원인을 교정하여야 근본적인 치료가 되기 때문에 반드시 원인을 찾아야 한다. 크게 철 소실, 철 요구량 증가, 철 흡수 장애로 나뉘며, 성별 및 연령대에 따라 그 원인들이 달라 이를 고려하여 병력청취와 검사들을 시행하여야 한다(Table 2).
남성 환자와 노인 환자의 철결핍빈혈의 가장 흔한 원인은 만성적인 출혈로, 반드시 위장 출혈에 관련된 문진과 내시경 검사 및 대변 잠혈 검사를 진행하여야 한다. 만성 출혈을 시사하는 위 내시경 소견으로는 궤양, 미란, 혈관형성이상(angiodysplasia)과 종양이고, 대장내시경 소견으로는 치질, 게실, 궤양, 혈관형성이상, 장염(염증성 장질환, 결핵성 장염, 감염성 장염 등)과 종양이다. 대변 잠혈 검사는 비용이 적게 들고, 비침습적일 뿐 아니라 내시경에서 접근하지 못하는 부위에서도 출혈이 있는지 알 수 있고, 위염, 십이지장염과 같은 염증이 단순한 흡수 장애 외 출혈을 동반되고 있는지도 감별할 수도 있는 검사이기 때문에 매우 유용하다. 철분약제 복용시 위양성이 있다는 주장이 있으나 철분 복용 때문이 아니고 출혈 포커스를 찾지 못하는 환자일 확률이 더 높으니 양성으로 나온다면 반드시 위장관 출혈 검사를 진행하는 것이 좋다. 주의할 점은 대변 잠혈 검사는 위음성이 있어 한 차례 검사하는 것보다는 몇 차례 반복적으로 검사를 하여야 한다. 약물 관련 병력, 특히 출혈 위험도를 높이는 항혈소판제, 스테로이드, 비스테로이드항염증제, 항응고제 복용을 반드시 확인하여야 한다. 이런 약제를 복용 중인 환자들 중에는 대변 잠혈 검사에서는 양성으로 나오지만 여러 번의 위내시경 및 대장내시경 검사를 비롯하여 캡슐 내시경을 하여도 출혈 포커스를 결국 찾지 못하는 경우가 있다(obscure source). 이런 경우는 경과 관찰을 하는 수밖에 없고 빈혈이 갑자기 심해지면 다시 출혈 위치를 찾는 반복적인 노력을 하여야 한다.
주기적인 월경을 하고 있는 젊은 여성의 경우는 모두 내시경을 할 필요는 없다. 대신 만성적인 출혈을 시사하는 증상 및 소화기 증상에 대해서 문진하여, 필요시 내시경 및 대변 잠혈 검사를 한다. 특히 젊은 여성 환자는 치핵 출혈과 같은 항문 출혈을 잘 이야기하지 않는 경우가 많기 때문에 문진에 꼭 포함하여야 한다. 월경 과다가 있는 경우 산부인과 진찰이 필수적이다.
그 외 철 소실은 투석 중 혈액 소실, 용혈을 통한 헤모글로빈 소실 그리고 혈뇨가 있다. 따라서 투석 환자, 용혈 환자, 그리고 혈뇨 환자는 철 관련 검사를 진행하여야 한다. 의심만 한다면 진단이 어렵지 않지만 이런 환자는 소구성 빈혈이 아니기 때문에 철결핍빈혈 동반을 놓치기 쉽다. 적혈구형성인자를 투여하는 환자의 경우 기능적 철결핍이 있기 때문에 적혈구형성인자 치료 반응이 미진한 경우 혈청 페리틴이 낮지 않더라도 주사 철을 투여하여야 한다.
철 소실과 함께 철결핍의 중요한 원인 중 하나는 흡수 장애이다. 흔히 놓치기 쉬운 원인이기 때문에 정확하고 자세한 문진이 필요하다. 먹는 음식을 통한 철 흡수를 위해서는 위산이 필요하고 철은 주로 십이지장에서 흡수되기 때문에 위나 십이지장에 질환이 있거나 수술한 경우 흡수 장애를 초래할 수 있다. 흡수 장애가 의심되는 내시경적 소견으로는 위염, 특히 헬리코박터 감염 위염과 위축성 위염이 있고, 위 또는 십이지장 수술 소견(위절제술이나 십이지장 우회 수술)이 있다. 만성 위축성 위염의 원인이 되며 철 흡수에 필요한 위산을 억제하는 위산분비억제약물 복용이 지속적으로 있었는지 물어보아야 한다[6]. 그 외 심부전 환자의 경우 만성 염증뿐 아니라 철 흡수 장애를 동반하여 철결핍이 생긴다고 보고되고 있어 심부전 여부를 파악하여야 한다[7,8].
철 함유 음식 섭취 부족은 노인과 채식주의자에서 철결핍빈혈을 일으키는 원인이 되므로 식생활에 관한 문진을 잘 하여야 하고, 성장이 빠른 신생아 및 청소년기는 생리적 요구량에 비해 상대적인 섭취 부족이 원인이 되니 전형적인 빈혈증상이 아닌 피곤함, 이식증(pica)과 같은 비특이적인 증상이 있으면 철결핍을 의심하여 혈색소 및 페리틴 검사를 진행하는 것이 바람직하다.
Helicobacter pylori 감염과 철결핍빈혈
Helicobacter pylori 감염은 위장관 출혈을 일으키거나, 위산 조성의 변화를 일으켜 철의 흡수를 억제시키거나 세균 자체가 철을 직접 이용하기 때문에 철결핍빈혈을 일으킬 수 있다. 메타분석에 의하면 헬리코박터 감염된 환자는 감염되지 않은 사람에 비해 철결핍빈혈 위험도가 2.8배가 된다고 보고하였고[9], 헬리코박터의 제균이 철 흡수를 올리고 철결핍빈혈 치료에 도움이 되며[10], 경구 철 치료에 불응 환자에서 헬리코박터 제균 치료를 통해 좋은 치료 효과를 얻었다고 하였다[11-13]. 제균에 의한 철결핍빈혈의 호전 효과는 특히 빈혈이 심한 환자에서 뚜렷하였다[14,15]. 이러한 연구 결과들은 철결핍빈혈 환자에서 헬리코박터 감염을 검사 및 제균요법이 철결핍의 치료 및 재발 방지에 도움이 된다는 것을 시사하고 있다. 저자의 경험에 의하면 철 보충 없이 제균요법만으로는 철결핍 개선이 매우 느리거나 없기 때문에 철 보충을 같이 시행하는 것을 추천한다.
철 보충 치료
수혈
철결핍 환자의 대부분은 빈혈이 심하지 않고 경구 또는 주사 철 투여에 교정되기 때문에 수혈이 필요하지 않는다. 하지만 생체 징후가 불안정한 심부전, 심허혈, 호흡부전 그리고 혈압 저하를 보이는 환자는 주사 철 투여로도 빈혈을 빠르게 교정시킬 수 없기 때문에 반드시 수혈로서 빈혈을 개선시켜야 한다. 단, 노인 심부전 환자의 경우 한꺼번에 많은 양의 수혈은 갑작스런 체액증가를 일으켜 호흡부전을 악화시키거나 심정지를 일으킬 수 있기 때문에 수혈 속도에 주의를 하여야 한다.
정맥 주사 치료
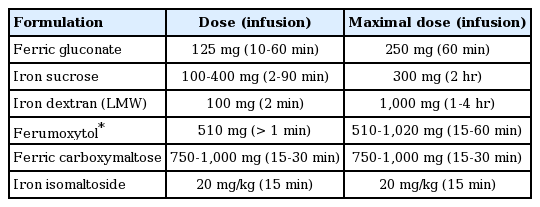
1954년 첫 주사 철 제제인 high molecular weight iron dextran (HMWID)는 출시된 이후 심각한 부작용이 종종 보고되었다[16,17]. Labile-free iron 때문에 생기는 과민반응으로 발열 및 오한이 생기고 심한 경우 혈압이 떨어져 승압제까지 투여해야 하는 경우였다. 따라서 주사 철 투여는 환자의 활력 상태를 모니터하면서 응급상황에 대처하는 약품이 반드시 준비되어야만 가능하였고, 철결핍 개선 효과는 좋았지만 이런 과민반응으로 인해 주사 철 제제는 경구 제제를 사용할 수 없는 환자에서만 투여되어 왔다. 1991년 더 이상 HMWID는 만들어지지 않게 되고, low molecular weight iron dextran (LMWID)이 제조되기 시작하였다. 이후 ferric gluconate와 iron sucrose와 같은 부작용이 적은 다른 종류의 주사용 철 제제도 생산되기 시작하였다. 하지만 여전히 과거의 경험으로 인해 주사 철 투여에 두려움이 많고, 정맥 천자의 편견 때문에 아직까지도 경구 투여보다는 제한적으로 사용되고 있다. 현재 사용되고 있는 주사 철 제제와 국내에서 판매되고 있는 주사는 표 3과 같다.
LMWID를 포함한 현재 이용 가능한 주사 철 제제는 안전하다는 후속 연구가 발표되자, 경구 철보다는 더 효과적이고, 매일 장기간 복용할 필요가 없고, 소화기 부작용이 거의 없는 주사 철 제제가 유럽과 미국에서는 점차 이용이 확대되고 있다. 특히 경구 약제 부작용이 있거나 경구 약제가 효과가 없는 경우, 빠른 철결핍빈혈 개선이 필요한 경우, 만성 신질환 환자에서 적혈구형성인자를 투여하는 경우가 적응증이 된다(Table 4). 염증성 장질환 환자 역시 경구 철에 효과가 없는 경우가 많고 경구 철에 장의 염증을 악화시킬 수도 있다고 발표가 되어 주사 제제가 일차 약제로 유럽에서 권유되고 있다[18]. 그 외 경구 철 흡수가 어려운 십이지장의 우회술이 포함되거나 경구 철 제제에 소화기 부작용이 많은 위 수술을 받은 환자에서도 적응증이 된다. 최근 산부인과 영역에서도 심한 자궁출혈을 보이는 철결핍빈혈의 경우 경구 철 제제가 철 요구량을 충족시킬 수 없기 때문에 보다 효과적인 주사 제제가 권유되고 있다[19]. 하지불안증후군(restless leg syndrome)에서도 같은 기간 투여시 주사 철 제제가 효과적이고 부작용도 별로 없었다고 보고되었다[20]. 항암 치료를 받는 환자가 철 주사를 맞는 경우 목표 혈색소에 더 빠르게 도달하였고, 적혈구형성촉진인자 요구량도 줄었다고 보고하였다[21].
주사 철의 투여 경로는 정맥이다. 근육 주사는 현재 더 이상 사용되지 않는다. 근육 주사시 통증이 있고, 투여된 부위 피부가 착색이 될 수 있으며, 투여 부위의 육종(sarcoma) 발생이 보고되었기 때문이다. 정맥 주사의 가장 흔한 불편은 정맥 천자 자체와 투여 반응(infusion reaction)이다. 급성 부작용으로는 오심, 구토, 두통, 홍조(flushing), 근육통, 가려움증, 관절통, 흉부통, 등 통증 그리고 저인산혈증(hypophosphatemia)이 있으나 모두 일시적인 부작용이며 특별한 조치 없이 사라지는 것으로 알려져 있다. 우려되는 과민반응(hypersensitivity)은 매우 드물지만[22,23], 과민반응 및 사망이 전혀 없는 것은 아니다[24]. 정맥 주사를 투여한 경우 감염에 취약해진다는 보고가 있어 감염 기간 동안 주사 치료는 가능한 피하는 것으로 권유되고 있고[25], 임신 초기의 안전성이 연구되지 못하였기 때문에 임신 초기는 피하는 것이 좋다. 또한 철약제의 과민반응 과거력이 있는 경우 금기이다[26]. 철 주사 투여에 과민반응 및 쇼크는 HMWID에서 보고되었고 이후 약제에는 거의 보고되지 않고 있으나 각 주사 제제에 따라 권유되는 주입속도와 용량을 지키는 것이 바람직하겠다(Table 3). LMWID의 경우는 주사 투여 후 사망률이 가장 낮은 것으로 되어 있으나 HMWID와 같이 덱스트란이 함유되어 있기 때문에 시험 투여(test dose)를 권유하고 있다[24]. 주사 철 투여 전 항히스타민의 선처치는 오히려 항히스타민 자체가 혈압을 낮추는 경우가 있어 철 투여로 인한 과민반응으로 오인되어 불필요한 처치 및 승압제 투여까지 될 수 있어 권유하지 않고 있다[27].
주사 철의 총 투여 용량은 빈혈을 교정하기 위한 양과 저장을 위한 양(500-1,000 mg)을 더하여 결정한다. 흔히 사용하는 계산식은 body weight in kilograms × 2.3 × hemoglobin deficiency (target hemoglobin level − patient hemoglobin level) + 500 to 1,000 mg이다. 경구 철은 체내 철이 충분한 경우 흡수가 거의 되지 않기 때문에 철 과다가 생기지 않지만, 주사 철은 주입한 양 그대로 체내에 남게 되므로 필요 이상 투여시 이차성 혈색소증(secondary hemochromatosis)이 생겨 간부전, 심부전 그리고 내분비 장애가 생길 수 있으니 혈청 페리틴이 500 ng/mL (mcg/L)를 넘지 않도록 주의하여야 한다.
경구 치료
경구 철은 대부분의 철결핍빈혈 환자의 1차 치료 선택이다. 가장 좋은(gold standard) 경구 철은 가격이 싸고 생체이용률(bioavailability)이 높은 ferrous sulfate이다. 다른 경구 철화합물로는 iron fumarate, iron gluconate, carbonyl iron 그리고 polysaccharide-iron complex 등이 있다. 권장 용량은 철 성분으로써 100-300 mg/day을 2-3차례 나누어 공복에 복용한다. 처방시 철 성분(elementary iron) 함량으로 용량을 계산하여야 하며, 일부 약제는 국내 보험 급여 용량대로 처방하면 투여해야 할 용량에 미치지 못하는 경우도 있으니 확인하여야 한다. 경구 철 약제는 복용시 철의 산화 성질로 인하여 위장관 점막을 자극하기 때문에 소화불량, 오심, 구토, 복통, 변비 등의 부작용이 생길 수 있다. 한 보고에 의하면 최대 70%의 환자에서 위장관 부작용이 있다고 하였다[28]. 부작용은 약 용량과 비례하니 부작용이 심하면 감량할 수 있다. 공복 복용시 철의 흡수가 잘 되지만 위장관 부작용도 더 잘 생기므로 위장관 부작용이 있다면 식후 또는 식사와 함께 복용할 수도 있다. 서방정 약제는 철이 주로 흡수되는 십이지장을 지나쳐 흡수가 잘 되지 않기 때문에 권유되지 않고 있지만 상부 위장 부작용이 적어 사용되고 있다
결 론
철결핍빈혈은 가장 흔히 볼 수 있는 빈혈로 연령, 성별 그리고 과거 수술력에 따라 원인이 각각 다르기 때문에 정확한 문진과 검사를 통해 원인을 찾아서 교정하는 것이 중요하다. 가임기 여성의 경우 소화기 증상이 없으면 내시경을 반드시 할 필요는 없지만 그 외의 경우, 소화기 출혈이 가장 흔한 원인이기 때문에 내시경 및 대변 잠혈 검사를 시행한다. 출혈이 명확하지 않은 환자의 경우 흡수 장애의 원인이 되는 헬리코박터 감염을 확인하고 제균하는 것이 치료 및 재발 방지에 도움이 된다. 원인 교정과 함께 철 보충을 해야 한다. 경구 치료는 장기간의 치료 기간이 필요하고 소화기 부작용이 흔한 반면, 정맥 철 투여는 소화기 부작용이 없고, 짧은 시간에 철겹핍을 교정시킬 수 있어 적응증이 되는 환자에서는 적극적으로 사용하여야 한다. 주사 부작용은 대부분 일시적이지만 권유되는 용량, 투여 속도 그리고 시험 투여 여부를 잘 지키는 것이 중요하다.