침습성 거대프로락틴분비종양으로 발현된 다발내분비샘종양1형 1예
Multiple Endocrine Neoplasia Type 1 Presenting with an Invasive Giant Prolactinoma
Article information
Abstract
뇌하수체 종양은 MEN1 환자의 15-50%에서 발생하나 거대 프로락틴분비종양으로 최초 임상 발현한 MEN1 증례는 국내에서 아직까지 보고된 바 없다. 본 증례에서 저자들은 크기가 큰 두개저부 종양으로 내원한 여자 환자에서 high-dose hook effect로 인해 진단이 지연되어 방사선 치료를 시행한 후 거대 프로락틴분비종양과 부갑상샘항진증을 발견하여 MEN1을 진단하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Pituitary tumors occur in 15-50% of patients with multiple endocrine neoplasia of type 1 (MEN1). To the best of our knowledge, no MEN1 case in which the initial lesion was an invasive giant prolactinoma has been reported from Korea. We describe a patient in whom a skull-base tumor involved the sellar and parasellar spaces. A 49 year-old female presented with headache and diplopia. The tumor was ultimately identified as a giant prolactinoma; the serum prolactin concentration increased from 155.6 ng/mL to 3,234.3 ng/mL after cranial irradiation. She was evaluated in terms of incidental hypercalcemia and was found to have parathyroid hyperplasia. Genetic analysis revealed a missense mutation in the MEN1 gene (c.643G>A, p.Val215Met). Two years of treatment with a dopamine agonist reduced, but did not normalize, the serum prolactin concentration. We highlight the aggressive behavior of the giant skull-base tumor, and the diagnostic delay caused by a high-dose hook effect of the MEN1-related prolactinoma.
서 론
다발내분비샘종양1형(multiple Endocrine neoplasia type 1, MEN1)은 뇌하수체, 췌장, 부갑상샘 중 두 개 이상의 내분비샘에서 종양 또는 증식이 한 환자에서 발생하는 질환을 말한다. 상염색체 우성으로 유전되며 염색체의 11q13에 위치한 MEN1 유전자의 돌연변이와 연관되어 있다. MEN1 환자 중에 뇌하수체 종양이 발생하는 경우는 약 15-50%로 다양하게 나타나며, MEN1 연관 뇌하수체 종양 중에 약 60%에서 프로락틴, 25% 미만에서 성장호르몬, 5%에서 부신겉질자극호르몬을 분비하고 나머지는 비기능성이며, 85%가 직경 1 cm 이상의 큰샘종이라고 알려져 있다[1]. 거대프로락틴분비샘종은 1) 종양의 직경이 4 cm 초과, 2) 혈청 프로락틴 > 1,000 ng/mL, 3) 고프로락틴혈증과 종양 효과로 인해 임상적 증상이 유발된 경우 진단할 수 있다[2]. 현재까지 거대프로락틴분비종양으로 최초 발현한 MEN1은 국외에서 몇 가지 증례[3,4]가 보고되었지만 국내에서는 아직 보고된 바 없다.
저자들은 두통과 복시 증상으로 내원한 49세 여자가 뇌 자기공명영상 검사에서 두개저부 종양이 발견되어 방사선 치료를 받았고, 그 이후에 혈청 프로락틴이 3,234 ng/mL로 증가하고 부갑상샘증식증(parathyroid hyperplasia)이 동반된 것이 발견되어 MEN1로 진단받은 증례를 경험하였다. 이에 high-dose hook effect로 진단이 지연된 거대프로락틴분비종양으로 임상 발현한 MEN1 1예를 보고하는 바이다.
증 례
환 자: 49세 여자
주 소: 두통, 복시
현병력: 내원 10년 전부터 간간히 두통 증상이 있었고, 내원 2년 전부터 두 달 간격으로 오른쪽 관자 부위의 심한 두통 증상이 반복되었다. 두통과 함께 안구 주변 부위와 오른쪽 안면 부위의 통증 및 복시 증상이 새롭게 나타나 신경외과를 방문하였다. 뇌 자기공명영상 검사에서 4.4 cm의 두개저부 종양이 발견되었고, 두개저부에 종양의 광범위한 침범을 보이고 있어 수술이 힘든 뇌막기원 종양으로 판단되어 방사선 치료(총 방사선량 5,000 cGy, 25분획)를 시행받았다. 치료 종료 8개월 후 시행한 검사에서 혈청 프로락틴 농도가 치료 전 155.6 ng/mL에서 3,234 ng/mL로 증가되는 양상을 보여 진료 의뢰되었다. 환자는 내원 당시 유즙 분비를 호소하지 않았고 그 이후 치료를 받는 중에도 나타나지 않았다.
과거력: 내원 1년 전 폐경 상태가 되었고, 불임으로 자녀가 없었다. 폐경 이전 유즙 분비가 있었지만 원인을 찾기 위한 검사는 받지 않았다.
가족력: 환자는 6남매 중 다섯째이고, 남매들 중 종양으로 수술받은 사람은 없었다. 첫째 언니가 유즙 분비 증상을 보여 시행받은 혈액 검사에서 고프로락틴혈증이 확인되었고, 감별진단을 위한 추가 검사를 권유하였으나 거부하였다.
신체 검사 소견: 내원 당시 혈압 120/80 mmHg, 맥박수 72 회/분, 호흡수 18 회/분, 체온 36.7도였고 의식은 명료하였으며, 지남력, 기억력, 언어 능력에는 이상이 없었다. 동공빛반사 검사, 외안근 검사, 안면 운동신경과 감각신경 검사에서 정상 소견을 보였다. 목젖과 혀는 정중선을 유지하고 있었고, 구역반사는 정상이었다. 무릎과 발목의 심부건반사, 상지와 하지의 감각신경 검사와 근력은 모두 정상이었다. 안과 검진상 시야 검사에서 시야 결손과 시야 장애는 없었고, 안저 검사상 시신경에 이상 소견은 없었다.
검사실 소견: 혈청 생화학 검사에서 혈당 87 mg/dL (70-99), 총콜레스테롤 264 mg/dL (≤ 200), 아스파르테이트아미노전달효소 20 IU/L (8-38), 알라닌아미노전달효소 19 IU/L (4-43), 알칼리성인산분해효소 71 IU/L (35-104), 총 단백 7.2 g/dL (6.5-8.3), 알부민 4.8 g/dL (3.5-5.2), 요소질소 11.2 mg/dL (6-20), 크레아티닌 0.6 mg/dL (0.5-0.9), 칼슘 10.8 mg/dL (8.6-10.2), 인 3.0 mg/dL (2.7-4.5)였다. 갑상샘 기능 검사상 갑상샘자극호르몬 1.13 uIU/mL (0.15-5.0), 유리 티록신 1.43 ng/dL (0.8-2.0)였고, 방사선 치료 전 기저 뇌하수체 호르몬 검사상 프로락틴 155.60 ng/mL (3.60-18.90), 부신겉질자극호르몬 40.90 pg/mL (10-60), 코르티솔 3.30 μg/dL (5-25), 난포자극호르몬 1.33 mIU/mL (폐경기 20.0-126.0), 황체형성호르몬 0.15 mIU/mL 이하(폐경기 11.0-50.0), 성장호르몬 2.22 ng/mL (성인 여성 0-10.70), 인슐린유사성장인자-I 213.5 ng/mL (68.6-416.5)였다. MEN1 진단 후 시행한 혈청 생화학 검사에서 공복 인슐린 2.2 uU/mL (2.6-24.9), 가스트린 18.54 pg/mL (< 90)였다.
방사선학적 소견: 뇌 자기공명영상 검사상 터키안내, 안장위, 안장옆 공간과 오른쪽 해면정맥굴, 다리뇌앞수조 부위를 침범하고 있는 44 × 30 × 20 mm 크기의 조영 증강되는 고형 낭성 종양이 관찰되었다(Fig. 1).

Brain T1-weighted magnetic resonance imaging. A 4.4-cm-diameter enhancing, solid cystic mass (arrow) involving the intrasellar, suprasellar, and parasellar spaces; the right cavernous sinus; and the prepontine cisterna, is evident.
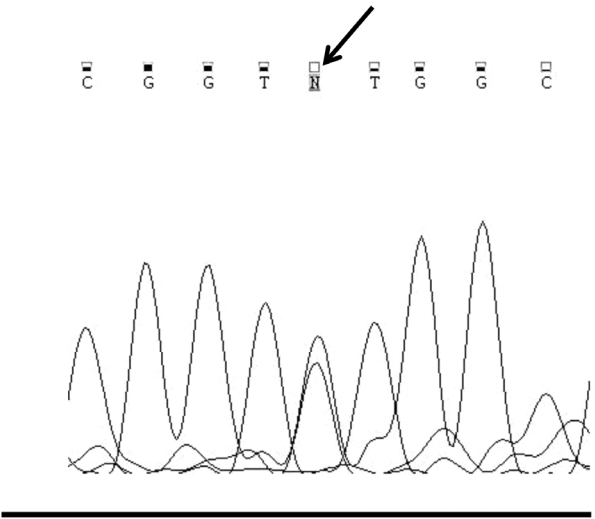
치료 및 경과: 이상의 결과를 통하여 high-dose hook effect로 인해 내원 당시 혈청 프로락틴 농도가 실제에 비해 낮게 측정된 침습성 거대프로락틴분비종양으로 진단하고 bromocriptine 10 mg으로 치료를 시작하였다. 이차성 골다공증을 배제하기 위해 시행한 골밀도 검사상 1-4번 요추의 T score가 -2.5로 골다공증 소견을 보였고 혈청 칼슘 농도가 높아 추가적으로 검사한 부갑상샘호르몬 농도가 105.2 pg/mL (14-72)로 증가되어 있어 부갑상샘 스캔 검사를 시행하였다(Fig. 2). 검사 결과 양측 아래쪽 부갑상샘 부위의 섭취가 보이고 경부 초음파 검사와 경부 전산화단층촬영 검사에서 해당 부위에 결절이 관찰되어 부갑상샘증식증(parathyroid hyperplasia)이 의심되었다. MEN1 진단을 위한 유전자 검사와 복강내 장기의 종양 여부를 확인하기 위한 복부 전산화단층촬영 검사를 시행하였다. MEN1의 원인 유전자인 MEN1 유전자의 염기서열을 분석하였고, 그 결과 MEN1 단백질의 215번째 아미노산 발린을 메티오닌으로 치환하는 MEN1 유전자의 과오돌연변이(c.634G>A, p.Val215Met)가 발견되었다(Fig. 3). 복부 전산화단층촬영 검사상 췌장 및 부신을 비롯한 복강내 장기의 종양 소견은 없었다(Fig. 4). 부갑상샘기능항진증 치료를 위한 부갑상샘 전절제술과 부갑상샘 일부 자가이식술 및 흉선 유암종 예방을 위한 흉선 절제술을 시행하였고 수술 후 병리 검사에서 좌우측 부갑상샘이 각각 크기 2.2 × 1.0 × 0.6 cm, 무게 0.9 g과 크기 2.2 × 1.0 × 0.6 cm, 무게 0.8 g으로 부갑상샘증식증이 확인되었다. 수술 후 혈청 칼슘 농도의 감소를 보여 경구 칼슘보충제 복용을 시작하였다. 부갑상샘 전절제술 및 전완부 자가이식술 시행 후 6개월째 혈청 칼슘 농도는 8.7 ng/dL (8.6-10.2), 부갑상샘 호르몬 농도는 28.8 pg/mL (14-72)로 경구 칼슘보충제는 감량 중이다.

Parathyroid gland scintigraphy using 99mTc-MIBI. In the delayed (3-h) image, abnormal accumulation of radioactivity is evident in the inferior aspects of both.

An abdominal computed tomography scan. No mass is evident in the pancreas, the liver, the gallbladder, the adrenal glands, or either kidney.
거대프로락틴분비종양에 대해 도파민 작용제 치료를 시작한 후 22개월째 혈액 검사에서 혈청 프로락틴 농도는 668.52 ng/mL로 감소하였으나(Fig. 5) 안장 부위 자기공명영상 검사에서 종양의 크기는 변화가 없었다. 약물 치료 시작 후 2년 뒤 주당 cabergoline 2 mg으로 약제를 변경하였고, 혈청 프로락틴 농도가 높은 상태를 보이고 있어 cabergoline의 용량을 주당 3 mg으로 증량하여 복용 중이다. 방사선 치료 18 개월 후 시행한 신속 부신겉질자극호르몬 검사에서 부신겉질자극호르몬 250 µg 정주 후 혈청 코티솔은 25.90 ug/dL까지 상승하였고 방사선 치료 25개월 후 시행한 기저 뇌하수체 호르몬 검사에서 부신겉질자극호르몬 73.30 pg/mL (10.0-60.0), 코르티솔 18.40 ug/dL (5-25), 갑상샘자극호르몬 1.21 uIU/mL (0.15-5.0), 유리티록신 0.921 ng/dL (0.8-2.0), 난포자극호르몬 0.30 mIU/mL (폐경기 27.7-93.3), 인슐린유사성장인자-I 103.0 ng/mL (87-238)로 뇌하수체 기능저하증으로 인한 호르몬 보충 요법은 아직 시행받지 않고 있다.
고 찰
MEN1은 임상적으로는 연관된 주요 내분비 종양(부갑상샘종, 위장관-췌장 신경내분비종, 뇌하수체샘종) 중 두 가지 이상이 있거나 유전학적으로는 아직 임상적으로 종양이 발생하지 않았더라도 MEN1 유전자 돌연변이를 가지고 있는 경우 진단할 수 있으며 MEN1이 임상적으로 진단된 환자의 직계 가족에서 하나 이상의 MEN1 연관 종양이 있을 경우 가족성 MEN1로 진단할 수 있다[1]. 환자의 첫째 언니가 고프로락틴혈증이 확인되었고 이후 진단적 검사를 거부하여 확인할 수 없었으나 영상 검사에서 뇌하수체샘종이 확인된다면 본 증례는 가족성 MEN1로 진단할 수 있다. 본 증례에서는 MEN1 유전자의 세 번째 엑손 215번째 코돈에서 과오돌연변이(c.634G>A, p.Val215Met)가 발견되었고 Choi 등[5]이 보고한 국내 MEN1 증례에서도 동일한 유전자 돌연변이가 확인된 바 있다. 위 증례의 환자는 흉선 유암종으로 최초 임상 발현하여 수술을 시행받았고 이후 부갑상샘항진증, 췌장의 비기능성 내분비 종양이 발견되어 MEN1로 진단받았다. 본 증례와 동일한 유전자 돌연변이를 가지고 있었음에도 불구하고 이 환자에서는 혈청 프로락틴 농도는 증가해 있었으나 뇌하수체 자기공명촬영에서 뇌하수체 종양은 발견되지 않아 본 증례의 환자와 임상 증상 발현에 차이가 있었다. 이것은 다발내분비샘종1형에서 유전형과 표현형 사이에는 명백한 상관관계가 없다는 기존 연구에서 잘 알려진 사실에 부합하는 결과이다[5,6].
MEN1에서는 부갑상샘종으로 인한 부갑상샘기능항진증이 가장 흔한 임상 증상으로 50세가 되면 거의 100%에 가까운 유병률을 보이며 대부분의 MEN1 환자의 최초 임상 증상도 부갑상샘종으로 인한 경우가 많다[1]. 반면 유럽에서 시행된 한 연구에 의하면 전체 MEN1 환자 중 17%가 뇌하수체 종양으로 최초 임상 발현을 하였고 42%의 환자에서 뇌하수체 종양이 발생하였다[6]. 위 연구에서는 MEN1 환자에서 발생한 뇌하수체 종양과 MEN1과 무관하게 발생한 뇌하수체 종양을 비교하였는데 MEN1 연관 뇌하수체 종양이 큰샘종인 경우가 더 많고(85% vs. 42%) 이 중 32%가 침습성 종양이었으며 호르몬 분비 종양의 경우 치료 후에 정상화되는 경우가 더 적었다(42% vs. 90%) [6]. MEN1에서 발생하는 뇌하수체 종양이 크기가 크고 공격적인 양상을 보이는 것과 프로락틴분비종양이 그 대부분을 차지하는 것은 잘 알려져 있으나 본 증례와 같이 직경이 4 cm 이상인 침습성 거대프로락틴분비종양이 발생하는 빈도가 얼마나 되는지에 대해서는 알려져 있지 않으며 국외에 몇 가지 증례만이 보고될 정도로 드문 것으로 생각된다.
Khare 등[3]이 본 증례와 유사하게 침습성 거대프로락틴분비종양으로 최초 임상 발현한 MEN1의 증례를 두통, 안구돌출, 시야 장애로 내원한 29세 남자를 보고하였는데 이 보고에서는 본 증례에서와 같이 뇌하수체 종양 발견 당시 시행한 선별 검사에서 혈중 칼슘 농도가 상승된 것을 발견하고 MEN1 유전자 검사를 시행하였다. 위 증례의 환자는 도파민 작용제에 대한 치료 반응이 좋아 카버골린 투약 1년 만에 혈청 프로락틴 농도가 32,000 ng/mL에서 55.85 ng/mL까지 감소하였으며 종양의 크기도 감소하고 안구돌출도 호전을 보였다. 반면 두통과 시력 감소로 내원한 11세 남아에서 발견된 뇌하수체 종양의 증례 보고에서는 소아의 뇌하수체 종양이 드물다는 점과 가족력상 프로락틴분비종양이 있다는 점에서 유전 질환이 의심되어 MEN1 유전자 검사를 시행하였고 MEN1로 진단받았다. 이 증례에서는 침습성 거대프로락틴분비종양이 도파민 작용제를 계속 증량하였음에도 불구하고 악화되어 여러 차례 수술을 시행해야만 하였다[4].
종양 직경 4 cm 이상, 혈청 프로락틴 농도 1,000 ng/mL 이상의 조건을 만족하고 임상 증상을 동반하는 거대프로락틴분비종양은 여성에서보다 남성에서 더 많이 발생하며 여성에서 발생할 경우 진단 당시 연령이 남성에 비해 높은 것으로 알려져 있다[7]. 도파민 작용제에 대한 반응은 보고에 따라 다르지만 대부분 도파민 작용제로 치료하면 프로락틴 농도와 종양 크기가 감소하고 임상 증상도 호전되므로 도파민 작용제 특히 카버골린이 1차 치료약제로 추천된다[8,9]. 본 증례는 뇌하수체 종양에 대해 방사선 치료를 시행한 후 2년간 도파민 작용제를 사용하였으므로 치료 효과가 방사선에 의한 것인지 약물에 의한 것인지 구분하기는 힘들다. 치료 후 종양 크기는 유의한 감소를 보이지는 못했고 프로락틴 농도는 감소하였으나 정상화되지는 못한 것으로 보아 일반적인 프로락틴 거대선종에 비해 치료반응이 좋지는 않은 것으로 생각되며 MEN1에서 뇌하수체 종양이 더 공격적이고 치료반응이 좋지 못한 것을 고려할 때 향후 임상 경과를 유의해서 지켜볼 필요가 있다.
여성에서 거대프로락틴분비종양이 발생하는 경우 고프로락틴혈증으로 인한 무월경, 유즙 분비 등의 임상 증상이 나타난 후 바로 진단되는 경우가 드물고 대부분 종양의 압박 효과로 인한 두통이나 시각이상으로 진단되기 때문에 2-30년 정도의 진단 지연이 흔하다[7]. 본 증례의 환자도 폐경 이전 유즙 분비, 불임 등 고프로락틴혈증을 시사하는 증상이 있었으나 바로 진단되지 못하고 뇌하수체 종양으로 인한 압박증상이 나타나 진단되었다. 고프로락틴혈증의 증상이 심하지 않을 수도 있고 그와 비슷한 증상을 유발할 수 있는 다양한 임상 상황이 있을 수 있음을 고려할 때 크기가 큰 두개저부 종양이 발견된 경우 연령이나 증상과 무관하게 프로락틴분비종양의 가능성이 배제되어야 한다.
혈중 프로락틴 농도를 측정하는 방법으로 면역방사계수측정법(immunoradiometric assay)이 흔히 사용된다. 이는 정확도와 민감도가 높고, 검사 결과가 빨리 나온다는 장점이 있는 반면에 측정하려는 물질의 항원 농도가 높게 될 경우 항원-항체 결합 반응의 장애로 결과 수치가 오히려 낮게 측정되는 high-dose hook effect가 나타나는 단점을 가지고 있다[10]. 본 증례와 같이 거대프로락틴분비종양의 가능성을 배제해야 하는 상황에서는 검체를 희석하여 정확한 프로락틴 수치를 측정해야만 high-dose hook effect로 인해 진단이 지연되어 적절한 치료를 받지 못하는 일을 피할 수 있다.
침습성 거대프로락틴분비종양은 전체 뇌하수체 종양의 일부에 불과하고 본 증례와 같이 MEN1이 동반되는 경우는 외국의 증례보고만 있고 국내에서는 아직까지 보고된 바 없다. 본 증례와 같이 터키안을 침범하는 크기가 큰 두개저부 종양이 발견된 경우 프로락틴 거대선종의 가능성을 배제해야 하며 침습성 거대프로락틴분비종양이 진단된 환자에서 혈청 칼슘 농도의 증가가 있을 경우 가족력을 주의 깊게 조사하고 MEN1 유전자 검사를 고려해야 한다. MEN1에서 발생하는 뇌하수체 종양은 크기가 크고 공격적이며 약물 치료에 대한 반응이 좋지 않은 경향을 보이므로 이 경우 적절한 치료가 무엇인지에 대해서는 향후 더 많은 임상 자료를 통해 연구해야 할 필요가 있다.