 |
 |
| Korean J Med > Volume 91(2); 2016 > Article |
|
мҡ”м•Ҫ
лӘ©м Ғ
м Җмһҗл“ӨмқҖ кіЁлӢӨкіөмҰқ м№ҳлЈҢлҘј л°ӣм§Җ м•Ҡкі мһҲлҠ” лҘҳл§ҲнӢ°мҠӨкҙҖм Ҳм—ј нҷҳмһҗл“Өм—җм„ң кіЁлӢӨкіөмҰқмқҳ мң„н—ҳ мҡ”мқёкіј кіЁл°ҖлҸ„ кІҖмӮ¬мқҳ м Ғм Ҳн•ң к°„кІ©мқ„ м•Ңм•„ліҙкі мһҗ н•ҳмҳҖлӢӨ.
л°©лІ•
BMD мёЎм •мқ„ л‘җ лІҲ мқҙмғҒ мӢӨмӢңл°ӣкі , кіЁлӢӨкіөмҰқмқ„ 진лӢЁл°ӣм§Җ м•ҠмқҖ 40м„ё мқҙмғҒмқҳ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗ 511лӘ…мқ„ нӣ„н–Ҙм ҒмңјлЎң мЎ°мӮ¬н•ҳмҳҖлӢӨ. мқҙл“Өмқ„ кё°м Җм№ҳ BMDк°Җ м •мғҒ(T-score > -1), кІҪмҰқ кіЁк°җмҶҢ(-1 вүҘ T-score > -1.5), мӨ‘л“ұлҸ„ кіЁк°җмҶҢ(-1.5 вүҘ T-score > -2), мӨ‘мҰқ кіЁк°җмҶҢ(-2 вүҘ T-score > -2.5)мқҳ 4кө°мңјлЎң 분лҘҳн•ҳмҳҖлӢӨ. к°Ғ кө°м—җм„ң 10%мқҳ нҷҳмһҗк°Җ кіЁлӢӨкіөмҰқ лҳҗлҠ” кіЁм Ҳмқҙ л°ңмғқлҗҳлҠ” кё°к°„мқ„ м¶”м •н•ҳмҳҖлӢӨ.
Abstract
Background/Aims
Osteoporosis occurs more frequently in rheumatoid arthritis (RA) patients than in healthy individuals. This study investigated the appropriate bone mineral density (BMD) measurement interval and risk factors associated with osteoporosis for RA patients.
Methods
A retrospective study was performed on 511 RA patients aged more than 40 years old who had undergone BMD testing more than once and who had normal BMD or osteopenia at the baseline BMD test and no history of any fracture of the spine or femur. The subjects were categorized into four subgroups: normal BMD (T-score > -1), mild (-1 вүҘ T-score > -1.5), moderate (-1.5 вүҘ T-score > -2), and advanced (-2 вүҘ T-score > -2.5) osteopenia. The BMD testing interval was defined as the estimated time for 10% of the RA patients to make the transition to osteoporosis without osteoporotic fracture or the administration of any osteoporosis drug.
Results
The observation period was 2,214 patient-years, with an average of 4.3 years. The estimated BMD testing interval was more than 10 years for normal, 4.3 years for mild, 2.5 years for moderate, and 1.5 years for advanced osteopenia in each of the RA patient groups.
Conclusions
Our study indicated that in normal or osteopenic RA groups, a baseline BMD T-score is the most important factor in estimating the interval in which osteoporosis is predicted to occur. In addition, we recommend that the BMD measuring interval should be greater than 10 years in normal BMD RA patients, 4 years in mild, 2 years in moderate, and 1 year in advanced osteopenic RA patients on the basis of L-spine BMD.
кіЁлӢӨкіөмҰқмқҖ лӮ®мқҖ кіЁл°ҖлҸ„мҷҖ кіЁмЎ°м§Ғмқҳ лҜём„ёкө¬мЎ°мқҳ м•…нҷ”лҘј нҠ№м§•мңјлЎң н•ҳл©°, кіЁк°•лҸ„мқҳ м Җн•ҳ л°Ҹ кіЁм ҲлҘ мқҳ мҰқк°ҖлҘј к°Җм ёмҳ¬ мҲҳ мһҲлҠ” м „мӢ м Ғмқё кіЁм§ҲнҷҳмқҙлӢӨ[1].
лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—јмқҖ м—јмҰқм„ұ кҙҖм Ҳм—јмқҙл©°, м§ҖмҶҚм Ғмқё м—јмҰқм—җ мқҳн•ҙ м „мӢ м Ғ кіЁлӢӨкіөмҰқ л°Ҹ көӯмҶҢм Ғ кіЁмҶҢмӢӨмқҙ лҸҷмӢңм—җ л°ңмғқлҗңлӢӨ. лҳҗн•ң, кіЁлҢҖмӮ¬мқҳ л¶Ҳк· нҳ•, кҙҖм Ҳмқҳ нҶөмҰқ л°Ҹ ліҖнҳ•мңјлЎң мқён•ң мҡҙлҸҷлҹү к°җмҶҢ, кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ңмқҳ мӮ¬мҡ© л“ұмңјлЎң мқён•ҙ мқјл°ҳ мқёкө¬м—җ 비н•ҙ кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳмқҳ мң„н—ҳм„ұмқҙ лҚ”мҡұ лҶ’лӢӨ[2,3].
лҢҖк·ңлӘЁ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң Haugeberg л“ұ[4]мқҳ м—°кө¬м—җм„ңлҸ„ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өмқҳ кіЁлӢӨкіөмҰқмқҳ л°ңмғқ л№ҲлҸ„лҠ” мқјл°ҳмқём—җ 비н•ҙ м•Ҫ 2л°° м •лҸ„лЎң лҶ’кІҢ лӮҳнғҖлӮ¬мңјл©°, кіЁм Ҳ мң„н—ҳмқҳ мң„н—ҳлҸ„лҸ„ кіЁм Ҳ л¶Җмң„лӮҳ м—°л №м—җ кҙҖкі„м—Ҷмқҙ нҸүк· 1.5л°° м •лҸ„ лҶ’кІҢ лӮҳнғҖлӮ¬лӢӨ. лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өмқҳ к°җмҶҢлҗң кіЁл°ҖлҸ„лӮҳ лҶ’мқҖ кіЁм ҲлҘ мқҖ кі л №, м„ұлі„, мІҙмӨ‘ м Җн•ҳ, н”јлЎңкіЁм Ҳмқҳ лі‘л Ҙ, кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ңмқҳ мӮ¬мҡ©, мӢ мІҙнҷңлҸҷ м Җн•ҳ, лҘҳл§ҲнӢ°мҠӨ мқёмһҗ м–‘м„ұ л°ҳмқ‘ л“ұкіј м—°кҙҖмқҙ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ[4].
лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өмқҳ кіЁлӢӨкіөмҰқмқҳ м„ лі„ кІҖмӮ¬мҷҖ кІҖмӮ¬л°©лІ•, 진лӢЁ мӢңм җм—җ кҙҖн•ң к¶Ңкі м•ҲмқҖ к·јкұ° мӨ‘мӢ¬мңјлЎң л°ңн‘ңлҗҳкі мһҲм§Җл§Ң, 추м Ғ кІҖмӮ¬ к°„кІ©м—җ лҢҖн•ҙм„ңлҠ” мқҳкІ¬мқҙ нҶөмқјлҗҳм§Җ м•ҠмқҖ мғҒнғңмқҙлӢӨ[1,5-9].
2011л…„ U.S. preventive services task force recommendation (USPSTF)мқҖ мҡ°м—°мҳӨм°Ё(precision error) л°Ҹ кіЁ көҗмІҙ мӢңкё°лҘј кі л Өн•ҳм—¬, мөңмҶҢ 2л…„мқҳ 추м Ғ кІҖмӮ¬ к°„кІ©мқ„ к¶Ңкі н•ҳмҳҖмқ„ лҝҗ, кіЁм Ҳ мң„н—ҳмқҳ мҳҲмёЎмқ„ н–ҘмғҒмӢңнӮӨкё° мң„н•ң к·јкұ°к°Җ мһҲлҠ” кІҖмӮ¬ к°„кІ©мқҖ м ңмӢңн•ҳм§Җ лӘ»н•ҳмҳҖлӢӨ[10].
мқҙм—җ м Җмһҗл“ӨмқҖ мқјл°ҳмқём—җ 비н•ҙ кіЁлӢӨкіөмҰқ л°Ҹ кіЁлӢӨкіөм„ұ кіЁм Ҳмқҙ лҚ” л§Һмқҙ л°ңмғқн•ҳлҠ” лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗкө°мқҳ кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳ л°ңмғқ, к·ём—җ м—°кҙҖлҗң мң„н—ҳ мқёмһҗмҷҖ нҠ№м„ұ л“ұм—җ л”°лҘё 추м Ғ кІҖмӮ¬мқҳ м Ғм Ҳн•ң мЈјкё°м—җ лҢҖн•ҙ м•Ңм•„ліҙкі мһҗ н•ҳмҳҖлӢӨ.
2005л…„ 1мӣ”л¶Җн„° 2015л…„ 1мӣ”к№Ңм§Җ 10л…„к°„ н•ң лҢҖн•ҷлі‘мӣҗ лҘҳл§ҲнӢ°мҰҳ м„јн„°лҘј л°©л¬ён•ҳм—¬ кіЁл°ҖлҸ„ кІҖмӮ¬(duel energy X-ray absorptiometry, DXA)лҘј мӢңн–үн•ң л§Ң 40м„ё мқҙмғҒмқҳ нҳҲмІӯ м–‘м„ұ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗлҠ” 1,248лӘ…мқҙм—ҲлӢӨ.
к·ёмӨ‘, мҙҲкё°кі л°ҖлҸ„ кІҖмӮ¬м—җм„ң м •мғҒ л°Ҹ кіЁк°җмҶҢмҰқмқҙл©°, кіјкұ° кіЁм Ҳмқҳ кё°мҷ•л Ҙмқҙ м—Ҷмңјл©°, м—°кө¬ кё°к°„ лҸҷм•Ҳ кіЁл°ҖлҸ„ кІҖмӮ¬лҘј 2нҡҢ мқҙмғҒ мӢңн–үн•ң 511лӘ…мқ„ лҢҖмғҒмңјлЎң нӣ„н–Ҙм Ғ кҙҖм°° м—°кө¬лҘј мӢңн–үн•ҳмҳҖлӢӨ.
1,248лӘ… мӨ‘ 737лӘ…мқҖ м ңмҷёлҗҳм—ҲлҠ”лҚ°, 536лӘ…мқҖ мқҙлҜё мқҙм „мқҳ кІҖмӮ¬м—җм„ң кіЁлӢӨкіөмҰқмқҙ 진лӢЁлҗҳм–ҙ кіЁлӢӨкіөмҰқ м№ҳлЈҢ мӨ‘мқҙм—Ҳкі , 23лӘ…мқҖ кіЁм Ҳмқҳ кё°мҷ•л Ҙмқҙ мһҲм—Ҳмңјл©°, 178лӘ…мқҖ 1нҡҢл§Ң кіЁлӢӨкіөмҰқ кІҖмӮ¬лҘј мӢӨмӢңн•ҳм—¬ м ңмҷён•ҳмҳҖлӢӨ.
м •мғҒ л°Ҹ кіЁк°җмҶҢмҰқмңјлЎң нҷ•мқёлҗң нҷҳмһҗл“Өмқҳ лі‘л Ҙкіј нқү추, мҡ”추 л°Ҹ кіЁл°ҳ, лҢҖнҮҙл¶Җ Xм„ лӢЁмҲңмҙ¬мҳҒмқ„ кІҖнҶ н•ҳм—¬ кіЁм Ҳ мң л¬ҙлҘј нҷ•мқён•ҳмҳҖмңјл©°, кіЁл°ҖлҸ„ кІҖмӮ¬лЎң мёЎм •лҗң лҢҖнҮҙкіЁ кІҪл¶Җ л°Ҹ мҡ”추 м „мІҙмқҳ T-score л°Ҹ bone mineral density (BMD) к°’мқ„ 추м Ғ кҙҖм°°н•ҳмҳҖлӢӨ.
추м Ғ кІҖмӮ¬м—җм„ң T-score -2.5 мқҙн•ҳмқҳ кіЁлӢӨкіөмҰқмқҙ л°ңмғқн•ҳкұ°лӮҳ кіЁм Ҳмқҳ л°ңмғқ, лҳҗлҠ” кіЁлӢӨкіөмҰқ м•Ҫмқ„ ліөмҡ©н•ҳлҠ” мӢңм җмқ„ мӮ¬кұҙл°ңмғқмңјлЎң м •мқҳн•ҳм—¬ 추м Ғ кҙҖм°°мқ„ мў…лЈҢн•ҳмҳҖлӢӨ.
кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳ л°ңмғқмқҳ мғҒкҙҖ мҡ”мқёмңјлЎң лӮҳмқҙ, м„ұлі„, body mass index (BMI), erythrocyte sedimentation rate (ESR), high sensitivity C-reactive protein (hs-CRP), нқЎм—° л°Ҹ мқҢмЈј, кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ң ліөмҡ©(лҲ„м Ғ ліөмҡ©лҹү, мқј нҸүк· ліөмҡ©лҹү), нҸҗкІҪ м—¬л¶Җ л“ұмқ„ кі л Өн•ҳмҳҖмңјл©°, ESR л°Ҹ hs-CRP л“ұмқҳ мғқнҷ”н•ҷм Ғ кІҖмӮ¬ кІ°кіјлҠ” DXA кІҖмӮ¬ мқјмқ„ кё°мӨҖмңјлЎң мөңк·ј 3к°ңмӣ” мқҙлӮҙмқҳ мёЎм •к°’мқ„ мӮ¬мҡ©н•ҳмҳҖлӢӨ.
мҙҲкё°кіЁл°ҖлҸ„ мёЎм • кІ°кіјлҘј л°”нғ•мңјлЎң, мҡ”추лӮҳ лҢҖнҮҙкіЁм—җм„ң к°ҖмһҘ лӮ®мқҖ к°’мқ„ кё°мӨҖмңјлЎң н•ҳм—¬ к°Ғк°Ғ м •мғҒкө°(T-score > -1) л°Ҹ кІҪмҰқ(-1 вүҘ T-score > -1.5), мӨ‘л“ұлҸ„(-1.5 вүҘ T-score > -2), мӨ‘мҰқ(-2 вүҘ T-score > -2.5)мқҳ кіЁк°җмҶҢмҰқкө°мңјлЎң лӮҳлҲ„м—ҲлӢӨ.
мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬ кІ°кіјм—җ л”°лҘё к°Ғ кө°мқҳ мқјл°ҳм Ғ нҠ№м„ұмқ„ 비көҗн•ҳкё° мң„н•ҙ көҗм°Ё 분м„қ(chi-square test) л°Ҹ мқјмӣҗл°°м№ҳ 분мӮ° 분м„қ(ANOVA)мқ„ мӢӨмӢңн•ҳмҳҖлӢӨ.
Kaplan Meier мғқмЎҙ 분м„қ л°Ҹ мғқмЎҙн‘ң 분м„қмңјлЎң нҶөн•ҙ к°Ғ кө°м—җм„ң кіЁлӢӨкіөмҰқмқҙ л°ңмғқн• кІғмңјлЎң мҳҲмёЎлҗҳлҠ” нҸүк· кё°к°„мқ„ нҷ•мқён•ҳмҳҖкі , Gourlay л“ұ[11]мқҙ л°ңн‘ңн•ҳмҳҖлҚҳ мһҗлЈҢлҘј м°ёкі н•ҳм—¬ к°Ғ кө°мқҳ 10%мқҳ нҷҳмһҗк°Җ кіЁлӢӨкіөмҰқмңјлЎң лҲ„м Ғ л°ңмғқн• кІғмңјлЎң мҳҲмёЎлҗҳлҠ” кё°к°„мқ„ м¶”м •н•ҳмҳҖлӢӨ.
кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳ л°ңмғқм—җ мҳҒн–Ҙмқ„ лҜём№ҳлҠ” мҡ”мқёмқ„ м°ҫкё° мң„н•ҙ Cox proportional hazard modelмқ„ мӮ¬мҡ©н•ҳмҳҖмңјл©°, м—°к°„ кіЁл°ҖлҸ„ к°җмҶҢмңЁ(annual BMD loss rate)кіј кіЁлӢӨкіөмҰқ кҙҖл Ё мң„н—ҳ мқёмһҗмҷҖмқҳ мғҒкҙҖм„ұмқ„ кІҖмҰқн•ҳкё° мң„н•ҙ Pearson мғҒкҙҖ 분м„қ л°Ҹ лҸ…лҰҪ t-кІҖм •мқ„ мӢӨмӢңн•ҳмҳҖлӢӨ.
лӘЁл“ нҶөкі„м№ҳмқҳ мң мқҳмҲҳмӨҖмқҖ p< 0.05 мҲҳмӨҖм—җм„ң мӢӨмӢңлҗҳм—Ҳмңјл©°, ліё м—°кө¬м—җм„ң мҲҳ집лҗң мһҗлЈҢмқҳ нҶөкі„мІҳлҰ¬лҠ” IBM SPSS Statistics Version 19 (IBM, New York, NY, USA)мқ„ мқҙмҡ©н•ҳмҳҖлӢӨ.
кІҖмӮ¬м—җ мӮ¬мҡ©лҗң DXA мёЎм • мһҘ비лҠ” Lunar Prodigy Advance (GE Medical Systems Lunar, Milwaukee, WI, USA)мҳҖмңјл©°, мқҙ мһҘ비лЎң мёЎм •лҗң к°’мқ„ кё°мӨҖмңјлЎң н•ҳмҳҖлӢӨ.
мҙқ кҙҖм°° кё°к°„мқҖ 2,214мқёл…„(patient-year)мқҙм—Ҳмңјл©°, к°ңмқёлӢ№ нҸүк· 4.3л…„мқҙм—ҲлӢӨ.
мҙҲкё°кіЁл°ҖлҸ„ кІ°кіјм—җ л”°лҘё к°Ғ кө°мқҳ мқјл°ҳм Ғ нҠ№м„ұмқ„ 비көҗн•ң кІ°кіјлҠ” н‘ң 1кіј к°ҷлӢӨ. мӨ‘л“ұлҸ„ л°Ҹ мӨ‘мҰқ кіЁк°җмҶҢмҰқкө°мқҙ м •мғҒкө°м—җ 비н•ҙ нҸүк· м—°л №мқҙ мң мқҳн•ҳкІҢ лҶ’м•ҳмңјл©°, мІҙмӨ‘ л°Ҹ BMIк°Җ мң мқҳн•ҳкІҢ лӮ®м•ҳлӢӨ. лҳҗн•ң нқЎм—° л°Ҹ нҸҗкІҪмқё кІҪмҡ°мқҳ 비мңЁлҸ„ мң мқҳн•ҳкІҢ лҶ’м•ҳлӢӨ.
к°Ғ кө°м—җм„ңмқҳ кіЁлӢӨкіөмҰқ л°ңмғқ л°Ҹ кіЁл°ҖлҸ„ мёЎм •м—җм„ң кіЁлӢӨкіөмҰқ 진лӢЁ м „ кіЁм Ҳ л°ңмғқм—җ кҙҖн•ң кІ°кіјлҠ” н‘ң 2мҷҖ к°ҷлӢӨ.
추м Ғ кҙҖм°° кІҖмӮ¬м—җм„ң мҡ”추м—җм„ң кіЁлӢӨкіөмҰқ 진лӢЁ м „ кіЁлӢӨкіөм„ұ кіЁм Ҳмқҙ л°ңмғқн•ң нҷҳмһҗлҠ” 15лӘ…(мҡ”추 7лӘ…, нқү추 7лӘ…, мҡ”추 л°Ҹ нқү추 лҸҷмӢңкіЁм Ҳ 1лӘ…)мқҙм—Ҳкі , кіЁм Ҳ м—Ҷмқҙ кіЁлӢӨкіөмҰқл§Ң л°ңмғқн•ң нҷҳмһҗлҠ” 56лӘ…мқҙм—ҲлӢӨ. лҢҖнҮҙкіЁ кІҪл¶Җм—җм„ңлҠ” кіЁлӢӨкіөмҰқ 진лӢЁ м „ кіЁлӢӨкіөм„ұ кіЁм Ҳмқҙ н•ң лӘ…лҸ„ м—Ҷм—Ҳмңјл©°, мҙқ 22лӘ…мқҙ кіЁлӢӨкіөмҰқмңјлЎң 진лӢЁлҗҳм—ҲлӢӨ.
BMDмқҳ к°җмҶҢ мҶҚлҸ„лҘј лӮҳнғҖлӮҙлҠ” м—°к°„ кіЁл°ҖлҸ„ к°җмҶҢмңЁ(annual BMD loss rate)мқҖ к°Ғ кө° к°„м—җ мң мқҳн•ң м°ЁмқҙлҘј ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ.
мҡ”추 л°Ҹ лҢҖнҮҙкіЁ кІҪл¶Җм—җм„ң кіЁлӢӨкіөмҰқмқҙ л°ңмғқн•ҳкё°к№Ңм§Җмқҳ нҸүк· кё°к°„ л°Ҹ 10% нҷҳмһҗк°Җ лҲ„м Ғ л°ңмғқн•ҳкё°к№Ңм§Җмқҳ кё°к°„мқ„ лӮҳнғҖлӮё н‘ңлҠ” м•„лһҳмқҳ н‘ң 3кіј к°ҷлӢӨ.
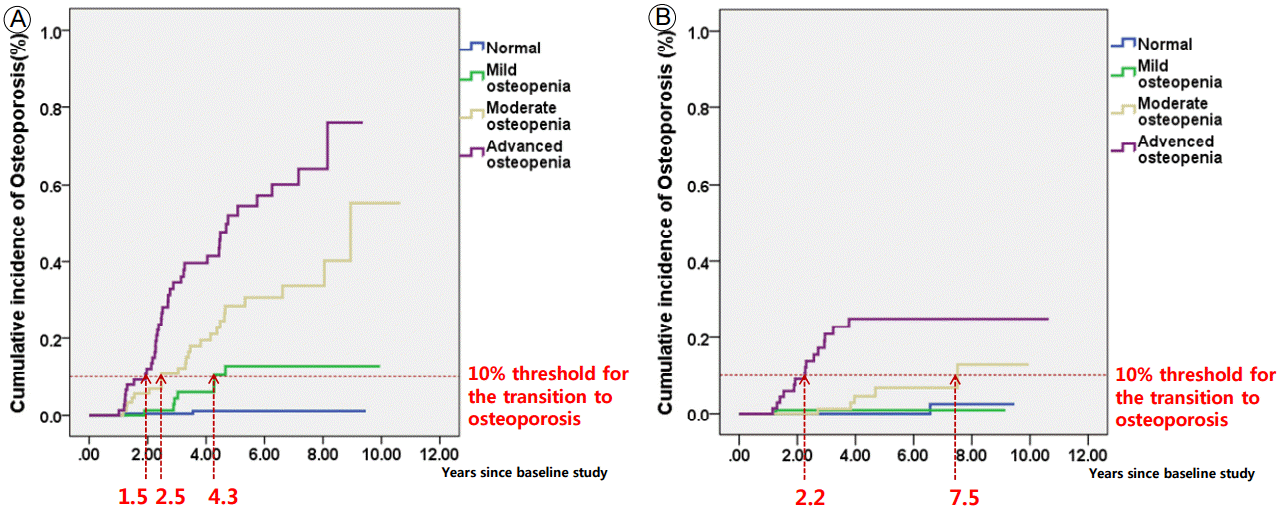
мҡ”추м—җм„ң к°Ғ кө°мқҳ л°ңмғқ нҸүк· кё°к°„мқҖ м •мғҒкө° 9.4л…„(9.29-9.49, 95% confidence interval [CI]), кІҪмҰқ кіЁк°җмҶҢмҰқкө° 9.2л…„(8.58-9.71, 95% CI), мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқкө° 7.9л…„(6.94-8.76, 95% CI), мӨ‘мҰқ кіЁк°җмҶҢмҰқкө° 5.4л…„(4.61-6.21, 95% CI)мңјлЎң лӮҳнғҖлӮ¬мңјл©°, лҢҖнҮҙкіЁм—җм„ңлҠ” м •мғҒкө° 9.4л…„(9.25-9.53, 95% CI), кІҪмҰқ кіЁк°җмҶҢмҰқкө° 9.1л…„(8.94-9.22, 95% CI), мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқкө° 9.4л…„(8.93-9.87, 95% CI), мӨ‘мҰқ кіЁк°җмҶҢмҰқкө° 8.6л…„(7.68-9.50, 95% CI)мңјлЎң лӮҳнғҖлӮ¬лӢӨ.
лҳҗн•ң к°Ғ кө°м—җм„ң 10 %мқҳ нҷҳмһҗк°Җ кіЁлӢӨкіөмҰқмқҙ лҲ„м Ғ л°ңмғқн•ҳкё°к№Ңм§Җмқҳ кё°к°„мқҖ мҡ”추м—җм„ң м •мғҒкө°мқҖ 10л…„ мқҙмғҒ(1.00-1.00, 95% CI), кІҪмҰқ кіЁк°җмҶҢмҰқкө° 4.3л…„(0.82-0.97, 95% CI), мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқкө° 2.5л…„(0.44-0.84, 95% CI), мӨ‘мҰқ кіЁк°җмҶҢмҰқкө° 1.5л…„0.27-0.59, 95% CI)мңјлЎң лӮҳнғҖлӮ¬мңјл©°, лҢҖнҮҙкіЁм—җм„ңлҠ” м •мғҒкө° л°Ҹ кІҪмҰқ кіЁк°җмҶҢмҰқкө°мқҖ 10л…„ мқҙмғҒ(1.00-1.00, 95% CI), мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқкө° 7.5л…„(0.89-0.96, 95% CI), мӨ‘мҰқ кіЁк°җмҶҢмҰқкө° 2.2л…„(0.91-0.96, 95% CI)мңјлЎң лӮҳнғҖлӮ¬лӢӨ.
к·ёлҰј 1мқҖ к°Ғ кө°м—җм„ң 10%мқҳ нҷҳмһҗк°Җ лҲ„м ҒмңјлЎң кіЁм Ҳ лҳҗлҠ” кіЁл°ҖлҸ„к°Җ -2.5 мқҙн•ҳлҘј лӮҳнғҖлӮј л•Ңк№Ңм§Җмқҳ кё°к°„мқ„ лӮҳнғҖлӮё к·ёлһҳн”„мқҙлӢӨ. мҡ”추л¶Җ л°Ҹ лҢҖнҮҙкіЁ кІҪл¶Җ к°Ғк°Ғ log rank (Mantel-Cox)к°Җ p< 0.001, p= 0.002лЎң к°Ғ кө° к°„мқҳ кіЁлӢӨкіөмҰқ л°ңмғқ мӢңк°„м—җ мң мқҳн•ң м°Ёмқҙк°Җ мһҲм—ҲлӢӨ.
н‘ң 4лҠ” Cox proportional hazards modelмқ„ м Ғмҡ©н•ҳм—¬ мҡ”추 л°Ҹ лҢҖнҮҙкіЁм—җм„ңмқҳ кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳ л°ңмғқ мң„н—ҳ мқёмһҗмқҳ 비лЎҖмң„н—ҳлҸ„лҘј лӮҳнғҖлӮё кІ°кіјмқҙлӢӨ.
мҡ”추м—җм„ң кіЁлӢӨкіөмҰқ лҳҗлҠ” кіЁм Ҳ л°ңмғқмқҳ 비лЎҖмң„н—ҳлҸ„(hazard ratio, HR)лҘј мӮҙнҺҙліҙл©ҙ, мҙҲкё°кіЁл°ҖлҸ„ 분лҘҳм—җ л”°лҘё м •мғҒкө°м—җ 비н•ҙ кІҪмҰқ кіЁк°җмҶҢмҰқкө°мқҖ 15.8л°°(95% CI = 1.93, 130.31), мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқкө°мқҖ 54.0л°°(95% CI = 7.13, 409.20), мӨ‘мҰқ кіЁк°җмҶҢмҰқкө°мқҖ 139.8л°°(95% CI = 18.58, 1052.12)лЎң 비лЎҖмң„н—ҳлҸ„к°Җ лҶ’м•ҳмңјл©°, мҠӨн…ҢлЎңмқҙл“ңлҘј мӮ¬мҡ©н•ҳлҠ” кІҪмҡ°(3.0л°°, 95% CI = 1.32, 6.79) л°Ҹ нҸүк· мӮ¬мҡ©лҹүмқҙ кі мҡ©лҹү(high dose)мқё кІҪмҡ°(5.0л°°, 95% CI = 2.13, 11.81), hs-CRPк°Җ лҶ’мқҖ кІҪмҡ° 1.2л°°(95% CI = 1.01, 1.32), м—°нҸүк· мҡ”추 кіЁл°ҖлҸ„ к°җмҶҢмңЁ 1% мҰқк°Җм—җ л”°лқј 1.3л°°мқҳ мң„н—ҳлҸ„к°Җ мҰқк°Җн•ҳмҳҖлӢӨ(95% CI = 1.18, 1.37).
лҢҖнҮҙкіЁм—җм„ң кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳ л°ңмғқмқҳ 비лЎҖмң„н—ҳлҸ„лҠ” м •мғҒ кіЁл°ҖлҸ„кө°м—җ 비н•ҙ мӨ‘мҰқ кіЁк°җмҶҢмҰқкө°мқҖ 286.1л°°(95% CI = 2.48, 33051.72) лҶ’м•ҳмңјл©°, мҠӨн…ҢлЎңмқҙл“ңлҘј мӮ¬мҡ©н•ҳлҠ” кІҪмҡ° 7.2л°°(95% CI = 1.02, 50.78), м—°нҸүк· лҢҖнҮҙкіЁмқҳ кіЁл°ҖлҸ„ к°җмҶҢмңЁ 1% мҰқк°Җм—җ л”°лқј 1.8л°°мқҳ мң„н—ҳлҸ„к°Җ мҰқк°Җн•ҳмҳҖлӢӨ(95% CI = 1.42, 2.39).
нҸүк· кіЁл°ҖлҸ„ к°җмҶҢмңЁкіј кіЁлӢӨкіөмҰқ кҙҖл Ё мң„н—ҳ мқёмһҗмҷҖмқҳ кҙҖл Ём„ұмқҖ н‘ң 5мҷҖ 6м—җ м ңмӢңн•ҳмҳҖлӢӨ. мҡ”추мқҳ м—°нҸүк· кіЁл°ҖлҸ„ к°җмҶҢмңЁмқҙ м—°л №(r = 0.138, p= 0.002), мқј нҸүк· мҠӨн…ҢлЎңмқҙл“ң мҡ©лҹү(r = 0.101, p= 0.022), ESR (r = 0.123, p= 0.005) л°Ҹ hs-CRP (r = 0.120, p= 0.007)мҷҖ м–‘мқҳ мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ. мҰү м—°нҸүк· кіЁл°ҖлҸ„ к°җмҶҢмңЁмқҙ нҒҙмҲҳлЎқ м—°л №мқҙ лҶ’м•ҳмңјл©°, мқјнҸүк· кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ң мӮ¬мҡ©лҹүмқҙ л§Һм•ҳкі , ESRкіј hs-CRPк°Җ лҶ’м•ҳлӢӨ. лҳҗн•ң, нҸҗкІҪ мқҙм „мқҳ м—¬м„ұм—җм„ң кіЁл°ҖлҸ„ к°җмҶҢмңЁмқҙ мң мқҳн•ҳкІҢ мҰқк°Җн•Ёмқ„ мқҳлҜён•ңлӢӨ.
лҢҖнҮҙкіЁмқҳ м—°нҸүк· кіЁл°ҖлҸ„ к°җмҶҢмңЁмқҖ м—°л №(r = 0.181, p< 0.001), мқјнҸүк· кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ң мӮ¬мҡ©лҹү(r = 0.092, p= 0.037) л°Ҹ hs-CRP (r = 0.128, p= 0.004)мҷҖ мң мқҳн•ң м–‘мқҳ мғҒкҙҖкҙҖкі„лҘј ліҙмҳҖлӢӨ.
м •мғҒ л°Ҹ кіЁк°җмҶҢмҰқ нҷҳмһҗмқҳ 추м Ғ кҙҖм°°м—җ кҙҖн•ң мІ«лІҲм§ё м—°кө¬лҠ” Hillier л“ұ[12]мқҙ 2007л…„м—җ л°ңн‘ңн•ң, кұҙк°•н•ң л…ёмқё м—¬м„ұмқ„ лҢҖмғҒмңјлЎң н•ң м „н–Ҙм„ұ мҪ”нҳёнҠё м—°кө¬лЎңм„ң, мҙҲкё° кіЁл°ҖлҸ„ мёЎм • нӣ„ 8л…„ мқҙлӮҙмқҳ 추к°Җм Ғмқё кіЁл°ҖлҸ„ кІҖмӮ¬лҠ” кіЁлӢӨкіөм„ұ кіЁм Ҳмқ„ мҳҲмёЎн•ҳлҠ”лҚ° мһҲм–ҙ мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬м—җ 비н•ҙ м–ҙл– н•ң 추к°Җм Ғмқё мқҙл“қлҸ„ м–»мқ„ мҲҳ м—ҶлӢӨкі л°ңн‘ңн–ҲлӢӨ.
нӣ„мҶҚлҗң Gourlay л“ұ[11]мқҳ м—°кө¬ м—ӯмӢң мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬к°Җ 추нӣ„ кіЁлӢӨкіөмҰқмқҳ л°ңлі‘мқ„ мҳҲмёЎн•ҳлҠ”лҚ° к°ҖмһҘ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ңлӢӨкі мЈјмһҘн•ҳл©°, мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬ кІ°кіјлЎңл¶Җн„° м •мғҒ л°Ҹ кіЁк°җмҶҢмҰқ нҷҳмһҗлҘј 세분нҷ”мӢңнӮЁ нӣ„, к°Ғ кө°м—җм„ң 10%мқҳ мқёмӣҗм—җм„ң кіЁлӢӨкіөмҰқмқҙ лҲ„м Ғ л°ңмғқн• кІғмңјлЎң мҳҲмёЎлҗҳлҠ” кё°к°„мқ„ м ңмӢңн•ҳмҳҖлӢӨ. лҳҗн•ң кІҖмӮ¬ лҢҖмғҒмһҗмқҳ кіЁлӢӨкіөмҰқ л°ңмғқмң„н—ҳлҸ„лҘј 세분нҷ”н•ҳм—¬, мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬мқҳ T-score -1.5лҘј кё°мӨҖмңјлЎң мң„н—ҳлҸ„м—җ л”°лҘё кІҖмӮ¬ мӢңн–ү мЈјкё°мқҳ м°Ёлі„нҷ”к°Җ н•„мҡ”н•ҳлӢӨкі мЈјмһҘн•ҳмҳҖлӢӨ[11,13].
мӮ¬мӢӨ к·ё мқҙм „л¶Җн„° кіЁк°җмҶҢмҰқ нҷҳмһҗмқҳ 추м Ғ кҙҖм°° кё°к°„мқ„ T-scoreл§ҢмңјлЎң м •н• мҲҳ мһҲлҠҗлғҗм—җ лҢҖн•ң мқҳл¬ёмқҖ кі„мҶҚ м ңкё°лҗҳм–ҙ мҷ”лӢӨ[14].
Siris л“ұ[15]мқҙ 2004л…„м—җ л°ңн‘ңн•ң лҢҖк·ңлӘЁ кҙҖм°°мғҒ мҪ”нҳёнҠё м—°кө¬мқё National osteoporosis risk assessment (NORA)м—җм„ңлҸ„ лӮҳнғҖлӮң л°”мҷҖ к°ҷмқҙ кіЁлӢӨкіөм„ұ кіЁм Ҳ л°ңмғқм—җ T-score -2.5лқјлҠ” кё°мӨҖмқҙ кіЁм Ҳл°ңмғқлҘ м—җм„ңлҠ” мқҳлҜёк°Җ мһҲмңјлӮҳ м ҲлҢҖм Ғмқё кіЁм Ҳ л°ңмғқ мҲ«мһҗлҠ” мҳӨнһҲл Ө кіЁк°җмҶҢмҰқ мқёкө¬м—җм„ң лӮҳнғҖлӮ¬лӢӨлҠ” м—°кө¬ кІ°кіјлҸ„ мһҲм—ҲлӢӨ.
к·ё мқҙнӣ„м—җлҸ„ кіЁлӢӨкіөмҰқмқҳ мң„н—ҳ мқёмһҗк°Җ мһҲмқ„ л•Ң кіЁлӢӨкіөмҰқ л°Ҹ кіЁм Ҳмқҳ л°ңмғқ кё°к°„мқҙ м•һлӢ№кІЁм§Ҳ мҲҳ мһҲкі , T-scoreк°Җ м•„лӢҢ мһ„мғҒм Ғмқё мң„н—ҳ мқёмһҗм—җ лҢҖн•ң мёЎм •мқ„ нҶөн•ҙ кіЁл°ҖлҸ„ кІҖмӮ¬мқҳ кІҖмӮ¬ к°„кІ©мқ„ м •н•ҙм•ј н•ңлӢӨлҠ” мЈјмһҘ лҳҗн•ң л…јмқҳлҗҳкі мһҲлӢӨ[16].
DXAлҠ” мёЎм • л¶Җмң„лӮҳ мёЎм • кё°мҲ м—җ л”°лҘё мҳӨм°Ё л°Ҹ кё°мӨҖ лҚ°мқҙн„°лІ мқҙмҠӨ мқёкө¬мқҳ нҸүк· кіј н‘ңмӨҖнҺём°Ём—җ л”°лҘё м°Ёмқҙк°Җ мһҲмқ„ мҲҳ мһҲмңјл©°, 추к°Җм Ғмқё мң„н—ҳ мқёмһҗ л°Ҹ кіЁм§Ҳ(bone quality)м—җ лҢҖн•ң м •ліҙк°Җ нҸ¬н•Ёлҗҳм§Җ м•ҠлҠ” л“ұ м—¬лҹ¬ м ңн•ңм җмқҙ мһҲлӢӨ[17].
к·ёлҹ¬лӮҳ DXAк°Җ кіЁлӢӨкіөмҰқмқҳ м •мқҳ л°Ҹ 진лӢЁ, 추м Ғ кҙҖм°°мқҳ н‘ңмӨҖ кІҖмӮ¬лЎңмҚЁ л„җлҰ¬ мқём •лҗҳкі мһҲкі , л§Ҳл•…н•ң лҢҖмІҙ к°ҖлҠҘн•ң кІҖмӮ¬л°©лІ•мқҙ нҳ„мһ¬ к°ңл°ңлҗҳм–ҙ мһҲм§Җ м•Ҡкі мһҲлӢӨ. л¬јлЎ trabecular bone score (TBS)лқјл“ м§Җ fracture risk assessment tool(FRAXВ®; World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK)к°Җ ліҙмҷ„м ҒмңјлЎң к°ңл°ңлҗҳм–ҙ м—°кө¬лҗҳкі мһҲмңјлӮҳ, DXAлҠ” м—¬м „нһҲ 진лӢЁлҝҗл§Ң м•„лӢҲлқј кіЁм Ҳ мң„н—ҳмқҳ м¶”м • л°Ҹ м№ҳлЈҢ л°ҳмқ‘мқҳ нҸүк°Җм—җлҸ„ кё°мӨҖмқҙ лҗҳлҠ” кІҖмӮ¬мһ„мқ„ л¶Җмқён• мҲҳ м—ҶлӢӨ[17].
л”°лқјм„ң, ліё м—°кө¬лҠ” нҳ„мһ¬ мғҒмҡ©нҷ”лҗҳкі мһҲкі , мқјм„ м—җм„ң кі„мҶҚ мӢңн–үлҗҳкі мһҲлҠ” DXA кІҖмӮ¬ кІ°кіјлҘј нҶ лҢҖлЎң 추м Ғ кҙҖм°° кІҖмӮ¬мқҳ нҡЁмҡ©м„ұмқ„ м•„м§Ғ кіЁлӢӨкіөмҰқмңјлЎң 진лӢЁлҗҳм§Җ м•ҠмқҖ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мӢңн–үн•ҳмҳҖмңјл©°, к·ё кІ°кіјлҠ” мқјл°ҳ м—¬м„ұмқ„ лҢҖмғҒмңјлЎң н–ҲлҚҳ м•һм„ м—°кө¬ кІ°кіјмҷҖ мғҒнҶөн•ҳлҠ” л©ҙмқҙ мһҲлӢӨ.
мҰү кіЁлӢӨкіөмҰқмңјлЎң 진лӢЁл°ӣм§Җ м•Ҡм•„ кіЁлӢӨкіөмҰқм—җ лҢҖн•ң м№ҳлЈҢлҘј л°ӣм§Җ м•Ҡкі мһҲлҠ” 40лҢҖ мқҙнӣ„мқҳ лӮЁл…Җ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗмқҳ кіЁл°ҖлҸ„ кІ°кіјлҘј 추м Ғ кҙҖм°°н•ҳм—¬ кіЁлӢӨкіөмҰқмқҳ л°ңмғқ мҳҲмғҒ мӢңкё°лҘј 추측н•ҳмҳҖкі , мқјл°ҳм ҒмңјлЎң м•Ңл Ө진 кіЁлӢӨкіөмҰқ л°ңмғқмқҳ мң„н—ҳ мқёмһҗмҷҖ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗмқҳ мғҒлҢҖмң„н—ҳлҸ„лҘј нҸүк°Җн•ҳмҳҖлӢӨ.
кё°мЎҙмқҳ м—°кө¬ кІ°кіјмҷҖ 비мҠ·н•ҳкІҢ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗкө°м—җм„ңмқҳ кіЁлӢӨкіөмҰқ мң лі‘лҘ мқҖ м•Ҫ 40% м •лҸ„лЎң нҷ•мқёлҗҳм—Ҳмңјл©°, лҢҖнҮҙкіЁ кіЁм Ҳм—җ 비н•ҙ мІҷ추м—җм„ңмқҳ кіЁм Ҳмқҙ л§Һмқҙ кҙҖм°°лҗҳм—ҲлӢӨ[18-20].
65м„ё мқҙмғҒмқҳ мқјл°ҳ м—¬м„ұл“Өмқҳ лҢҖнҮҙкіЁмқ„ лҢҖмғҒмңјлЎң н•ң м—°кө¬м—җм„ң Gourlay л“ұ[11]мқҖ нҷҳмһҗкө°мқ„ м •мғҒ л°Ҹ кІҪмҰқ, мӨ‘л“ұлҸ„, мӨ‘мҰқмқҳ кіЁк°җмҶҢмҰқкө°мңјлЎң кө¬л¶„н•ң нӣ„, к°Ғ кө°мқҳ 10%м—җм„ң кіЁлӢӨкіөмҰқмқҙ л°ңмғқн• кІғмңјлЎң мҳҲмёЎлҗҳлҠ” кё°к°„мқ„ м ңмӢңн•ҳмҳҖлҠ”лҚ°, м •мғҒ л°Ҹ кІҪмҰқ кіЁк°җмҶҢмҰқм—җм„ң 15л…„, мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқм—җм„ң 5л…„, мӨ‘мҰқ кіЁк°җмҶҢмҰқм—җм„ң 1л…„мқҳ кіЁл°ҖлҸ„ кІҖмӮ¬ к°„кІ©мқ„ 추мІңн•ҳмҳҖлӢӨ. к·ёлҹ¬лӮҳ ліё м—°кө¬лҠ” к·ём—җ 비н•ҙ лҢҖнҮҙкіЁмқҳ кіЁлӢӨкіөмҰқ л°ңмғқмқҖ мҳӨнһҲл Ө лҚ” лҠҰмқ„ кІғмңјлЎң мҳҲмёЎлҗҳм—ҲлӢӨ. к·ё мӣҗмқёмңјлЎңлҠ” мҡ°м„ Gourlay л“ұ[11]мқҳ м—°кө¬лҠ” мҡ”추 кІҖмӮ¬лҘј мӢңн–үм№ҳ м•Ҡм•ҳлӢӨлҠ” мӮ¬мӢӨкіј лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗм—җм„ң мІҷ추 кіЁм Ҳмқҙ лҢҖнҮҙкіЁ кіЁм Ҳм—җ 비н•ҙ лҚ” л§Һмқҙ л°ңмғқн•ңлӢӨлҠ” Brennan л“ұ[18] л°Ҹ Ghazi л“ұ[19]мқҳ м—°кө¬ кІ°кіјмҷҖ м—°кҙҖн•ҳм—¬ к·ё кІ°кіјлҘј н•ҙм„қн•ҙм•ј н• кІғмңјлЎң ліҙмқёлӢӨ. лҳҗн•ң Gourlay л“ұ[11]мқҖ мғҒлҢҖм ҒмңјлЎң кі л №мқҳ м—¬м„ұл§Ңмқ„ лҢҖмғҒмңјлЎң н•ҳмҳҖлӢӨлҠ” м җ лҳҗн•ң м°Ёмқҙк°Җ лӮҳлҠ” мӣҗмқёмңјлЎң мғқк°ҒлҗңлӢӨ.
T-scoreлҘј кё°мӨҖмңјлЎң н•ң кіЁлӢӨкіөмҰқ л°ңмғқм—җ к°ҖмһҘ мӨ‘мҡ”н•ң мҡ”мқёмқҖ кё°мЎҙ м—°кө¬[11,12]мҷҖ л§Ҳм°¬к°Җм§ҖлЎң мҡ”추 л°Ҹ лҢҖнҮҙкіЁ лӘЁл‘җм—җм„ң мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬ кІ°кіјмҳҖмңјл©°, к·ё лӢӨмқҢмңјлЎң лҢҖнҮҙкіЁм—җм„ңлҠ” м—°л №мқҙ, мҡ”추м—җм„ңлҠ” нҸүк· мҠӨн…ҢлЎңмқҙл“ң мҡ©лҹүмқҙ м—°кҙҖ мһҲлҠ” кІғмңјлЎң ліҙмқёлӢӨ.
лҳҗн•ң ліё м—°кө¬м—җм„ңлҠ” T-scoreк°Җ к°Җ진 мғҒлҢҖм„ұмқ„ к°җмҮ„н•ҳкі м—°мҶҚм„ұмқ„ нҷ•мқён•ҳкё° мң„н•ҙм—°к°„ кіЁл°ҖлҸ„ к°җмҶҢмңЁкіј мң„н—ҳ мқёмһҗмҷҖмқҳ м—°кҙҖм„ұмқ„ 분м„қн•ҳмҳҖлҠ”лҚ°, мҡ”추м—җм„ңлҠ” м—¬м„ұмқҳ кіЁк°җмҶҢмңЁмқҙ лӮЁм„ұліҙлӢӨ лҚ” нҒ° кІғмңјлЎң лӮҳнғҖлӮ¬мңјл©°, м—°л №мқҙлӮҳ нҸүк· мҠӨн…ҢлЎңмқҙл“ң ліөмҡ©лҹү, м—јмҰқ н‘ңм§Җмһҗл“ӨкіјлҸ„ м–‘мқҳ мғҒкҙҖкҙҖкі„к°Җ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ. лҢҖнҮҙкіЁм—җм„ңлҠ” м—°л №кіј нҸүк· мҠӨн…ҢлЎңмқҙл“ң ліөмҡ©лҹү, hs-CRPмҷҖ м–‘мқҳ мғҒкҙҖкҙҖкі„к°Җ мһҲлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ.
м—¬м„ұмқҳ нҸҗкІҪ м—¬л¶ҖлҠ” мҳӨнһҲл Ө нҸҗкІҪ м „мқј кІҪмҡ° кіЁк°җмҶҢмңЁмқҙ лҚ” лҶ’мқҖ кІғмңјлЎң ліҙмқҙлҠ”лҚ°, мқҙлҠ” лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—јмқҳ л°ңлі‘лҘ мқҙ 40лҢҖм—җ лҶ’м•„ м§Ҳлі‘мқҳ мҙҲкё°м—җ н•ҙлӢ№н•ҳл©°, лҳҗн•ң мқҙл“Өмқҙ кҙҖм°° кё°к°„ мӨ‘ нҸҗкІҪкё°(mean 44.8, range 40-52.6)м—җ лӢӨлӢӨлҘҙкё° л•Ңл¬ёмңјлЎң мғқк°ҒлҗңлӢӨ.
ліё м—°кө¬лҘј нҶөн•ҙ кіЁл°ҖлҸ„к°Җ м •мғҒмқҙкұ°лӮҳ кіЁк°җмҶҢмҰқмқё 40м„ё мқҙнӣ„мқҳ лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗм—җм„ңмқҳ м Ғм Ҳн•ң кіЁл°ҖлҸ„ кІҖмӮ¬ мЈјкё° л°Ҹ мң„н—ҳ мқёмһҗм—җ лҢҖн•ң кі м°°мқ„ мӢңн–үн•ҳмҳҖлӢӨ.
кіЁлӢӨкіөмҰқмқҳ 진лӢЁ л°Ҹ м№ҳлЈҢ, 추м Ғ кҙҖм°°м—җм„ң мӨ‘мҡ”н•ң м җмқҖ кіЁм Ҳмқҙ л°ңмғқн•ҳкё° м „м—җ мЎ°кё° л°ңкІ¬н•ҳм—¬, м Ғм Ҳн•ң м№ҳлЈҢлҘј нҶөн•ҙ к°ңмқёмқҳ мӮ¶мқҳ м§Ҳ л°Ҹ мӮ¬нҡҢм Ғ м№ҳлЈҢ 비мҡ©мқ„ к°җмҶҢмӢңнӮӨлҠ” кІғмқҙлқј н• мҲҳ мһҲлӢӨ. лҳҗн•ң лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗлҠ” к·ё м§Ҳнҷҳмқҙ к°–кі мһҲлҠ” нҠ№м„ұмңјлЎң мқён•ҙ мқјл°ҳ мқёкө¬ліҙлӢӨ лҚ” мһҗмЈј BMDлҘј мёЎм •н•ҙм•ј н• кІғмқҙлӢӨ.
кіЁк°җмҶҢмҰқмқҳ 추м Ғ кҙҖм°° кё°к°„мқ„ кіЁл°ҖлҸ„лӮҳ T-scoreл§ҢмңјлЎң м •н•ҳлҠ” кІғмқҖ к°ңмқё нҠ№м„ұм—җ л”°лҘё м°Ёмқҙ л°Ҹ кіЁкө¬мЎ°мқҳ мғҒмқҙм„ұ л“ұмңјлЎң мқён•ҙ л¬ём ңм җмқҙ мһҲмңјлҜҖлЎң, DXA лҝҗл§Ң м•„лӢҲлқј FRAXВ®, TBS л“ұмқҙ нҸ¬н•Ёлҗң мғҲлЎңмҡҙ к¶Ңкі м•Ҳм—җ лҢҖн•ң 추к°Җм Ғмқё м—°кө¬к°Җ н•„мҡ”н• кІғмқҙлқј мғқк°ҒлҗңлӢӨ.
к·ёлҹ¬лӮҳ ліё м—°кө¬мқҳ кІ°кіјм—җ 비추м–ҙ ліј л•Ң, кіЁм Ҳмқҳ мң„н—ҳлҸ„к°Җ лӮ®мңјл©ҙм„ң мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬ кІ°кіјк°Җ м •мғҒ лҳҗлҠ” кІҪмҰқ кіЁк°җмҶҢмҰқмқё лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗл“Өм—җкІҢ 1-2л…„л§ҲлӢӨ кіЁлӢӨкіөмҰқ кІҖмӮ¬лҘј л°ҳліөн•ҳлҠ” кІғмқҖ кёҖлЈЁмҪ”мҪ”лҘҙнӢ°мҪ”мқҙл“ңлҘј ліөмҡ©н•ҳлҠ” лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗм—җм„ңлҸ„ л¬ҙмқҳлҜён• мҲҳ мһҲлӢӨ.
к·ёлҹ¬лҜҖлЎң нҳ„ мӢңм җм—җм„ңлҠ” мҙҲкё°кіЁл°ҖлҸ„ кІҖмӮ¬ кІ°кіјк°Җ м •мғҒмқё лҘҳл§ҲнӢ°мҠӨ кҙҖм Ҳм—ј нҷҳмһҗмқҳ кіЁл°ҖлҸ„ 추м Ғ кІҖмӮ¬лҠ” 10л…„ мқҙнӣ„м—җ мӢңн–үн•ҳлҠ” кІғмқҙ нғҖлӢ№н• кІғмңјлЎң ліҙмқҙл©°, кІҪмҰқ кіЁк°җмҶҢмҰқ нҷҳмһҗлҠ” 4л…„, мӨ‘л“ұлҸ„ кіЁк°җмҶҢмҰқ нҷҳмһҗлҠ” 2л…„, мӨ‘мҰқ кіЁк°җмҶҢмҰқ нҷҳмһҗлҠ” 1л…„ л§ҲлӢӨ 추м Ғ кІҖмӮ¬лҘј мӢңн–үн•ҳлҠ” кІғмқҙ нғҖлӢ№н• кІғмңјлЎң ліҙмқёлӢӨ.
REFERENCES
1. Cosman F, de Beur SJ, LeBoff MS, et al. ClinicianвҖҷs guide to prevention and treatment of osteoporosis. Osteoporos Int 2014;25:2359вҖ“2381.



2. Deodhar AA, Woolf AD. Bone mass measurement and bone metabolism inrheumatoid arthritis: a review. Br J Rheumatol 1996;35:309вҖ“322.


3. Gough AK, Lilley J, Eyre S, Holder RL, Emery P. Generalized bone loss in patients with early rheumatoid arthritis. Lancet 1994;344:23вҖ“27.


4. Haugeberg G, Uhlig T, Falch JA, Halse JI, Kvien TK. Bone mineral density and frequency of osteoporosis in female patients with rheumatoid arthritis: results from 394 patients in the Oslo County Rheumatoid Arthritis register. Arthritis Rheum 2000;43:522вҖ“530.


5. Frost SA, Nguyen ND, Center JR, Eisman JA, Nguyen TV. Timing of repeat BMD measurements: development of an absolute risk-based prognostic model. J Bone Miner Res 2009;24:1800вҖ“1807.


6. Hillier TA, Stone KL, Bauer DC, et al. Evaluating the value of repeat bone mineraldensity measurement and prediction of fractures in older women: the study ofosteoporotic fractures. Arch Intern Med 2007;167:155вҖ“160.


8. Clunie G. Screening for postmenopausal osteoporosis with any modality is cost-effective including screening initiation at 55 years of age. Evid Based Med 2012;17:195вҖ“196.


9. Ott SM. What should be the interval between bone density screenings? Cleve Clin J Med 2013;80:240вҖ“242.


10. Nelson HD, Haney EM, Dana T, Bougatsos C, Chou R. Screening for osteoporosis: an update for the U.S. Preventive Services Task Force. Ann Intern Med 2010;153:99вҖ“111.


11. Gourlay ML, Fine JP, Preisser JS, et al. Bone-density testing interval and transition to osteoporosis in older women. N Engl J Med 2012;366:225вҖ“233.



12. Hillier TA, Stone KL, Bauer DC, et al. Evaluating the value of repeat bone mineral density measurement and prediction of fractures in older women. Arch Intern Med 2007;167:155вҖ“160.


13. Gourlay ML, Preisser JS, Lui LY, Cauley JA; Ensrud KE; Study of Osteoporotic Fractures Research Group. BMD screening in older women: initial measurement and testing interval. J Bone Miner Res 2012;27:743вҖ“746.



14. Doshi KB, Khan LZ, Williams SE, Licata AA. Bone mineral density testing: is a T score enough to determine the screening interval? Cleve Clin J Med 2013;80:234вҖ“239.


15. Siris ES, Chen YT, Abbott TA, et al. Bone mineral density thresholds for pharmacological intervention to prevent fractures. Arch Intern Med 2004;164:1108вҖ“1112.


16. Leslie WD, Morin SN, Lix LM. Bone-density testing interval and transition to osteoporosis. N Engl J Med 2012;366:1547. author reply 1547-1548.

18. Brennan SL, Toomey L, Kotowicz MA, Henry HJ, Griffiths H, Pasco JA. Rheumatoid arthritis and incident fracture inwomen: a caseвҖ“control study. BMC Musculoskelet Disord 2014;15:13.



Cumulative incidence of osteoporosis according to baseline T-score range, (A) L-spine, (B) femur neck.
FigureВ 1.
TableВ 1.
Comparisons of the general characteristics of the enrolled patients by baseline BMD
| Normal group (n = 144) | Mild osteopenia (n = 102) | Moderate osteopenia (n = 145) | Advanced osteopenia (n = 120) | p value | |
|---|---|---|---|---|---|
| Age, yrs | 49.10 Вұ 7.01a | 51.71 Вұ 8.53b | 53.70 Вұ 8.87b,c | 54.09 Вұ 8.99c | <0.001 |
| Sex | |||||
| вҖғMale | 14 (9.7) | 14 (13.7) | 28 (19.3) | 21 (17.5) | 0.114 |
| вҖғFemale | 130 (90.3) | 88 (86.3) | 117 (80.7) | 99 (82.5) | |
| Height, cm | 159.32 Вұ 6.24 | 158.48 Вұ 6.03 | 158.58 Вұ 6.63 | 157.88 Вұ 6.33 | 0.328 |
| Weight, kg | 61.30 Вұ 9.08a | 58.06 Вұ 7.74b,c | 59.45 Вұ 8.25a,b | 56.40 Вұ 8.24c | <0.001 |
| BMI, kg/m2 | 24.13 Вұ 3.14a | 23.12 Вұ 2.85b,c | 23.62 Вұ 2.70a,b | 22.61 Вұ 2.84c | <0.001 |
| Current smoker, % | 6 (4.2) | 3 (2.9) | 13 (9.0) | 13 (10.8) | 0.045 |
| Current drinker, % | 9 (6.3) | 10 (9.8) | 12 (8.3) | 9 (7.5) | 0.775 |
| Menopause, % | 53 (40.8) | 48 (54.5) | 79 (67.5) | 63 (63.6) | <0.001 |
| Steroid use, % | 113 (78.5) | 81 (79.4) | 114 (78.6) | 93 (77.5) | 0.989 |
| ESR, mm/h | 23.52 Вұ 25.31 | 20.52 Вұ 20.73 | 25.05 Вұ 24.23 | 24.00 Вұ 25.08 | 0.531 |
| hs-CRP, mg/dL | 0.91 Вұ 1.92 | 0.95 Вұ 2.01 | 1.36 Вұ 3.12 | 1.58 Вұ 3.21 | 0.136 |
TableВ 2.
Overview of the study
| Normal group (-1 < T-score) | Mild osteopenia (-1.5 < T-score вүӨ -1) | Moderate osteopenia (-2 < T-score вүӨ -1.5) | Advanced osteopenia (-2.5 < T-score вүӨ -2) | |
|---|---|---|---|---|
| L-spine (n = 511) | ||||
| вҖғNumber of patients | 241 | 95 | 98 | 77 |
| вҖғStudy period, pt-yr | 1097.1 | 439.9 | 486.5 | 417.3 |
| вҖғNewly diagnosed osteoporosis without fracture | 1 (0.4) | 4 (4.2) | 18 (18.4) | 33 (42.9) |
| вҖғVertebral fracture with T > 2.5 | 1 (0.4) | 3 (3.2) | 6 (6.1) | 5 (6.5) |
| вҖғFinal BMD, g/cm2 | 1.18 Вұ 0.14b | 1.05 Вұ 0.12c | 1.01 Вұ 0.16d | 0.92 Вұ 0.16e |
| вҖғFinal T-score | 0.26 Вұ 1.16b | -0.80 Вұ 0.91c | -1.15 Вұ 1.00d | -1.66 Вұ 1.09e |
| вҖғBone loss ratea, % | 1.35 Вұ 3.64 | 1.36 Вұ 4.03 | 1.71 Вұ 5.74 | 1.04 Вұ 4.75 |
| Femur neck (n = 511) | ||||
| вҖғNumber of patients | 209 | 114 | 116 | 72 |
| вҖғStudy period, pt-yr | 935.8 | 543.6 | 599.2 | 337.2 |
| вҖғNewly diagnosed osteoporosis without fracture | 1 (0.5) | 1 (0.9) | 5 (4.3) | 15 (20.8) |
| вҖғHip fracture with T > 2.5 | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| вҖғFinal BMD, g/cm2 | 0.94 Вұ 0.10b | 0.84 Вұ 0.09c | 0.79 Вұ 0.10d | 0.73 Вұ 0.11e |
| вҖғFinal T-score | -0.07 Вұ 0.79b | -0.78 Вұ 0.66c | -1.20 Вұ 0.71d | -1.61 Вұ 0.78e |
| вҖғBone loss ratea, % | 1.71 Вұ 3.88 | 2.01 Вұ 5.18 | 2.61 Вұ 5.05 | 1.88 Вұ 4.6 |
TableВ 3.
Interval between baseline testing and the development of osteoporosis
| Baseline BMD |
Mean interval between baseline testing and the development of osteoporosis |
Interval between baseline testing and the development of osteoporosis in 10% of each group |
||
|---|---|---|---|---|
| Lumbar spine | Femur neck | Lumbar spine | Femur neck | |
| Normal | 9.4 (9.29-9.49)a | 9.4 (9.25-9.53)a | > 10 | > 10 |
| Mild osteopenia | 9.2 (8.58-9.71)a | 9.1 (8.94-9.22)a | 4.3 | > 10 |
| Moderate osteopenia | 7.9 (6.94-8.76)a | 9.4 (8.93-9.87)a | 2.5 | 7.5 |
| Advanced osteopenia | 5.4 (4.61-6.21)a | 8.6 (7.68-9.50)a | 1.5 | 2.2 |
TableВ 4.
Risk factors related to the occurrence of osteoporosis
| Variables |
Lumbar spine |
Femur neck |
||||
|---|---|---|---|---|---|---|
| HR | 95% CI | p value | HR | 95% CI | p value | |
| Baseline group | ||||||
| вҖғMild osteopenia | 15.84 | 1.93-130.31 | 0.010 | 10.17 | 0.08-1326.17 | 0.351 |
| вҖғModerate osteopenia | 54.01 | 7.13-409.20 | <0.001 | 8.55 | 0.08-929.98 | 0.370 |
| вҖғAdvanced osteopenia | 139.82 | 18.58-1052.12 | <0.001 | 286.13 | 2.48-33051.72 | 0.020 |
| Age, yrs | 1.03 | 0.98-1.07 | 0.276 | 1.09 | 0.99-1.19 | 0.075 |
| Women | 2.08 | 0.68-6.39 | 0.199 | 0.43 | 0.08-2.42 | 0.341 |
| Height, cm | 1.23 | 0.78-1.95 | 0.369 | 1.05 | 0.51-2.14 | 0.904 |
| Weight, kg | 0.69 | 0.37-1.29 | 0.249 | 0.87 | 0.29-2.61 | 0.805 |
| BMI, kg/m2 | 2.31 | 0.51-10.38 | 0.274 | 1.26 | 0.10-6.00 | 0.859 |
| Current smoker (Y or N) | 0.68 | 0.07-6.22 | 0.730 | 2.58 | 0.00-28233.08 | 0.842 |
| Current drinker (Y or N) | 0.00 | 0.00-58.37 | 0.965 | 0.24 | 0.00-2049.03 | 0.754 |
| Menopause (Y or N) | 1.27 | 0.58-2.80 | 0.555 | 0.81 | 0.11-5.78 | 0.835 |
| Steroid use (Y or N) | 2.99 | 1.32-6.79 | 0.009 | 7.19 | 1.02-50.78 | 0.048 |
| Cumulative steroid, mg | 1.00 | 1.00-1.00 | <0.001 | 0.99 | 0.99-1.00 | 0.012 |
| Mean steroid (low or high)a | 5.02 | 2.13-11.81 | <0.001 | 3.29 | 0.46-23.53 | 0.235 |
| ESR, mm/h | 0.99 | 0.97-1.01 | 0.200 | 0.98 | 0.95-1.01 | 0.263 |
| hs-CRP, mg/dL | 1.15 | 1.01-1.32 | 0.038 | 0.97 | 0.72-1.31 | 0.864 |
| Bone loss rate, % | 1.28 | 1.18-1.37 | <0.001 | 1.84 | 1.42-2.39 | <0.001 |
TableВ 5.
Risk factors for rapid bone loss
TableВ 6.
Risk factors for rapid bone loss
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 10,081 View
- 214 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



