만성 난치성 기침
Chronic Refractory Cough
Article information
Trans Abstract
Chronic refractory cough is defined as a cough that persists despite guideline based treatment. It is seen in 20-46% of patients presenting to specialist cough clinics and it has a substantial impact on quality of life and healthcare utilization. Several terms have been used to describe this condition, including the recently introduced term cough hypersensitivity syndrome. Key symptoms include a dry irritated cough localized around the laryngeal region. Symptoms are not restricted to cough and can include globus, dyspnea, and dysphonia. Chronic refractory cough has factors in common with laryngeal hypersensitivity syndromes and chronic pain syndromes, and these similarities help to shed light on the pathophysiology of the condition. Its pathophysiology includes cough reflex sensitivity, central sensitization, peripheral sensitization, and paradoxical vocal fold movement. Chronic refractory cough often occurs after a viral infection. The diagnosis is made once the main disease that causes chronic cough have been excluded (or treated) and cough remains refractory to medical treatment. Treatments include speech pathology interventions using techniques adapted from the treatment of hyperfunctional voice disorders, as well as the use of centrally acting neuromodulators such as gabapentin and pregabalin. Potential new treatments in development also show promise.
서 론
기침의 지역사회 유병률은 세계적으로 성인 인구의 약 2.3-18%를 차지하며, 이 중 만성 기침의 유병률은 약 10-38%로 보고되고 있다[1,2]. 만성 기침의 국내 유병률에 대한 연구는 드물지만, 최근 지역사회 노인 인구를 대상으로 한 설문조사에서는 4.6-9.3%로 보고되었다[3]. 대부분의 만성 기침은 국내 기침 진료 지침을 포함한 여러 진료 지침에 제시된 가이드라인 및 프로토콜에 따라 적절한 검사 및 치료를 하면 기침의 원인에 대한 확인과 치료가 가능하다[4,5]. 하지만, 일부 만성 기침의 경우 진료 지침에 제시된 가이드라인이나 프로토콜을 따라 검사 및 치료를 함에도 불구하고 원인을 파악하기 어렵고 치료가 안 되는 경우가 있다. 최근에는 이러한 경우를 원인을 찾는데 실패한 것이 아니라, 하나의 다른 임상적 질환으로 접근을 해야 한다는 의견들이 대두되고 있으며 여기에 대한 연구들이 많이 보고되고 있다[6]. 이를 만성 난치성 기침(chronic refractory cough) 또는 만성 특발성 기침(chronic idiopathic cough)이라는 용어를 사용하여 정의하고 있는데, 본고에서는 이러한 만성 난치성 기침에 대해 좀 더 자세히 알아보고자 한다.
정 의
기침은 지속 기간에 따라 급성 기침(3주 미만), 아급성 기침(3주 이상 8주 미만), 만성 기침(8주 이상)으로 분류한다. 만성 난치성 기침의 정의는 아직도 명확하지 않지만, 8주 이상의 기침의 만성 기침 환자에서 제시된 진료 지침의 가이드라인에 따른 충분한 검사 및 치료에도 불구하고 기침의 호전이 없는 경우로 정의되고 있다. 만성 기침으로 병원을 찾는 환자들의 약 20-46%에서 만성 난치성 기침의 특징을 보인다고 알려져 있으며 용어로는 만성 난치성 기침이나 만성 특발성 기침, 또는 설명되지 않는 만성 기침(unexplained chronic cough) 등이 사용된다. 하지만, 용어를 좀 더 구분하자면 기침의 원인을 확인할 수 없을 경우에는 만성 특발성 기침 또는 설명되지 않는 기침이라고 하고, 기침의 원인이 될 만한 질환에 대해 적절한 치료를 함에도 불구하고 기침의 호전이 없는 경우를 만성 난치성 기침이라고 할 수 있다. 하지만, 설명되지 않는 만성 기침이나 만성 특발성 기침의 경우 대부분이 흡입 스테로이드제제나 프로톤펌프억제제 등의 경험적 치료를 함에도 불구하고 계속 기침이 지속되기 때문에 이들도 만성 난치성 기침에 포함시킬 수 있다.
기침 과민 증후군(cough hypersensitivity syndrome)
만성 난치성 기침을 이해하기 위해서는 먼저 기침 과민증후군의 개념에 대한 이해가 필요하다. 만성 기침에 대한 최근의 연구들은 만성 기침과 신경병증 질환(neuropathic disorder)과의 유사성, 기침 반사 과민성, 후두 과민성(후두는 기침 수용체의 밀도가 가장 높다)을 강조하고 있다. 최근에는 만성 난치성 기침 환자들의 대부분은 여러 가지 다른 원인들에 의한 한 가지 질환(a single umbrella with different subtypes)으로 설명할 수 있다는 의견이 제시되고 있는데, 이것이 기침 과민 증후군의 개념이다[7]. 기침 과민 증후군은 후두와 상기도의 과민성과 관련이 있는데, 기침 과민 증후군 환자들의 기도(airway)에는 Transient receptor potential V1 (TRPV1)이나 TRPA1과 같은 기침 수용체가 상향조절(upregulation)되어 있고 이로 인해 무해한 자극이더라도 과민하게 반응하여 기침이 유발되는, 일종의 기도의 감각신경 이상으로 설명할 수 있다는 것이다[8]. 만성 기침의 흔한 원인으로 알려져 왔던 기침형 천식, 비부비동염, 위식도역류 질환 등도 기침 과민 증후군의 서로 다른 아형(subtype)이라는 의견도 있다[9]. 또한, 만성 난치성 기침은 기침 과민 증후군의 한 표현형인데, 비록 유발 인자는 밝혀지지 않았지만 위식도 역류가 관련이 있을 것이라는 의견도 있다[7]. 이러한 관점에서 보면, 왜 단지 몇몇 사람들만 흔한 원인 질환이 있고 다른 사람들은 그렇지 않은지, 왜 원인 질환의 치료에도 종종 호전이 없는지, 왜 원인 질환 없이 기침이 발생하는지 등에 대한 설명이 가능하다. 하지만 기침 과민 증후군의 개념에 대한 제한점도 있는데, 대부분의 근거가 전문가 의견이라는 점과 기침 과민성을 객관적으로 확진할 방법이 없다는 것이다. 유럽 호흡기학회(European respiratory society)에서는 14개국의 44명의 전문가를 대상으로 기침 과민 증후군에 대한 설문조사를 시행하였다[10]. 대부분의 응답자들(89%)은 기침 과민 증후군이 유용한 개념이며 기관지 과민성과는 구분된다는데(82%) 동의하였다. 그러나 기전에 대해서는 의견의 불일치를 보였다. 예를 들면, 응답자의 약 70%에서는 기침 신경체계(neural mechanism)의 상향 조절이 만성 난치성 기침의 중요한 특징이라는데 동의를 하였지만, 기도의 염증이 감각신경의 활성화와 직접적인 관련이 있다는 응답자는 약 41%였으며, 기침반사 과민성이 대부분의 증상을 설명할 수 있다는 데에는 단지 45%만이 동의를 하였다. 또한, 진단에 있어서도 기침 과민 증후군이 구심성 신경의 과민성이 특징이기는 하지만, 현재로는 객관적으로 정량할 수 있는 검사법이 없기 때문에 단지 임상 증상만을 가지고 진단할 수밖에 없는 실정이다[9].
후두 과민성(laryngeal hypersensitivity)
후두 과민성은 만성 난치성 기침을 이해하는데 도움이 되는 또 하나의 다른 개념이다[11-14]. 무해한 자극에 대한 후두의 과민성의 증가로 정의할 수 있으며 기침, 호흡곤란, 발성 장애, 또는 성문연축 등을 동반한 후두 감각 이상의 증상들을 유발한다. 만성 난치성 기침의 환자들은 기침 외에도 다양한 증상을 호소하지만, 대부분의 환자들에서 이러한 증상들은 후두에 국한된다. 그래서 감각 이상을 정의하는 데에는 후두 과민 증후군(laryngeal hypersensitivity syndrome)이라는 용어가 좀더 적절할 수도 있을 것이다[15]. 이러한 후두의 감각 이상은 기침 그 자체보다 환자들을 더 불편하게 할 수도 있다. 후두 과민성 설문지가 후두 과민성을 측정하는데 도움이 될 수 있다[16]. 이 설문지는 통증/온도, 자극 증상, 기도폐쇄 증상의 3가지 그룹으로 1-7점의 총 14개의 항목으로 구성되어 있으며 정상 대조군의 평균은 19.2점이며 17.1점 이하이면 후두 과민성을 의심할 수 있다. 후두 과민 증후군의 다른 임상 양상으로는 모순성 대주름 운동(paradoxical vocal fold movement, PVFM), 인두 이물감(globus pharyngeus), 근긴장발성 장애(muscle tension dysphonia) 등이 있다[17,18].
만성 난치성 기침의 병인
기침 반사 과민성(cough reflex hypersensitivity)
기침 반사 과민성은 만성 난치성 기침의 중추성 또는 말초성 민감화에 관여하는 중요한 특징이다[8,19]. 상기도 감염에 의한 기도의 자극이 기침을 유발하는데, 이때 기도 점막에 손상을 주고 감각신경의 염증성 신경병증 변화를 일으켜 기침 반사의 과민성이 일어나게 된다[8]. 또한, 바이러스에 의한 상기도감염에서는 기도의 transient receptor potential (TRP) 수용체가 상향 조절되고[20] 이로 인해 기침이 반복되면서 화학 매개체들이 분비되는 염증성 기전을 통하여 더욱 기침을 조장하게 된다[8].
말초성 민감화(peripheral sensitization)
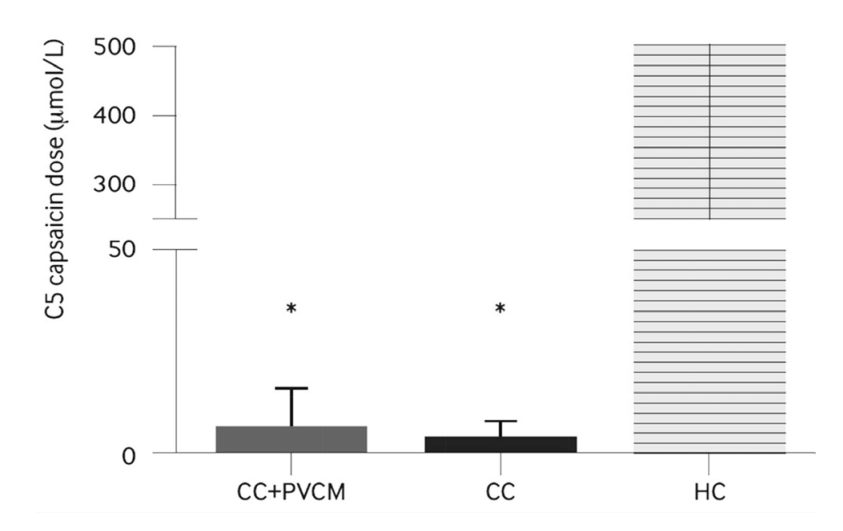
만성 기침에서의 말초성 민감화는 인후두, 식도, 비강, 기관지 등 미주신경에 의해 감각이 매개되는 부위에서 일어난다. 히스타민이나 프로스타글란딘 같은 염증매개 물질들이 구심성 신경말단(C-fiber)을 감작시키고 구심성 신경의 흥분도를 증가시켜 기침의 역치를 감소시키는데[21], 이는 만성 난치성 기침에서 TPRV1 수용체의 발현의 증가와 연관이 있다[22]. 기침 반사의 민감도는 TRPV1 수용체를 활성화시키는 capsaicin의 흡입으로 측정할 수 있는데, 만성 난치성 기침에서는 capsaicin에 대한 기침 반사 과민성이 현저히 증가해있다(Fig. 1) [11]. 비록 만성 난치성 기침에서 TRPV1 수용체의 역할이 증명되기는 하였지만, TRPV1 길항제인 SB-705498을 이용한 임상 시험에서는 의미 있는 결과를 보여주지는 못하였다. SB-705498은 capsaicin에 대한 기침 반사 감수성은 유의하게 향상시켰지만, 객관적인 기침 횟수, 기침의 강도, urge-to-cough, 기침 관련 삶의 질 등의 기침에 대한 임상적인 결과에 대해서는 대조군에 비해 유의한 결과를 보이지 못하였다[23]. 이는 기침 반사 감수성은 말초성 기전의 억제로 감소시킬 수 있지만, 기침 자체에 대한 치료를 위해서는 중추성 기전에 대한 치료도 필요하다고 할 수 있겠다.
중추성 민감화(central sensitization)
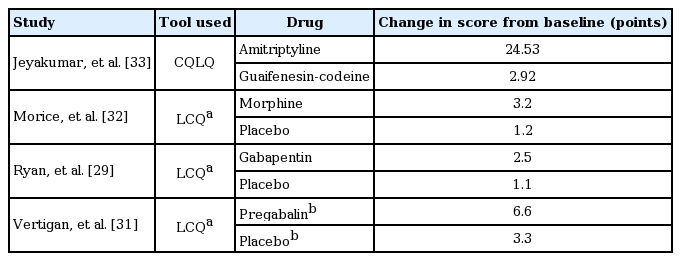
중추성 민감화는 기침을 막 하려고 하는, 하기 직전의 느낌인 “urge-to-cough”라고도 하며 중추성 감각 경로의 흥분도의 증가가 특징이다[24,25]. 중추성 민감화는 대표적으로 신경병증 통증의 기전으로 알려져 있는데, 만성 난치성 기침과 신경병증 통증 사이에는 유사한 공통점이 있어서[26] 만성 난치성 기침을 신경병증 기침으로도 생각할 수 있다. 즉, 신경병증 통증에서는 말초의 감각신경이나 중추성 투사경로(central projection pathway)의 조직 손상으로 신경세포의 활성도가 변하게 되고(말초성 또는 중추성 민감화), 이로 인하여 통각과민증(hyperalgesia)이나 무해자극통증(allodynia) 등과 같은 비정상적인 통증이 발생한다. 즉, 만성 난치성 기침인 신경병증 기침의 3가지 특징들, 후두 감각 이상, 기침과민증(hypertussia), 무해자극 기침(allotussia)은 신경병증 통증과 매우 유사하다는 것이다. 목의 감각 이상을 호소하는 후두 감각 이상은 신경병증 통증에서의 피부의 얼얼한 느낌(tingling sensation)과 같은 감각 이상과 유사하고, 기침을 유발하는 자극에 대한 과도한 기침인 hypertussia는 신경병증 통증에서의 자극에 대해 과도하게 통증 반응을 호소하는 hyperalgesia와 유사하다. 기침을 유발하는 자극에 아님에도 불구하고 기침을 하는 allotussia는 신경병증 통증에서의 만지기만 해도 통증을 호소하는 allodynia와 유사하다(Table 1) [27]. 이에 대한 근거로는 피부와 기도의 말초 신경 분포에서 서로 같은 종류의 신경섬유(Aβ, Aδ, C-fiber)로 구성되어 있다는 것과 통증과 기침을 담당하는 감각신경의 수용체의 종류가 서로 같다는 것이다[26]. 또한, 기능적 뇌 자기공명영상에서 capsaicin으로 자극 후 urge-to-cough를 느낄 때와 손바닥에 유해한 열을 가했을 때 활성화되는 뇌 영역이 서로 유사한 것도 만성 난치성 기침과 신경병증 통증 사이의 유사성을 뒷받침하는 증거가 될 수 있다[26]. 기침이 유발되기 직전의 urge-to-cough를 느낄 때 대뇌피질의 여러 부위가 활성화되는 것은 알려진 기침 반사의 수준인 뇌간(brain stem)을 넘어서 더 높은 수준의 중추성 기전(higher brain regulation)이 만성 난치성 기침과 관련이 있음을 시사한다고 할 수 있다[28]. 또한, 만성 난치성 기침에서 gabapentin [29], pregabalin [30,31], morphine [32], amitriptyline [33] 등의 같은 중추성 신경조절 물질에 대한 치료반응 역시 만성 난치성 기침에서 중추성 민감화의 역할을 뒷받침하는 근거가 될 수 있다[8,29]. 만성 난치성 기침에서 중추성 민감화의 기전이 관여한다는 결과를 보여주는 연구들을 표 2에 요약하였다.
성대주름 모순운동(PVFM)
만성 난치성 기침은 PVFM과도 연관이 있다[11]. PVFM은 자극 후에 흡기시 성대주름의 내전으로 인해 성대가 열리지 않고 닫혀버리는 비정상적인 후두의 운동패턴이다. 흔한 증상으로는 흡기시 호흡곤란, 협착음, 목의 답답함, 기침 등이 있는데, 이러한 증상들 역시 만성 난치성 기침의 증상들과 유사하다. 즉, 증상, 유발 인자, 목소리 분석 결과, 동반된 내과적 질환 등이 만성 난치성 기침과 PVFM 환자들에서 서로 다르지 않다는 점에서 PVFM 역시 만성 난치성 기침의 하나의 병태 생리로 여겨지고 있다(Fig. 2) [18].
만성 난치성 기침의 임상 양상
만성 난치성 기침의 임상적 특징은 하루 종일 발생하는 간헐적인 기침 발작이다. 기침은 주로 후두 근처에서 발생하며 에어컨이나 발성 같은 정상적으로는 기침을 유발하지 않는 자극에 기침을 하는 allotussia와 아주 낮은 농도의 자극에도 기침을 하는 hypertussia가 있다. 후두의 불편감이나 감각 이상도 기침을 일으키는 유발 인자가 될 수 있다[34]. 기침은 수개월에서 수년 동안 지속되기도 하며 특히, 여성에서 유병률이 높다. 이는 capsaicin에 대한 기침 반사 민감도가 남성에 비해서 여성에서 더 높고[10,35] 또한 여성에서 대뇌피질의 일차성 체성감각의 활성도가 높은 것과 연관이 있다[10]. 한 연구에서는 기침의 발생 시점이 폐경과 관련이 있다고 보고하였는데, 이는 에스트로겐 농도의 감소가 기침 반사의 민감도를 높이고, 폐경 동안 무증상의 기도 염증이 증가되는 것으로 설명하고 있다[35]. 다른 연구에서는 만성 난치성 기침 환자들의 42%에서는 기침이 바이러스성 상기도 감염과 함께 시작하였고 바이러스성 상기도 감염 환자의 36-43%에서는 감염 후 3개월 이상 기침이 지속되었다고 보고하였다[19,36]. 환자들은 기침과 더불어 후두 증상도 흔히 호소하며 만성 난치성 기침 환자의 약 40%에서 발성 장애가 동반된다[14,34]. 후두 과민성과 기침 반사 과민성은 건강한 정상 대조군에 비해서 증가되어 있으며 성문 폐쇄 반사(glottic closure reflex)라고 하는 후두 자극에 대한 성문의 반사적인 닫힘 역시 만성 난치성 기침 환자에서 증가되어 있다[37].
만성 난치성 기침의 진단
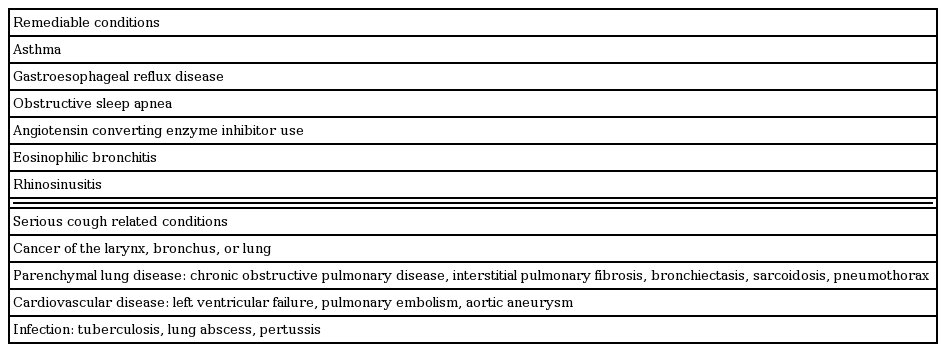
만성 난치성 기침은 만성 기침의 알려진 원인에 대한 검사 및 치료에도 불구하고 기침의 호전이 없을 때 진단할 수 있다[38]. 하지만 기침의 심각한 원인을 암시하는 경고 증상(alarm symptom)이 있을 경우에는 이에 대한 검사가 먼저 필요하다(Table 3). 객혈, 과도한 흡연, 호흡기계 진찰이나 흉부 방사선 사진의 이상 소견 등의 대표적인 증상이 있을 경우에는 폐암, 감염증, 또는 심각한 질환에 대한 검사가 즉시 이루어져야 한다. 만약 경고증상이 없다면 치료가 가능한 흔한 원인들에 대한 검사가 필요하다. 여기에는 천식(병력, 폐기능 검사, 기관지 유발 검사, 호기 산화질소 검사), 호산구성 기관지염(유도객담 호산구, 호기 산화질소 검사), 비부비동염(비강내시경), 위식도역류 질환(위식도내시경)에 대한 검사들이 포함된다. 이때에도 놓치지 말아야 할 심각한 질환에 대해서는 항상 염두에 두고 객관적인 검사를 포함한 자세한 병력 청취와 신체 검진이 적절이 이루어져야 한다(Table 4). 만성 난치성 기침은 충분한 내과적 검사 및 치료에도 불구하고 기침이 지속되는 경우로 정의되는 배제 진단으로 진단이 이루어진다. 이러한 환자들의 검사에 있어서는 만성 기침의 접근에 근거한 지침이 필수적이다[39,40]. 이러한 지침에 근거하여 충분한 검사 및 치료가 이루어졌음에도 불구하고 기침이 지속되는 경우 만성 난치성 기침으로 진단할 수 있다.
만성 난치성 기침의 치료
만성 난치성 기침의 치료는 비약물 치료와 약물 치료 두 가지로 나눌 수 있다. 비약물 치료로는 언어병리 치료(speech pathology management)가 있고 약물 치료에는 중추신경계에 작용하는 약물인 신경조절제(neuromodulator)가 있다.
언어병리 치료(speech pathology management)
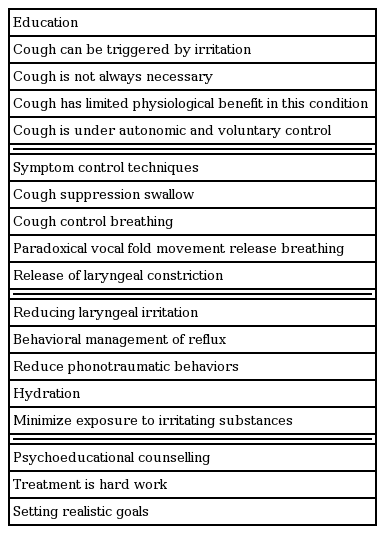
언어병리 치료의 첫 번째는 만성 난치성 기침의 특징을 파악하는 것이다. 기침의 특성은 어떠한지, urge-to-cough나 PVFM은 없는지, 목소리 변화는 없는지 등을 파악하는데, 이는 잘 수련된 언어병리학자(speech pathologist)에 의해 이루어져야 한다. Urge-to-cough에 대해서는 어떻게 유발되는지 즉, 특정한 냄새나 운동, 또는 말하거나 호흡하거나, 먹거나 마실 때 유발되는지 등의 유발 인자를 찾는 것이 중요하다. 그래서 기침이 발생하기 전, 이러한 urge-to-cough를 느낄 때 이것을 완화시켜서 기침을 억제하는 테크닉을 코치하는 것이다. 목소리 특성의 확인도 필요한데, 목소리의 톤의 높고 낮음이나, 큰 소리를 내거나, 오랫동안 말할 때 기침이 유발되는 건 아닌지 파악한다. 또한, PVFM 등의 유무 확인을 위한 후두 평가도 필요하다. 이렇게 얻어진 정보로 언어병리 치료 프로그램을 만든다. 언어병리 치료는 크게 4가지 부분으로 나눌 수 있다. 환자의 기침의 특성에 대해 교육을 하고, 기침 증상을 조절하는 테크닉을 알려주고, 후두의 자극을 감소시키는 법을 알려주고, 심리교육 상담을 하는 것이다(Table 5) [27]. 언어병리 치료의 목표는 기침을 유발하는 감각을 확인하는 법을 교육하여 기침의 수의적인 조절 능력을 향상시키고, 기침을 다른 신체 반응, 예를 들면 호흡이나 연하 운동으로 대신하게 하고, 후두를 자극시킬 수 있는 행동을 변화시키는 것이다. 만성 난치성 기침에서 이러한 언어병리 치료의 효과는 몇몇 연구들을 통해서도 그 효과가 입증되었다[12,41-44].
신경조절제(neuromodulator)
중추성 신경조절제(gabapentin, pregabalin, morphine, amitriptyline, baclofen)는 만성 난치성 기침의 병인과 관련이 있는 신경 민감화(neural sensitization)에 작용한다[45]. Morphine, gabapentin, amitriptyline, pregablain은 무작위 대조 시험에서 기침 관련 삶의 질과 레스터 기침 설문 점수(Leicester cough questionnaire score)를 대조군보다 유의하게 향상시켰다(Table 6)[29,31-33]. Baclofen은 무작위 대조 시험은 아니지만 비무작위 비교 연구에서 대조군보다 기침 반사 감수성을 유의하게 감소시켰으며[46], 역류성 기침에서도 유의한 효과를 보여주었다[47]. 만성 난치성 기침의 신경조절제 치료에 대한 한 체계적 문헌고찰을 보면 무작위 대조 시험이 2개 밖에 없고 연구들이 모두 이질적이기는 하지만, 대부분의 기침 관련 평가 지표들에서 임상적으로 유의한 효과가 있음을 보고하였다[38]. 하지만, 이러한 언어병리 치료와 신경조절제도 제한점들이 있다. 언어병리 치료는 기침을 감소시키기는 하지만, 완전히 제거하지는 못하고 신경조절제는 어지러움, 입마름, 졸리움, 인지력 장애 등의 부작용이 있다. 또한, 약제를 중단하였을 경우 다시 재발한다는 단점이 있다. 그래서 최근에 언어 병리 치료와 신경조절제의 병합 치료에 대한 연구가 진행이 되었고 그 결과가 발표가 되었다.
비약물 치료와 신경조절제의 병합 치료
최근 만성 난치성 기침에서 언어병리 치료와 신경조절제인 pregabalin의 병합 치료에 대한 연구가 진행되었다[31]. 40명의 환자를 무작위 배정하여 한 군은 언어병리 치료와 pregabalin 300 mg을 병합하여 치료하였고, 다른 한 군은 언어병리 치료와 위약을 병합하여 두 군을 서로 비교하였다. 기침에 대한 객관적인 평가 지표들, 레스터 기침 설문점수와 기침(visual analogue scale, VAS) 점수는 단독 치료군보다 병합 치료군에서 더 좋은 효과를 보였다. 중요한 것은 이전의 gabapentin 연구와는[29] 달리 치료 종료 후에도 기침의 억제 효과가 유지되었다는 점이다. 기침 반사 민감도에서는 두 군 모두에서 좋은 효과를 보였지만, 특히 병합 치료군에서 치료 전과 후의 차이가 더 컸고 이러한 효과 역시 치료 종료 후에도 계속 유지되었다. 결론적으로 만성 난치성 기침에서 약물 치료와 신경조절제의 병합 치료는 서로 다른 경로에 작용하여 좀 더 완전한 기침의 해소를 가져올 수 있었다.
새롭게 개발 중인 치료 약제
최근에는 만성 난치성 기침에 대한 새로운 약제들이 연구되고 있는데, 주로 기도의 말초 기침 수용체에 대한 길항제가 이에 속한다. TRPV-1 길항제는 무작위 대조시험에서 기침 반사 민감도가 TRPV-1 길항제 치료군에서 치료 전후로 유의하게 좋은 효과를 보였다. 하지만, 기침의 객관적인 지표인 시간당 기침 횟수나 기침 VAS 점수, 레스터 기침 설문 점수 등에서는 두 군 간에 유의한 차이를 보이지 못하였다. 즉, TRPV-1 길항제는 기침 반사 민감도는 개선시켰으나 기침에 대한 임상적인 효과는 보여주지 못하였다[23]. 퓨린성(P2X3) 수용체는 기도의 구심성 미주신경에 존재하며 감각뉴런의 과민성을 일으킨다. 만성 난치성 기침 환자를 대상으로 퓨린성 수용체 길항제(AF-219)의 효과를 연구한 무작위 대조시험에서는 기침의 증상에 대한 여러 가지 지표들이 대조군에 비해 AF-219 치료군에서 유의하게 좋은 효과를 보여주었다[48]. 기침 반사 민감도에 대한 AF-219의 효과에 대해서는 현재 임상 연구가 진행 중이다.
2016년 미국 흉부의사협회 가이드라인
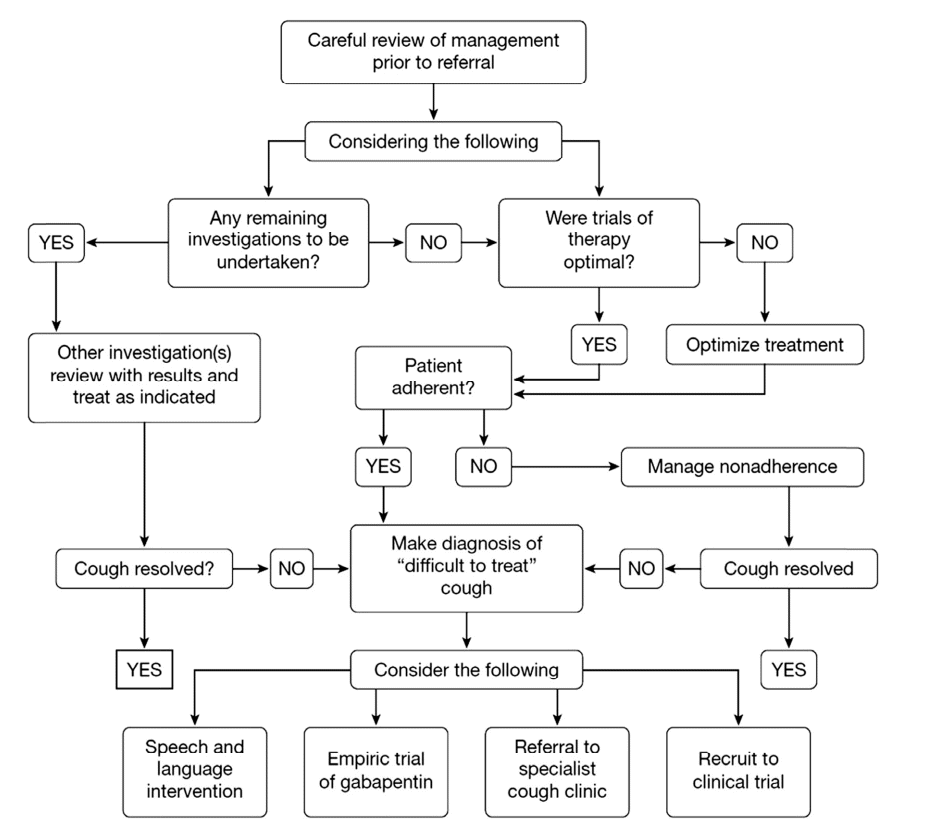
최근에 미국 흉부의사협회에서 만성 난치성 기침에 대한 가이드라인과 전문가 위원단 의견(expert opinion)을 발표하였다[45]. 여기에서는 만성 난치성 기침을 충분한 검사 및 치료에도 불구하고 8주 이상 지속되는 경우로 정의하였다. 가이드라인으로는 그림과 같이 제시하고 있으며(Fig. 3), 만성 난치성 기침이라고 판단이 되면 언어병리 치료를 하거나 gabapentin의 경험적 치료를 하거나 기침 전문가한테 의뢰를 하거나 임상 시험에 포함시킬 것을 권고하고 있다. 이 외에도 아래와 같은 6개의 권고사항을 발표하였다.
1. 만성 난치성 기침은 검사나 치료에도 불구하고 8주 이상의 설명되지 않는 기침으로 정의한다.
2. 만성 난치성 기침 환자는 가이드라인이나 프로토콜에 근거한 진단을 받아야 하며, 여기에는 기관지 과민성과 호산구성 기관지염에 대한 객관적인 검사 또는 코르티코스테로이드 경험적 치료 등이 포함된다.
3. 원인불명의 만성 난치성 기침 환자는 다양한 방식의 언어병리 치료가 권장된다.
4. 만성 난치성 기침 환자에서 기관지 과민성이나 유도객담 호산구 검사, 호기 산화질소 검사에 대한 결과가 음성일 경우에는 흡입용 코르티코스테로이드가 처방되어서는 안 된다.
5. 만성 난치성 기침 환자에서 gabapentin 치료를 시도해 볼 수 있는데, 치료 전 부작용이나 위험-이익 프로파일을 충분히 설명해야 하고, 치료 후 6개월 시점에서는 이러한 위험-이익 프로파일의 재평가 후 약물 치료의 지속 여부를 결정해야 한다.
6. 만성 난치성 기침 환자에서 산성 위식도역류 질환에 대한 정밀 검사가 음성일 경우, 프로톤펌프억제제의 사용을 권고하지 않는다.
하지만, 이상의 권고사항에 대한 권고 등급은 전부 전문가 의견이거나 2B 또는 2C의 매우 약한 권고 등급이므로 실제 임상에 적용할 때에는 이러한 점을 잘 고려해야 하겠다.
결 론
만성 난치성 기침은 진료 지침이나 프로토콜에 따른 충분한 검사 및 치료에도 불구하고 명확한 원인을 찾지 못하고 기침이 8주 이상 지속되는 경우를 의미한다. 병태 생리에는 기침 반사 과민성, 말초성 및 중추성 민감화, PVFM 등이 관여하는 것으로 알려져 있으며 기침 과민 증후군 또는 후두과민성의 개념으로 이해되고 있다. 치료로는 언어병리 치료와 신경조절제의 약물 치료, 또한 이 둘의 병합 치료도 사용될 수 있다. 지난 10여 년 동안 만성 난치성 기침의 이론적 이해와 평가 및 치료 등에 대한 점진적인 발전이 있었으며 이제는 하나의 임상적인 실체(clinical entity)로 인식되고 있다. 하지만, 진단기준이나 병태 생리가 아직도 밝혀지지 않은 부분이 많고 치료에 있어서도 구체적인 적응증이나 반응 평가 등 객관적인 기준이 애매하므로 향후 추가의 연구가 더 진행되어야 하겠다.