서 론
전신성 아밀로이드증은 단클론 경쇄에서 기인한 아밀로이드 원섬유 단백질이 세포외기질에 축적되는 형질세포 질환과 연관된 전신 질환으로 심장, 신장, 간, 자율신경, 말초신경, 피부 등에 침범되어 다양한 증상을 일으킨다. AL 아밀로이드증은 그중 가장 흔하고 잘 알려져 있는 아형으로 1950-1989년 기간 동안 미국에서 아밀로이드증 환자를 대상으로 하여 Kyle 등[1]이 시행한 역학조사 및 2000-2008년 기간 동안 영국에서 Pinney 등[2]이 아밀로이드증 환자를 대상으로 행해진 역학 연구에서 적어도 1년에 백만 명당 8명 이상 발생하는 것으로 보고되었다. 심장, 신장을 침범한 AL 타입의 아밀로이드증은 다수 보고되고 있다. 하지만 신이식 후 이식신에 발생한 AL 타입의 아밀로이드증은 매우 드문 사례로 외국에는 이식 후 이식신(kidney allograft)에 발생한 de novo AL 아밀로이드증에 대한 예가 드물게 보고된 바가 있지만 국내에서는 아직 그러한 사례 보고가 없다.
안정된 이식신장 기능을 가진 신장 이식 수여자에서 우연히 발생한 단백뇨에 대한 원인 평가를 위해 시행한 신 조직검사에서 이식신의 de novo 아밀로이드증을 진단하여 보고하는 바이다.
증 례
환 자: 62세 남자
주 소: 노작성 호흡곤란
현병력 및 과거력: 양쪽 방광요관 역류성 요로병증, grade III (vesicoureteral-reflux-uropathy, grade III, both)에 의한 말기신부전으로 3년간 혈액투석 치료를 받던 환자로 1992년 12월 신장이식 수술(공여자 23세 남자, 비혈연 간 생체이식)을 시행받았다. Cyclosporine (아침 125 mg, 저녁 100 mg)과 prednisolone (7.5 mg 하루 한 번)을 투약해오던 중 2005년 9월 혈청 크레아티닌(creatinine)이 1.5에서 1.9 mg/dL로 상승되어 신장조직 생검을 시행한 결과, 이식신장의 거부 반응을 시사하는 신세뇨관염(tubulitis)의 소견은 보이지 않으면서 신세뇨관 및 신간질에 섬유화를 동반한 만성 이식신 병증(chronic allograft nephropathy, grad II [a])이 관찰되었다(Congo-red stain 음성). 당시 투약하던 면역억제제를 tacrolimus (2 mg 하루 두 번), mycophenolate mofetil (500 mg 하루 두 번), prednisolone (6 mg 하루 한 번 아침)으로 변경하였다. 그 후 단백뇨 발생 및 혈청 creatinine의 증가 없이 안정된 이식신장 기능이 관찰되던 중 2013년 10월 1회성 소변 검사(spot urine test)에서 단백 1(+)가 발생하였으나 경과 관찰하였고 2014년 1월 1회성 소변 단백 2(++), 2014년 3월 1회성 소변 단백 3(+++)으로 증가된 소견을 보여, 단백뇨의 원인 평가를 위해 전기영동 검사, 유리형경쇄 검사 및 신장 조직검사를 시행하였다. 흡연(40 pack-years) 중이었고, 간염이나 결핵 등의 과거력은 없었다.
이학적 소견: 2014년 4월 내원시 키 167 cm, 체중 58 kg, 혈압 83/57 mmHg, 맥박 74회/분, 체온 36°C, 호흡수 20회/분이었다. 흉부 청진에서 양측 폐하부의 거친 호흡음이나 심 잡음은 들리지 않았고 노작성 호흡곤란을 호소하였다(뉴욕심장협회 기능적 분류 III).
검사실 소견: 말초 혈액 검사에서 백혈구 10.5 × 103/mm3 (참고치 4-10 × 103), 혈색소 14.4 g/dL (참고치 12-16), 혈소판 196 × 103/mm3 (참고치 140-440 × 103), 혈청 생화학 검사에서 혈중요소질소 20 mg/dL (참고치 0-27), 크레아티닌 0.9 mg/dL (참고치 0.4-1.3), 총 단백 5.9 g/dL (참고치 5.8-8), 알부민 3.4 g/dL (참고치 3.3-5), 혈청 전해질 검사에서 나트륨 145 mM/L (참고치 137-150), 칼륨 3.8 mM/L (참고치 3.5-5.3)였고 프로트롬빈시간 10.4초(참고치 11-13), 활성화부분트롬보플라스틴시간28.5초(참고치28-45)였으며심장표지자검사에서 creatine kinase-isoenzyme MB (CK-MB) 4.38 ng/mL (참고치 0-5), troponin-T (TnT) 0.060 ng/mL (참고치 0-0.1), N-terminal pro-brain natriuretic peptide (NT-proBNP) 3,366 pg/mL (참고치 0-300)였다. 1회성 소변 검사에서 단백 2+, 혈중 글로불린 검사에서는 IgM 44.1 mg/dL (참고치 40-230), IgG 920 mg/dL (참고치 700-1,600), IgA 136.6 mg/dL (참고치 70-400)였다.
심전도: 사지 유도의 QRS군에서 저전압 소견이 관찰되었다.
혈청 및 소변 단백전기영동 검사/면역고정 전기영동 검사 및 유리형경쇄 정량 검사(turbidimetric assay): 혈청 및 소변 단백전기영동 검사에서 M-단백띠(M-band)가 관찰되었고, 혈청 및 소변 면역 전기영동 검사에서 M-단백띠는 모두 유리형경쇄(free light chain lambda) lambda (λ)형으로 확인되었다. 유리형경쇄 정량 검사에서 소변 유리형경쇄 kappa형 및 lambda형은 각각 158.07 mg/L (참고치 0.012-32.710), 2,390 mg/L (참고치 0-4.99), 혈청 유리형경쇄 kappa형 및 lambda형은 각각 21.70 mg/L (참고치 3.3-19.4), 875.23 mg/L (참고치 5.71-26.30)로 정상보다 높은 수치를 보였고, 혈청 유리형경쇄 kappa/lambda의 비는 0.02 (참고치 0.26-1.65)로 비정상 소견을 보였다.
신장초음파 소견: 좌측 이식신에 비정상적인 소견은 없었으며 우측 자가신장은 국소적인 병변이 없이 위축되어 있었으며, 좌측 자가신장은 관찰되지 않았다.
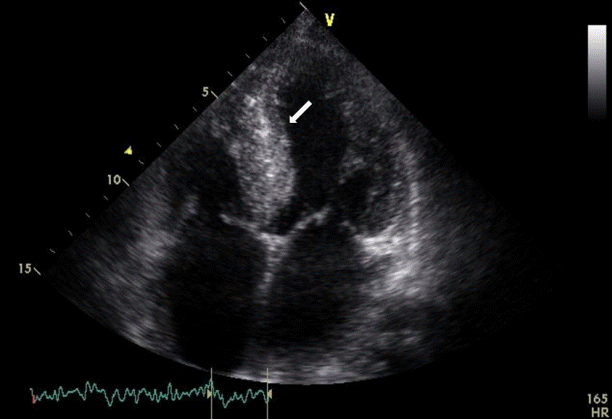
심장초음파 소견: 심박출률 67%, 심방확장, 심한 좌심실비대, 우심실비대, 심실벽 두께 증대와 함께 승모판역류 II/IV, 초기 승모판 혈류 속도와 초기 승모판륜 속도의 비(E/E') 17.4, 승모판의 확장초기 속도/확장후기 속도의 비(E/A) 1.3으로 중등도의 좌심실이완 장애 소견이 관찰되었고 심실중격 두께(interventricular septal thickness)는 이완기 14.7 mm (참고치 8-11), 수축기 19.3 mm로 증가되어 있었으며 침윤성 심근병증에서 전형적으로 보이는 얼룩덜룩한 형태(speckled pattern)의 심근 소견이 보여 심장 아밀로이드증을 의심하였다(Fig. 1).
골수조직 검사 소견: 골수 검사 결과 정상적인 삼선형 조혈(trilinear hematopoiesis)을 보였으며 골수내 형질세포가 차지하는 백분율은 3%로 약간 증가되어 있었고 핵이 한쪽으로 치우치지 않은 비정상적인 형질세포가 흩어져서 분포하였다. 국소적인 형질세포의 군집은 관찰되지 않았다.
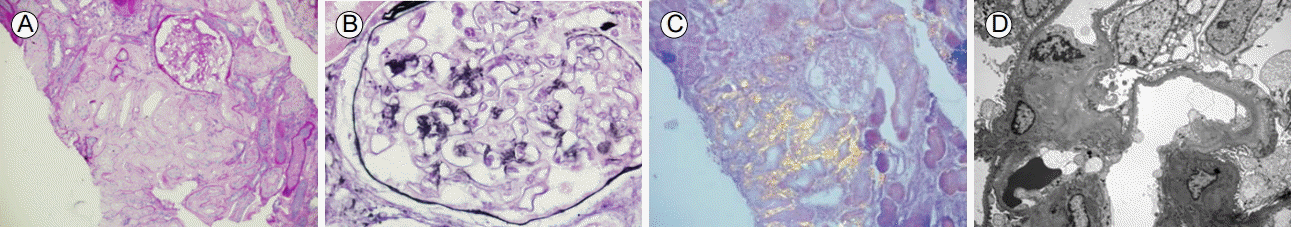
광학현미경 검사: 관찰된 사구체는 6개였으며 한 사구체는 구형경화되어 있었다. 나머지 사구체에는 메산지움 부위에 균질한 양상의 물질의 축적에 의한 기질의 증가가 관찰되었다(Fig. 2A). 간질은 10% 이하의 소수 단핵세포의 침윤과 함께 균질성을 띄는 물질의 축적 소견을 보였다. 세뇨관은 10% 정도에서 경한 위축 소견을 보였고 명확한 세뇨관의 염증은 없었다. Methenamine silver stain 염색 후에 사구체 기저막에서 수직 방향으로 정렬된 가시 모양의 상피하 침전물이 관찰되었고(Fig. 2B) Congo-red 염색 후에 편광현미경으로 보았을 때 특징적인 붉은색과 연두색이 혼재된 소위 apple-green색을 띠어(Fig. 2C) 아밀로이드증을 진단하였다. 파라핀 조직을 이용한 면역조직화학적 검사에서 kappa 및 lambda에 대해서는 음성이었다.
면역형광염색: 관찰된 사구체는 2개였으며 메산지움, 모세혈관 부위에 IgG, IgM, C3, C4, C1q, 섬유소원에 대해 음성 소견을 보였다.
전자현미경 검사: 관찰된 사구체는 1개였으며 메산지움 부위에서는 직경이 긴 분지하지 않는 유전분 원섬유의 축적에 의한 기질의 증가가 관찰되었고, 메산지움세포의 증식은 관찰되지 않았다. 기저막은 부분적으로 같은 원섬유로 인해 두꺼워져 있었다(Fig. 2D). 족세포는 부분적인 융합을 보였다.
치료 및 치료 후의 반응: 환자는 신 조직검사, 심장초음파 검사, 소변 및 혈청 유리형경쇄 검사를 통하여 이식신 및 심장을 함께 침범한 AL 아밀로이드증으로 진단되었고 TnT 0.060 ng/mL, NT-proBNP 3,366 pg/mL, 혈청 유리형경쇄 차이 ≥ 180 mg/L로 revised Mayo stage IV에 해당되어 6개월 정도의 중앙 생존율이 예상되었으며 이식신에 대한 유지 면역억제제의 변경 없이 1개월 간격으로 4일간 melphalan 8 mg/day와 deflazacort 18 mg/day 치료를 시작하였다.
치료 후의 반응 모니터링을 위해 치료 후 1개월마다 소변 M-단백, 소변 유리형경쇄 검사, CK-MB, TnT를 평가하였다(Table 1). 장기 반응은 NT-proBNP 및 TnT, 사구체여과율의 감소 여부로 평가하였고 클론성 형질세포의 변화는 유리형경쇄 생산량과 M-단백의 양의 감소 여부로 평가하였다. 치료 시작 3개월 후 장기 반응, 클론성 형질세포 변화에서 모두 질환 진행(disease progression)을 보이고 인후염, 노란 콧물, 대상포진 등의 감염 증상이 심해져 항암 치료를 중단하였고 이후 심부전에 대한 보존적인 치료 중 노작성 호흡곤란이 더 심해지다가(뉴욕심장협회 기능적 분류 III-IV) 진단 6개월 만에 급성 심장사(sudden cardiac death)로 사망하였다.
고 찰
전신성 아밀로이드증이 신장과 심장을 침범한 경우에 대해서는 국내외 문헌에 다수 보고되고 있다. 국내 Lee 등[3]이 심장에 침범한 아밀로이드증의 발생 빈도와 예후에 대해 발표한 논문에 의하면 129명의 전신성 아밀로이드증 환자들 중 62명이 심장침범, 49명이 신장침범 환자였으며 신장, 심장을 함께 침범한 보고로는 대한내과학회지에 Kim 등[4]이 발표한 증례가 있다.
하지만 이식신에서 발생한 신생(de novo) AL 아밀로이드증은 매우 드물고 외국에서의 첫 보고는 1998년 Le 등[5]이 발표한 이식신에 발생한 de novo 아밀로이드증 증례이며 이후 1999년 Dysseleer 등[6]이 단세포군 감마글로불린병증(monoclonal gammopathy)이 있던 환자에서 신장 이식 후 de novo 아밀로이드증이 발생한 사례를 보고하였다. 이후 2010년 Chen 등[7]이 신이식 후 단백뇨 및 신부전의 드문 원인으로서 이식신에 발생한 de novo 아밀로이드증 사례를 발표한 바가 있다. 이후 2011년 Qian 등[8]이 신이식 후 16년에서 31년 사이 이식신에 발생한 de novo AL 아밀로이드증에 대한 4가지 증례를 모아 발표하였고 2014년 Guitard 등[9]이 발표한 신이식 후 면역억제제를 tacrolimus에서 everolimus로 바꾼 후 단백뇨를 보이면서 이식신에서 우연히 발견된 de novo AL 아밀로이드증 사례가 있다.
본 증례는 신이식 22년 후 단백뇨가 발생하여 전기영동 검사, 유리형경쇄 검사 및 이식신 생검을 시행하여 이식신에 발생한 lambda형의 유리형경쇄 질환으로 확인되었다. 이식신에 발생한 AL 타입의 아밀로이드증은 매우 드문 사례로 저자들이 확인한 바로는 국내 첫 보고이다.
이식신에 AL 타입의 아밀로이드증이 발생하는 경우의 치료에 대한 자료는 매우 제한적이다. Qian 등[8]이 발표한 4가지 증례 발표에 의하면 bortezomib와 prednisolone으로 치료한 증례의 경우 이식신 기능이 안정화되었고 자가조혈모세포 이식을 시행한 증례의 경우 혈액학적으로 완전한 관해를 이루었다. 그러나 전자는 치료 후 관찰 기간이 5개월로 짧았고 후자는 이미 침착된 아밀로이드 단백에 의한 것으로 추정되는 이식신 부전이 발생하여 결국 두 번째 신이식이 필요하였으며 나머지 두 증례에서는 치료를 고려하던 중 예기치 못한 뇌혈관 질환 및 심근경색(추정)으로 인해 진단 3개월, 10개월 후에 사망하였다[8].
본 증례의 환자는 심장초음파에서 심장 아밀로이드증이 의심되었고 이러한 경우 심장 질환의 진행 정도가 생존율의 예측에 중요하여 질환의 병기 설정 및 예후 평가를 위해 revised Mayo staging system을 사용하였다. Kumar 등[10]에 의하면 revised Mayo staging system은 AL 아밀로이드증 환자에서 진단 당시 NT-proBNP, TnT, 혈청 유리형경쇄 차이의 일정 수치 이상을 위험 인자로 선정하고 해당되는 위험 인자 개수와 stem cell transplantation 시행 여부에 따라 생존율이 예측 가능하다. 본 증례의 환자는 revised Mayo stage IV에 해당하였고 이 경우에 진단 후 중앙생존율이 5.8개월 정도로 예측되었다.
AL 아밀로이드증의 치료는 형질세포 질환의 치료로 이를 위해 면역글로불린 단클론성 경쇄의 생산 감소를 목표로 한 항암 치료를 시행한다. 현재 시행되고 있는 항암 치료는 고용량 경정맥 melphalan (high dose melphalan, HDM) 치료 후 자가조혈모세포 이식(autologous stem cell transplantation, ASCT), melphalan과 prednisone 병합 요법 또는 melphalan과 dexamethasone 병합 요법, proteasome 억제제인 bortezomib를 기반으로 한 병합 요법, thalidomide, lenalidomide를 기반으로 한 병합 요법 등이 있다. 형질세포 질환의 치료와 함께 침범한 특정 장기에 대한 치료가 병행되어야 하고 심장 AL 아밀로이드증의 경우에는 심장 이식 수술 후 HDM/ASCT를 시행하는 방법이 있으나 본 증례의 환자와 같이 대부분의 환자가 심장 외 다른 장기의 아밀로이드증을 동반하는데 이런 경우 심장 이식 수술의 금기에 해당한다. 그 외 이미 침착된 아밀로이드 단백에 대한 항체를 이용한 치료법 등이 개발 연구 중이다.
선택된 전신성 아밀로이드증 환자에서 항암 치료 후 자가조혈모세포이식이 1차 약제임이 잘 정립되어 있으나 자가조혈모세포 이식은 치료 관련 사망률이 높아서 현재는 환자를 엄밀히 위험 계층화하여 자가조혈모세포 이식을 받을 적임성이 있는지 평가해야 한다. NT-proBNP가 5,000 pg/mL 이하이고 troponin이 0.06 ng/mL 이하인 경우 치료 연관 치사율은 1% 미만이지만 심장 표지자 수치가 높으면 자가조혈모세포 이식 후 조기 사망률을 예측하는 독점적 인자가 된다. 본 증례의 환자는 TnT 0.060 ng/mL, NT-proBNP 3,366 pg/mL로 치료 관련 사망률이 높게 예측되었고 따라서 자가조혈모세포 이식의 적응증이 되지 않았다.
자가조혈모세포 이식의 적응이 되지 않는 전신성 아밀로이드증 환자에서 melphalan, dexamethasone 병합 요법이 표준 치료이고 최근에는 bortezomib를 기반으로 한 병합 요법(bortezomib, cyclophosphamide, dexamethasone)이 일차 치료로 대두되고 있다. Bortezomib는 높은 혈액학적, 장기 반응으로 인해 심한 심장침범이 있는 예후가 나쁜 전신성 아밀로이드증 환자에서 그 사용이 늘고 있다. 본 증례 환자는 비용 문제로 bortezomib는 사용할 수 없었지만 이와 같은 환자에게 bortezomib, thalidomide, lenalidomide 등 새로운 약물을 기반으로 한 병합 요법이 더욱 적절한 치료 방법이 아니었을까 생각되며 그 외 이미 침착된 아밀로이드 단백에 대한 항체를 이용한 약물 등이 향후 기대되는 치료이다.
본 증례의 환자의 경과가 좋지 않았던 것은 아밀로이드증을 진단할 당시 이미 심한 노작성 호흡곤란 및 심장의 수축 기능 부전을 반영하는 저혈압 등 심장침범이 상당히 진행한 상태였던 점과 함께 경제적인 이유로 인해 자가조혈모세포 이식 및 bortezomib 등의 새로운 약물을 기반으로 한 병합 요법을 하지 못한 점, melphalan과 prednisolone 병합 요법을 시작하였으나 치료 관련 사망률을 낮추기 위해 낮은 용량을 사용하였고 혈액학적 및 장기 반응이 좋지 않았던 점, 이미 침착된 아밀로이드 단백의 독성으로 인해 심부전이 악화되었을 가능성 등이 영향을 미쳤을 것으로 생각된다.
이식신의 아밀로이드증은 진행되어 이식신 기능 저하가 발생할 수 있겠지만 이식신에 발생한 아밀로이드증의 경우에도 심장침범의 정도가 환자의 예후를 결정할 수 있을 것으로 보인다. 향후 신장 이식 후 발생하는 단백뇨를 보이는 환자에서 그 원인을 감별하기 위해서 신부전의 기저 질환과 상관없이 혈청 및 소변 전기영동 검사와 유리형경쇄 검사가 시행되어야 하며 이식신 아밀로이드증으로 진단되는 경우 동반되는 장기, 특히 심장침범을 동반한 경우에 대한 치료 전략 수립이 필요하다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






