쇼그렌증후군에 동반된 원위신세관산증 2예
Two Cases of Distal Renal Tubular Acidosis accompanied by Sjögren’s Syndrome
Article information
Abstract
저자들은 저칼륨혈증 및 신석회증을 각각 주 증상으로 발현된 쇼그렌증후군 동반 원위신세관산증 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Renal tubular acidosis (RTA) is a syndrome characterized by hyperchloremic metabolic acidosis and an inability to excrete highly acid urine, in which the impaired acid excretion is disproportional to the reduction in the glomerular filtration rate. Distal renal tubular acidosis (dRTA) is frequently associated with immune-mediated disease, including Sjögren’s syndrome. Sjögren’s syndrome is a systemic autoimmune disease that mainly affects exocrine glands, such as the lacrimal and salivary glands, resulting in xerophthalmia and xerostomia. Extraglandular manifestations are frequent and may include renal involvement. Recently, we experienced two cases of renal tubular acidosis in patients with Sjögren’s syndrome. The first patient had lower extremity weakness and hypokalemia and the second had nephrocalcinosis. We discuss the frequency and pathogenesis of dRTA in Sjögren’s syndrome.
서 론
원위신세관산증은 원위신세관에서의 산 분비 배설장애로 인해 요의 산성화 장애와 고염소혈증성 대사성 산증을 보이는 질환이다. 원인은 크게 원발성과 속발성이 있으며 속발성의 경우에는 자가면역질환과 관련되어 있는 경우가 많다. 쇼그렌증후군(Sjögren’s syndrome)은 눈물샘과 침샘 등의 외분비 기관을 주로 침범하여 안구건조증, 구강건조증 등의 증상을 나타내는 자가면역질환이다.
쇼그렌증후군에서 신장을 침범하는 비율은 18.4%에서 67%까지 보고에 따라 다양하게 나타나고 있다[1]. 조직학적으로는 신증후군, 간질성 신염 등의 다양한 형태로 나타나며, 기능적으로는 원위신세관산증(type 1)이 가장 흔하게 나타나는 것으로 알려져 있다. 대개 원위신세관산증은 무증상으로 발현되는 경우가 많으나, 저칼륨혈증, 신석회증을 동반할 수 있다[2]. 저자들은 쇼그렌증후군에서 심한 저칼륨혈증과 신석회증으로 발현한 원위신세관산증 2예를 경험하여 문헌고찰과 함께 보고하는 바이다.
증 례
증례 1
환 자: 여자 21세
주 소: 하지 위약감
과거력 및 현병력: 7년 전 양 하지 점상출혈이 발생하였고, 당시 헤노흐-쇤라인 자반증(Henoch–Schönlein purpura)이 의심되어 스테로이드를 투여받았으며, 이후에도 3-4개월마다 자반증이 반복되었다. 내원 1년 전부터 간헐적인 오심을 느꼈으며, 내원 2개월 전부터 점차 심해지면서 식사량이 감소했다. 내원 1일 전 아침 기상 후 양측 하지에 쥐가 나는 듯한 느낌과 위약감이 발생하였고, 점차 상지 쪽으로 위약감이 진행하여 응급실로 내원하였다.
가족력 및 사회력: 특이사항은 없었고, 약물 복용의 병력도 없었다.
계통 문진(review of system): 2개월간 6 kg의 체중이 감소되었고, 위약감 및 오심이 동반되었다.
신체검진: 내원 당시 혈압은 112/70 mmHg, 맥박수는 62회/분, 호흡수는 18회/분, 체온은 36.9℃였다. 신장은 155 cm, 체중은 43.1 kg였다. 운동기능 검사에서 양 상지는 medical research council grade Ⅴ로 정상이었고, 양 하지는 grade Ⅱ의 위약감이 있었다. 흉부와 복부 검진에서 특이소견은 없었다.
검사실 소견: 말초혈액 검사에서 백혈구 5,300/mm3, 혈색소 11.0 g/dL, 혈소판 138,000/mm3였으며, C-반응단백은 0.07 mg/dL였다. 전해질 검사에서 나트륨 140 mmol/L, 칼륨 2.0 mmol/L, 염소 123 mmol/L, 총 이산화탄소는 12 mmol/L, 오스몰 농도 309 mOsmol/kg였다. 동맥혈 가스분석은 pH 7.19, pCO2 23 mmHg, pO2 123 mmHg, HCO3- 9 mmol/L, 혈청 음이온차 5 mmol/L 그리고 산소포화도는 98%였다. 생화학 검사에서 혈액요소질소 23 mg/dL, 크레아티닌 1.44 mg/dL, 총 단백 8.3 mg/dL, 알부민 3.7 mg/dL, AST 34 U/L, ALT 34 U/L, ALP 63 U/L, 총 빌리루빈 0.6 mg/dL였다. 요 검사에서 비중 1.005, pH 6.5, 알부민 ±, 적혈구 1-4/HPF, 백혈구 < 1/HPF였다. 요 전해질 검사에서 나트륨 25 mmol/L, 칼륨 9.4 mmol/L, 염소 29 mmol/L, 오스몰 농도 126 mOsmol/kg였고, 요 음이온차는 5.4 mmol/L로 양의 값을 보였다. Trans-tubular potassium gradient (TTKG)는 11.52였다. 24시간 소변 검사에서 Na 170 mmol/day (정상 범위 40-220 mmol/day), K 88 mmol/day (정상 범위 25-120 mmol/day), Cl 158 mmol/day (정상 범위 110-250 mmol/day), Ca 30 mg/day 이하(정상 범위 70-180 mg/day), citrate 0.40 mmol/day (정상 범위 1.6-6.4 mmol/day)였다.
면역학적 검사에서 항핵항체 1:160 (speckled pattern), 류마티스인자 111 IU/mL (positive), 항Ro 항체와 항La 항체는 양성, 스트렙토라이신 O, 항이중가닥 DNA 항체, 항SCl 70 항체, 항RNP 항체는 음성이었다. 혈청 C3 68 mg/dL (정상 범위 70-150 mg/dL), C4 14 mg/dL (정상 범위 10-35 mg/dL)였다. IgA 228 mg/dL (정상 범위 90-400 mg/dL), IgM 177 mg/dL (정상 범위 45-230 mg/dL)였고 IgG 2,560 mg/dL (정상범위 700-1,700 mg/dL)로 증가되어 있었다. 호르몬 검사에서 레닌 1.0 ng/mL/hr, 알도스테론 15.3 ng/dL로 정상이었다. 갑상선 기능은 정상이었다.
방사선학적 소견: 흉부 X-선 검사에서 특이소견은 없었다. 신장초음파 검사에서 이상소견은 관찰되지 않았다. 타액선 스캔(salivary gland scan) 검사에서 턱밑샘과 귀밑샘의 흡수가 감소되어 있었다(Fig. 1).
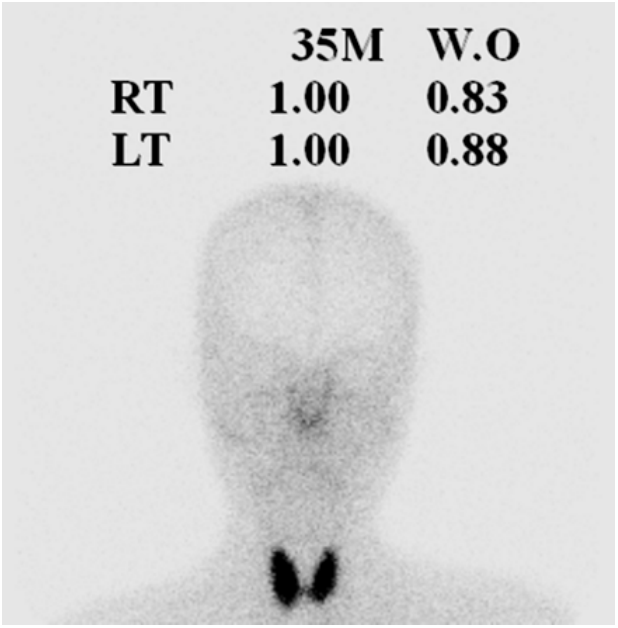
Decreased submandibular and parotid salivary glands. M, minutes; W.O, wash out; RT, right; LT, left.
그 외 검사 소견: 중탄산나트륨 부하 검사(bicarbonate loading test)를 시행하였다. 중탄산나트륨 투약 후 시행한 정맥혈 가스분석에서는 pH 7.503, pCO2 40.4 mmHg, pO2 16.5 mmHg, HCO3- 30.5 mmol/L였고, 요 pH 7.574, pCO2 27 mmHg, HCO3- 25 mmol/L였다. 요-혈액 pCO2 차이(UBpCO2)는 -13 mmHg로 30 mmHg 미만이었으며, 중탄산염 분획배설률(fractional excretion of HCO3-, FeHCO3-)는 5%로 H+-ATPase의 결함에 의한 원위신세관산증에 합당한 소견을 보였다[3].
치료 및 경과: 환자는 상기 증상 및 자가항체 등 검사실 소견으로 쇼그렌증후군에 동반된 원위신세관산증을 진단받고 prednisolone 및 dapsone, potassium citrate를 경구복용하기 시작하였다. 치료 3개월 뒤 추적 검사에서 혈청 나트륨 138 mmol/L, 칼륨 4.7 mmol/L, 염소 111 mmol/L, 총 이산화탄소 21 mmol/L로 원위신세관산증은 비교적 안정적인 상태를 유지하였다. 이후 prednisolone 증량 및 감량을 반복하였으며, 복약 순응도가 다소 떨어지면서 피부 자반증이 심해지고 적혈구침강속도(erythromcyte sedimentation rate)는 상승소견을 보여 cyclophosphamide를 경구로 약 2달간 복용하였다. 현재 prednisolone만유지중에있으나증상에큰호전이없어 rituximab을 사용하고 호전 여부를 관찰 중이다.
증례 2
환 자: 여자 28세
주 소: 건강검진에서 발견된 신석회증
과거력 및 현병력: 환자는 초등학교 시절부터 입이 잘 마르고 혀가 갈라지는 증상이 있었고, 중학교 무렵 턱밑샘이 불룩하게 튀어나와 수술을 받은 병력이 있는 분으로, 2007년 쇼그렌증후군(Sjögren’s syndrome)으로 진단받은 후 hydroxychloroquine과 prednisolone을 복용하며 지냈다. 대학교 때 요로결석이 3회 반복적으로 발생하여 체외충격파쇄석기(extracoporeal shock wave lithotripsy)로 치료받은 병력이 있었다. 최근 건강검진으로 시행한 복부초음파에서 신장에 석회화 소견이 관찰되어 신장내과 외래로 내원하였다.
가족력 및 사회력: 특이사항은 없었다.
계통 문진(review of system): 두통 및 어지럼증을 호소하는 것 외에 특이소견은 없었다.
신체검진: 내원 당시 혈압은 95/60 mmHg, 맥박수는 64회/분, 호흡수는 18회/분, 체온은 36.8℃였다. 신장은 166.5 cm, 체중은 44.5 kg였다. 복부 및 흉부 검진에서 특이소견은 없었다.
검사실 소견: 말초혈액 검사에서 백혈구 5,310/mm3, 혈색소 10.7 g/dL, 혈소판 255,000/mm3였으며, 적혈구침강속도 101 mm/hr, C-반응단백 0.02 mg/dL였다. 전해질 검사에서 나트륨 139 mmol/L, 칼륨 3.1 mmol/L, 염소 103 mmol/L, 총 이산화탄소 23 mmol/L, 오스몰 농도 292 mOsmol/kg였다. 동맥혈 가스분석은 pH 7.355, pCO2 35.1 mmHg, pO2 152 mmHg, HCO3- 20.1 mmol/L, 혈청 음이온차는 13 mmol/L였다. 생화학 검사에서 혈액요소질소 15 mg/dL, 크레아티닌 1.26 mg/dL, 총 단백 8.9 mg/dL, 알부민 4.1 mg/dL, AST 23 U/L, ALT 11 U/L, ALP 42 U/L, 총 빌리루빈 0.5 mg/dL였다. 요 검사에서 비중 1.007, pH 7.5, 알부민 ±, 적혈구 5-9/HPF, 백혈구 20-29/HPF였다. 요 전해질 검사에서 나트륨 66 mmol/L, 칼륨 32.4 mmol/L, 염소 64 mmol/L였고, 크레아티닌 54.13 mg/dL, 오스몰 농도 318 mOsmol/kg였다. 요 음이온차는 34.4 mmol/L였고, 요 pH는 7.5였다. TTKG는 8.04였다.
방사선학적 소견: 흉부 X-선에서 특이소견은 없었다. 신장초음파 검사에서 오른쪽 신장은 11.2 cm, 왼쪽 신장은 11.0 cm로 크기는 정상 범위였다. 양쪽 신장 수질내 뚜렷한 신석회증이 확인되었고 수신증은 보이지 않았다(Fig. 2).
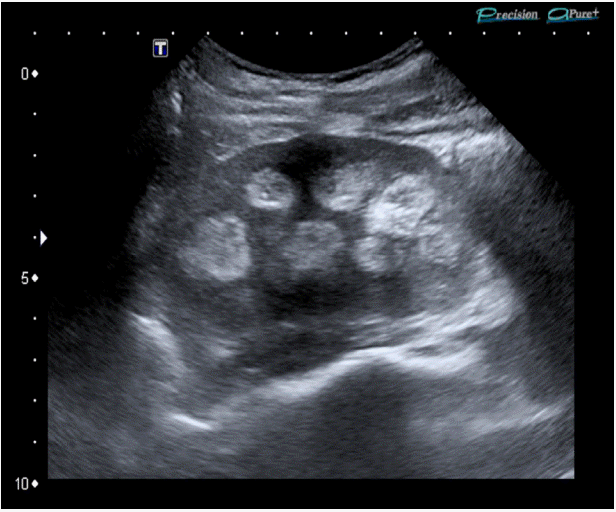
Ultrasonographic appearance of the patient’s kidney showing increased echogenicity of the renal medulla (medullary nephrocalcinosis).
그 외 검사 소견: 중탄산나트륨 부하 검사(bicarbonate loading test)를 시행하였다. 중탄산나트륨 투약 후 시행한 정맥혈 가스분석에서는 pH 7.463, pCO2 40.9 mmHg, pO2 48.3 mmHg, HCO3- 28.8 mmol/L였고, 요 pH 7.132, pCO2 37.1 mmHg, HCO3- 11.9 mmol/L였다. 요-혈액 pCO2 차이(UBpCO2)는 -3.8 mmHg으로 30 mmHg 미만이었으며, FeHCO3-는 0.74%로 H+-ATPase의 결함에 의한 원위신세관산증에 합당한 소견을 보였다[3].
치료 및 경과: 환자는 쇼그렌증후군으로 류마티스내과 외래에서 prednisolone을 복용하고 있었던 것에 potassium citrate를 추가하여 복용하기 시작하였다. 치료 3개월 뒤 시행한 추적 검사에서 혈청나트륨 139 mmol/L, 칼륨 3.6 mmol/L, 염소 107 mmol/L, 총 이산화탄소 25 mmol/L로 원위신세관산증은 안정된 상태를 유지하였다. 이후 환자는 더 이상 요로결석의 재발 없이 외래 추적관찰 중이다.
고 찰
원위신세관산증은 원위신세관에서의 산 분비 배설 장애로 인해 요의 산성화 능력 장애를 특징으로 하는 질환으로, 저칼륨혈증(hypokalemia), 칼슘 과다 배설 및 신석회화, 다뇨 등이 함께 동반될 수 있는 것으로 알려져 있다[4].
원위신세관산증의 발생 기전은 1) H+-ATPase의 결함으로 인해 수소이온의 분비 결함, 2) 막전압 의존성 결함(voltage dependent defect), 3) 막투과성 증가로 경사도 결함(gradient defect)이 발생하면서 유발하는 수소이온의 역확산으로 나눌 수 있다[4]. 저칼륨혈증은 수소이온의 배설 장애로 Na+-K+ 교환이 증가하고, 중탄산염의 배설에 의해 체액이 감소하면서 renin-aldosterone system이 항진되어 발생하는 것으로 생각된다.
중탄산염 부하 검사는 원위부에서의 소변 산성화 능력의 감소를 알 수 있는 민감한 검사 중 하나로[4], 중탄산 분획배설률(FeHCO3-)을계산함으로써근위신세관에서의산성화 능력을 평가할 수 있어 근위신세관산증과 원위신세관산증을 감별하는 데 사용할 수 있다. 중탄산나트륨 부하 후 요-혈액 pCO2 차이(UBpCO2)의 정상치는 30 mmHg을 초과하는 것으로 알려져 있으며[3], 소변과 혈액 내의 이산화탄소 분압 차이가 정상적으로 상승하지 않아 요-혈액 pCO2 차이가 30 mmHg 이하인 경우 H+ pump 결손에 의한 원위신세관산증으로 진단이 가능하다. 저자들이 경험한 2가지 증례 모두 최대 요-혈액 pCO2 차이가 각각 -13 mmHg, -3.8 mmHg으로 30 mmHg 미만의 값을 보여 원위신세관에서의 산성화 능력 장애를 확인할 수 있었다.
Jang 등[5]이 신세관산증으로 진단된 37명의 환자를 대상으로 진행한 연구에서 주소는 전신쇠약감(20예, 54%), 식욕부진 및 구역(17예, 46%), 다뇨 및 다음(15예, 41%), 요로결석(9예, 24%), 상하지 이상감각증(9예, 24%), 하지 위약감(8예, 22%), 근마비(4예, 11%) 순으로 나타났다. 이 중 요로결석은 모두 원위신세관산증에서만 발생하였다. 대사성 산증과 저칼륨혈증이 함께 동반된 예는 22예(59%)였으며, 저칼륨혈증만 있었던 예는 9예(24%)였다. 저자들이 경험한 두 예에서도 신석회증 및 저칼륨혈증으로 인한 하지 위약감을 주 증상으로 나타냈다.
산증이 발생하면 골 용해를 통해 과다한 수소 인산칼슘(calcium phosphate)의 분비가 증가하고, 세관(tubule)에서의 재흡수는 감소하게 되어 고칼슘뇨증 및 고인산뇨증이 발생한다. 또한 대사성 산증은 근위세관세포의 pH를 저하시킴으로써, 저칼륨혈증은 근위세관세포 사이의 수소이온과 칼륨이온의 교환을 막아 칼슘의 결정화(crystallization)를 방지하는 구연산염의 배설을 억제하여 구연산염뇨증(hypocitraturia)을 일으킨다. 특히 원위신세관산증에서 소변 pH가 증가하면 인산칼슘의 용해도가 저하되어 요로결석 및 신석회증을 일으키게 된다[6].
모든 원위세뇨관산증 환자에서 대사성 산혈증(acidemia)이 동반되는 것은 아니다. 불완전 원위신세관산증(incomplete distal renal tubular acidosis)은 요 산성화 장애로 요 pH는 높지만, 암모늄의 배설이 상대적으로 높은 수준으로 유지되어 산혈증으로 진행하지 않는 경우를 말한다. 아직까지 불완전 원위신세관산증의 발생기전은 정확히 알려지지 않았으나, 구연산염의 배설이 억제되고, 근위세관에서의 암모늄과 수소이온 분비가 촉진되어 상대적으로 대사성 산증이 발생하지 않는 것으로 생각된다[6].
저자들이 경험한 환자들 중 2번 증례의 환자는 중탄산염의 감소가 심하지 않았으며, 산혈증은 없었고, 매우 경미한 저칼륨혈증을 보여 일차적으로 원위신세뇨관산증을 의심하기에는 증거가 부족했다. 하지만 본 증례에서처럼, 산혈증을 동반하지 않는다고 하더라도 쇼그렌증후군에서 저칼륨혈증, 고칼슘뇨증 혹은 신석회증이 동반되는 경우에는 우선적으로 원위신세관산증이 동반되어 있는지를 의심하고 확인하는 것이 필요하다. 1번 증례 환자의 경우 과거 검사 결과를 보면 본원에 방문하기 이미 3년 전 검사에서도 총 이산화탄소가 18 mmol/L로 유의한 중탄산염의 감소를 보였음에도 대사성 산증을 의심하지 못하고 외래에서 관찰 중이었다. 원위세관성 대사성 산증의 경우 심한 임상증상을 보이는 경우는 많지 않으므로 진단 및 치료를 위해서는 임상의의 관심이 꼭 필요하다.
쇼그렌증후군에서 신장 침범은 다양한 양상으로 발현하게 되는데 사구체보다는 신세관을 침범하며, 특히 신세관산증의 발생이 흔한 것으로 알려져 있다. 2013년 Goules 등[2]이 보고한 바에 따르면 총 715명의 쇼그렌증후군 환자 중 35명(4.9%)에서 신장 침범이 확인되었는데, 그중 13명(48.6%)은 간질성 신염, 17명(48.6%)는 신증후군을 나타냈고 5명(14.3%)은 간질성 신염 및 신증후군을 모두 동반한 환자였다. 게다가 간질성 신염 단독으로 확인된 13명 환자 중 요 pH가 7 이상인 환자가 총 10명으로 대부분이 신세관산증을 동반하고 있었다. 2000년 Aasarød 등[1]은 쇼그렌증후군에서의 원위신세관산증의 발생률을 11.3%로 보고하였다.
현재까지 쇼그렌증후군에서 신세관 장애가 나타나는 기전은 명확하게 알려진 바 없으나, Morris and Fudenberg [7]는 자가면역질환에서 만들어지는 비장기특이성 항체에 의해 신세관의 손상이 초래되어 요 산성화 능력에 결함이 오는 것으로 설명하였다. McCurdy 등[8]은 항핵항체(antinuclear Ab), 항평활근항체(anti-smooth muscle Ab), 미토콘드리아항체(mitochondrial Ab), 티로글로불린 항체(thyroblobulin Ab) 등이 양성인 경우에 발생하는 신세관산증을 과글로불린성 신세관산증이라고 명명하였으며, 이후에 보고된 사례들을 보면 50% 이상이 쇼그렌증후군이었다. Siamopoulos 등[9]은 조직학적으로 림프구와 형질세포가 간질 및 신세관의 기저막에 침윤하면서 세포의 구조 변형을 일으켜 수소이온 분비에 장애를 일으킨다고 발표한 바 있다. 또한 원위신세관산증이 동반된 쇼그렌증후군 환자에게서 신장조직 검사를 시행하여 H+-ATPase와 결합하는 다클론항체를 통해 광학현미경으로 관찰한 결과 사이세포의 H+-ATPase가 결핍되어 있다는 것이 밝혀졌다[10].
원위신세관산증의 치료는 저칼륨혈증과 대사성 산증의 교정이다. 대사성 산증을 교정할 경우 저칼륨혈증이 악화될 수 있으므로 저칼륨혈증의 교정이 항상 먼저 이루어져야 하며, 정상 칼륨 범위를 유지하기 위해 지속적인 칼륨투여가 필요하다. 대사성 산증의 교정을 위해서는 1-2 mmol/kg/day의 구연산염 혹은 중탄산염의 투약을 권고하고 있으며, 교정이 원활하게 이루어질 경우 고칼슘뇨증도 함께 교정된다[1].
원위신세관산증의 예후는 대사성 산증 자체보다는 동반되는 자가면역질환에 의해 좌우가 되며, 치료가 잘 유지되는 경우에는 예후가 양호한 것으로 알려져 있다[1].