다량의 심낭삼출로 나타난 쇼그렌증후군 1예
Sjögren’s Syndrome Presenting as a Large Pericardial Effusion
Article information
Abstract
호흡곤란 및 흉통을 주소로 내원한 환자에서 심낭삼출이 첫 증상으로 발현된 일차성 쇼그렌증후군을 건조증상, 침샘조직검사, 그리고 심낭삼출액 분석을 포함하여 진단하고 성공적으로 치료하였기에 문헌고찰과 함께 증례보고하는 바이다.
Trans Abstract
Primary Sjögren’s syndrome (pSS) is characterized by lymphocytic infiltration to the lacrimal and salivary glands. However, it also includes a wide spectrum of clinical manifestations, including musculoskeletal, lung, kidney, neurological, and cardiac manifestations. Cardiac involvement in pSS leads to various conditions including pericardial effusion (PE), left heart failure, pulmonary hypertension, and left atrial hypertrophy. A large PE without pulmonary arterial hypertension is extremely rare and there has been no case in Korea, to date. We report a case of a 45-year-old woman with newly-diagnosed pSS who presented with a large PE and pleural effusion. The patient experienced a significant improvement of the PE following treatment with steroids.
서 론
일차성 쇼그렌증후군(primary Sjögren’s syndrome, pSS)은 만성자가면역질환으로 눈물샘, 침샘과 같은 외분비샘에 림프구가 침윤되어 안구건조와 구강건조를 주증상으로 하나 근골격계, 폐, 콩팥, 신경 그리고 심장에도 임상증상이 나타날 수 있다. pSS에서 심장 침범은 대부분 증상이 없는 것으로 알려져 있으나 심낭삼출, 좌심실 기능부전, 폐동맥 고혈압 그리고 좌심방 비대 등으로 다양하게 나타날 수 있다. 그러나 폐동맥고혈압 없이 다량의 심낭삼출로 나타나는 경우는 매우 드물다.
저자들은 호흡곤란을 주소로 내원하여 양측성 흉수 및 다량의 심낭삼출을 첫 증상으로 하여 pSS을 진단한 증례를 경험하였고 성공적으로 치료하였기에 문헌고찰과 함께 증례보고 한다.
증 례
환 자: 45세 여자
주 소: 호흡곤란 및 흉통
현병력: 1년 전부터 차가운 물에 손이 닿으면 파랗게 변하는 증상과 함께 안구건조감, 구강건조 증상이 있었으나 별다른 검사 및 치료 없이 지내다, 내원 15일 전부터 숨을 들이마실 때 발생하는 가슴통증 및 호흡곤란이 심해지고, 최근 10분 가량 도보가 불가능할 정도로 증상이 심해져 자세한 검사를 위해 내원하였다.
과거력: 특이병력은 없었다.
가족력: 특이병력은 없었다.
신체검사 소견: 내원시 활력 징후는 혈압 130/85 mmHg, 맥박 72회/분, 호흡수 20회/분, 체온 36.4℃였다. 의식은 명료하고 외관상 급성 병색이 관찰되었다. 흉부 청진상 양측 폐하엽의 호흡음이 감소되었고, 심장청진상 특이소견은 없었다. 복부 진찰에서 장음은 정상이었고, 압통이나 반발통은 없었다. 구강은 점막이 마르고 혀가 갈라진 소견이 보였다. 관절의 부종이나 압통은 없었다. 피부 발진은 보이지 않았고, 림프절 종대는 없었다.
검사실 소견: 입원 당시 시행한 말초혈액 검사에서 백혈구 4300/mm3, 혈색소 9.1 g/dL (참고치 12-16), 적혈구침강속도 2 mm/hr (참고치 0-20), C-반응단백질 0.01 mg/L (참고치 0-0.5)이었다. 혈액생화학 검사에서 AST/ALT 28/30 IU/L, 알부민 3.6 g/dL, 혈액요소질소 17.6 mg/dL, 크레아티닌 0.54 mg/dL, 나트륨 141 mEq/L, 칼륨 4.1 mEq/L, 혈당 100 mg/dL, 철 14 ug/dL, 총 철결합능 230 ug/dL 그리고 ferritin 2.39 ng/mL였다. 면역학적 검사상 항핵항체는 양성(1:160)으로 speckled 양상이었다. 류마티스인자는 16 IU/mL (참고치 0-15), C3 47 mg/dL (참고치 65-135), C4 15 mg/dL (참고치 13-35)였다. 항-SS-A/Ro 항체 127 EU (참고치 0-20)로 양성이었으며, 항-SS-B/La 항체 3.3 EU (참고치 0-20), 항 이중나선 DNA 항체 2.23 IU/mL (참고치 0-7.0), 항 Sm 항체 음성, 항 histone 항체 음성, 항 centromere 항체 음성, 항 cardiolipin 항체 음성소견이었다. 면역혈청 검사에서 거대세포바이러스 음성, 엡스타인-바 바이러스 음성, hepatitis B surface antigen 음성, anti-hepatitis B surface 양성, anti-hepatitis C virus 음성, venereal disease research laboratory test 음성, human immunodeficiency virus 항체 음성이었다. 흉수 검사에서 젖산탈수소효소(lactate dehydrogenase, LDH) 72 U/L, 총 단백질 3.0 g/dL, 아데노신탈아미노화효소(adenosine deaminase, ADA) 11 U/L, acid-fast bacillus 검사 음성, 세균배양검사 음성이고, 세포질 검사에서 악성세포는 관찰되지 않았으나 항핵항체는 양성으로 speckled 양상이었다. 심낭삼출 검사에서는 LDH 72 U/L, 총 단백질 3.0 g/dL, ADA 17 U/L, 항핵항체 양성소견이 관찰되었고, 세포질 검사에서 악성세포는 관찰되지 않았다.
방사선학적 소견: 단순 흉부 방사선촬영에서 심장 음영의 길이가 흉곽 음영의 내부 길이의 절반 이상 차지한 심장비대 소견과 양측성 흉수 소견이 보이며, 양측 와위에서 오른쪽 1.1 cm, 왼쪽 2.4 cm로 흉수저류가 관찰되었다(Fig. 1A). 흉부 전산화 단층촬영에서 양쪽 간질성 폐부종 소견이 관찰되며, 양측성 흉수와 함께 심낭삼출 소견이 관찰되었다(Fig. 2A).

(A) On admission, chest X-ray showed cardiomegaly and a bilateral pleural effusion without consolidation in both lungs. (B) After treatment, it showed a decrease in both the bilateral pleural effusion and cardiac size. PA-LT, posterior anterior-left lateral view.
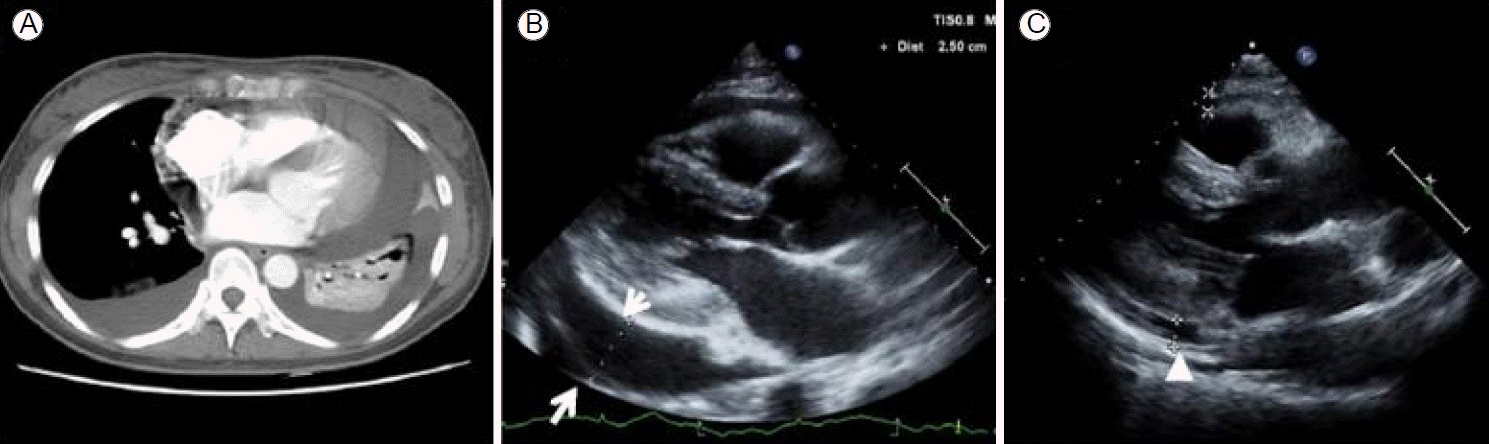
(A) On admission, chest CT revealed a bilateral pleural effusion with intrafissural loculation in the left hemithorax, as well as mild cardiomegaly along with a moderate pericardial effusion. (B) Echocardiography revealed there to be a large pericardial effusion (1.8 to 3 cm, white arrows). (C) After treatment, the pericardial effusion was markedly decreased to a depth of 0.7 cm (arrowhead). CT, computed tomography.
심초음파 검사 소견: 심초음파에서 심박출량 78%로 정상 범위 내에 있었으며, 심벽운동에 이상소견은 없었다. 1.8 cm에서 3 cm의 다량의 심낭삼출로 인한 좌심실에서 요동운동이 관찰되었다(Fig. 2B). 이외에 우심실 비대나 삼첨판막 이상소견 등의 폐동맥 고혈압을 의심할 만한 소견은 보이지 않았다.
치료 및 경과: 환자는 다량의 심낭액이 있었으며 이는 삼출물로 진단되었다. 삼출액의 양이 많아 호흡곤란을 동반한 흉통이 심하여 증상의 완화를 위해 흉수천자 및 심막천자를 통해 각각 520 mL, 260 mL 배액을 시행하였다. 배액을 유지하면서 단순 흉부 방사선촬영에서 흉수 및 심낭삼출이 감소하였고(Fig. 1B), 환자의 호흡곤란 증상도 호전되었다. 심막천자를 통해 배액을 시행한 후 심초음파 경과관찰에서 심낭삼출 또한 0.7 cm로 감소소견이 확인되었다(Fig. 2C). 건조구강 및 건조안에 대한 검사를 위해 쉬르머 검사와 로즈벵갈 염색 검사를 시행하였고, 쉬르머 검사에서 5분 동안 우안에서 < 5 mm로 눈물분비 감소소견을 보이며, 로즈벵갈 염색 검사에서 우안에 각막 상피세포에 손상이 있음을 확인하였다. 심낭삼출액과 흉수액의 세포병리 소견상 다수의 림프구와 반응성 심장막 또는 흉막세포가 관찰되었다(Fig. 3A and 3B). 확진을 위해 시행한 침샘조직검사상 침샘의 위축 또는 파괴 없이 다수의 국소적 림프구 및 형질세포의 침윤이 관찰되었다. 고배율에서 림프구의 수가 50/4 mm2 이상으로 관찰되어 쇼그렌증후군의 초기 변화에 합당하다(Fig. 3C and 3D). 본 환자는 건조구강 및 건조안, 쉬르머 검사 양성, 항핵항체와 SS-A/Ro 항체 양성, 그리고 침샘조직검사의 소견으로 2002년 미국 유럽 합의기준(American-European Consensus group criteria)의 진단기준에 따라 pSS으로 진단되었다. 최종적으로 pSS에 의한 심낭삼출로 판단되어 장막염 조절을 위해 비스테로이드소염제(non-steroidal anti-inflammatory drug)와 프레드니솔론 10 mg을 투여하였고, 심낭삼출과 흉수는 악화 없이 호전되어 3개월 후 프레드니솔론은 2.5 mg까지 감량하여 외래에서 추적관찰 중이다.

(A) Pericardial fluid included a small number of reactive mesothelial cells and lymphocytes in the fibrinous background on liquid-based cytology (PAP stain, ×400). (B) The pleural effusion contained many lymphocytes, macrophages, and reactive mesothelial cells (PAS stain, ×400). (C) A minor salivary gland biopsy revealed seromucinous glands and ducts without atrophy or destruction of the minor salivary gland (H&E, ×100). (D) A minor salivary gland biopsy showed the focal aggregation of lymphoplasma cells without significant destruction of the surrounding tissue (H&E, ×400).
고 찰
쇼그렌증후군이 다른 자가면역질환에 이차적으로 발생하지 않고 단독으로 발생하는 경우를 pSS으로, 류마티스관절염, 전신경화증, 전신홍반루푸스, 염증근염, 원발성 담관성간경화 등 다른 질환에 추가적으로 나타나는 경우를 이차성 쇼그렌증후군(secondary SS)으로 분류한다[1]. pSS는 주로 외분비샘을 침범하는 결체조직질환으로, 아시아에서의 발생률은 만인년 당 6.0-11.8명으로 알려져 있다[2]. 진단 분류기준은 적어도 6개의 국제적 진단기준이 있으나, 아직 세계보건기구에서 인증된 진단기준은 없다. 그 중 2002년도에 개정된 미국-유럽 합의기준은 1. 불충분한 눈물 생성의 건조안 증상, 2. 부적절한 찢어짐으로 나타나는 각막 손상의 안구 증상, 3. 침분비 저하 증상의 구강 증상, 4. 림프구 군집을 보이는 침샘의 조직검사, 5. 손상된 침샘 기능을 보여주는 검사, 6. 자가면역항체의 존재의 6가지 항목 중 4가지 이상 해당하고 원인질환이 없을 때 pSS으로 진단할 수 있다[3].
pSS에서 선외증상은 흔하게 관찰되는데, 관절통과 관절염이 가장 빈번하고, 이외에 드물지만 폐고혈압, 가성림포종, 폐림프종, 아밀로이드증도 발생 가능하다. 하지만 pSS에서 늑막염이나 심낭염 등과 같은 장막염이 동반되는 경우는 드문 것으로 알려져 있다. 국내에서 발표한 연구에 따르면, pSS를 진단받은 96명의 환자에서 선외증상 중 관절통과 관절염이 40.6%에서 가장 흔하게 나타났으며, 이어서 레이노현상(24.0%), 간 침범(18.8%), 근육 침범(12.5%), 그리고 말초신경병증(9.4%) 증상이 있었다. 이외에 늑막염 등의 폐 침범은 5.2%에서 나타났으며, 심장 침범은 언급되지 않았다[4]. 해외에서 발표된 연구에서 증상의 유무와 상관없이 심초음파를 시행하여 352명의 pSS 환자에서 52명(14.8%)의 환자에서 심낭삼출이 있음을 보고하였다. 그 중 41명(78.8%)은 적은 양이었고, 11명(21.2%)에서 중등도 또는 다량의 심낭삼출을 보였으며, 심방/심실 전도장애는 453명의 환자 중 20명(14.4%) 환자에서 관찰되었다[5]. 증상과 상관없이 33명의 pSS 환자와 79명의 이차성 쇼그렌증후군 환자가 포함된 112명의 심초음파를 평가한 연구에서는 69명(61.6%)에서 비정상적인 심초음파 소견이 확인되었고, 이 중 pSS 환자가 55.5%를 차지하였다. 비정상 심초음파 소견 중 21.2%에서 심낭삼출이 관찰되었다. 이외에 10.3%에서 대동맥판막의 비후와 석회화가 보였으며, 6.9%에서 이첨판의 이완기 하강비 감소가 관찰되었고, 3.4%에서 이첨판의 비후와 석회화가 보였고, 3.3%에서 이첨판 역류가 관찰되었으나 이 연구에서는 폐고혈압을 보이는 환자는 없었다[6]. 이와 같이 국내 연구 보고는 없으나 pSS에서 심초음파상 무증상의 심낭삼출이 관찰되는 경우는 해외에서 드물지 않게 보고되고 있다. 이 환자에서는 심장과 관련된 기저질환은 없었으며, 심막천자 검사에서도 감염이나 종양의 소견은 보이지 않았다. 전신홍반루푸스로 인한 이차성 쇼그렌증후군의 가능성도 있으나, 전신홍반루푸스의 미국류마티스학회 기준 중 장막염, 항핵항체 양성소견의 2가지 항목 이외는 합당한 소견이 없었다. 다른 자가면역질환의 가능성도 배제되고 다수의 림프구 침윤이 심장막액에서도 보였던 바 저자들은 pSS에 의한 심낭삼출로 결론내었다.
pSS 치료는 건조안, 구강건조, 전신적 임상증상에 대한 증상 완화와 합병증의 예방 및 치료로 나누어져 있다. 건조안에서 인공눈물이 효과가 충분하지 않을 때에는 무스카린성 수용제작용제가 도움이 된다[1]. 전신 증상에 대한 치료에서는 항말라리아 약제와 스테로이드와 같은 면역억제제도 사용 가능하다. Hydroxychloroquine은 pSS와 관련된 관절통과 피로에 효과적이며, 리툭시맙과 같은 항 CD-20 단클론성 항체 또한 심각한 전신 장기 침범이 있는 경우 치료제로 쓸 수 있다[7]. 장막염이 동반된 pSS에서의 스테로이드 치료는 간질성 폐렴이 동반되어 있지 않는 상태에서 30 mg 또는 40 mg/일의 용량으로 시작하는 것으로 되어 있다[8]. pSS에 동반된 장막염이나 심낭삼출의 보고가 적지만 한 증례에서는 양측성 흉수가 동반된 pSS 환자에게 프레드니솔론 40 mg/일로 치료를 시작하여 양측성 흉수는 호전되었고, 30일째에 양측성 흉수는 사라졌으며 이후에도 재발하지 않았다[9]. 증례에서 대부분 좋은 반응을 보였지만, 용량 감량 과정에서 재발 또한 잘 하는 것으로 알려져 있어 지속적인 경과관찰을 권고한다[9]. 일본에서 발표된 증례에서도 pSS 환자의 양측성 흉수에 대해 결핵이나 종양소견은 없었고, 경험적 항생제를 투약하였으나 흉수의 호전은 보이지 않아 프레드니솔론 40 mg/일을 투여하였고, 이후 흉수는 치료되었다[8]. 심낭삼출과 흉수가 동반된 pSS 환자는 지금까지 3개의 증례밖에 보고가 되지 않았다. 심낭삼출과 흉수가 동반된 pSS 환자에게 3일간 메틸프레드니솔론 500 mg을 정주하였고, 2주일 동안 프레드니솔론을 50 mg/일으로 감량하였다. 이 환자는 4개월 후 심낭삼출이 완전히 관해되었다[10].
호흡곤란 및 흉통을 초기증상으로 하여 심낭삼출과 흉수를 동반한 pSS이 진단된 국내 보고는 아직 없었다. 그러나 해외 증례에서는 심낭삼출이 동반된 pSS이 일부 보고되었으며 몇몇 연구에서는 무증상의 pSS에서도 심초음파상 심낭삼출이 나타난 연구들이 보고된 바, 이에 pSS 환자에서 증상이 없더라도 심장 침범여부를 확인하기 위해 심장초음파 같은 검사가 고려될 수 있겠다. 본 환자에서는 흉수 및 심낭삼출이 감염, 종양 그리고 장막염을 일으킬 만한 다른 자가면역질환들의 동반은 배제되고 건조증상 및 조직검사로 pSS와 관련되어 있음을 결론내고 치료하였다.