ى„œë،
ى‹ ى„¸يڈ¬ى•”ى¢…ى€ 비뇨기계ى—گى„œ ë°œىƒي•کëٹ” 다른 ى•”ى¢…ê³¼ 비êµگي•کى—¬ 드문 يژ¸ى´ى§€ë§Œ 남ى„±ى—گى„œëٹ” ىƒپ대ى پىœ¼ë،œ ي”يˆ ê´€ى°°ëگکëٹ” ى•”ى´ë‹¤. 2014ë…„ ë¯¸êµ ى•” ي†µê³„를 ë³´ë©´ 남ىگى—گى„œëٹ” 6번ى§¸ë،œ ىگى£¼ ë°œىƒي•کëٹ” ى•”ىœ¼ë،œ 39,140ëھ…ى´ 발병ي• 것ىœ¼ë،œ ىکˆىƒپي•کê³ ىˆىœ¼ë©°, ى—¬ى„±ى—گى„œëٹ” 24,780ëھ…ى´ 발병ي•کى—¬ 8번ى§¸ë،œ ىگى£¼ ë°œىƒي•کëٹ” ى•”ى—گ ي•´ë‹¹ëگœë‹¤ê³ ë³´ê³ ي•کê³ ىˆë‹¤[1]. 2011ë…„ى„ 기ى¤€ىœ¼ë،œ ىڑ°ë¦¬ë‚کë¼ى—گى„œëڈ„ 2,722ëھ…ى´ 발병ي•کى—¬ 남ى„± ى „ى²´ ى•”ىک 9번ى§¸ë¥¼ ى°¨ى§€ي•کê³ ىˆë‹¤[2].
ى‹ ى„¸يڈ¬ى•”ىک ى›گ격 ى „ى´ëٹ” يڈگ, 림ي”„ى ˆ, 뼈, ê°„, 뇌, ë°ک대 ى¸، ى‹ ى¥, 부ى‹ 등ى—گ ي”يˆ ë°œىƒي•œë‹¤. ى‹ ى„¸يڈ¬ى•”ى€ ى²کىŒ ىˆکىˆ ë،œ ى¢…ى–‘ى´ ى„±ê³µى پىœ¼ë،œ ى œê±°ëگکى—ˆë‹¤ ي•کëچ”ë¼ëڈ„ ىˆکë…„ى´ ى§€ë‚ک ى „ى´ê°€ 발견ëگکëٹ” ê²½ىڑ°ê°€ 드물ى§€ ى•ٹى•„ى„œ, 길게ëٹ” ى²« ىˆکىˆ ى´ي›„ 17ë…„ى´ ى§€ë‚کى„œ ë°œىƒي•œ ê²½ىڑ°ëڈ„ ë³´ê³ ëگœ ى پى´ ىˆë‹¤[3]. ي•کى§€ë§Œ ى•” ي™کىگى—گى„œ ى›گ발부ىœ„ ى´ى™¸ى—گى„œ 발견ëگœ 단ى¼ يک¹ى€ 다발 ى¢…ê´´ى—گى„œ ىƒˆë،œىڑ´ ى›گë°œى„± ى•”ى„ ى§„단ي•œ ê²½ىڑ°ëڈ„ ى—¬ëں¬ ê±´ ë°œي‘œëگکê³ ىˆى–´ ى،°ى§پ ê²€ى‚¬ىک ي•„ىڑ”ى„±ى´ ى گى°¨ ê°•ى،°ëگکê³ ىˆë‹¤[4].
본 ى €ىگ들ى€ ى‹ ى„¸يڈ¬ى•”ىœ¼ë،œ ê·¼ى¹کى پ ىڑ°ى¸، ى‹ ى¥ ى ˆى œىˆ ى„ ë°›ى€ ي™کىگى—گى„œ 1ë…„ ي›„ ë°œىƒي•œ ىڑ°ى¸، يڈگ병변ى—گ 대ي•کى—¬ ى‹ ى„¸يڈ¬ى•”ىک ى „ى´ë،œ ê°„ى£¼ي•کى—¬ ى¹ک료ي•کىک€ê³ , ى „ى´ë،œ ىƒê°پي–ˆëچک يڈگ병변ىک يپ¬ê¸°ê°€ ى گى°¨ ى¦ê°€ي•کى—¬ ى،°ى§پ ê²€ى‚¬ ى´ي›„ ى›گë°œى„± يڈگى•”ى„ ي™•ى§„ي•کê³ ى´ى—گ 대ي•کى—¬ ىڑ°ىƒپى¸، يڈگى—½ ى ˆى œىˆ ى„ ى‹œي–‰ي•کىک€ë‹¤. ى´ي›„ ى•ˆى •ى پىœ¼ë،œ ىœ ى§€ëگکëچک ى¢Œى¸، يڈگê²°ى ˆىک يپ¬ê¸° ى¦ê°€ ى†Œê²¬ى„ ë³´ى—¬ ى،°ى§پ ê²€ى‚¬ë¥¼ ي†µي•´ ى‹ ى„¸يڈ¬ى•”ىک ى „ى´ë¥¼ ي™•ى¸ي•کىک€ê³ , 비디ىک¤ ي‰ê°•ê²½ ىˆکىˆ ى„ ي†µي•œ ىگگ기 ى ˆى œىˆ ë،œ ى¹ک료 ي›„ ي•ى•”ى¹ک료 ى¤‘ى¸ 1ىکˆë¥¼ ê²½ي—کي•کىک€ë‹¤. ى‹ ى„¸يڈ¬ى•” ي™کىگىک ى›گë°œى„± يڈگى•” ë°œىƒ ë°ڈ ى´ي›„ 발견ëگœ ى‹ ى„¸يڈ¬ى•”ىک يڈگى „ى´ëٹ” êµë‚´ى—گى„œ ë³´ê³ ëگکى§€ ى•ٹى€ ى¦ë،€ë،œ ى´ى—گ 문ي—Œê³ ى°°ê³¼ ي•¨ê»ک ë³´ê³ ي•کê³ ىگ ي•œë‹¤.
ى¦ ë،€
ي™کىگ: 63ى„¸ 남ىگ
ى£¼ى†Œ: يڈگى¢…ê´´
يک„ë³‘ë ¥: ي™کىگëٹ” 2010ë…„ 4ى›”, ى¸ê·¼ ى¢…ي•©ë³‘ى›گى—گى„œ ىڑ°ى¸، ى‹ ى„¸يڈ¬ى•” 1기(T1N0M0) ى§„단 ي›„ ê·¼ى¹کى پ ىڑ°ى¸، ى‹ ى¥ ى ˆى œىˆ ى„ ى‹œي–‰ي•کىک€ê³ ىˆکىˆ ê²°ê³¼, ى‹ ى¥ ë‚´ êµي•œëگœ يˆ¬ëھ…ى„¸يڈ¬ى•”ى¢…(Clear cell carcinoma)ىœ¼ë،œ ي™•ى¸ëگکى—ˆê³ , 병기ëڈ„ 1기(pT1N0)ىک€ë‹¤. ى´ي›„ 경과 ê´€ى°° ى¤‘ ى‹œي–‰ي•œ ي‰ë¶€ ى „ى‚°ي™” 단ى¸µى´¬ىکپى—گى„œ 2011ë…„ 10ى›” يڈگى¢…ê´´ê°€ ي™•ى¸ëگکى—ˆë‹¤. ى´ى—گ ىک료ى§„ى€ ى‹ ى„¸يڈ¬ى•”ىک يڈگى „ى´ë،œ ê°„ى£¼ي•کê³ ê³ ى‹ى پ ي•ى•”ى¹ک료ى¸ sunitinibىœ¼ë،œ ى¹ک료 ëڈ„ى¤‘, يڈگ 병변ىک يپ¬ê¸° ى¦ê°€ى†Œê²¬ى„ ë³´ى—¬ 2ى°¨ ى•½ى œى¸ everolimusë،œ ى•½ى œë¥¼ 변경ي•کى—¬ ى¹ک료를 ي•کىک€ى§€ë§Œ ى§€ى†چى پىœ¼ë،œ يڈگ병변ىک يپ¬ê¸°ëٹ” ى¦ê°€ى†Œê²¬ى„ ë³´ىک€ë‹¤. ى´ي›„ ëڑœë ·ي•œ ى¹ک료 방법ى´ ى—†ë‹¤ëٹ” ى´ى•¼ê¸°ë¥¼ ë“£ê³ ى—°ê³ ى§€ 관계ë،œ 본ى›گ ë‚´ى›گي•کىک€ë‹¤.
ê³¼ê±°ë ¥: 2007ë…„ ê³ يکˆى••ê³¼ 뇌ى،¸ى¤‘ى—گ 대ي•کى—¬ يˆ¬ى•½ ى¤‘ى´ë©°, 30ê°‘ë…„(pack-years)ىک ي،ى—°ë ¥ى´ ىˆىœ¼ë‚ک 4ë…„ ى „부ي„° 금ى—° ىƒپيƒœى´ë©° ىŒى£¼ë ¥ى€ ى—†ى—ˆë‹¤.
ى§„ى°° ى†Œê²¬: ى…ى›گ ى‹œ يٹ¹ى´ 병ىƒ‰ ë³´ى´ى§€ ى•ٹى•کê³ يکˆى•• 130/90 mmHg, 맥박ىˆک 분당 92يڑŒ, يک¸ي،ىˆک 분당 20يڑŒ, ى²´ىک¨ 36.4℃ىک€ë‹¤. ىکى‹ى€ ëھ…료ي•کىک€ê³ ي‰ë¶€ ى²ى§„ى—گى„œ ى‹¬ë°•ëڈ™ى€ ê·œى¹™ى پى´ى—ˆىœ¼ë©° ى‹¬ى،ىŒى€ 들리ى§€ ى•ٹى•کê³ ى–‘ يڈگى•¼ىک يک¸ي،ىŒى—گى„œ ى´ىƒپى†Œê²¬ى€ 들리ى§€ ى•ٹى•ک다. ë‘گ경부 ë°ڈ ى•،ى™€ë¶€ 림ي”„ى ˆ ى¢…대ëٹ” ى—†ى—ˆë‹¤.
ê²€ى‚¬ى‹¤ ى†Œê²¬: ë§گى´ˆ يکˆى•،ê²€ى‚¬ى—گى„œ ë°±يکˆêµ¬ 6,800/mm3 (يک¸ى¤‘구: 55.5%), يکˆىƒ‰ى†Œ 13.2 g/dL, ي—¤ë§ˆي† يپ¬ë¦؟ 39.4%, يکˆى†ŒيŒگ 139,000/mm3ى´ى—ˆë‹¤. يکˆى² ىƒي™”ي•™ê²€ى‚¬ى—گى„œ ى´ 단백 6.2 g/dL, ى•Œë¶€ë¯¼ 3.9 g/dL, AST/ALT 22/92 IU/L, BUN 19.0 mg/dL, يپ¬ë ˆى•„ي‹°ë‹Œ 1.2 mg/dLىک€ë‹¤. ى†Œë³€ ê²€ى‚¬ëٹ” ى •ىƒپى´ى—ˆë‹¤.
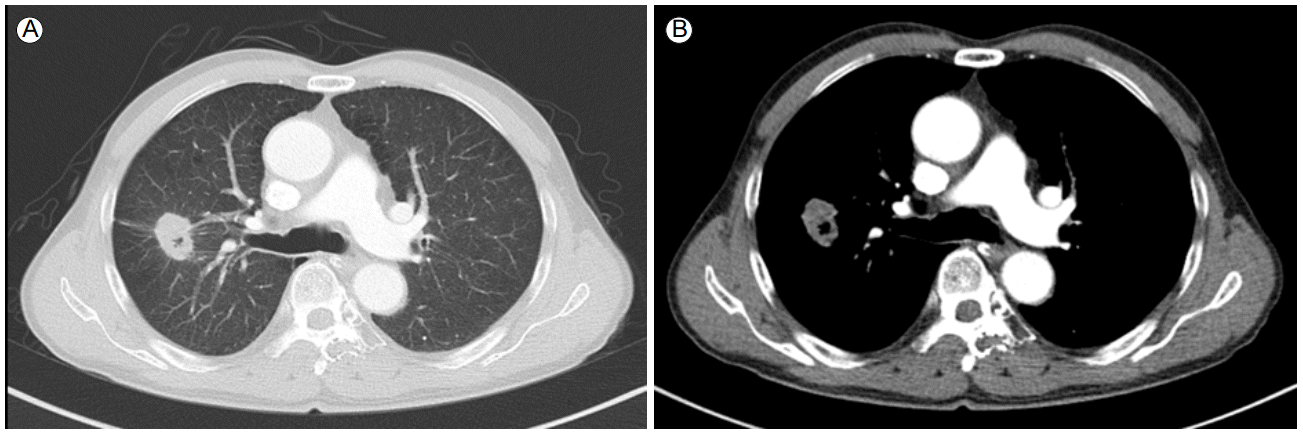
ë°©ى‚¬ى„ ى†Œê²¬: ي‰ë¶€ ى»´ي“¨ي„° 단ى¸µى´¬ىکپى—گى„œ 3ê°œى›” ى „ى—گ 비ي•´ يپ¬ê¸° ë³€ي™”를 ë³´ى´ى§€ ى•ٹëٹ” ىڑ°ى¸، يڈگ ىƒپى—½ى—گ 2.6 أ— 2 أ— 2 mm يپ¬ê¸°ىک 경계부ىœ„ê°€ ëھ…ي™•ي•کë‚ک ى،°ىکپ ى¦ê°•ى´ ëڑœë ·ي•کى§€ ى•ٹى€ ى¢…ى–‘ 30 Hounsfield units (HU) (Fig. 1)ى´ ىˆى—ˆê³ ى¢Œى¸، يڈگ ىƒپى—½ 4 mm يپ¬ê¸°ىک ى،°ىکپ ى¦ê°•ى´ ëھ…ي™•ي•کى§€ ى•ٹى€ ê²°ى ˆ(54 HU, Fig. 2)ى´ ë³´ىک€ê³ 림ي”„ى ˆ ى „ى´ëٹ” ë³´ى´ى§€ ى•ٹى•ک다. 복부 ى»´ي“¨ي„° 단ى¸µى´¬ىکپى—گى„œ ى‹ ى„¸يڈ¬ى•”ىک êµى†Œ ى¬ë°œ ى†Œê²¬ى€ ë³´ى´ى§€ ى•ٹى•ک다.
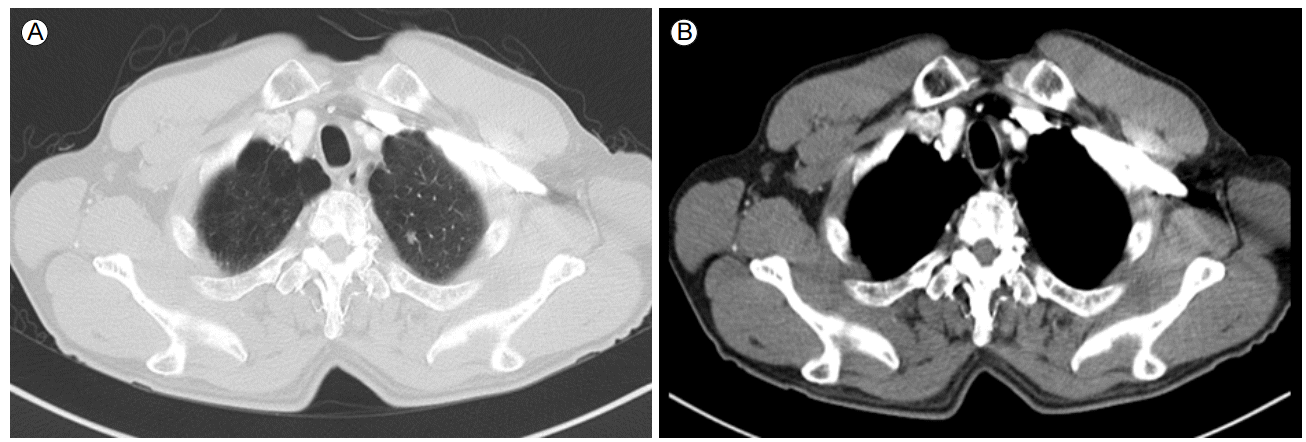
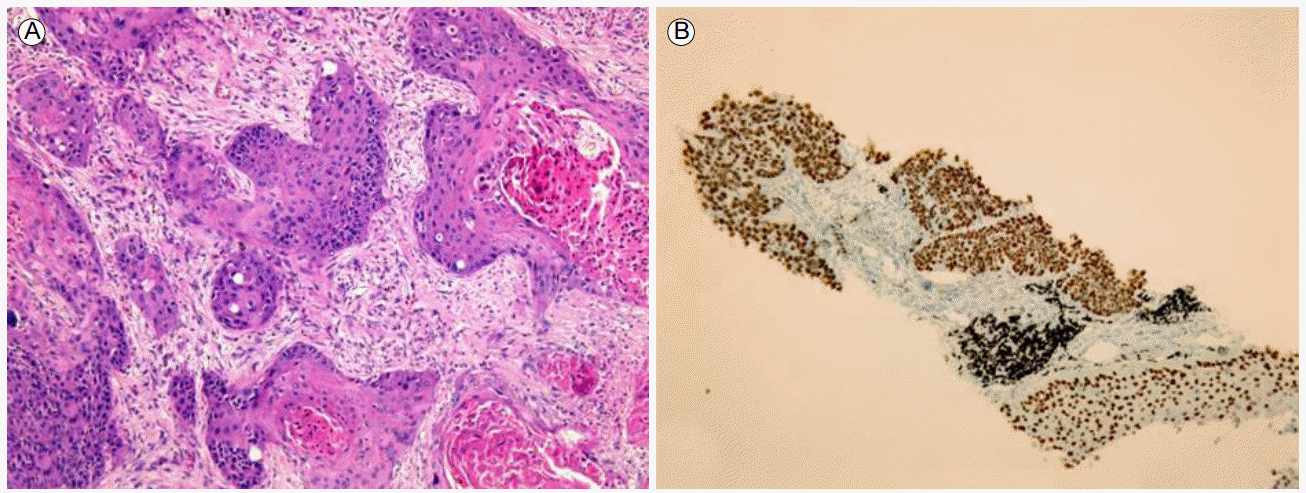
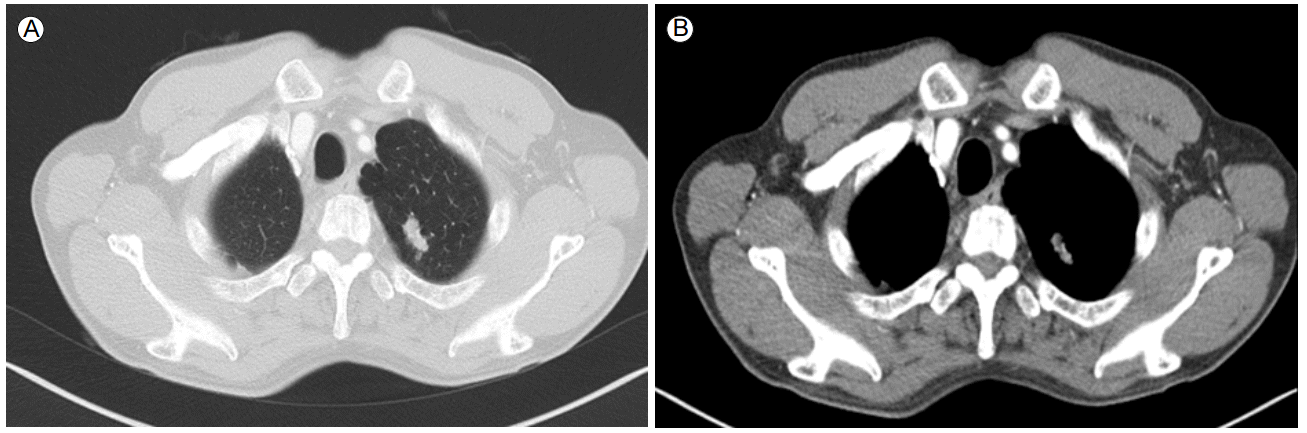
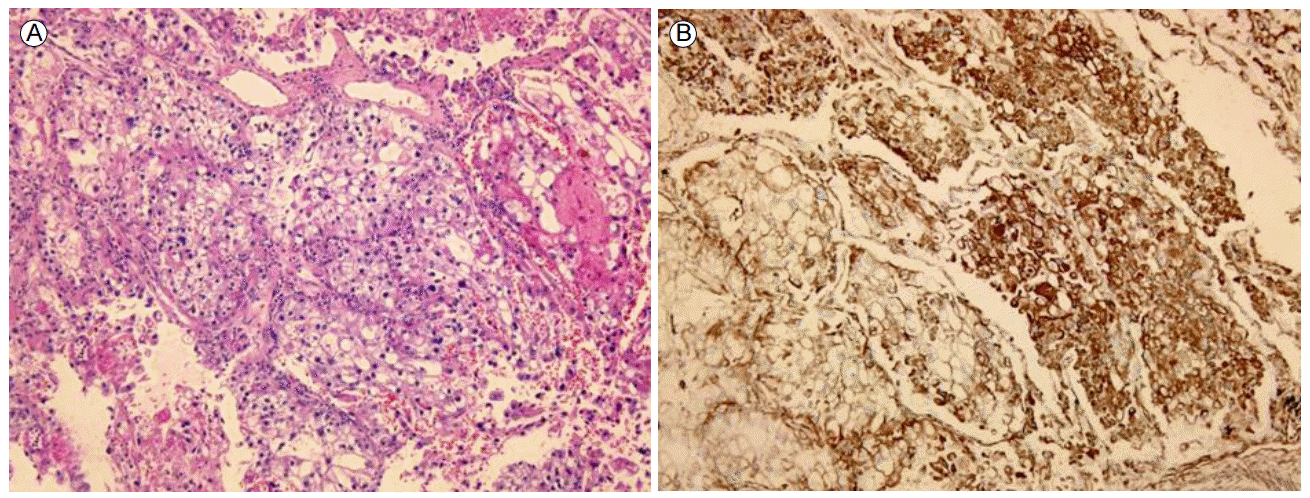
ى¹ک료 ë°ڈ 경과: ي•ى•”ى¹ک료 ى „ ى،°ى§پي•™ى پ ي™•ى¸ى„ ىœ„ي•´ ىڑ°ى¸، يڈگ ىƒپى—½ىک 병변ى—گ 대ي•کى—¬ ى»´ي“¨ي„° 단ى¸µى´¬ىکپ ىœ ëڈ„ي•ک ê²½ي”¼ى پ ë°”ëٹک ىƒê²€ى„ ى‹œي–‰ي•کىک€ë‹¤. ê·¸ ê²°ê³¼ ë©´ى—ى،°ى§پي™”ي•™ ى—¼ىƒ‰ى—گى„œ p40, p63ى—گ ى–‘ى„±ى¸ يژ¸يڈ‰ىƒپي”¼ى„¸يڈ¬ى•”ىœ¼ë،œ ي™•ى¸ëگکى—ˆë‹¤(Fig. 3). ى›گë°œى„± يڈگى•”ىœ¼ë،œ ي™•ى§„ي•کê³ ë³‘ê¸° ى„¤ى • ê²€ى‚¬ىƒپ 1기(T1bN0M0)ë،œ ىڑ°ى¸، يڈگ ىƒپى—½ ى ˆى œىˆ ى„ ى‹œي–‰ي•کىک€ë‹¤. ىˆکىˆ ى‹œ ي‰ë§‰ى—گ ى—¬ëں¬ ê³³ىک ىœ ى°© ى†Œê²¬ى´ ىˆى—ˆىœ¼ë‚ک ىˆ ي›„ ىµœى¢… ى،°ى§پê²€ى‚¬ ê²°ê³¼ ي‰ë§‰ ى¹¨ىٹµى´ë‚ک ى¢…격ëڈ™ 림ي”„ى ˆ ى „ى´ëٹ” ى—†ى—ˆë‹¤. ى،°ى§پ ê²€ى‚¬ ى´ي›„ ى‹ ى¥ى•”ى—گ 대ي•œ ي‘œى پى¹ک료(everolimus)ëٹ” ى¤‘단ي•کىک€ê³ ىˆکىˆ ى´ي›„ ى™¸ëک ي†µي•œ 경과 ê´€ى°°ë§Œى„ ي•کë©° ى§€ى¼œë³´ëچک ى¤‘ ىˆکىˆ 4ê°œى›” ي›„ ى¶”ى پê´€ى°°ë،œ ى‹œي–‰ي•œ ي‰ë¶€ ى»´ي“¨ي„° 단ى¸µى´¬ىکپى—گى„œ ى¢Œى¸، يڈگ ىƒپى—½ ê²°ى ˆ يپ¬ê¸° ى¦ê°€ى†Œê²¬(4 → 20 mm, Fig. 4)ى„ ë³´ى—¬ ى¢Œى¸، يڈگ ىƒپى—½ ê²°ى ˆى—گ 대ي•´ى„œëڈ„ ëکگ다ى‹œ ى»´ي“¨ي„° 단ى¸µى´¬ىکپ ىœ ëڈ„ي•ک ê²½ي”¼ى پ ë°”ëٹک ىƒê²€ى„ ى‹œي–‰ي•کىک€ê³ يˆ¬ëھ…ى„¸يڈ¬ى•”ى¢…(Clear cell carcinoma, Fig. 5)ىœ¼ë،œ ي™•ى§„ëگکى–´ 비디ىک¤ ي‰ê°•ê²½ ىˆکىˆ ى„ ي†µي•œ ىگگ기 ى ˆى œىˆ ë،œ ى¹ک료ي•کىک€ë‹¤. ىˆکىˆ ى‹œ ى¢…ê´´ëٹ” ىœ،ى•ˆىœ¼ë،œ ي™•ى¸ëگکى§€ ى•ٹى•کى§€ë§Œ يˆ¬ى‹œ ى،°ىکپ(C-arm)ى„ ى´ىڑ©ي•کى—¬ ى¢…괴를 ي™•ى¸ي•کى—¬ ى ˆى œي•کىک€ë‹¤. ىˆکىˆ ي›„ ى‹ ى¥ى•”ىک يڈگ ى „ى´ى—گ 대ي•کى—¬ everolimus를 ى‚¬ىڑ©ي•کê³ ى§€ê¸ˆê¹Œى§€ ى§ˆë³‘ىک ى¬ë°œ ى†Œê²¬ ى—†ى´ ى¹ک료 ى¤‘ى´ë‹¤.
ê³ ى°°
ى‹ ى„¸يڈ¬ى•”ىک ىگى—° 경과ëٹ” 매ىڑ° 다ى–‘ي•´ى„œ ى‰½ê²Œ ىکˆى¸،ي•ک기 يک들다. ى‹ ى¥ ى ˆى œىˆ ë،œ ى™„ى „ ى¹کىœ ê°€ ê°€ëٹ¥ي•œ ê²½ىڑ°ëڈ„ ىˆê³ , ىک¤ëœ 기간 ëڈ™ى•ˆىک ى 복기를 ê±°ى³گ ىکˆىƒپي•کى§€ ëھ»ي•œ ي•´ë¶€ي•™ى پ ىœ„ى¹کى—گ ى „ى´ê°€ ë°œىƒي•کëٹ” ê²½ىڑ°ëڈ„ ىˆë‹¤[5]. ى‹ ى„¸يڈ¬ى•”ى€ 림ي”„ى„± ëکگëٹ” يکˆي–‰ى„±ىœ¼ë،œ ى£¼ë،œ ى „ى´ëگکë©°, 복막 ى „ى´ë‚ک ى¸ى ‘ 구ى،°ë¬¼ë،œىک ى§پى ‘ ى¹¨ë²”ى—گ ىکي•´ى„œëڈ„ ى§ˆë³‘ى´ ى§„ي–‰ëگ ىˆک ىˆىœ¼ë©° ي”ي•œ ى „ى´ ى¥ê¸°ëٹ” يڈگ(50-60%), 뼈(30-40%), ê°„(30-40%), 뇌(5%) ىˆœىœ¼ë،œ ى•Œë ¤ى ¸ ىˆë‹¤[6]. ى›گ격 ى „ى´ê°€ ىˆëٹ” ê²½ىڑ° ىˆکىˆ , ë©´ى— ى¹ک료, ë°©ى‚¬ى„ ى¹ک료, ي™”ي•™ ى¹ک료, يک¸ë¥´ëھ¬ ى¹ک료 등ى—گ ىک ë°کى‘ي•کى§€ ى•ٹى•„ 대부분 1ë…„ ë‚´ى—گ ى‚¬ë§ي•کë©° 5ë…„ ىƒى،´ىœ¨ى´ 0-20%ى—گ 불과ي•ک다[7].
1-3기 ى‹ ى„¸يڈ¬ى•” ي™کىگى—گى„œ ىˆکىˆ ى´ي›„ى—گëڈ„ 20-30%ëٹ” ى¬ë°œي•کë©° يڈگ ى „ى´ê°€ ى¬ë°œي™کىگىک 50-60%ى—گى„œ ë°œىƒي•کë©°, يڈ‰ê· ى¬ë°œ 기간ى€ ىˆکىˆ ى´ي›„ 1-2ë…„ى´ë©° 대부분 3ë…„ ى´ë‚´ى—گ ë°œىƒي•œë‹¤. ى‹ ى„¸يڈ¬ى•”ىک يڈگ ى „ى´ ي™کىگىک ىکˆي›„ëٹ” ى „ى´ ى¢…ى–‘ىک يپ¬ê¸°ى™€ ى™„ى „ ى ˆى œ ى—¬ë¶€, 림ي”„ى ˆ ى „ى´ ى—¬ë¶€ê°€ ى¤‘ىڑ”ي•œ ىکˆي›„ى¸ىگ들ى´ë©° ى™„ى „ ى ˆى œë¥¼ ى‹œي–‰ ë°›ى€ ي™کىگى—گى„œëٹ” 3ë…„, 5ë…„ ىƒى،´ىœ¨ى´ ê°پê°پ 54%, 40%ë،œ ë³´ê³ ëگœ ë°” ىˆë‹¤[8].
êµë‚´ى—گى„œ يڈگى•”ىک ë°œىƒë¥ ى€ 남녀 ëھ¨ë‘گى—گى„œ 4번ى§¸ى—گ ي•´ë‹¹ي•کى§€ë§Œ, ى‚¬ë§ë¥ ى€ ê°€ى¥ 높ى€ ى•”ىœ¼ë،œ ى „ى²´ ى•” ى‚¬ë§ë¥ ىک ى•½ 18.9%를 ى°¨ى§€ي•œë‹¤. يڈگى•”ىک ى™„ى „ ى ˆى œëٹ” ىƒى،´ىœ¨ى„ 높ى´ى§€ë§Œ ى•½ 25%ىک ي™کىگ만ى´ ى§„단 ى‹œى گى—گ ىˆکىˆ ى´ ê°€ëٹ¥ي•ک다. ى§„단 ى‹œى گى—گى„œىک 병기ëٹ” ىƒى،´ىœ¨ى„ ىکˆى¸،ي•کëٹ” ëچ° ê°€ى¥ ى¤‘ىڑ”ي•کê³ ى¢…ى–‘ىک يپ¬ê¸° ë°ڈ ى£¼ë³€ىک ى¹¨ë²” ى—¬ë¶€ى™€ 림ي”„ى ˆىک ى „ى´ ى—¬ë¶€ى—گ ë”°ë¼ ë³‘ê¸°ê°€ ë³€ي™”ي•کë©° ى¹ک료 방법 ى—ى‹œ 병기ى—گ ë”°ë¼ ê²°ى •ëگœë‹¤. يڈگى•”ى€ ى ˆى œê°€ ê°€ëٹ¥ي•œ ى،°ê¸°ى—گ 발견ëگکى–´ ى¹ک료를 ي•کىک€ى„ ê²½ىڑ° 5ë…„ ىƒى،´ىœ¨ى´ 80%ê°€ ëگ ىˆک ىˆë‹¤ëٹ” ë³´ê³ ê°€ ىˆىœ¼ë¯€ë،œ ê·¸ى—گ 대ي•œ ى§„단ى€ 매ىڑ° ى¤‘ىڑ”ي•ک다.
يڈگى—گ ë°œىƒي•کëٹ” ى „ى´ى•”ىک ي™•ى¸ى—گ ê°€ى¥ يٹ¹ى´ى پى¸ ê²€ى‚¬ëٹ” ى،°ىکپى¦ê°• ى»´ي“¨ي„° 단ى¸µى´¬ىکپى´ë©° ë‚کى„ يک• ى»´ي“¨ي„° 단ى¸µى´¬ىکپ ë°ڈ ê³ ي•´ىƒپëڈ„ ى»´ي“¨ي„° 단ى¸µى´¬ىکپى€ 매ىڑ° 민ê°گي•œ 방법ىœ¼ë،œ 5 mm ى´ي•کىک ى‘ى€ ê²°ى ˆê¹Œى§€ 발견ي• ىˆک ىˆë‹¤, ىگ기공ëھ…ىکپىƒپى—گى„œëٹ” يڈگ ى „ى´ى•”ىک ى§„단ى—گëٹ” 민ê°گëڈ„ê°€ ë§ژى´ ë–¨ى–´ى§€ë©° يڈگ ى „ى´ى•”ىک ى§„단 ى‹œ ى–‘ى „ىگë°©ى¶œ 단ى¸µى´¬ىکپëڈ„ ëڈ„ى›€ى´ ëگ ىˆک ىˆë‹¤. ى‹ ى„¸يڈ¬ى•”ىک يڈگ ى „ى´ 병변ىک ى–‘ىƒپى—گ 대ي•´ى„œëٹ” 구ى²´ى پىœ¼ë،œ ë³´ê³ ëگœ ë°”ëٹ” ë§ژى§€ ى•ٹى€ëچ° ى¼ë°کى پىœ¼ë،œ ى‹ ى„¸يڈ¬ى•”ى€ ى»´ي“¨ي„° 단ى¸µى´¬ىکپى—گى„œ ê°•ي•œ ى،°ىکپى¦ê°•ى„ ë³´ى´ë©° ê·¸ ى •ëڈ„ëٹ” ى‹ ى„¸يڈ¬ى•”ىک 분ي™” ë°ڈ ى•„يک•ى—گ ë”°ë¼ ë‹¬ë¼ى§„다. êµë‚´ىک ي•œ ى—°êµ¬ى—گى„œëٹ” 36ëھ…ىک ى‹ ى„¸يڈ¬ى•”ىک يڈگ병변 ي™کىگ들ى„ 대ىƒپىœ¼ë،œ ى‹ ى„¸يڈ¬ى•”ىک يڈگ ى „ى´ëٹ” ى›گë°œى„± يڈگى•”ى—گ 비ي•کى—¬ 높ى€ ى،°ىکپى¦ê°•ى„ ë³´ى¸ë‹¤ê³ ë°œي‘œي•کىک€ë‹¤. 61 HUى„ 기ى¤€ىœ¼ë،œ 0.62ىک 민ê°گëڈ„, 0.87ىک يٹ¹ى´ëڈ„를 ë³´ىک€ë‹¤. ي•کى§€ë§Œ ى´ëں¬ي•œ 방법ىœ¼ë،œëڈ„ ى‹ ى„¸يڈ¬ى•”ىک يڈگ ى „ى´ى™€ ى›گë°œى„± يڈگى•”ىک ى™„ë²½ي•œ 구별ى€ 불가ëٹ¥ي•کë‹¤ê³ ي•کىک€ê³ ê²°êµى—گëٹ” ى،°ى§پي•™ى پ ي™•ى§„ى´ ي•„ىڑ”ي•کë‹¤ê³ ê°•ى،°ي•کىک€ë‹¤[9].
ى•” ي™کىگë‚ک ê³ ىœ„ي—کêµ°ى—گى„œ 발견ëگœ 단ى¼ يڈگ ê²°ى ˆ 대ي•œ ATSىک ê¶Œê³ ى•ˆ(The American Association for Thoracic Surgery guidelines)ى—گ 따르면 5-6 mm ى´ي•کىک ê²°ى ˆىک ê²½ىڑ° ê²°ى ˆىک ىŒىکپى—گ 관계ى—†ى´ 6ê°œى›”-1ë…„ 간격ىœ¼ë،œ ى¶”ى پ ê²€ى‚¬ë¥¼ 권ي•کê³ ىˆىœ¼ë©°, 8-10 mmىک ê²°ى ˆىک ê²½ىڑ° ىŒىکپى—گ ë”°ë¼ 3-6ê°œى›” ى¶”ى پ ê²€ى‚¬ë¥¼ ي•œ ي›„ يپ¬ê¸°ىک ë³€ي™”ê°€ ىˆىœ¼ë©´ ى،°ى§پ ê²€ى‚¬ë¥¼ ي•کëڈ„ë، 권ي•کê³ ىˆë‹¤[10].
ى›گë°œى„± يڈگى•”ىک ê²½ىڑ°, يڈگ ى „ى´ë¥¼ ëڈ™ë°کي•کëٹ” ê²½ىڑ°ê°€ ى•½ 10%ë،œ ë³´ê³ ëگکê³ ىˆىœ¼ë¯€ë،œ, يٹ¹يˆ 대결ى ˆ 병변ى„ ëڈ™ë°کي•œ 다발ى„± يڈگ ê²°ى ˆى´ ى‹ ى„¸يڈ¬ى•” ي™کىگى—گى„œ 발견ëگœ ê²½ىڑ°ى—گëڈ„ ى´ ë‘گ ê°€ى§€ى—گ 대ي•œ ê°گ별ى§„단ى´ ë°کë“œى‹œ ê³ ë ¤ëگکى–´ى•¼ ي•œë‹¤. 본 ى¦ë،€ى—گى„œëٹ” ىڑ°ى¸،ىک 1ê°œ, ى¢Œى¸،ىک 1ê°œىک يڈگ ى¢…ê´´ ëھ¨ë‘گ ëڈ™ë§¥ê¸°ى—گ ى،°ىکپىک ى¦ê°€ê°€ 불분ëھ…ي•کë©° 다발ى„±ىœ¼ë،œ ى‹ ى„¸يڈ¬ى•”ىک ى „ى´ë¥¼ 먼ى € ê³ ë ¤ي•کê³ ي•ى•”ى¹ک료를 ى‹œي–‰ي•کى—¬ ىµœى¢… ى§„단ى´ ëٹ¦ى–´ى،Œë‹¤.
ى•…ى„± ى¢…ى–‘ ي™کىگى—گى„œ يڈگ ى¢…괴를 발견ي•کىک€ى„ ë•Œëٹ” ىڑ°ى„ ى „ى´ى•”ى„ ىکى‹¬ي•´ى•¼ ي•کë‚ک, ى›گë°œى„± ى¢…ى–‘ىک ê·¼ى¹کى پ ى¹ک료 ي›„ ى¬ë°œىک ى¦ê±°ê°€ ى—†ëٹ” ي™کىگë‚ک ى¹ک료ى—گ ë°کى‘ى´ ى—†ى„ ë•Œى—گëٹ” يڈگ ى „ى´ى™€ يڈگى•”ى„ ëڈ™ى‹œى—گ ىƒê°پي•کê³ ى´ë¥¼ 구별ي•کى—¬ ى پى ˆي•œ ى¹ک료를 ى‹œي–‰ي•´ى•¼ ي•œë‹¤. ىœ„ ى¦ë،€ëٹ” ى‹ ى„¸يڈ¬ى•” ي™کىگىک ى‹ ى¥ ى ˆى œىˆ ي›„ ى¶”ى پ ê´€ى°° ى¤‘ 발견ëگœ 단ى¼ يڈگ 병변ى—گى„œ ى،°ى§پ ê²€ى‚¬ىک ي•„ىڑ”ى„±ى„ ë³´ى—¬ى£¼ê³ ىˆىœ¼ë©° ى،°ى§پ ê²€ى‚¬ë¥¼ ي†µي•œ ى •ي™•ي•œ ى§„단 ي›„ ê·¸ى—گ ë§ëٹ” ى¹ک료 계يڑچ ى„¤ى •ىک ي•„ىڑ”ى„±ى„ ë³´ى—¬ى¤€ë‹¤.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






