급성 췌장염의 진단 및 치료
Diagnosis and Treatment of Acute Pancreatitis
Article information
Trans Abstract
Acute pancreatitis is common, and is sometimes associated with significant morbidity and mortality. Early diagnosis and assessment of the severity of the condition are important when decisions must be made on appropriate early-stage treatment and/or patient transfer to medical facilities familiar with the condition. Initial intensive management of acute pancreatitis is important to minimize complications and mortality. In the present review, we discuss initial diagnosis of the condition, severity assessment, and the adequacy of early treatments, with reference to recently updated Korean guidelines.
서론
급성 췌장염은 비교적 흔히 진료할 수 있는 질환이나 중증도가 매우 다양하여 췌장에만 염증이 발생하는 경증의 형태에서부터 다발 장기부전 및 사망에 이르는 중증의 형태까지 발생할 수 있다. 경증 췌장염에서는 사망률이 1% 미만인데 반해, 중증 췌장염에서는 매우 높아 무균 괴사 췌장염에서는 10%, 감염 괴사 췌장염의 경우는 25-30%에 이른다[1]. 급성 췌장염 환자에서 사망은 약 50%에서 발병 2주 내에 발생하므로 급성 췌장염의 진단과 동시에 중증도 평가를 시행해 초기에 중증 경과를 보일 것으로 예측되는 환자를 선별하여 집중 치료를 제공하고, 향후 적절한 치료를 제공할 수 있는 기관으로 전원하거나 집중치료의 기준을 제시하는 것이 중요하다. 또한 초기에 경증 또는 중등도의 췌장염이라 하더라도 중증 췌장염으로 진행할 수 있기 때문에 초기 집중적인 치료가 매우 중요하다. 이에 본고에서는 급성 췌장염의 진단과 중증도 분류 및 기본적인 치료 지침을 위주로 살펴보고자 한다.
급성 췌장염의 진단
급성 췌장염 발생시 정확한 진단과 원인에 대한 감별 후 중등도를 파악하여 초기에 적절한 치료계획을 세우는 것이 치료의 예후에 매우 중요하다. 그러나 전형적인 임상 소견이 없거나 검사 결과가 모호하거나 다른 복부 질환과의 감별이 필요하여 진단이 어려운 경우도 많다.
진단 기준
일반적으로 급성 췌장염은 상복부 통증, 혈액검사에서 혈청 아밀라아제나 리파아제가 정상 상한치의 3배 이상 상승, 영상학적으로 복부전산화 단층촬영(abdominal computed tomography, CT), 자기공명영상(magnetic resonance imaging, MRI), 복부초음파 등에서 췌장염 소견에 합당할 때, 이 세 가지 중 두 가지 이상 만족할 경우로 진단한다[1]. 그러나 이런 진단 기준에 부합되더라도 다른 급성 복통을 일으킬 수 있는 위장관 천공, 급성 담낭염, 장마비, 장간막동맥 허혈 혹은 경색, 급성 대동맥 박리, 급성 심근경색 등에 대한 감별이 반드시 필요하다.
임상 증상 및 징후
급성 췌장염 환자의 약 90% 이상에서 상복부 통증을 호소하며, 40-70%에서는 등으로 방사되는 전형적인 복통을 호소한다. 복통의 특징은 시작과 동시에 30분 안에 빠르게 최고조로 이르게 되어 참기 어려울 정도의 통증을 유발하며 호전 없이 24시간 이상 지속되기도 한다. 복통 외에 나타나는 증상과 징후는 식욕부진, 오심과 구토, 고열, 장음의 감소 등이 있다[2-4]. 신체검사에서는 복부에 심한 압통이 있으면서 때때로 복부의 긴장(abdominal guarding)이 동반된다. 드물지만 모든 환자에서 복통이 나타나는 것은 아닌데, 특히 중증 급성 췌장염 환자의 30-40% 정도에서 전형적인 복통 증세를 보이지 않아 부검으로 급성 췌장염이 진단된 경우가 있다. 이는 복통이 없이 혼수상태나 다발성 장기 부전으로 내원해 초기 진단이 어려웠기 때문으로 설명된다[5,6].
생화학적 검사
급성 췌장염이 의심될 때 혈청의 췌장 효소 상승은 진단에 중요한 역할을 한다. 가장 흔히 이용되는 검사는 혈청 아밀라아제와 리파아제 검사로 리파아제가 아밀라아제에 비해 민감도는 비슷하지만 특이도는 더 우월하다[7]. 혈청 아밀라아제의 근원은 췌장이 약 40% 정도를 차지하고 있고 나머지는 주로 침샘과 다른 부분에 있다. 따라서 혈청 아밀라아제 상승은 급성 췌장염 외에도 다른 질환들을 감별해야 한다. 또한 급성 췌장염이라도 상승하지 않는 경우가 있는데, 이는 혈청 아밀라아제가 급성 췌장염 발생 후 바로 감소하기 때문에 경한 급성 췌장염에서 혈액 검사 시기가 늦어진 경우, 만성 췌장염 특히 알코올성 만성 췌장염의 급성 악화의 경우, 중성지방의 상승이 검사를 방해하여 고중성 지방혈증이 있는 경우 정상 수치로 나올 수 있다[8-10]. 반대로 혈청 아밀라아제는 신부전이 있거나 macroamylasemia 같은 췌장질환이 아닌 경우에도 상승할 수 있다. 혈청 리파아제는 췌장염의 진단에 있어서 아밀라아제보다 우수한데 민감도는 85-100%, 특이도는 84.7-99% 정도로 알려져 있다[11]. 혈청 리파아제는 아밀라아제에 비해 더 오랫동안 수치가 상승되어 있고 특히 특이도에 있어 혈청 리파아제는 췌장 외에는 영향을 줄 다른 중요한 근원이 되는 장기가 없다. 그러나 혈청 리파아제 역시 급성 췌장염 이외의 상태에서도 상승할 수 있는데 특히 신부전이 있을 때 아밀라아제와 마찬가지로 신장 기능의 저하에 의해 제거기능이 감소하여 수치가 상승하게 된다. 크레아티닌 청소율이 13-39 mL/min에서 아밀라아제는 반수 이상, 리파아제는 1/4 정도에서 증가되어 있다[12,13]. 다른 췌장 효소 검사로는 혈액이나 소변으로 아밀라아제 isoenzyme, phospholipase A2, elastase1, anionic trypsinogen (trysinogen-2) 등을 측정할 수 있다[14]. 그러나 임상에서 흔하게 사용되지는 않고 있다.
영상 검사
복부 초음파 검사는 비침습적인 검사로 췌장의 비대, 췌장 주변의 염증 변화, 복수 등 급성 췌장염의 소견을 관찰할 수 있고 원인 감별에 도움을 줄 수 있어 초기 검사로 추천될 수 있다[7]. 그러나 복부 비만이나 주변 장관의 공기로 인해 정확한 검사를 시행하기가 어려운 경우가 적지 않아 초음파 검사의 주요 목적은 급성 췌장염의 확진보다는 담낭 담석이나 총담관 담석에 의한 총담관의 확장을 확인하는 데 있다. 복부 CT는 급성 췌장염을 확진하는 데 있어 가장 좋은 검사로 다른 복부 질환들을 감별할 수 있고 췌장염의 중증도를 결정할 수 있으며 동반된 합병증을 확인할 수 있다[1,7]. 최근에는 multi-detector CT의 사용으로 정확도가 증가하고 있다. 급성 췌장염을 나타내는 복부 CT 소견으로는 췌장의 비대, 췌장 실질의 불균질(heterogeneity), 췌장 주변의 액체 저류 등이 있으며 조영제를 사용하면 췌장 괴사를 확인할 수 있다. 그러나 일부 연구에서 CT 촬영 중에 사용하는 조영제가 췌장의 미세순환에 영향을 주어 췌장염을 악화시킨다는 보고가 있다[15,16]. 또한 모든 급성 췌장염 환자에서 복부 CT 검사가 필요한 것은 아니므로 다른 방법으로 급성 췌장염을 진단하거나 다른 질환을 배제하는데 문제가 없다면 증상 발생 후 72-96시간 후에 검사하는 것이 추천된다. 추가로 복부 CT를 시행하는 경우는 환자가 장기 부전이 지속되거나, 패혈증 소견을 보이거나, 임상적으로 악화되는 경우 등이다[1]. Magnetic resonance cholangiopancreatography (MRCP)는 담췌관의 해부학 구조를 파악하고 담관 담석을 확인할 수 있으며 조영 MRI로는 출혈성 췌장 괴사를 감별하는 데 CT보다 유용하다. 일반적으로 복부 MRI는 CT만큼이나 진단에 있어 정확하고 합병증이나 췌장의 괴사, 증증도 평가에도 좋은 검사이다[7,17,18]. 내시경역행담췌관조영술(Endoscopic retrograde cholangiopancreatography, ERCP)은 시술과 관련된 합병증으로 인해 급성 췌장염의 진단을 목적으로 시행하지 않으나 담석성 췌장염이 강력히 의심되는 경우에는 진단과 동시에 치료 목적으로 고려해야 한다.
원인에 대한 평가 및 감별진단
급성 췌장염의 원인에 대한 평가를 위해 이전 췌장염 병력, 담석질환, 음주력, 약물복용력, 고지혈증 유무, 외상, 최근 ERCP와 같은 침습적 시술 여부 등과 같은 개인력과 췌장질환의 가족력, 신체검진, 혈청 생화학검사, 영상 검사 등을 시행해야 한다(Table 1). 혈액 검사로 빌리루빈, ALT, AST, 알칼리인산분해요소(alkaline phosphatase) 등을 측정하여 담석성 췌장염을 감별해야 한다. ALT가 150 IU/L이상인 경우나 빌리루빈, 알칼리인산분해요소, γ-GTP, ALT, ALT/AST중에 3개 이상 증가된 경우도 담석성 급성 췌장염일 가능성이 높다[19,20]. 중성 지방이 1,000 mg/dL 이상 증가한 경우에는 고지혈증에 의한 췌장염 가능성이 높으며, 고칼슘혈증이 있으면 부갑상선 기능항진증도 고려해야 한다[21,22]. 영상 검사로는 비교적 손쉽게 시행할 수 있는 복부 초음파가 담낭 담석이나 담도 확장 등을 확인하여 원인을 아는 데 도움을 줄 수 있다. 그러나 복부 초음파에 이상이 없다고 담석성 췌장염을 배제하기는 어렵다. 복부 CT는 진단과 동시에 종양이나 외상 등 여러 가지 원인에 대해 평가할 수 있지만, 담관 담석의 확인은 민감도가 40-53% 정도로 낮아서 적당하지 않다[20]. 담도성 원인에 대한 감별로 복부 초음파나 생화학 검사에서 음성이고 급성 췌장염의 원인이 불확실한 경우 미세담석이나 만성췌장염, 종양 등 감별을 위해 내시경초음파(endoscopic ultrasonography)가 추천된다. 내시경초음파 역시 음성소견이면 MRCP가 담관 담석뿐 아니라 해부학적 변이 여부 등을 판별하는데 도움을 줄 수 있다. 여기에서도 정상이라면 유전적 원인에 대한 검사도 고려해 보아야 한다.
급성 췌장염의 중등도 평가
급성 췌장염으로 사망하는 경우 약 50%에서 발병 2주 내에 발생하므로 급성 췌장염의 중증도 평가는 초기에 중증 경과를 보일 것으로 예측되는 환자를 선별하여 조기에 집중 치료를 시작하고 예후를 예측하는 데 중요하다. 그러나 급성 췌장염의 임상 양상은 다양하여 중증도에 대한 객관적인 평가는 쉽지 않아서 현재까지 중증 췌장염의 예측은 각 나라나 기구마다 여러 판정 기준이 이용되고 있다.
임상지표로서 신체질량지수(Body Mass Index, BMI) 30 kg/m2 이상인 비만이 중증 급성 췌장염과 관련이 있는 것으로 알려져 있다. 그러나 비만이 급성 췌장염과 관련된 사망에는 관련이 없다는 보고도 있다[23,24]. C-reactive protein (CRP) 수치는 급성 췌장염 악화를 제시하는 믿을 만한 인자로 현재 여겨지고 있다. 여러 권고안들에서도 급성 췌장염 발생 48시간 이후 측정한 15 mg/dL 이상의 혈청 CRP 수치를 예후 인자로 추천하고 있다[1,3,7,25]. 다른 생화학 검사로 입원 시 혈청 blood urea nitrogen (BUN) ≥ 20 mg/dL과 입원 24시간 이후 BUN 상승이 사망률과 연관성을 가진다는 보고가 있고[26], 입원 시와 입원 24시간 이내의 혈청 creatinine > 2.0 mg/dL이 높은 사망률과 관련이 있다는 보고가 있었다[27,28]. 급성 췌장염에서 혈당 > 250 mg/dL인 경우 높은 사망률과 관련을 가진다는 보고도 있지만, 혈당 > 125 mg/dL는 장기 부전이나 사망률과는 연관성이 떨어진다는 보고도 있다[29,30]. 급성 췌장염 환자에서 혈관 내 용적의 감소로 인한 적혈구 용적률(hematocrit)의 상승과 관련되어 입원 시 적혈구 용적률 ≥ 44%이거나 입원 후 24시간 이내에 적혈구 용적률이 감소되지 않는 경우는 췌장의 괴사와 연관된 예측 인자로 제시되었다[31]. 췌장효소 활성 펩타이드, 특히 trypsinogen activation peptide와 carboxypeptidase activation peptide 측정은 급성 췌장염의 중증도 예측에 중요한 정보를 제공하지만 혈청 CRP 이외에는 신속 검사가 어려워 임상적 유용성은 떨어진다[3].
영상 검사를 이용한 중증도 평가
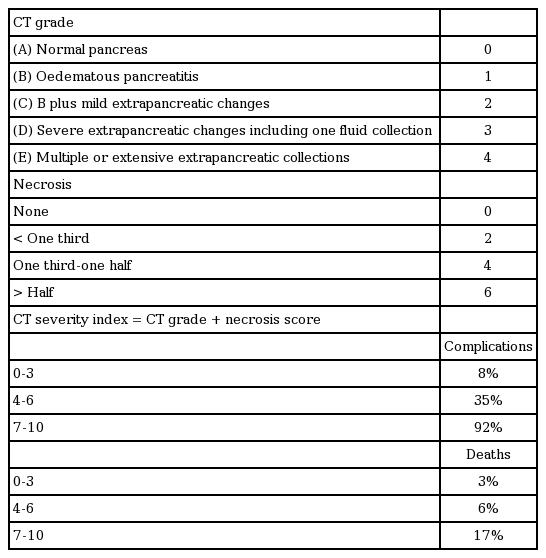
급성 췌장염에서 췌장의 허혈, 괴사 및 병변 범위를 평가하기 위해 조영 증강 복부 CT가 필수적이고 괴사성 췌장염과 부종성 췌장염을 구별하는 데 가장 유용한 검사이다. 또한 복부 CT에서 확인된 췌장의 괴사는 국소 및 전신 합병증과 밀접한 연관성이 있는 것으로 알려져 있어 췌장의 괴사가 의심되는 경우에 적절한 검사이다. 급성 췌장염 발병 4-10일 후 시행하면 거의 100%에서 췌장 괴사의 진단이 가능하고 입원 초기(입원 후 36-48시간 이내)에 시행하여도 급성 췌장염의 중증도 평가에 유용하다[1,3,7]. CT severity index는 췌장 괴사의 유무, 괴사 범위 및 염증 변화의 범위 등을 결합하여 수치화한 것으로(Table 2) 예후와 잘 연관되어 있는 것으로 받아들여지고 있다[32]. CT severity index가 0-3인 경증 급성 췌장염 환자는 임상 양상이 악화되는 경우에만 복부 CT를 추가로 시행하고, CT severity index가 4-10인 중등도 이상의 급성 췌장염 환자에서는 임상상의 호전이 없는 경우에도 시행할 수 있다. CT를 재시행하는 경우는 임상호전이 없거나 증상의 변화 혹은 침습적인 시술을 고려하는 경우 등이다[1]. 또한, 급성 췌장염이 회복되어 퇴원하는 경우에도 가성낭종이나 가성 동맥류와 같은 무증상 합병증을 발견하기 위해 복부 CT 시행이 권고되기도 한다[33]. 조영 증강 복부 MRI도 조영 증강 복부 CT와 유사한 정도로 췌장 괴사의 유무, 괴사 및 염증성 변화의 범위 등을 평가하는 데 유용하다.
중증도 판정 지표를 이용한 평가
단일 생화학 검사나 영상 검사만으로는 중증도 평가에 한계가 있어 다양한 지표들을 활용해 중증도를 판정하는 데 이용되고 있다. 1974년 발표된 Ranson 지표는 다변수 평가법 중 가장 많이 알려진 것으로 입원 시에 5개 항목, 입원 후 48시간 이내에 6개 항목을 측정하여 3가지 이상 관찰되는 경우 중증 췌장염으로 정의하였다(Table 3) [34]. Imrie 등[35]이 개발한 Glasgow 지표는 알코올과 담석 췌장염에 모두 사용할 수 있는 Ranson 지표와 유사한 다변수 평가법으로, Ranson 지표 중 3개 지표를 삭제하고 알부민을 첨가하여 총 9개의 지표로 단순화하였다(Table 4). Acute Physiology and Chronic Health Evaluation (APACHE) II 지표는 특정 질환에 대한 임상 평가가 아니라 중환자실에서 이용되어 온 지표로 12가지의 생리적인 측정치와 나이, 5개의 장기에 기초한 만성 건강 상태를 평가하고 이를 점수화하여 전체 점수를 합산하는 방법으로 산출된다(Table 5) [36]. APACHE II 지표는 입원 수 시간 내에 급성 췌장염의 중증도를 판정할 수 있고 수시로 반복 측정할 수 있어 진행 여부를 평가할 수 있다는 장점이 있다. 비만이 중증 급성 췌장염의 발병과 관련이 있고 사망의 독립적인 예측인자로 인식되면서 APACHE II 지표에 신체질량지수를 더하여 새로운 APACHE-O도 만들어졌다[37]. New Japanese severity scoring system은 9개의 예후 인자로 단순화해 중증과 경증 췌장염을 쉽게 구별하였다(Table 6)[38]. Bedside index for severity in acute pancreatitis 지표는 입원 24시간 동안 BUN > 25 mg/dL, impaired mental status, systemic inflammatory response syndrome (SIRS), age > 60 years, pleural effusion 5개 항목을 갖고 각각 1점을 주어 점수가 높아짐에 따라 사망률이 높아짐을 보고하였다(Table 7) [39].
최근의 the international association of pancreatology (IAP)/the american pancreatic association (APA) 가이드라인에 따르면 증증 급성 췌장염의 예측에 중요한 것으로 입원 당시와 48시간 후 SIRS가 제시되고 있다[1]. SIRS는 다음 네 가지 기준 중 2가지 이상 만족할 때로 정의한다. (1) temperature < 36℃ (96.8℉) or > 38℃ (100.4℉), (2) heart rate > 90/min, (3) respiratory rate > 20/min, and (4) white blood cells (< 4 × 109/L, > 12 × 109) or 10% bands [40]. 급성 췌장염에서 48시간 이상 지속되는 SIRS는 다발성 장기부전 및 사망률과 관련 있는 중요한 요소이다. 지속적인 SIRS 시 사망률이 약 25% 이르는 반면 일시적인 SIRS는 8% 정도로 보고되었고 민감도는 79-86%, 특이도 79-86%였다[41,42]. SIRS는 비교적 간단하고 반복적으로 측정할 수 있어 다른 복잡한 scoring 시스템에 비해 유용하다 할 수 있다. 그러나 다른 검사 방법보다 SIRS가 더 우수하거나 열등한지는 명확하지는 않다[43]. 결국 환자 자체의 위험 요소(나이, 동반질환, BMI 등)와 SIRS의 지속여부 같은 임상적 위험도 분류, 초기 치료에 대한 반응(지속적인 SIRS 여부, BUN, Creatinine 등)이 급성 췌장염의 예후를 예측하는 중요한 기준이 된다[1].
급성 췌장염의 치료
급성 췌장염 진단 및 중등도 예측 후 초기 집중 치료를 요하는 환자군을 선별하여 적절한 치료를 시행하는 것은 췌장염에 의한 합병증 발생 및 사망률을 감소시키는 데 중요하다. 급성 췌장염 자체를 호전시키는 방법은 아직 뚜렷하지 않아 주로 보존적 치료와 합병증에 대한 처치가 치료의 근간으로 환자를 금식시키고 적절한 수액 공급을 조기에 실시하는 것이 가장 중요하다. 이외에도 진통제를 포함한 보존적 치료, 경장관 영양법, 합병증을 줄이기 위한 항생제 및 단백분해효소 등의 사용 여부 등으로 분류해 볼 수 있다.
보존적 치료
수액요법
급성 췌장염 발생시 혈관투과성의 증가와 colloid 삼투압의 감소로 인해 췌장주위, 후복막강뿐 아니라 복강, 흉강 등으로 세포외액의 누출이 발생해 상당한 순환 혈장량의 손실이 유발된다. 저혈량증(hypovolemia)은 췌장의 미세순환을 감소시켜 괴사성 췌장염 발생의 주요 원인이 된다. 따라서 심혈관 장애를 안정화하고 췌장의 미세순환을 증가시키기 위해 손실된 수액에 대한 즉각적인 공급이 필요하다. 초기 수액 투여는 일반적으로 Ringer’s lactate가 추천되고, Hartmann’s solution이 이와 성분이 유사하다. 초기 수액공급의 기준은 심혈관 및 신기능 유지를 목적으로 평균 혈압 65 mmHg 이상, 소변량 > 0.5-1 mL/kg/hr를 유지할 것을 권고한다[2,3,25,44-46]. 초기에 5-10 mL/kg/h 속도로 투여하고 일반적으로 첫 24시간에 2,500-4,000 mL 정도면 충분하다고 한다. 모든 췌장염 환자에서 4,000 mL 이상의 과도한 수액공급이 필요하지는 않다. 2015년 일본 지침의 경우 탈수나 shock이 있는 경우 주의 깊은 모니터링을 하면서 150-600 mL/h로 초기 수액공급하고, 탈수가 없는 경우 130-150 mL/h로 투여할 것을 권고한다[7]. 일반적으로 중심정맥압 측정은 필요하지 않으나 중증의 췌장염에서는 적절한 용적 상태 파악을 위해 필요하고, 폐동맥 쐐기압(pulmonary wedge pressure), 동맥가스혈 분석, 전해질 검사 등을 시행해야 한다[2,3,25,44-46]. 또한, 적절한 수액공급의 지표로 활력징후, 소변량 및 헤마토크릿의 감소정도(입원 후 첫 12시간, 24시간)를 적어도 매 4-6시간 간격으로 측정해야 한다.
대부분의 시험적 연구에서 초기의 적극적인 수액공급 및 산소공급은 췌장 괴사를 최소화하고 생존율을 증가시킨다고 보고하고 있다[47-49]. 그러나 최근 몇몇 연구결과에서는 초기 24시간 이내에 4 L 이상의 과도한 수액공급이 모든 환자에서 필요하지는 않으며 초기에 과도한 수액공급으로 인한 혈액희석(hemodilution)으로 호흡기 합병증이 증가하거나 패혈증 및 사망률 빈도가 높아진다는 보고도 있다[50-52].
통증조절과 산소공급
급성 췌장염에 의한 통증은 지속적이고 심해 불안감을 야기하고 임상경과에 악영향을 미칠 수 있어 마약성 진통제 등을 이용한 복통의 완화는 치료 초기에 매우 중요하다. 현재까지는 어떤 특정한 형태의 투약에 대한 명확한 이점이 보고된 바 없으나 일부 연구에서 non-narcotic analgesic buprenorphine이 procaine보다 우수하며 오디괄약근 수축과 같은 악영향을 미치지 않고 pethidine (meperidine hydrochloride; Demerol)과 비슷한 진통효과가 있다고 한다[53-55]. 또한 복통이 심할 경우 환자주도 통증조절(patient-controlled analgesia)을 시행해 볼 수 있다. 진통제 투약의 빈도나 양은 경험있는 의사에 의해 모니터링 되어야 하며 동시에 침상에서 산소포화도 모니터링을 시행해야 한다. 산소공급은 첫 24-48시간 동안 투여를 권고하는데, 특히 통증 등으로 마약성 진통제를 사용하는 경우에는 초기에 침상에서 산소포화도 모니터링을 하면서 공급한다. 산소농도는 적어도 95% 이상 유지되어야 하며 95% 이하인 경우 동맥가스혈 분석을 시행한다[2,3,25,44-46].
경비위배액
경비위배액(nasogastric drainage)은 경증의 급성 췌장염에서는 필요하지 않으나 마비성 장폐쇄(paralytic ileus)나 잦은 구토 등이 있는 경우 필요할 수 있다. 그러나 급성 췌장염 환자에서 경비위배액이 췌장의 안정화에 유용하다는 뚜렷한 연구결과는 없다. 경증 및 중등도 췌장염의 무작위 대조군 연구에서 위배액은 통증 경감이나 입원기간 단축 등의 임상 경과에 의미 있는 영향을 주지 못했다. 오히려 통증이나 구역감을 증가시킨다는 보고들도 있다. 따라서 모든 췌장염에서 경비배액관 삽입은 권고되지 않으며 췌장염으로 인한 마비성 장폐쇄나 잦은 구토가 있는 경우 삽입을 고려해야 한다[2,3,25, 44-46].
영양지원
경증의 급성 췌장염에서 자연적인 식이진행은 대부분 3-7일내 가능하므로 비경구 영양법이나 경장관 영양법(enteral nutrition)이 필요하지는 않다. 일반적으로 경증의 췌장염에서 환자는 통증이 없어지면 짧은 기간 금식 후 경구식이가 가능하고 통증이 없으면 가능한 빨리 경구식이를 진행하는 것이 좋다. 따라서 경증의 췌장염에서는 환자가 5-7일 이내에 정상식이를 섭취할 수 있다면 경장관 영양 등은 일반적으로 필요하지 않다[2,3,25,44-46]. 경장관 영양법은 중증의 급성 췌장염 초기에 장마비 등이 없다면 조기에 시작하는 것이 경정맥 영양법(intravenous hyperalimentation)보다 우수하다. 경장관 영양법은 염증성 반응을 제거하고 감염 빈도나 수술 빈도를 낮추고 입원기간을 단축해 비용도 절감할 수 있다고 보고되었다. 그러나 사망률이나 감염 외 다른 합병증의 발생 빈도에는 별다른 차이가 없었다. 영양공급은 대부분 경장관 영양만으로 가능하나 충분한 칼로리 공급이 어렵다면 경정맥 영양이 추가로 필요할 수 있다. 경장관 영양법이 보다 우수하다고 판단되는 근거는 중증의 급성 췌장염에서 장관의 장벽기능(barrier function)이 저하되면 박테리아나 endotoxin의 장벽투과성을 증가시켜 장기부전을 일으킬 수 있는 nitric oxide나 cytokine의 생성을 촉진시킬 수 있고, 또한 패혈성 합병증을 일으킬 수 있는 강력한 병적 장내 세균의 위내 군체형성(colonization) 빈도를 증가시킬 수 있기 때문이다. 경장관 영양법은 이러한 장벽기능을 안정화시켜 적절한 영양공급뿐 아니라 전신 합병증을 예방하고 이환율 및 사망률을 감소시킬 수 있다. 또한 경정맥 영양과 관련된 감염, 패혈증 같은 합병증 역시 피할 수 있다. 그러나 최근의 메타 분석 결과를 보면 경장관 영양이 우수하다는 결과와 함께 안정성이나 효과에서 경장관 영양법이 더 우수하다고 보기에는 자료가 충분치 않다는 의견도 있다[56,57].
영양 공급로는 경비공장 배액관(nasojejunal tube)이 일반적으로 추천되었었다. 일반적으로 췌장 외분비기능의 자극을 피하기 위해 가능한 treitz ligament 이하로 공장 배액관(jejunal tube)을 삽입해 영양 공급하는 것을 추천한다[2,3,25,44-46]. 그러나 최근의 문헌고찰에 따르면 경비위 배액관(nasogastric tube)을 이용한 영양공급이 공장 배액관을 이용하는 것과 비교해 안전성이나 사망률 등에 차이가 없고, 또한 경비위배액관은 삽입이 비교적 쉽고 관을 유치하기도 용이하다[58,59]. 따라서 경비관 삽입은 환자 상태 등에 따라 선택적으로 결정될 수 있으며 현재는 두 가지 방법 모두 추천된다[1].
비경구 영양법은 인체에서 췌장의 분비기능을 유의하게 자극하지 않고 췌장기능에도 특별한 부작용을 일으키지는 않는다. 비경구 영양법의 적응증은 비교적 단순해 지속적인 장마비나 complex pancreatic fistulae, 복부구획증후군 등으로 인해 경장관 영양이 불가능한 경우, 즉 경장관 영양으로 목적한 만큼의 영양섭취가 어려운 경우이다[2,3,25,44-46]. 경구식이는 탄수화물과 단백질이 충분하고 지방이 전체 에너지 섭취의 30% 미만의 저지방식이가 추천된다[60].
예방적 항생제 투여
단순히 급성 췌장염에서 감염성 합병증의 예방을 위한 항생제 사용은 추천되지 않는다[1]. 그러나 감염성 췌장 괴사나 패혈증 환자에서의 사망률은 매우 높기 때문에 중증의 급성 췌장염에서 감염성 합병증을 예방하기 위해 항생제 사용이 추천되었다. 일반적으로 괴사성 췌장염에서 발열, 백혈구 증가증이나 장기 부전이 동반된 경우 배양검사나 복부 CT 유도하 흡입검사 등을 시행하는 동안에 예방적으로 항생제를 사용하는 것이 합당하다. 이는 임상증상이 없는 괴사성 췌장염에서 예방적 항생제 사용이 내성균이나 진균 감염의 기회를 제공할 수 있다는 데 근거한다. 최근의 무작위 대조군 연구 결과를 보면 췌장 침투율이 좋은 ciprofloxacin, ofloxacin, imipenem, pefloxacine (pefloxacin) 같은 항생제를 예방적 투여시 췌장내 충분한 조직농도를 유지할 수 있어 감염성 합병증의 빈도를 낮추고 일부 연구에서는 사망률을 감소시킨다는 보고가 있다. 그렇지만 사망률이나 합병증 감소에 차이가 없었다는 보고들도 있다. 메타 분석에서도 췌장 침투율이 좋은 광범위 항생제의 예방적 사용은 감염성 합병증이나 사망률을 감소시킨다고 보고하였으나 역시 차이가 없다는 보고들도 있다[61-66]. 따라서 향후 이에 대한 명확한 진단 기준에 따른 광범위한 대단위 비교연구가 필요하다. 또한, 예방적 광범위 항생제의 사용 시 중증의 급성 췌장염에서 감염성 합병증이나 사망률을 감소시킨다 하더라도 내성균이나 진균 감염의 위험을 증가시키고 이로 인한 사망률을 증가시킬 수 있다는 것을 고려해야 한다[62-72]. 임상연구에서는 예방적으로 췌장조직 침투율이 좋은 fluconazole의 사용이 중증의 급성 췌장염에서 진균 감염의 빈도를 감소시킨다고 보고한 바 있으나 이에 대한 대조연구는 아직 보고된 바 없다[71-72].
결과적으로 중증의 췌장염 혹은 중증 췌장염이 예측되는 환자에서 감염과 연관된 합병증 빈도 감소를 목적으로 광범위 항생제의 예방적 투여는 근거가 미약하고 사망률을 감소시키거나 CT로 증명된 괴사성 췌장염에서의 생존율도 증가시키지는 않는다. 궤사성 췌장염에서 감염이 의심되거나 추가적인 시술이 필요한 경우에는 항생제를 투여한다[1].
약물치료: 단백분해효소 억제 제제 등
단백분해효소 억제제(Protease inhibitor)나 췌장분비억제제(anti-secretory), 항산화제 혹은 항염증제(anti-oxidative, anti-inflammatory agent) 등의 효과에 대해서는 논란이 되고 있다. 지금까지의 초기 연구에서 단백분해효소 억제제나 췌장 분비억제제(octreotide), 항염증제(lexipafant) 등의 유용성이 제기되었으나 뚜렷하게 우수하다는 연구 결과를 보여주지는 못했다. 특히 급성 췌장염에서 단백분해효소 억제제의 유용성은 대부분의 초기 연구에서는 실망스런 결과를 보여주었고 일련의 무작위 대조군 연구(6 trials of gabexate mesilate and 4 trials of aprotinin)의 메타 분석에 따르면 급성 췌장염에서 단백분해효소 억제제의 사용이 합병증을 감소시키나 수술적 중재술의 빈도나 사망률을 감소시키지는 않는다고 보고하였다[73-76]. 그러나 중등도 이상의 급성 췌장염에서는 사망률이 유의하게 감소하였다. 또한, 고용량 gabexate mesilate (2,400 mg/day)의 지속 정맥주입이 장기부전을 동반한 중증 췌장염에서 합병증과 사망률을 감소시켰다는 보고도 있다[77]. 췌장 효소 분비를 억제하는 작용이 있는 somatostatin이나 이와 유사한 octreotide 역시 급성 췌장염 초기에 사용하면 췌장염에 의한 합병증이나 사망률을 감소시킬 수 있다는 연구 보고도 있지만 상반된 보고도 있다. 이러한 연구에 대한 메타분석에서는 somatostatin이나 octreotide 같은 약물이 급성 췌장염에서 사망률을 감소시킬 수 있다고 하였다[78].
일본이나 이탈리아 등의 가이드라인에서는 중등도 이상의 췌장염 초기에 단백분해효소 억제제의 정맥주입 치료를 권고하고 있고, 특히 일본의 경우 gabexate mesilate, nafamostat mesilate, ulinastatin 등의 제재에 대해 중등도에 따른 구체적인 사용 지침을 제시하기도 한다[45,46,79]. 그러나 영국, 미국 등의 대부분 가이드라인에서는 메타분석 등을 근거로 현재 치료지침으로 인정하고 있지 않다. 따라서 향후 지역, 인종 및 중등도에 따른 국내외 대단위 비교연구가 필요할 것으로 생각된다.
기타
일반적으로 H2-blocker나 proton pump inhibitor (PPI)는 급성 췌장염 환자에서 급성 위점막병변(acute gastric mucosal lesion)이나 출혈성 궤양을 동반한 경우를 제외하고는 필요하지 않다[2,3,25,44-46]. PPI 사용 효과에 대한 무작위 비교연구는 아직 없고 이에 대한 지침 역시 아직 보고된 바 없으나 스트레스성 궤양이나 급성 위점막병변이 발생한 급성 췌장염의 경우 사용을 고려한다. 한 문헌 고찰에서는 cimetidine이 급성 췌장염과 연관된 합병증의 빈도를 증가시키는 경향이 있고 통증기간을 증가시킬 수도 있다고 보고하고 있다[80]. 그렇지만 현재까지 cimetidine이나 H2-blocker, PPI 등이 급성 췌장염의 임상 경과를 호전 혹은 악화시킬 수 있다는 임상적 근거는 부족하다.
장의 오염제거(gut decontamination)는 감염성 합병증 예방에 이점이 있다고 생각되나 아직 근거가 미약하고 probiotics의 예방적 사용 역시 예방 목적으로 추천되지는 않는다[1].
집중치료(intensive care unit) 및 전문가에 전원이 필요한 경우
2013년 IAP/APA 권고안에 따르면 중증 췌장염 환자나 방사선, 내시경 혹은 수술적 중재술이 필요한 경우 가능한 상급병원 전문가에 의뢰할 것을 권고한다. 또한 급성 췌장염 환자에서 Society of Critical Care Medicine (SCCM) [81] 기준에 한 가지 이상 해당하는 경우 중환자실 집중 치료를 시행해야 한다[ (1) 분당 맥박수 < 40회 혹은 > 150회; (2) 수축기동맥혈압 < 80 mmHg 혹은 평균동맥혈압 < 60 mmHg 혹은 이완기동맥혈압 > 120 mmHg; (3) 분당 호흡수 > 35회; (4) 혈청 sodium < 110 mmol/L or > 170 mmol/L; (5) 혈청 potassium < 2.0 mmol/L or > 7.0 mmol/L; (6) paO2 < 50 mmHg; (7) pH < 7.1 or > 7.7; (8) 혈당 > 800 mg/dL (> 44.4 mmol/L); (9) 혈청 calcium > 15 mg/dL (> 3.75 mmol/L); (10) 무뇨증, 혹은 (11) 혼수상태]. 초기 치료에도 지속적인 장기 부전이 있는 경우 역시 중환자실 집중치료가 필요하다[1].
담석성 췌장염에서 담낭절제술의 필요성과 시기
담석성 췌장염에서 내시경유두괄약근 절개술은 췌장염의 재발을 예방할 수는 있으나 근본적으로 담낭담석에 의한 담도성 산통이나 담낭염을 예방할 수는 없으므로 담석성 췌장염의 경우 담낭 절제술이 필요하다. 담낭절제술은 일반적으로 경증의 췌장염의 경우 입원해 있는 동안 수술을 권고하나 중증의 췌장염으로 췌장주위 체액고임 등이 있는 경우는 췌장염이 회복되거나 6주 이상 지나 시행하는 것이 안전하다[1]. 한 후향 연구에서 중증의 췌장염에서 조기에 담낭 절제술을 시행한 경우 감염성 체액저류(infected collections)의 빈도가 높다고 하였다[82].
복부구획증후군(abdominal compartment syndrome, ACS)의 치료
ACS는 지속적으로 복강내압이 20 mmHg을 초과해 상승이 지속되는 경우로 새로운 장기 부전의 발생 및 악화, 과도한 수액 투여 등과 연관이 있다. 복압이 상승함에 따라 심박출량이 감소하고 주요 장기로의 혈액공급에 장애가 발생해 ACS 발생은 사망률을 급격히 증가시킬 수 있다. 일반적인 신체검사로 진단할 수 없고 방광을 통해 압력을 측정해야 한다[83]. 과도한 수액공급, 중증도의 췌장염, 신장 및 호흡기 장기부전, CT 등에서 여러 곳에 액체집적이 관찰되는 경우에는 복강내압을 주기적으로 측정해야 한다. 복강내압이 12 mmHg 이상 지속 시 적극적으로 복강내 감압을 위해 비위관을 삽입해 위장 감압과 적절한 수액 공급 및 순환을 유지해 보존적 치료를 유지하면서 15 mmHg 이하로 유지해야 한다. 보존적 치료에도 20 mmHg 이상 유지되고 장기 부전이 발생하면 수술적 감압을 고려해야 한다[1].
궤사성 췌장염에 대한 치료
무균 궤사성 췌장염(sterile necrotizing pancreatitis)에서 방사선, 내시경 혹은 수술적 중재술이 필요한 경우는 walled-off necrosis에 의한 종괴로 위장이나 담도 폐쇄가 발생하거나 감염의 증후가 없더라도 복통 같은 임상증상이 지속되거나 disconnected duct syndrome 등이 발생하는 경우이다. 괴사성 췌장염에서 2차 감염은 보통 증상 발현 약 2-4주 후에 주로 발생하는데 복부 영상에서 췌장 괴사 부위에 공기음영이 관찰되면 강력하게 감염을 의심할 수 있고, 괴사 조직이나 주위 저류액의 균 동정으로 감염을 증명할 수 있다. 균 감염은 복부 CT 또는 초음파 유도하 세침흡인(fine needle aspiration, FNA)을 통하여 진단될 수 있고, 진단 정확도는 89-100%로 높지만 위음성률도 12-25% 정도로 보고되고 있다[84,85]. 일반적으로는 지속적인 발열이나 염증을 나타내는 생화학 검사 수치의 증가나 영상소견에서 감염을 예측할 수 있으므로 일반적인 사용은 추천되지 않는다. FNA는 궤사성 췌장염 발생 이후 수주간 치료에도 이차 감염의 증거가 없으면서 임상적인 호전이 없는 경우 고려함이 적절하다. FNA를 시행함으로써 감염성 궤사의 진단을 더 빨리 할 수 있다거나 항생제 치료 방향이나 결과를 향상시킬 수 있다는 증거가 아직 없다[1].
감염성 췌장 괴사가 의심되거나 확진된 경우의 치료는 괴사된 췌장이나 췌장 주위 조직을 제거하는 것이 기본적인 방법이나 적절한 시기는 췌장염 발생 후 적어도 4주 정도 연기하는 것이 사망률과 합병증을 줄일 수 있다[21,86]. 수술의 높은 사망률과 이환율을 극복하기 위해서 여러 가지 중재적 치료, 즉 내시경초음파를 이용한 경벽 배액술(EUS-guided transmural drainage)이나 경피적 배액술을 먼저 고려하고 다음 단계로 필요하다면 내시경 혹은 수술적 궤사 제거술을 시행한다. 즉 감염성 췌장 괴사 환자에서 초기에는 항생제 투여와 보존적 치료를 하여 괴사 제거술을 가능하면 최대한 지연하고 임상적 상황이 악화되거나 패혈증으로 진행하는 소견이 보이면 괴사 부위의 배액술과 괴사 제거술을 시행한다. 급성 췌장염 발병 후 4주 정도가 지나면 정상 췌장과 괴사된 췌장의 경계구분이 분명해지고 괴사 부분이 액화되므로(walled-off necrosis) 괴사 제거술이 용이하고 괴사 제거술의 합병증을 최소화할 수 있다[1].
결론
급성 췌장염은 초기에 임상 증상 및 생화학 검사, 영상 검사 등을 통해 진단하고 원인 감별을 시행하며 중증도를 판정해야 한다. 이후 중증도에 따라 적극적인 수액치료 및 통증조절을 시행하면서 경장관 영양법 시행여부를 결정하고, 항생제나 췌장단백효소 억제제 등의 투여여부를 결정해야 한다. 또한 중증 췌장염에서는 중환자실 집중 치료 및 상급병원 전원여부에 대한 평가가 고려되어야 한다. 복부구획증후군이나 췌장 궤사와 같은 경우 사망률과 합병증 위험이 높아 내시경 치료나 방사선 중재술, 외과적 수술 등이 필요할 수 있어 적절한 치료 시기 및 방법의 선택이 중요하다. 마지막으로 국내에서는 아직 국내 현실을 반영한 대규모 연구 결과가 부족해 대부분 외국의 연구 결과를 바탕으로 하고 있어 향후 이에 대한 지속적인 연구가 요구된다.
Acknowledgements
급성췌장염 진료 권고안 개발에 함께 참여하시고 본 원고에 도움을 주신 김태현, 이상협, 고동희 교수님께 깊이 감사드립니다.