혈전성 혈소판감소성 자반증이 동반된 성인형 스틸병
Adult-Onset Still’s Disease with Thrombotic Thrombocytopenic Purpura
Article information
Abstract
성인형 스틸병은 다양한 임상증상을 보이는 드문 질환으로 TTP가 동반되는 경우는 매우 드물고 사망률 또한 높다. 이에 저자들은 스테로이드, 항TNF-α제제, 면역 글로불린, 혈장 교환술 치료에 반응이 없었던 TTP를 동반한 성인형 스틸병을 경험하였기에 국내 최초로 보고하는 바이다.
Trans Abstract
Adult-onset Still’s disease (AOSD) is a rare systemic inflammatory disorder that affects multiple organs and is fatal in some cases. Thrombotic thrombocytopenic purpura (TTP), another rare disease, is characterized by multiple organ failure and microangiopathic hemolytic anemia. TTP is an extremely rare complication of AOSD. We report a 59-year-old woman who presented with TTP that manifested after she was diagnosed with AOSD. Initially, her clinical manifestations improved with glucocorticoid therapy. However, her disease worsened and was accompanied by acute kidney injury, thrombocytopenia, hemolytic anemia, petechiae, and impaired consciousness. These clinical findings led to a diagnosis of TTP. This is the first report of AOSD complicated by TTP in Korea. Awareness of the possible development of TTP as a complication of AOSD is important for early diagnosis and treatment.
서 론
성인형 스틸병(adult onset Still’s disease, AOSD)은 고열, 소실성 발진, 관절통 혹은 관절염, 간·비종대, 림프절 종대, 인후통 등을 특징으로 하는 전신 염증질환으로 정확한 발병기전은 아직 명확하지 않다[1]. 증상 및 경과가 다양하고, 경우에 따라 여러 장기를 침범하여 치명적일 수 있다[2]. 검사 소견으로는 백혈구 증가증, 빈혈, 간기능 이상, 혈청 페리틴(ferritin)의 급격한 상승을 보이며 류마티스인자, 항핵항체를 비롯한 자가 항체는 대개 음성이다. 혈전성 혈소판감소성 자반증(thrombotic thrombocytopenic purpura, TTP)은 용혈성 빈혈, 혈소판 감소증, 신경학적 증상, 발열 및 신부전이 주된 증상으로 성인형 스틸병에 합병되어 발생한 경우는 전 세계적으로 드물며 국내에서는 보고된 적이 없다[3]. 이에 저자들은 고용량 글루코코르티코이드, 항tumor necrosis factor-α (TNF-α) 제제, 면역 글로불린, 혈장 교환술 치료에 모두 반응이 없었던 TTP가 동반된 성인형 스틸병을 경험하였기에 보고하는 바이다.
증 례
환 자: 59세 여자
주 소: 열감
현병력: 내원 2주 전부터 시작된 열감, 오한, 인후통, 전신통이 지속되어 응급실을 통하여 내원하였다.
과거력 및 가족력: 특이 사항 없었다.
사회력: 주부
진찰 소견: 활력 징후는 혈압 120/80 mmHg, 맥박수 90회/분, 호흡수 22회/분, 체온 38.7’C였다. 신체 진찰에서 연어색 피부 발진이 양측 팔과 다리에서 관찰되었고, 경부 림프절은 만져지지 않았다. 흉부 청진과 심음은 정상 소견이었고 복부 진찰에서 간과 비장은 만져지지 않았다.
혈액검사 소견: 말초 혈액 검사에서 백혈구 9,730/µL (호중구 89%, 림프구 7.1%, 단핵구 1.7%), 혈색소 10.5 g/dL, 혈소판은 146,000/µL이었다. 그리고 C-반응단백(C-reactive protein) 9.44 mg/dL, 적혈구침강속도(erythrocyte sedimentation rate) 89 mm/hr, 페리틴(ferritin) > 165,000 ng/mL (정상범위 10-291 ng/mL)으로 모두 상승되어 있었다. 생화학적 검사에서 혈청젖산탈수소효소(LDH) 1561.5 U/L (정상범위 264-463 U/L), AST 296 U/L, ALT 317 U/L로 상승되어 있었다. 면역학적 검사에서 HBs 항원 음성, HBs 항체 양성, HCV 항체 음성, VDRL 음성, HIV 항체 음성, 류마티스인자 13.0 IU/mL (정상범위 0-20 IU/mL)으로 정상 범위이며 항핵항체, 항호중구 세포질 자가항체는 음성이었다. 혈액 배양검사, 뇨 배양검사, 객담 배양검사, 결핵균 검사에서 특이소견 없었고, 엡스타인-바 바이러스(Epstein-Barr virus) 항체, 거대세포바이러스(cytomegalovirus) 항체, 렙토스피라(Leptospira) 항체, Rickettsia tsutsugamushi 항체 모두 음성이었다.
영상 소견: 흉부 X선은 정상이었으며, 복부 컴퓨터 단층 촬영에서 비장 비대가 관찰되었고, 흉부 컴퓨터 단층촬영에서 경미한 폐부종과 기관지염이 관찰되었다.
경과 및 치료: 혈액 배양 검사 및 흉·복부 컴퓨터 단층 촬영에서 감염 및 악성 종양의 증거는 발견되지 않았고, 39℃ 이상의 고열, 인후통, 연어색 피부발진, 호중구 증다, 간수치 상승, 그리고 항핵항체와 류마티스인자 음성 소견으로 Yamaguchi 등[1]이 제시한 분류기준을 충족하여 성인형 스틸병으로 진단하였다(환자는 응급실 내원 후 개인적 사정으로 치료 거부하고 퇴원하였다가 2일 후 입원하였고, 입원 이후의 임상적 경과를 Fig. 1에 표시하였다).
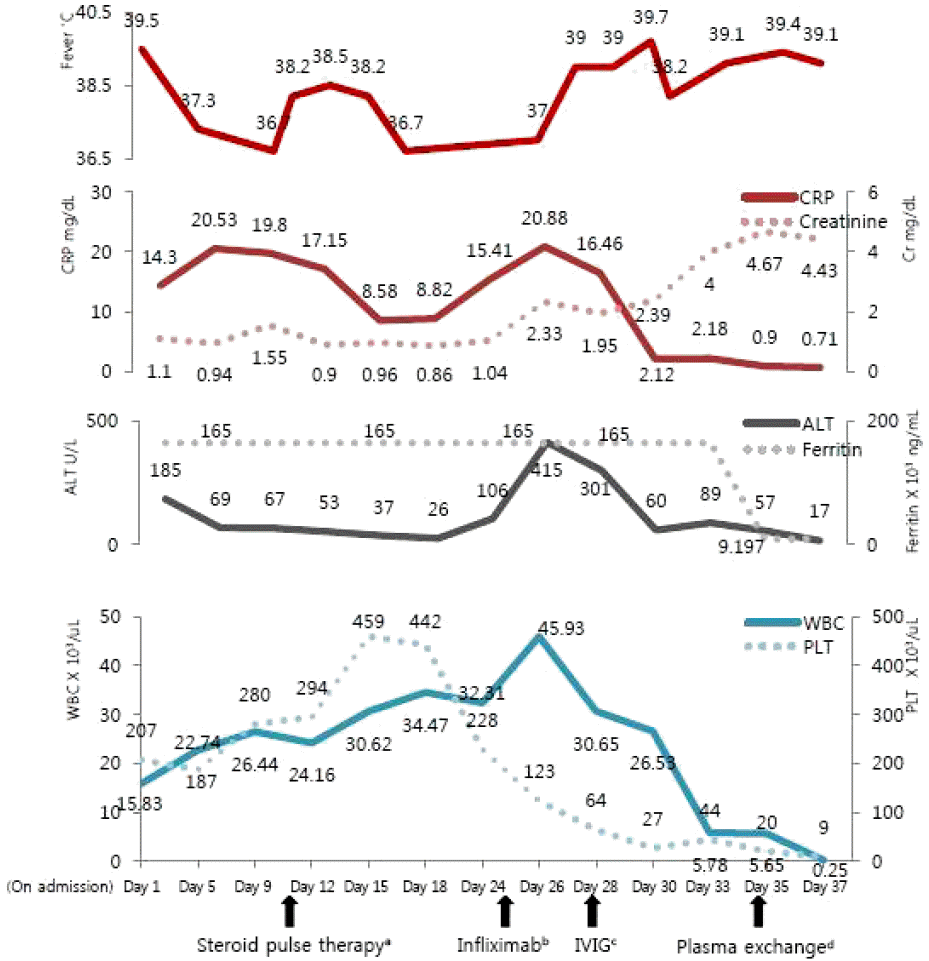
The graph shows the patient’s clinical course. Despite administering high-dose steroid, an anti-TNF-α agent, and plasma exchange therapy, the patient got worse with a fever, increased white blood count, C-reactive protein, and liver enzymes. TNF-α, tumor necrosis factor-α; CRP, C-reactive protein; WBC, white blood cell; IVIG, intravenous immunoglobulin; PLT, platelet; Cr, creatinine. aMethylprednisolone 250 mg/day on days 10-12; b200 mg on day 25; cImmunoglobulin (20 g/day) on days 26-28; dOn days 29-36.
3일간의 스테로이드 충격요법(methylprednisolone 250 mg/day) 후 경구용 스테로이드(prednisolone 40 mg/day)를 투여하였고 이후 발열, 피부발진, 전신통 등의 임상증상이 호전되었고 간수치, C-반응단백 수치도 감소하였다. 그러나 스테로이드 치료 10일째부터 발열, 피부 발진, 전신통이 다시 발생하였고 백혈구, C-반응단백, 간수치가 상승하였다. 성인형 스틸병의 악화로 진단하여 스테로이드를 증량하였고(methylprednisolone 250 mg/day) 항TNF-α제제인 infliximab 200 mg을 투여하였다. 그러나 스테로이드 치료 13일째, 의식이 급속하게 저하되고 양측 하지의 자색반이 새롭게 관찰되었다(Fig. 2A). 혈액 검사에서 blood urea nitrogen, creatinine 수치가 각각 62 mg/dL, 2.33 mg/dL으로 상승하는 등 신기능이 급격히 악화되었고, 백혈구 32,310/µL, 젖산탈수소효소 11,078.5 U/L로 상승하였고, 혈색소 5.1 g/dL, 혈소판 64,000/µL로 감소하였으며, prothrombin time, activated partial thromboplastin time은 정상이었다. 말초 혈액 도말에서 분열 적혈구가 다수 관찰되었고(Fig. 2B) Coomb’s 검사 음성으로 자가면역성 용혈 질환의 가능성을 배제하였다.
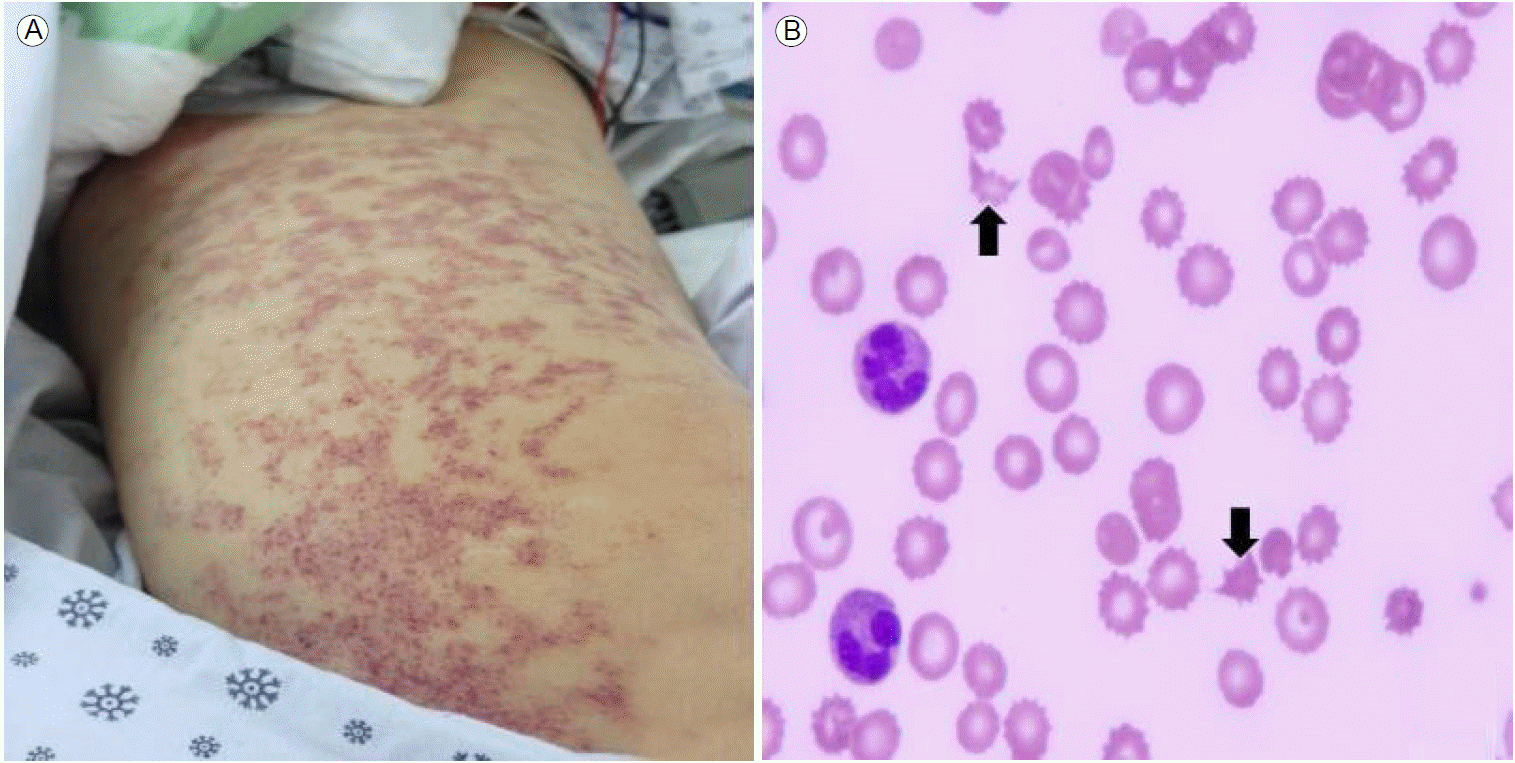
(A) Purpura was observed on her lower legs. (B) Peripheral blood smear shows schistocytes (×400). The arrows show fragmented RBC. RBC, red blood cell.
용혈성 빈혈, 급격한 의식 저하, 신부전, 혈소판 감소증 등의 임상 소견을 바탕으로 TTP로 진단하였고 3일간의 면역글로불린주사(20 g/day)와 수차례에 걸친 혈장 교환술을 시행하였으나 다발성 장기부전으로 진행하였고, 지속성 신대체요법에도 불구하고 스테로이드 치료 24일째 사망하였다(Fig. 1).
고 찰
성인형 스틸병의 합병증으로 발생한 식혈증후군(hemophagocytic syndrome)과 파종성 혈관 내 응고장애(disseminated intravascular coagulation)에 대한 보고는 많이 있었지만 성인형 스틸병에 TTP가 합병된 경우는 전 세계적으로 매우 드물며, 문헌 조사에 의하면 본 증례가 18번째 보고이며 국내에서는 아직 보고된 바가 없다[2,4]. 외국의 사례들에서 환자의 평균 나이는 32.2세, 남녀 성비는 11:6, 성인형 스틸병으로 진단 후 TTP가 합병되기까지 걸린 시간은 3일에서 17년으로 다양하였다. 2명의 환자에서 a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13 (ADAMTS-13)이 감소되어 있었고 17명의 환자 중 3명이 사망하였다[4]. 본 증례에서 ADAMTS-13은 측정하지 않았다.
TTP는 혈전성 미세혈관병증(thrombotic microangiopathy)에 의한 용혈성 빈혈, 혈소판 감소증이 동반된 드문 전신 질환으로 발열, 신장 침범, 출혈 증상, 중추 신경계 증상이 특징적이다. 발생 원인으로는 금속 단백 분해효소인 ADAMTS-13의 결핍 혹은 현저한 활성도 감소와 관련이 있는 것으로 알려져 있고, 세균이나 바이러스 감염, 약물, 독소, 임신과 출산, 췌장염, 결체 조직 질환, 악성 종양 등과 같은 중증 염증 반응 이후에 일어날 수 있다[3]. 또한 자가면역질환에서 생성되는 염증성 사이토카인에 의해 ADAMTS-13에 대한 항체가 생성되고 이로 인해 ADAMTS-13의 활성도가 감소하여 TTP가 발생할 수 있다[5,6].
성인형 스틸병에 합병된 TTP는 그 발생 기전에 대해 연구된 바가 드물다. 성인형 스틸병에서는 다양한 사이토카인, 인터페론 감마(interferon-γ), TNF-α의 활성도 증가로 인해 혈관 내피 세포의 손상과 활성화를 유발하고 혈전성 미세혈관병증을 일으킬 수 있다[7]. 본 증례에서도 발열을 동반한 임상증상의 악화와 혈액검사에서 혈소판 감소, 간수치와 C-반응단백, 그리고 페리틴의 상승이 있었고 의식의 저하, 하지의 자색반, 신기능 악화, 용혈성 빈혈 등이 차례로 동반되어 TTP로 진단하였다. 이러한 임상경과를 고려할 때 성인형 스틸병의 악화로 염증성 사이토카인 폭풍(cytokine storm)이 동반되고 그로 인한 합병증으로 ADAMTS-13에 대한 자가 항체가 생성되어 ADAMTS-13의 활성도가 감소하여 TTP가 발생한 것으로 생각된다.
한편 TTP 발생의 원인으로 약제 가능성도 고려해볼 수 있다. 일반적으로 TTP를 유발할 수 있는 약제로 quinine이 잘 알려져 있으며 mitomycin, gemcitabine과 같은 항암제, cyclosporine, tacrolimus와 같은 면역 억제제 등도 연관이 있다[3]. 드물기는 하지만 항TNF-α제제 사용 후 TTP가 발생한 증례도 보고된 바 있다. 크론병 환자에서 4차례의 adalimumab 투여 이후 TTP에 합당한 임상소견 및 검사실 소견으로 TTP로 진단 후 혈장 교환술로 치료한 사례이며[8], 아직까지 infliximab과 TTP 발생의 상관관계에 대한 보고는 없다. 자가면역질환 및 염증성 장질환에서 항TNF-α제제 투여 이후 빈혈, 호중구 감소증, 혈소판 감소증 혹은 범혈구감소증 등과 같은 혈액학적 부작용 발생에 대한 문헌조사에서 etanercept, infliximab 등이 혈액학적 부작용과 관련이 있었으며, 투여 기간은 약 1주에서 120주까지 다양하였다[9]. 본 증례에서 infliximab 투여 5일 전부터 임상증상이 악화되었고, infliximab 투여 후 부작용이 발생하기까지의 기간을 고려할 때 infliximab에 의해 유발된 TTP보다는 AOSD의 합병증으로 TTP가 발생한 것으로 생각된다.
대부분의 성인형 스틸병은 예후가 비교적 양호한 것으로 알려져 있으나, 식혈증후군이나 파종성 혈관 내 응고장애, TTP 등이 동반된 경우는 치명적인 결과를 초래할 수도 있다[3]. 따라서 질병의 경과 및 치료 반응에 따라 비스테로이드성 항염제, 스테로이드, methotrexate, azathioprine, leflunomide, cyclosporine과 같은 항류마티스제제를 사용할 수 있으며 기존 치료에 불응성인 성인형 스틸병 혹은 심각한 합병증이 동반된 경우 항TNF-α제제, 항interleukin (IL)-1 수용체제제, 항IL-6 수용체제제 등을 사용할 수 있다[10]. Sumida 등[10]에 의하면 etanercept 치료에 불응성인 TTP가 동반된 성인형 스틸병 환자를 tocilizumab (항IL-6 수용체제제)과 혈장 교환술 및 혈액 투석을 지속하며 성공적으로 치료한 사례가 보고된 바 있다.
성인형 스틸병의 치료과정에서 임상증상의 악화 및 백혈구 증가, 간수치 상승, C-반응단백의 상승 등과 같은 혈액검사의 악화가 발생할 경우 반드시 합병증을 고려해야 한다. 또한 의식의 저하, 하지의 자색반, 혈소판의 감소, 신기능의 악화 등이 동반될 경우 성인형 스틸병의 합병증으로 TTP가 발생할 수 있음을 인지해야 한다.