ى„œ ë،
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼(encapsulating peritoneal sclerosis, peritoneal fibrosis)ى€ 복막يˆ¬ى„ ي™کىگى—گ게 ىƒê¸°ëٹ” ي•©ë³‘ى¦ىœ¼ë،œى„œ 비êµگى پ ى پى€ ىœ ë³‘ë¥ ى„ ë³´ى´ى§€ë§Œ(0.3-3.3%) ى‚¬ë§ë¥ ى´ 25%ى—گى„œ 50%까ى§€ ى´ë¥´ëٹ” ى‹¬ê°پي•œ ي•©ë³‘ى¦ى´ë‹¤[1]. ê³ ë†چëڈ„ يڈ¬ëڈ„당ىک 복막يˆ¬ى„ى•،, ë°کë³µى پى¸ ى„¸ê· ى„± 복막ى—¼, ë°ڈ ى¥ê¸°ê°„ىک 복막 يˆ¬ى„ ىœ ى§€ 등ى´ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ىœ„ي—ک ىڑ”ى¸ىœ¼ë،œ ى•Œë ¤ى ¸ ىˆë‹¤[2].
ى„¸ê· ى„± 복막ى—¼(bacterial peritonitis)ى€ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ىœ ë°œ ىڑ”ى¸ى„ê³¼ ëڈ™ى‹œى—گ ëھ‡ëھ‡ ى¦ë،€ ë³´ê³ ى—گى„œëٹ” ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ ي™کىگê°€ ىˆکىˆ ي›„ ى،°ى ˆëگکى§€ ى•ٹëٹ” ى„¸ê· ى„± 복막ى—¼ى—گ ىکي•´ ى‚¬ë§ي–ˆىŒى„ ë³´ê³ ي•œ ë°” ىˆë‹¤[2].
경구 ىکپى–‘ى´ ê°€ëٹ¥ي•œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ë‚´ê³¼ى پ ى¹ک료 경과 ى¤‘ ى„¸ê· ى„± 복막ى—¼ى´ 병발ي•کëٹ” ê²½ىڑ°ى—گ 대ي•کى—¬ ى پي•©ي•œ ى¹ک료 ى§€ى¹¨ى€ ى•„ى§پ ى •ي•´ى§„ 바가 ى—†ë‹¤[2,3].
ى €ىگ들ى€ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىœ¼ë،œ 경구 ىٹ¤ي…Œë،œى´ë“œى™€ يƒ€ëھ©ى‹œيژœ ë³µىڑ© ى¤‘ى—گ ى„¸ê· ى„± 복막ى—¼ى´ 병발ي•œ ë‘گ ىکˆë¥¼ ê²½ي—کي•کىک€ë‹¤. ي•œ ىکˆëٹ” ي•ىƒى œ ى¹ک료ى™€ ىˆکىˆ ى پ ë°°ى•،ىˆ ى„ ë°کë³µي•کىک€ىœ¼ë‚ک 복막ىک 격막(septation)ىœ¼ë،œ ي•ىƒى œ يˆ¬ê³¼ىœ¨ى´ ى¢‹ى§€ ى•ٹى•„ ى‚¬ë§ي•œ ë°کë©´ى—گ 다른 ىکˆëٹ” ي•ىƒى œ ى¹ک료ى™€ ى پê·¹ى پى¸ ى¥ىœ ى°©ë°•ë¦¬ىˆ ى„ 병ي–‰ي•کى—¬ يک¸ى „ëگکى–´ ى´ى—گ 문ي—Œê³ ى°°ê³¼ ي•¨ê»ک ë³´ê³ ي•کê³ ىگ ي•œë‹¤.
ى¦ ë،€
ى¦ë،€ 1
55ى„¸ ى—¬ىگ ي™کىگê°€ ىک¤ي•œê³¼ ë³µي†µى„ ى£¼ى†Œë،œ ى‘급ى‹¤ى—گ ë‚´ى›گي•کىک€ë‹¤. ي™کىگëٹ” يƒ€ى›گى—گى„œ 20ë…„ê°„ ى§€ى†چى™¸ëک복막يˆ¬ى„(continuous ambulatory peritoneal dialysis)ى„ ىœ ى§€ي•کىک€ê³ ë‚´ى›گ 5ë…„ ى „ ë°کë³µëگکëٹ” ى„¸ê· ى„± 복막ى—¼ىœ¼ë،œ يکˆى•،يˆ¬ى„ىœ¼ë،œ ى „ي™کي•کىک€ë‹¤.
ë‚´ى›گ 5ê°œى›” ى „ ë³µي†µ, 복부يŒ½ë§Œ, 구ى—, 구ي† 를 ى£¼ى†Œë،œ 본ى›گ ى†Œي™”기내과ë،œ ë‚´ى›گي•کىک€ë‹¤. 당ى‹œ ى²´ىک¨ى€ 36.7℃ë،œ ى—´ى€ ى—†ى—ˆê³ 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپى—گى„œ 다ëں‰ىک ê³ ىŒىکپ ë³µىˆکى™€ ى„يڑŒي™”ëگکê³ ى،°ىکپ ى¦ê°•ى´ ë³´ى´ëٹ” 복막 ë²½ 비ي›„ ى†Œê²¬ى„ ë³´ى—¬ ê²°ي•µى„± 복막ى—¼ يک¹ى€ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ىکى‹¬ي• ىˆک ىˆى—ˆë‹¤. 복막ى•،ى€ 무ىƒ‰ى—گ ى گëڈ„ê°€ ë†’ê³ يƒپي•کىک€ىœ¼ë©° ë³µىˆک ê²€ى‚¬ى—گى„œ ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ(ADA) 147.9 IU/L, ë°±يکˆêµ¬(white blood cell) 1,350/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬[polymorphonuclear leukocyte] 55%, 림ي”„구 45%), يکˆى²-ë³µىˆک ى•Œë¶€ë¯¼ ë†چëڈ„ى°¨(serum-ascites albumin gradient) 0.8 g/dL, ي•ى‚°ê· ëڈ„ë§گ ىŒى„± ê²€ى‚¬ 등ى„ ë³´ىک€ë‹¤.
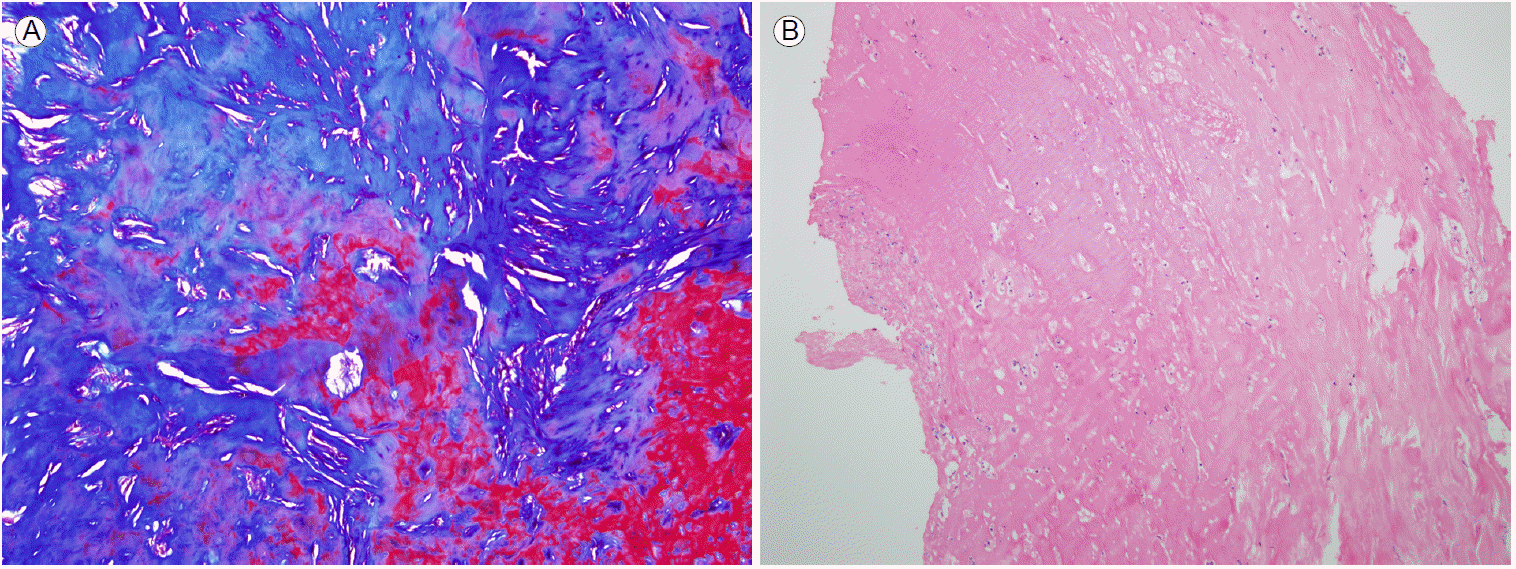
ى„¸ê· ى„± 복막ى—¼ ىکى‹¬ي•کى—¬ ي•ىƒى œ ى¹ک료ë،œ ى‹œي”„ë،œي”„ë،ى‚¬ى‹ , ë©”يٹ¸ë،œë‹ˆë‹¤ى،¸ى„ 15ى¼ê°„ ى •ë§¥ ë‚´ يˆ¬ى•½ي•کىک€ىœ¼ë‚ک ىƒپيƒœëٹ” يک¸ى „ëگکى§€ ى•ٹى•کê³ ë³µىˆکى™€ يکˆى•، ë°°ى–‘ ê²€ى‚¬ى—گى„œ ىŒى„± 결과가 ë‚کى™”다. ê²°ي•µى„± 복막ى—¼ ى§„단ى—گ ىˆى–´ى„œ, ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œىک ى ˆë‹¨ê°’(cut-off value)ى„ 39 IU/Lë،œ ى •ي•کىک€ى„ ë•Œ 100%ىک 민ê°گëڈ„ى™€ 97%ىک يٹ¹ى´ëڈ„ë،œ ى§„단ى´ ê°€ëٹ¥ي•کى—¬[4] 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپê³¼ ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ ىˆکى¹کë،œ ê²°ي•µى„± 복막ى—¼ى„ ىکى‹¬ي•کىک€ê³ ي™•ى§„ى„ ىœ„ي•کى—¬ 복강경 복막 ى،°ى§پ ىƒê²€ى„ ى‹œي–‰ ي›„ 경구 ي•ê²°ي•µى œ(ى´ى†Œë‹ˆى•„ى§€ë“œ, 리يŒœي•€, ي”¼ë¼ى§„ى•„마ى´ë“œ)를 يˆ¬ى—¬ ى‹œى‘ي•کىک€ë‹¤. 4ê°œى›”ê°„ىک ي•ê²°ي•µى œ ى¹ک료ى—گëڈ„ 불구ي•کê³ , ë³µي†µ, 복부 يŒ½ë§Œ, 구ي† ى™€ 구ى— 등ىک ى¦ىƒپى´ يک¸ى „ëگکى§€ ى•ٹى•کىœ¼ë©° ê²°ي•µ ë°°ى–‘ê²€ى‚¬ى™€ 복막 ى،°ى§پ ىƒê²€ ى†Œê²¬ى´ ê²°ي•µى„± 복막ى—¼ى—گ ي•©ë‹¹ي•کى§€ ى•ٹى•ک다(Fig. 1).
ë‚´ى›گ 30ى¼ ى „ ى‹ ى¥ë‚´ê³¼ى—گ ىک뢰ëگکى—ˆê³ , يکˆى•، ê²€ى‚¬ى—گى„œ يکˆىƒ‰ى†Œ(Hb) 10 g/dL, ë°±يکˆêµ¬ 2,100/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 52.4%), C-ë°کى‘ 단백(C-reactive protein) 51.97 mg/Lىœ¼ë،œ ë³´ىک€ىœ¼ë©° ë³µىˆک ê²€ى‚¬ى—گى„œ ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ 139.3 IU/L, ë°±يکˆêµ¬ 1,320/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 35%)ىœ¼ë،œ ë³´ىک€ë‹¤. يکˆى•،, ë³µىˆک ê²€ى‚¬ ê²°ê³¼ ë°ڈ 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپىœ¼ë،œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ىکى‹¬ي•کى—¬ ëھ¨ë“ ي•ê²°ي•µى œë¥¼ ى¤‘단ي•کىک€ê³ 경구 ىٹ¤ي…Œë،œى´ë“œ(prednisolone 25 mg)ى™€ يƒ€ëھ©ى‹œيژœ(10 mg) ى¹ک료를 ى‹œى‘ي•کىک€ë‹¤. ىٹ¤ي…Œë،œى´ë“œ ىڑ©ëں‰ى€ ي•œ 달ى—گ 걸ى³گ 12.5 mg까ى§€ ى گى§„ى پىœ¼ë،œ ê°گëں‰ي•کىک€ë‹¤. ي•ê²°ي•µى œ ى¹ک료 기간 ى¤‘ يکˆى•، ê²€ى‚¬ىƒپ ë°±يکˆêµ¬ê°گى†Œى¦ى´ ى§€ى†چى پىœ¼ë،œ ë³´ىک€ىœ¼ë‚ک ي•ê²°ي•µى œ ى¤‘단 ى´ي›„ 10ى¼ 만ى—گ ë°±يکˆêµ¬ 5,100/mm3ىœ¼ë،œ يک¸ى „ëگکى—ˆë‹¤.
ى…ى›گ 당ى‹œ يکˆى••ى€ 100/60 mmHg, ى‹¬ë°•ىˆک 분당 60يڑŒ, يک¸ي، ىˆک 분당 20يڑŒ, ى²´ىک¨ 36.7℃ىک€ë‹¤. ى¥ىŒى€ 다ى†Œ ê°گى†Œëگکى—ˆىœ¼ë©° ى••ي†µ ë°ڈ ë°کë°œ ى••ي†µى€ ê´€ى°°ëگکى§€ ى•ٹى•ک다.
복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپى—گى„œ ë°©يک•ى„± ë³µىˆک(loculated ascites)ى™€ 복막 비ي›„ ë°ڈ ى،°ىکپ ى¦ê°• ى†Œê²¬ى€ ë‚´ى›گ 30ى¼ ى „ ى‚¬ى§„ê³¼ 비êµگي•کى—¬ ى°¨ى´ê°€ ى—†ى—ˆë‹¤(Fig. 2). يکˆى•، ê²€ى‚¬ى—گى„œ يکˆىƒ‰ى†Œ 10.4 g/dL, ë°±يکˆêµ¬ 20,900/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 95.6%), ى پيکˆêµ¬ ى¹¨ê°•ë¥ (erythrocyte sedimentation rate) > 120 mm/hr, C-ë°کى‘ 단백 185.3 mg/L, ى•Œë¶€ë¯¼ 3.8 g/dL, ى –ى‚°ى—¼(lactate) 3.96 mmol/L, ëڈ™ë§¥يکˆ ê°€ىٹ¤ 7.37-36-89-20.8-97%ë،œ ي™•ى¸ëگکى—ˆê³ ë³µىˆک ى²œىگ ى‹œ 복막ى•،ىک ى گëڈ„ê°€ 보다 높ى•„ى،Œê³ , ë³µىˆک ê²€ى‚¬ى—گى„œëٹ” ë°±يکˆêµ¬ 16,000/uL (다يک•ي•µ ى¤‘ى„±êµ¬ 95%), 단백 5.6 g/dL, ى –ى‚° يƒˆىˆکى†Œيڑ¨ى†Œ(LDH) 8,032 IU/L, ى•„ë°€ë¼ى•„ى œ 113 U/L, ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ 105.4 IU/L, يکˆى²-ë³µىˆک ى•Œë¶€ë¯¼ ë†چëڈ„ ى°¨ 1.4 g/dLىœ¼ë،œ ي™•ى¸ëگکى–´ ى„¸ê· ى„± 복막ى—¼ى—گ ي•©ë‹¹ي•کىک€ë‹¤.
ي™کىگëٹ” ىک¤ى‹¬ى„ يک¸ى†Œي•کىک€ى§€ë§Œ 경구 ىکپى–‘ى´ ىœ ى§€ëگکى–´ ى™„ى „ 비경구 ىکپى–‘법(total parenteral nutrition)ى´ ي•„ىڑ”ى¹کëٹ” ى•ٹى•ک다.
ى…ى›گ 경과 3ى¼ى§¸, ë³µىˆکى—گى„œ ى¥ë‚´êµ¬ê· (Enterococcus facium)ى´ ëڈ™ى •ëگکى–´ ë°کى½”마ى´ى‹ ى„ ى •ë§¥ ë‚´ يˆ¬ى—¬ي•کىک€ê³ , ê·¸ëŒىŒى„± ى„¸ê· ىک ëڈ™ى‹œê°گى—¼ى„ ë°°ى œ ëھ»ي•کى—¬ ëھ©ى‹œي”„ë،ى‚¬ى‹ (moxifloxacin)ëڈ„ ى¶”ê°€ى پىœ¼ë،œ ى •ë§¥ ë‚´ يˆ¬ى•½ي•کىک€ë‹¤. يک¸ى „ى„ ë³´ى´ى§€ ى•ٹى•„ 8ى¼ ي›„ ي‹°ى œى‚¬ى´يپ´ë¦°(tigecycline)ىœ¼ë،œ êµگى²´ي•کى—¬ ى •ë§¥ ë‚´ يˆ¬ى•½ي•کىک€ê³ 30ى¼ê°„(ى…ى›گ 경과 12-47ى¼) ىœ ى§€ي•کىک€ë‹¤. ى…ى›گ 경과 46ى¼ى§¸ ë³µىˆک ى²œىگ ê²€ى‚¬ى—گى„œ ى¥ë‚´êµ¬ê· ى´ ىŒى „ëگکê³ , يکˆى•، ê²€ى‚¬ëٹ” ë°±يکˆêµ¬ 7,000/mm3, ى پيکˆêµ¬ ى¹¨ê°•ë¥ 6 mm/hr, C-ë°کى‘ 단백 5.01 mg/Lىœ¼ë،œ يک¸ى „ëگکى—ˆëٹ”ëچ° ë³µىˆک ê²€ى‚¬ëٹ” ë°±يکˆêµ¬ 4,600/uL (다يک•ي•µ ى¤‘ى„±êµ¬ 98%)ë،œ ى—¼ى¦ىƒپيƒœë¥¼ ë³´ى´ë©° 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپ ى†Œê²¬ى—گى„œ ى—¬ى „يˆ ë°©يک•ى„± ë³µىˆکê°€ ي™•ى¸ëگکى–´(Fig. 3) ى…ى›گ 경과 17ى¼, 58ى¼, 87ى¼ى—گ ى„¸ ى°¨ë،€ى—گ 걸ى³گ ىˆکىˆ ى پ ë°°ى•،ى„ ى‹œëڈ„ي•کىک€ى§€ë§Œ, ë³µىˆک ى گëڈ„ê°€ 높ى•„ ىک ë°°ى•،ëگکى§€ ى•ٹى•ک다.
ى…ى›گ 경과 58ى¼ ى‹œي–‰ي•œ ى،°ى§پ ىƒê²€ى—گى„œ ى¥ë‚´êµ¬ê· ى´ 다ى‹œ ëڈ™ى •ëگکى—ˆىœ¼ë©°, يکˆى•، ê²€ى‚¬ëٹ” ى پيکˆêµ¬ ى¹¨ê°•ë¥ 96 mm/hr, C-ë°کى‘ 단백 145.33 mg/Lىœ¼ë،œ ى•…ي™”ëگکى—ˆىœ¼ë©° ë³µىˆک ê²€ى‚¬ëٹ” ë°±يکˆêµ¬ 4,300/uL(다يک•ي•µ ى¤‘ى„±êµ¬ 81%)ë،œ ى°¨ëڈ„ê°€ ى—†ى—ˆë‹¤. ي•ىƒى œ ى¹ک료ë،œ ى•”ي”¼ى‹¤ë¦°/ى„¤ë°•يƒگ(ى…ى›گ 경과 65-86ى¼), ي‹°ى œى‚¬ى´يپ´ë¦°(ى…ى›گ 경과 86-93ى¼), ë°کى½”마ى´ى‹ (ى…ى›گ 경과 94-130ى¼) 등ى„ ى •ë§¥ ë‚´ يˆ¬ى•½ ى‹œëڈ„ي•کىک€ىœ¼ë‚ک ى¥ë‚´êµ¬ê· ى€ ىŒى „ëگکى§€ ى•ٹى•ک다. ى…ى›گ 경과 113ى¼ى—گ C-ë°کى‘ 단백ى´ 187.23 mg/L까ى§€ ىƒپىٹ¹ي•کى—¬ ي‹°ى œى‚¬ى´يپ´ë¦° ى •ë§¥ ë‚´ يˆ¬ى•½ىœ¼ë،œ êµگى²´ي•کى—¬ ى¹ک료 ى¤‘ ë°کى½”마ى´ى‹ ë‚´ى„± ى¥ë‚´êµ¬ê· ىœ¼ë،œ ê· êµگ대를 ë³´ى—¬ 리네ى،¸ë¦¬ë“œ(linezolid)를 ى •ë§¥ ë‚´ يˆ¬ى•½ي•کىک€ë‹¤. 리네ى،¸ë¦¬ë“œ ى‚¬ىڑ© ي›„ ىƒپيƒœê°€ ى¢‹ى•„ى§€ë©°, C-ë°کى‘ 단백 ىˆکى¹کê°€ 99 mg/L까ى§€ ë–¨ى–´ى§€ëٹ” 등 يک¸ى „ى„ ë³´ىک€ىœ¼ë‚ک ى¹ک료 5ى¼ë§Œى—گ ë²”يکˆêµ¬ê°گى†Œى¦ى„ ë³´ى—¬ 리네ى،¸ë¦¬ë“œë¥¼ ى§€ى†چي• ىˆک ى—†ى–´ ي‹°ى œى‚¬ى´يپ´ë¦°ىœ¼ë،œ ى¬ى „ي™ک ي›„, ى…ى›گ 경과 146ى¼ى—گ ىکپى–‘ 부ى،±ê³¼ يŒ¨يکˆى¦ ى•…ي™”ë،œ ى‚¬ë§ي•کىک€ë‹¤.
ى¦ë،€ 2
64ى„¸ 남ىگ ي™کىگê°€ ë°œى—´, ë³µي†µ, 복부 يŒ½ë§Œى„ ى£¼ى†Œë،œ ë‚´ى›گي•کىک€ë‹¤. 만ى„± ى‚¬êµ¬ى²´ى‹ ى—¼ى—گ ىکي•œ ë§گ기 ى‹ ى§ˆي™کىœ¼ë،œ 15ë…„ê°„ ى§€ى†چ ى™¸ëک복막يˆ¬ى„(8,000 mL)ى„ ىœ ى§€ي•کىک€ë‹¤. ë‚´ى›گ 4ë…„ ى „ ى‹¬ى¥ë§‰ى‚¼ى¶œى•،ê³¼ ي‰ë§‰ى‚¼ى¶œى•،ىœ¼ë،œ ى§€ى†چى پى¸ 복막يˆ¬ى„ ىˆœي™ک(continuous cycling peritoneal dialysis at 12,000 mL)ىœ¼ë،œ ى „ي™کي•کë©° ى™¼ىھ½ ىƒپى™„ى—گ ëڈ™ى •ë§¥ë£¨ ىˆکىˆ ى„ ى‹œي–‰ي•کى—¬ يکˆى•،يˆ¬ى„ ى „ي™کى—گ 대비ي•کىک€ë‹¤. ë‚´ى›گ 1ë…„ ى „ ي‰ë§‰ى‚¼ى¶œى•،ى´ 다ى‹œ 발견ëگکى–´ يکˆى•، يˆ¬ى„ىœ¼ë،œ ى „ي™کي•کىک€ë‹¤.
ë‚´ى›گ 5ê°œى›” ى „ يکˆى•، ê²€ى‚¬ëٹ” يکˆىƒ‰ى†Œ 10.6 g/dL, ë°±يکˆêµ¬ 5,900/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 81%), C-ë°کى‘ 단백 22.59 mg/Lى´ى—ˆê³ , 복막ى•،ى€ 무ىƒ‰ى—گ يƒپي•کë©° ى گëڈ„ê°€ ë‚®ى•کê³ ë³µىˆک ê²€ى‚¬ëٹ” ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ 17.3 IU/L, ë°±يکˆêµ¬ 800/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 10%)ى´ى—ˆë‹¤. يکˆى•،, ë³µىˆک ê²€ى‚¬ ê²°ê³¼ ë°ڈ 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپىœ¼ë،œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ى§„단ي•کىک€ىœ¼ë©° ى´ي›„ 경구 ىٹ¤ي…Œë،œى´ë“œ(prednisolone 30 mg)ى™€ يƒ€ëھ©ى‹œيژœ(10 mg)ىœ¼ë،œ ى¹ک료 ى‹œى‘ي•کىک€ë‹¤. ىٹ¤ي…Œë،œى´ë“œ ىڑ©ëں‰ى€ 2달간 10 mg까ى§€ ى گى§„ى پىœ¼ë،œ ê°گëں‰ي•کىک€ë‹¤.
ë‚´ى›گ 당ى‹œ يکˆى••ى€ 130/80 mmHg, ى‹¬ë°•ىˆک 분당 84يڑŒ, يک¸ي، ىˆک 분당 20يڑŒ, ى²´ىک¨ 38.1℃ى´ى—ˆë‹¤. ى¥ىŒى€ 다ى†Œ ê°گى†Œëگکى–´ ىˆى—ˆىœ¼ë©° ى••ي†µ ë°ڈ ë°کë°œ ى••ي†µى€ ê´€ى°°ëگکى§€ ى•ٹى•ک다.
ë³µىˆکى²œىگ ê²€ى‚¬ى—گى„œ ë°±يکˆêµ¬ 13,500/uL (다يک•ي•µ ى¤‘ى„±êµ¬ 95%), 단백 3.5 g/dL, يƒˆىˆکى†Œيڑ¨ى†Œ 10,816 IU/L, ى•„ë°€ë¼ى•„ى œ 38 U/L, ى•„ëچ°ë…¸ى‹ يƒˆى•„미노يڑ¨ى†Œ 84.2 IU/Lىœ¼ë،œ ى„¸ê· ى„± 복막ى—¼ىœ¼ë،œ ى§„단ëگکى—ˆê³ , ë³µىˆکى—گى„œ يڈگë ´ ë§‰ëŒ€ê· (Klebsiella pneumoniae)ى´ ëڈ™ى •ëگکى—ˆë‹¤. يکˆى•، ê²€ى‚¬ëٹ” يکˆىƒ‰ى†Œ 9.1 g/dL, ë°±يکˆêµ¬ 12,300/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 94.6%), ى پيکˆêµ¬ ى¹¨ê°•ë¥ > 120 mm/hr, C-ë°کى‘ 단백 197.73 mg/dLى´ى—ˆë‹¤.
ي™کىگëٹ” 경구 ىکپى–‘ى´ ê°€ëٹ¥ي•کى—¬ ى™„ى „ 비경구 ىکپى–‘법ى´ ي•„ىڑ”ى¹ک ى•ٹى•ک다. 40ى¼ê°„ىک ى •ë§¥ ë‚´ ي•ىƒى œ ى¹ک료 ي›„(ê³ ىڑ©ëں‰ ى„¸ي”„يٹ¸ë¦¬ى•…ى†گ[4 g/day], ى‹œي”„ë،œي”„ë،ى‚¬ى‹ [400 mg/day]) يکˆى•، ê²€ى‚¬ى—گى„œ يکˆىƒ‰ى†Œ 9.3 g/dL, ë°±يکˆêµ¬ 7,300/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 85.3%), ى پيکˆêµ¬ ى¹¨ê°•ë¥ 76 mm/hr, C-ë°کى‘ 단백 50.53 mg/dLىœ¼ë،œ يک¸ى „ëگکى—ˆىœ¼ë‚ک 복막ى•،ى€ ى—¬ى „يˆ يƒپي•کê³ ى–‘ى´ ى¤„ى§€ ى•ٹى•کىœ¼ë©° ë³µىˆک ê²€ى‚¬ى—گى„œ ë°±يکˆêµ¬ 70,000/uL (다يک•ي•µ ى¤‘ى„±êµ¬ 95%)ë،œ ى•…ي™”ëگکى—ˆê³ ى¹ک료 ى „ ى‚¬ى§„ê³¼ 비êµگي•کى—¬ ى „ى‚°ë‹¨ى¸µى´¬ىکپ ى†Œê²¬(Fig. 4) ى—ى‹œ ى•…ي™”ëگکëٹ” ى–‘ىƒپى´ى—ˆë‹¤. ى„¸ê· ى„± 복막ى—¼ى´ ى§€ى†چëگکëٹ” ىƒپي™©ىœ¼ë،œ ىˆکىˆ ىœ„ي—کى„±ى€ 높ى§€ë§Œ 단ىˆœ ë°°ى•،ىˆ 보다 ى¥ىœ ى°©ë°•ë¦¬ىˆ ë°ڈ 복막 ى ˆى œىˆ ى„ ى‹œي–‰ي•کىک€ë‹¤. ىˆکىˆ ي›„ 14ى¼ê°„ ى„¸ي”„يٹ¸ë¦¬ى•…ى†گ(2 g/day), ى‹œي”„ë،œي”„ë،ى‚¬ى‹ (400 mg/day)ى„ ى •ë§¥ ë‚´ يˆ¬ى•½ ىœ ى§€ي•کىک€ىœ¼ë©°, ىˆکىˆ ى¤‘ ى¥ 미ى„¸ى²œê³µ ê°€ëٹ¥ى„± ىˆى–´ ë©”يٹ¸ë،œë‹ˆë‹¤ى،¸(1,500 mg/day)ى„ ىˆکىˆ ي›„ 10ى¼ ëڈ™ى•ˆ ى •ë§¥ ë‚´ يˆ¬ى•½ي•کىک€ë‹¤. ىˆکىˆ ي›„ 7ى¼ى§¸ ي™کىگëٹ” ê³ يک• ى‹ى´ë¥¼ ë³µي†µ ى—†ى´ ى„ى·¨ ê°€ëٹ¥ي•کىک€ê³ , ىˆکىˆ ي›„ 10ى¼ى§¸ 경구 ىٹ¤ي…Œë،œى´ë“œ(prednisolone 30 mg)ى™€ يƒ€ëھ©ى‹œيژœ(10 mg) ى¬يˆ¬ى—¬ ى‹œى‘ي•کىک€ë‹¤. ىˆکىˆ ي›„ 2달ى§¸, يکˆى•، ê²€ى‚¬ëٹ” ë°±يکˆêµ¬ 6,600/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 75.5%), C-ë°کى‘ 단백 4.9 mg/dLىک€ê³ ë³µىˆکê²€ى‚¬ëٹ” ë°±يکˆêµ¬ 5/uLى´ى—ˆىœ¼ë©° 복부 ى „ى‚°ë‹¨ى¸µى´¬ىکپ ى†Œê²¬ëڈ„ يک¸ى „ëگکى–´(Fig. 5) ي‡´ى›گي•کىک€ë‹¤.
ي‡´ى›گ ي›„ 20ê°œى›”ى§¸, ي™کىگ ىƒپيƒœëٹ” ى–‘يک¸ي•کê³ يکˆى•، ê²€ى‚¬ى—گى„œ ë°±يکˆêµ¬ 4,500/mm3 (다يک•ي•µ ى¤‘ى„±êµ¬ 75.5%), C-ë°کى‘ 단백 9.93 mg/dLىœ¼ë،œ ى•ˆى •ى پى´ë©° ى¥يڈگىƒ‰ ى¦ىƒپى€ ى—†ى—ˆë‹¤. ىœ ى§€ ى¹ک료ë،œ يƒ€ëھ©ى‹œيژœ(10 mg) ë°ڈ ى € ىڑ©ëں‰ ىٹ¤ي…Œë،œى´ë“œ(prednisolone 2.5 mg every other day)를 ىˆکىˆ ي›„ 15ê°œى›”까ى§€ يˆ¬ى—¬ي•کىک€ê³ يک„ى¬ëٹ” ëھ¨ë“ ى•½ë¬¼ى„ ى¤‘단ي•œ ىƒپيƒœى´ë‹¤.
ê³ ى°°
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىœ¼ë،œ 경구 ىٹ¤ي…Œë،œى´ë“œ ë³µىڑ© ى¤‘ى—گ ى„¸ê· ى„± 복막ى—¼ى´ 병발ي•œ ë‘گ ى¦ë،€ë¥¼ ى‚´يژ´ë³´ى•ک다.
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ى •ي™•ي•œ 발병기ى „ى´ ë°يک€ى§€ى§„ ى•ٹى•کى§€ë§Œ ى—¬ëں¬ ىڑ”ى¸ë“¤ى´ ى†Œê°œëگکê³ ىˆëٹ”ëچ°, ى¼ى°¨ى پىœ¼ë،œ 복막 يˆ¬ê³¼ى„±ى„ ى¦ê°€ى‹œي‚¤ëٹ” ىڑ”ى¸ë“¤ى´ë‹¤. 복막يˆ¬ى„ ى‹œى‘ ى—°ë ¹ى´ ى–´ë¦¬ê±°ë‚ک 복막يˆ¬ى„ى„ ى¥ê¸°ê°„ ىœ ى§€ي• ىˆکë،, ى„¸ê· ى„± يک¹ى€ ى§„ê· ى„± 복막ى—¼ى´ ë°کë³µëگکê±°ë‚ک, ىƒى²´ى—گ 부ى پي•©ي•œ ê³ ë†چëڈ„ يڈ¬ëڈ„당 복막يˆ¬ى„ى•،ê³¼ ë² يƒ€ ى°¨ë‹¨ى œë¥¼ ë§ژى´ ى‚¬ىڑ©ي• ىˆکë، ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ë°œىƒ ê°€ëٹ¥ى„±ى´ 높다[2]. 복막يˆ¬ى„ ى‹œى‘ ى—°ë ¹ى´ ى–´ë¦´ىˆکë، ى،°ى§پ ى†گىƒپىک يڑŒë³µëٹ¥ى´ ى¢‹ى•„ 복막 ى†گىƒپى´ ى„¬ىœ ي™”ë،œ ى‰½ê²Œ ى§„ي–‰ي•ک기 때문ىœ¼ë،œ ىƒê°پëگœë‹¤[5].
ى¦ë،€ 1ى€ ي™کىگê°€ يƒ€ى›گى—گى„œ ى¹ک료 ë°›ى•ک기 때문ى—گ يˆ¬ى„ى•، ë†چëڈ„ 등ىک ى •ي™•ي•œ ى •ë³´ëٹ” ëھ¨ë¥´ى§€ë§Œ, 복막يˆ¬ى„ ى‹œى‘ ى—°ë ¹ى´ 20ى„¸ىک€ê³ 복막يˆ¬ى„ى„ 20ë…„ê°„ ىœ ى§€ي•کىک€ىœ¼ë©°, ê·¸ 빈ëڈ„ë‚ک ى›گى¸ ê· ى£¼ëٹ” ëھ¨ë¥´ى§€ë§Œ ى„¸ê· ى„± 복막ى—¼ى´ ë°کë³µëگکëٹ” 등, ë³µي•©ى پى¸ ى›گى¸ë“¤ë،œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى´ 병발ي•œ 것ىœ¼ë،œ ىƒê°پëگœë‹¤. ى¦ë،€ 2ëٹ” ى„¸ê· ى„± 복막ى—¼ى´ 1يڑŒىک€ê³ 당ى‹œ ê· ى£¼ëٹ” يڈ¬ëڈ„ىƒپêµ¬ê· ë£¨ê·¸ë‘گ넨ى‹œىٹ¤(staphylococcus lugdunensis)ë،œ ي†µىƒپى پىœ¼ë،œ ى¹ک료ëگکى—ˆىœ¼ë©° ë‚®ى€ ë†چëڈ„ىک يڈ¬ëڈ„당 복막ى•،ى„ ى‚¬ىڑ©ي–ˆى§€ë§Œ(1.5%, 2.5%), 18ë…„ê°„ىک ىک¤ëœ 복막يˆ¬ى„ ىœ ى§€ê¸°ê°„ى´ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ىœ ë°œي–ˆى„ 것ىœ¼ë،œ ىƒê°پëگœë‹¤.
ى،°ê¸°ى—گ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ى§„단ي•کëٹ” ي‘œى§€ىگê°€ 발견ëگکى§€ ى•ٹê³ ى¹ک료 ى‹¤يŒ¨ ë°ڈ ى‚¬ë§ë¥ ى´ 높ى•„ ىکˆë°©ى´ ëچ”ىڑ± ى¤‘ىڑ”ى‹œ ëگœë‹¤. يک„ى¬ ى œى‹œëگکê³ ىˆëٹ” 방법ى€ ىƒى²´ى پي•© 복막 يˆ¬ى„ى•،(biocompatible dialysate) ى‚¬ىڑ©ê³¼ 계يڑچëگœ 복막يˆ¬ى„ ى¤‘단(planned peritoneal dialysis discontinuation)ى´ ىˆê³ 복막 ى„¸ى²™ى—گëٹ” يک„ى¬ ë…¼ë€ى´ ىˆë‹¤. ىƒى²´ى—گ 부ى پي•©ي•œ 복막يˆ¬ى„ى•،ى€ ê³ ë†چëڈ„ يڈ¬ëڈ„당, يڈ¬ëڈ„당분ي•´ى‚°ë¬¼, ى –ى‚° 등ى„ ي•¨ىœ ي•کê³ ىˆى–´ 복막 يˆ¬ê³¼ى„±ى„ 높ى´ê²Œ ëگکê³ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى„ ى¼ىœ¼ي‚¬ ىˆک ىˆë‹¤. يڈ¬ëڈ„당ى´ ي•¨ىœ ëگکى§€ ى•ٹى•„ يڈ¬ëڈ„당분ي•´ى‚°ë¬¼ى´ ى پى€ ى•„ى´ى½”ëچ±ىٹ¤يٹ¸ë¦°(icodextrin) 기ë°کىک ى¤‘ى„± 복막يˆ¬ى„ى•،(neutral solution)ى„ ى‚¬ىڑ©ي•کëڈ„ë، 권ى¥ي•کê³ ىˆë‹¤[6]. 복막 يˆ¬ى„ 기간ى´ 길ى–´ى§ˆىˆکë، 복막يˆ¬ê³¼ى„±ى´ ى¦ê°€ي•کى—¬ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک 발병과 ê´€ë ¨ى´ ىˆëٹ” 것ىœ¼ë،œ ë³´ى¸ë‹¤[7]. ى´ى—گ ى¼ë³¸ يˆ¬ى„ ى„¼ي„°ى—گى„œëٹ” 복막يˆ¬ى„ىک ىµœى¥ ىœ ى§€ 기간ى„ 5-8ë…„ىœ¼ë،œ ë³´ê³ ىˆىœ¼ë©° ى پ당ي•œ ى‹œê¸°ى—گ 계يڑچëگœ 복막يˆ¬ى„ ى¤‘단ى„ ê¶Œê³ ي•کê³ ىˆë‹¤[6,7]. ي•کى§€ë§Œ ىµœê·¼ ى¤‘ى„± 복막يˆ¬ى„ى•،ى„ ى‚¬ىڑ©ي•œ ي™کىگ êµ°ى—گى„œëٹ” ىœ ى§€ 기간ى—گ ë”°ë¼ ë³µë§‰ يˆ¬ê³¼ى„±ى´ ى¦ê°€ي•کى§€ ى•ٹëٹ” 것ىœ¼ë،œ ë³´ى—¬, 계يڑچëگœ 복막يˆ¬ى„ ى¤‘단ىک ي•„ىڑ”ى„±ى—گ 대ي•œ ى¶”ê°€ى پى¸ ى—°êµ¬ê°€ ي•„ىڑ”ي• 것ى´ë‹¤. ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک 2/3ëٹ” 복막يˆ¬ى„ ى¤‘ى§€ ى´ي›„ى—گ 발병ي•کëٹ” 것ىœ¼ë،œ ى•Œë ¤ى ¸ ى¼ë³¸ 등ى§€ى—گى„œ 복막يˆ¬ى„ ى¤‘ى§€ ى´ي›„ى—گ ى—¬ëں¬ ى—¼ى¦ى „구물ى§ˆ, ى„¬ىœ ى†Œ 등ىک ى œê±°ë¥¼ ىœ„ي•´ 복막 ى„¸ى²™ى„ ى‹œي–‰ي•کê³ ىˆë‹¤[6]. ي•کى§€ë§Œ 다기관 ى „ي–¥ ى—°êµ¬ى—گ 따르면 복막 ى„¸ى²™ى´ ى„¸ê· ى„± 복막ى—¼ى„ ىœ ë°œي•کى—¬ ىک¤يˆë ¤ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ 발병ى—گ ى¢‹ى§€ ى•ٹى€ ىکپي–¥ى„ 미ى¹کëٹ” 것ىœ¼ë،œ ë³´ê³ ëگکى—ˆë‹¤[8].
ى¦ë،€ 1, ى¦ë،€ 2 ëھ¨ë‘گ ى¤‘ى„± 복막يˆ¬ى„ى•،ى€ ى‚¬ىڑ©ي•کى§€ ى•ٹى•کê³ , ى¦ë،€ 2ëٹ” 계يڑچëگœ 복막يˆ¬ى„ ى¤‘단ي•کىک€ىœ¼ë‚ک 복막 ى„¸ى²™ى€ ى‹œي–‰ي•کى§€ ى•ٹى•ک다.
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ ى¹ک료ى—گ 대ي•œ 무ى‘ىœ„ ى،°ى ˆ ى—°êµ¬(randomized controlled study)ê°€ ى‹œي–‰ëگœ ى پى´ ى—†ى–´ ëھ…ي™•ي•œ ى¹ک료 ى§€ى¹¨ى´ ى •ي•´ى ¸ ىˆى§€ëٹ” ى•ٹ다. ى—¬ëں¬ ى¦ë،€ ë³´ê³ ى™€ ëھ‡ëھ‡ ى‘ى€ ê·œëھ¨ىک ى—°êµ¬ى—گى„œëٹ” 복막يˆ¬ى„ ى¤‘ى§€ى™€ ىٹ¤ي…Œë،œى´ë“œ يک¹ى€ 다른 ë©´ى—ى–µى œى œى™€ ي•¨ê»ک ى™„ى „ 비경구 ىکپى–‘법ى„ ىœ ى§€ي•کëٹ” 등ىک 대ى¦ ى¹ک료를 ê¶Œê³ ي•کê³ ىˆë‹¤. ى—¬ëں¬ ى„¬ىœ ي™” ى§ˆي™کىک ى¹ک료ى—گ ى“°ى´ëٹ” يƒ€ëھ©ى‹œيژœ ëکگي•œ ى‹œëڈ„ëگکê³ ىˆë‹¤[8,9].
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى´ ى§„ي–‰ي•کى—¬ 비가ى—ى پى¸ ى¥ يڈگىƒ‰ى´ ë°œىƒي•کىک€ى„ ê²½ىڑ°ى—گëٹ” ى•½ë¬¼ى¹ک료를 비ë،¯ي•œ 대ى¦ ى¹ک료ëٹ” يڑ¨ê³¼ê°€ ى œي•œëگکى–´ ىˆکىˆ ى پ ى¹ک료가 ê¶Œê³ ëگکê³ ىˆë‹¤. ىˆکىˆ ى پ ى¹ک료ëٹ” 40%ىک ى‚¬ë§ë¥ ى„ ë³´ى—¬ ى§€ى–‘ëگکى–´ ى™”ىœ¼ë‚ک, Kawanishi 등[10]ى—گى„œëٹ” ىˆکىˆ ي›„ 4%ىک ى‚¬ë§ë¥ ى„ ë³´ê³ ي•کى—¬, ىˆ™ë ¨ëگکê³ ê²½ي—ک ë§ژى€ ى™¸ê³¼ىکê°€ ى§‘ëڈ„ي•کëٹ” ê²½ىڑ° ىˆکىˆ ى پ ى¹ک료ىک يڑ¨ê³¼ê°€ ىˆىŒى„ ى…ى¦ي•کىک€ë‹¤. ى§€ى†چى پى¸ 대ى¦ ى¹ک료ى—گëڈ„ 불구ي•کê³ ى¥ يڈگىƒ‰ى´ ي•´ê²°ëگکى§€ ى•ٹى„ ë•Œ, ê²½ي—ک ىˆëٹ” ى „문 ى™¸ê³¼ىکê°€ ى§‘ëڈ„ي• ىˆک ىˆëٹ” ê²½ىڑ°ى—گ ي•œي•کى—¬ ىˆکىˆ ى پ ى¹ک료가 ê¶Œê³ ëگکê³ ىˆë‹¤. 본 ë‘گ ى¦ë،€ ëھ¨ë‘گ ى¥ ىœ ى°©ى´ ىˆىœ¼ë‚ک 경구 ىکپى–‘ى´ ê°€ëٹ¥ي•œ ىƒپيƒœë،œ يک„ ë°©ى¹¨ى—گى„œ ىˆکىˆ ى پ ى¹ک료ىک ى پى‘ى¦ى—گ ي•´ë‹¹ëگکى§€ ى•ٹى•ک다.
단ىˆœ ى„¸ê· ى„± 복막ى—¼ىک ê²½ىڑ°, 대개 ي•ىƒى œ ى¹ک료만ىœ¼ë،œ يک¸ى „ëگکë©° 3ى„¸ëŒ€ ى„¸يŒ”ë،œىٹ¤يڈ¬ë¦°ىک 2ى£¼ ىœ ى§€ىڑ”법ى´ ê°€ى¥ ë„گ리 ê¶Œê³ ëگکê³ ىˆë‹¤[11]. ي•کى§€ë§Œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى´ ëڈ™ë°کëگœ ê²½ىڑ° ي•ىƒى œ يˆ¬ê³¼ىœ¨ى´ ë–¨ى–´ى§€ë©° ë°©يک•ى„± ë³µىˆکىک ë°°ى•،ëڈ„ ىڑ©ى´ى¹ک ى•ٹى•„ 기ى،´ ى¹ک료만ىœ¼ë،œ يک¸ى „ى„ 기대ي•ک기 ى–´ë µë‹¤.
ى¦ë،€ 1ى€ ي•ىƒى œ ى¹ک료ى™€ ىˆکىˆ ى پ ë°°ى•،ىˆ ىک 병ي–‰ى´ ى£¼ëگœ ى¹ک료ىک€ë‹¤. ى´ˆê¸°ى—گëٹ” ي•ىƒى œى—گ ë°کى‘ى´ ى¢‹ى•کىœ¼ë‚ک 겹겹ى´ ى¤‘격ى„ يک•ى„±ي•œ ي”¼ë§‰ىœ¼ë،œ ى¸ي•´ ي•ىƒى œ يˆ¬ê³¼ىœ¨ى´ ى¢‹ى§€ ى•ٹى•„ ى„¸ê· 박멸ى´ ىڑ©ى´ى¹ک ى•ٹى•کê³ , ى¹ک료기간ى´ ى—°ى¥ëگ¨ى—گ ë”°ë¼ ë‹¤ى œë‚´ى„± ê· ىک ى¤‘ë³µê°گى—¼ى´ ë°œىƒي•کى—¬ ë°کë³µى پى¸ ىˆکىˆ ى پ ë°°ى•،ىˆ ى—گëڈ„ 불구ي•کê³ يک¸ى „ى„ ë³´ى´ى§€ ëھ»ي–ˆë‹¤. ى¦ë،€ 2ëٹ” ي•ىƒى œ ى¹ک료ى™€ ى¥ىœ ى°©ë°•ë¦¬ىˆ ë°ڈ 복막ى œê±°ىˆ ى„ ى‹œي–‰ي•کىک€ë‹¤. ى„¸ê· ى„± 복막ى—¼ى´ ى،°ى ˆëگکى§€ ى•ٹëٹ” ىƒپيƒœى—گى„œ ىˆکىˆ ي›„ ى¶”ê°€ ê°گى—¼ىک ىœ„ي—کى´ ىˆىœ¼ë‚ک ى„¸ê· ى„± 복막ى—¼ ى¹ک료를 ىœ„ي•´ ىˆکىˆ ى„ ى‹œëڈ„ي•کىک€ê³ يک¸ى „ëگکى—ˆë‹¤.
ى €ىگ들ى€ ىµœê·¼ 비ىٹ·ي•œ ى‹œê¸°ى—گ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ ي™کىگى—گى„œ 경구 ىٹ¤ي…Œë،œى´ë“œ ë³µىڑ© ى¤‘ ى„¸ê· ى„± 복막ى—¼ى´ 병발ي•œ ىœ ى‚¬ي•œ ى¦ë،€ë¥¼ ê²½ي—کي•کىک€ë‹¤. ي•ىƒى œ ë°ڈ ى پê·¹ى پى¸ ىˆکىˆ ى پ ى¹ک료를 ى‹œي–‰ي•œ ى¦ë،€ 2ى—گى„œ 대ى¦ ى¹ک료ى™€ ي•ىƒى œë§Œ ىœ ى§€ي•œ ى¦ë،€ 1보다 ى¢‹ى€ 결과를 ë³´ى•ک다. ë‘گ ي™کىگىک ë‚کى´, ى „ى‹ ىƒپيƒœ, ى¥ يڈگىƒ‰ىک ى§„ي–‰ ى •ëڈ„ê°€ 비ىٹ·ي•کىک€ë‹¤. 비ىٹ·ي•œ ى،°ê±´ى—گى„œ ى„¸ê· ى„± 복막ى—¼ىک ى¹ک료를 ى‹œى‘ي•œ ë‘گ ى¦ë،€ë§Œىœ¼ë،œ ىکˆي›„ ى¸ىگ를 ىکˆى¸،ي•ک기ëٹ” يک들ى§€ë§Œ, ى¦ë،€ 2ى—گى„œëٹ” ë‚کيƒ€ë‚کى§€ ى•ٹى•کëچک 다ى œë‚´ى„± ê· ىک ى¤‘ë³µê°گى—¼, ي•ىƒى œ 부ى‘ىڑ©, ىکپى–‘부ى،± 등ى´ ىڑ”ى¸ى¼ 것ىœ¼ë،œ ىکˆى¸، ê°€ëٹ¥ي•ک다. ي•کى§€ë§Œ ى´ëں¬ي•œ ى§•ي›„들ى€ ى¹ک료 ى‹œى‘ 100ى¼ ى´ي›„ ë‚کيƒ€ë‚¬ê³ 40ى¼ى§¸ى—گ ىˆکىˆ ى„ ى‹œي–‰ي•œ ى¦ë،€ 2ى—گى„œëٹ” ë‚کيƒ€ë‚کى§€ ى•ٹى•ک다. ى پى ˆي•œ ى‹œê¸°ى—گ ë¹ ë¥¸ ىˆکىˆ ى پ ى¹ک료가 ى¤‘ىڑ”ي• 것ىœ¼ë،œ ىکˆىƒپëگœë‹¤.
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىœ¼ë،œ 1ë…„ê°„ ىٹ¤ي…Œë،œى´ë“œ ى¹ک료 ى¤‘, ى¥ى²œê³µ ë°ڈ 복강내 ë†چى–‘ى´ ë°œىƒي•œ ى¦ë،€ ë³´ê³ ê°€ ىˆë‹¤[12]. 본 ى¦ë،€ى™€ëٹ” 달리 ى¥ ى²œê³µى´ ëڈ™ë°کëگکى—ˆê³ ى¥ 문ي•©ىˆ ىک ى–´ë ¤ى›€ى´ ىˆى–´ ى پى ˆي•œ ىˆکىˆ ى پ ى¹ک료가 ى‹œي–‰ëگکى§€ ëھ»ي•کى—¬ ي•ىƒى œ ى¹ک료 ë°ڈ 대ى¦ ى¹ک료만 ىœ ى§€ي•کëچک ى¤‘ ى‚¬ë§ي•کىک€ë‹¤. 다른 ى¦ë،€ ë³´ê³ ى—گى„œëٹ” ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ ى§„단 ي›„ى—گ ي™کىگىک 거부ë،œ 복막يˆ¬ى„ ى¤‘ى§€ë¥¼ ëھ»ي•کىک€ىœ¼ë©° ى´ي›„ ى„¸ê· ى„± 복막ى—¼ى´ 병발ي•کىک€ë‹¤[13]. 본 ى¦ë،€ى™€ 달리 ى پى ˆي•œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ىک ى¹ک료 ë°ڈ ي•©ë³‘ى¦ ىکˆë°©ى„ ي•کى§€ ى•ٹى•„ ى§ˆي™کىک ى§„ي–‰ ى •ëڈ„ê°€ ى‹¬ي–ˆê³ ىˆکىˆ ي›„ ي•ىƒى œ ى¹ک료ى—گëڈ„ ى¥ 누ى¶œى´ ى§€ى†چëگکى–´ يŒ¨يکˆى¦ىœ¼ë،œ ى‚¬ë§ي•کىک€ë‹¤. ëکگ 다른 ى¦ë،€ ë³´ê³ ى—گى„œëٹ” 복막يˆ¬ى„ ىœ ى§€ ى¤‘ى—گ ê²°ي•µى„± 복막ى—¼ى´ ë°œىƒي•کى—¬ 3ى£¼ê°„ ي•ê²°ي•µى œ ىœ ى§€ي•کىک€ê³ ى•½ى œ ë‚´ى„± ë°ڈ ىˆœى‘ëڈ„ى—گ 문ى œê°€ ى—†ى—ˆىŒى—گëڈ„ ى•…ي™”ëگکى—ˆë‹¤[14]. ىکپىƒپê²€ى‚¬ى—گى„œ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى´ ى§„단ëگکى–´ ى¥ىœ ى°©ë°•ë¦¬ىˆ ë°ڈ 복막ى œê±°ىˆ ى„ ى‹œي–‰ي•کىک€ê³ ىˆکىˆ ى „ê³¼ ëڈ™ى¼ي•œ ي•ê²°ي•µى œ ىœ ى§€ ى¤‘ى—گ يک¸ى „ëگکى—ˆë‹¤. ى¦ë،€ 2ى™€ ê°™ى´ ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ ى¹ک료 ëڈ„ى¤‘ ê°گى—¼ى´ 병발ي•œ ىکˆëٹ” ى•„니ى§€ë§Œ ىˆکىˆ ى پ ى¹ک료 ي›„ ى´ى „ê³¼ ëڈ™ى¼ي•œ ى¹ک료 ى•½ى œى—گ ى¢‹ى€ ë°کى‘ى„ ë³´ى¸ ى گى´ ىœ ى‚¬ي•کىک€ë‹¤.
ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى´ ى§„단ëگکë©´ 복막يˆ¬ى„ ى¤‘ى§€ë¥¼ يڈ¬ي•¨ي•œ 대ى¦ ى¹ک료 ى‹œي–‰ى„ ê¶Œê³ ي•œë‹¤. ى¹ک료 ëڈ„ى¤‘ ى„¸ê· ى„± 복막ى—¼ى´ ëڈ™ë°کëگ ê²½ىڑ° 2ى£¼ ى´ىƒپىک ى پى ˆي•œ ë‚´ê³¼ى پ ي•ىƒى œ ى¹ک료ى—گ يک¸ى „ëگکى§€ ى•ٹëٹ”다면 기ى،´ىک ê²½ي™”ى„± ي”¼ë§‰ى„± 복막ى—¼ى—گى„œ ىˆکىˆ ى پى‘ى¦ى—گ ي•´ë‹¹ëگکى§€ ى•ٹëچ”ë¼ëڈ„ ى،°ê¸°ى—گ ى پê·¹ى پى¸ ىˆکىˆ ى پ ى¹ک료를 ê³ ë ¤ي•´ى•¼ ي• 것ىœ¼ë،œ ىƒê°پي•œë‹¤.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






