 |
 |
| Korean J Med > Volume 85(6); 2013 > Article |
|
мҡ”м•Ҫ
м Җмһҗл“ӨмқҖ Bнҳ• к°„м—јм—җ мқҳн•ң к°„кІҪнҷ”к°Җ мһҲлҠ” нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң л°ҳліөм Ғмқё ліөмҲҳ л°Ҹ ліөл§үм—јмқҳ мҰқмғҒмқҙ л°ңмғқн•ҳм—¬ кІҪнҷ”м„ұ ліөл§үм—ј мқҳмӢ¬н•ҳм—җ к°ңліөмҲ лЎң мқҙлҘј нҷ•м§„н•ҳмҳҖкі мқҙнӣ„ мҠӨн…ҢлЎңмқҙл“ң м№ҳлЈҢлЎң нҳём „лҗң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқ„ 1мҳҲлҘј кІҪн—ҳн•ҳмҳҖкё°м—җ л¬ён—Ңкі м°°кіј н•Ёк»ҳ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
Abstract
Encapsulating peritoneal fibrosis (EPF) is a serious, uncommon complication of chronic peritoneal dialysis. However, it is rare in hemodialysis patients. EPF is characterized by peritoneal membrane inflammation followed by peritoneal membrane fibrosis and encapsulation. The etiology is unclear, but inflammation of the deteriorated peritoneum causes peritoneal fibrosis. We present a case of EPF that occurred in a 29-year-old man with hepatitis B-associated liver cirrhosis with ascites that was treated solely with hemodialysis. We managed this patient surgically and then medically with prednisolone. To our knowledge, this is the first such case in Korea, so we report this case with a literature review. (Korean J Med 2013;85:629-633)
кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҖ ліөл§үмқҳ 섬мң нҷ”мҷҖ мң м°©мңјлЎң мқён•ң кё°кі„м Ғ мһҘ нҸҗмғүмқ„ мң л°ңн•ҳлҠ” мһ„мғҒмҰқнӣ„кө°мңјлЎң 1980л…„ Gandhi л“ұ[1]мқҙ мІҳмқҢ ліҙкі н•ҳмҳҖлӢӨ. нҠ№м§•м ҒмңјлЎң ліөл§ү м—јмҰқмқҙ 진н–үлҗҳл©ҙм„ң 섬мң нҷ”к°Җ л°ңмғқлҗҳкі н”јл§ү нҳ•м„ұмқ„ н•ҳлҠ” м§ҲнҷҳмңјлЎң мЈјлЎң ліөл§ү нҲ¬м„қмқҳ л§Ңм„ұ н•©лі‘мҰқмңјлЎң л°ңмғқн•ҳл©° л°ңмғқ кё°м „мқҖ лӘ…нҷ•н•ҳм§Җ м•Ҡм§Җл§Ң лӢӨм–‘н•ң мқёмһҗк°Җ мһ‘мҡ©н• кІғмңјлЎң 추측лҗҳкі мһҲлӢӨ. л°ңмғқмқҳ мң„н—ҳмқёмһҗлЎңлҠ” м§ҖмҶҚм„ұ нҷҚл°ҳм„ұ лЈЁн‘ёмҠӨ, мғқмӢқкё°кі„мқҳ мў…м–‘, ліөк°•лӮҙ м•”мў…, к°„кІҪнҷ” нҷҳмһҗм—җм„ң ліөл§ү м •л§Ҙ лӢЁлқҪмҲ мқ„ мӢңн–үн•ң кІҪмҡ°, л°ҳліөм Ғмқё ліөмҲҳ мІңмһҗ к·ёлҰ¬кі лІ нғҖм°ЁлӢЁм ң мӮ¬мҡ© л“ұмқҙ ліҙкі лҗҳм–ҙмһҲлӢӨ[1-4].
мһ„мғҒмҰқмғҒмқҖ мҙҲкё°м—җ л°ңм—ҙ, кө¬м—ӯ, мһ…л§ӣ м—ҶмқҢ, мІҙмӨ‘к°җмҶҢ л“ұмқҳ 비нҠ№мқҙм Ғмқё мҰқмғҒмңјлЎң мӢңмһ‘лҗҳкі ліөл§ү лӮҙ нҷңлҸҷм„ұ 섬мң нҷ”к°Җ л°ңмғқн•ҳм—¬ ліөнҶө, мһҘ нҸҗмғү л“ұмқҙ лӮҳнғҖлӮңлӢӨ. 진лӢЁмқ„ мң„н•ҙм„ңлҠ” ліөл¶Җ м „мӮ°нҷ” лӢЁмёө мҙ¬мҳҒмқҙ 비침мҠөм Ғмқё л°©лІ•мңјлЎң лҜјк°җлҸ„мҷҖ нҠ№мқҙлҸ„к°Җ лҶ’мқҖ кІҖмӮ¬мқҙкі нҷ•м§„мқҖ к°ңліөмҲ мқ„ нҶөн•ң мЎ°м§Ғ кІҖмӮ¬лЎң мқҙлЈЁм–ҙ진лӢӨ[2].
м§ҖкёҲк№Ңм§Җ көӯлӮҙм—җм„ң ліөл§ү нҲ¬м„қкіј кҙҖл Ён•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јм—җ лҢҖн•ҙм„ңлҠ” ліҙкі к°Җ л“ңл¬јм§Җ м•ҠкІҢ мһҲмңјлӮҳ нҳҲм•ЎнҲ¬м„қ мӨ‘мқё нҷҳмһҗм—җм„ңмқҳ мҳҲлҠ” ліҙкі лҗң л°”к°Җ м—Ҷкі н•ҙмҷём—җм„ңмқҳ ліҙкі лҸ„ л§Өмҡ° л“ңл¬јлӢӨ[3,5]. м Җмһҗл“ӨмқҖ көӯлӮҙм—җм„ң ліөл§ү нҲ¬м„қмқҳ кіјкұ°л Ҙмқҙ м—ҶлҠ” нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң л°ңмғқн•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ 1мҳҲлҘј кІҪн—ҳн•ҳмҳҖкё°м—җ л¬ён—Ңкі м°°кіј н•Ёк»ҳ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
нҷҳ мһҗ: 29м„ё, лӮЁмһҗ
мЈј мҶҢ: л°ңм—ҙ л°Ҹ ліөнҶө
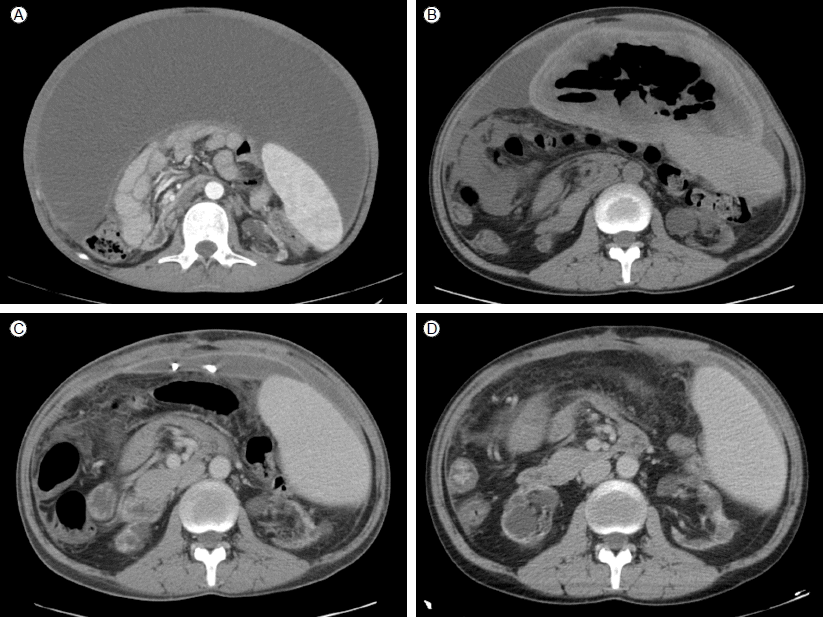
нҳ„лі‘л Ҙ: лӮҙмӣҗ 5л…„ м „м—җ Bнҳ• к°„м—јм—җ мқҳн•ң к°„кІҪнҷ”лҘј 진лӢЁ л°ӣм•ҳкі 2л…„ м „л¶Җн„° ліөмҲҳлЎң мқён•ң ліөл¶ҖнҢҪл§Ңмқҙ мһҲм–ҙ л°ҳліөм ҒмңјлЎң ліөмҲҳ мІңмһҗмҲ мқ„ мӢңн–үл°ӣм•ҳлӢӨ. лӢ№мӢң ліөмҲҳлҠ” нҳҲм„ұмқҳ м—¬м¶ңм•Ў м–‘мғҒмқҙм—Ҳкі ліөл¶Җ мҙҲмқҢнҢҢм—җм„ң лӢӨлҹүмқҳ ліөмҲҳмҷҖ к°„кІҪнҷ” мҶҢкІ¬мқҙ кҙҖм°°лҗҳм—ҲмңјлӮҳ ліөл§ү 비нӣ„ мҶҢкІ¬мқҖ м—Ҷм—ҲлӢӨ. лӮҙмӣҗ 1л…„ 6к°ңмӣ” м „ м§ҖмҶҚм Ғмқё ліөл¶Җ нҢҪл§Ң л°Ҹ ліөнҶөмқҙ л°ңмғқн•ҳм—¬ мӢңн–үн•ң ліөл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒкІҖмӮ¬мғҒ 비нӣ„лҗң ліөл§ү лӮҙл¶Җм—җ м•ЎмІҙ м ҖлҘҳ мҶҢкІ¬мқҙ мһҲм–ҙ(Fig. 1A) кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмңјлЎң мқҳмӢ¬лҗҳм–ҙ нғҖлӘ©мӢңнҺңмқ„ н•ҳлЈЁ 10 mg ліөмҡ©н•ҳкё° мӢңмһ‘н•ҳмҳҖлӢӨ. мқҙнӣ„м—җлҸ„ мһ„мғҒмҰқмғҒмқҖ нҳём „лҗҳм§Җ м•Ҡм•ҳкі ліөмҲҳлҘј мЎ°м Ҳн•ҳкё° мң„н•ҙм„ң л°ҳліөм Ғмқё ліөмҲҳ мІңмһҗмҲ мқ„ мӢңн–үл°ӣм•ҳлӢӨ. лӮҙмӣҗ 3к°ңмӣ” м „л¶Җн„°лҠ” ліөмҲҳ мІңмһҗлЎңлҠ” ліөмҲҳ мЎ°м Ҳмқҙ м–ҙл ӨмӣҢ кІҪн”јм Ғ л°°м•ЎкҙҖ мӮҪмһ…мҲ мқ„ мӢңн–үн•ҳмҳҖлӢӨ. л°°м•ЎкҙҖмқ„ нҶөн•ҙ нҳҲм•Ў м–‘мғҒмқҳ мӮјм¶ңм•Ўмқҙ л§Өмқј 100-200 cc м •лҸ„ л°°м•Ўлҗҳм—ҲлӢӨ. нҷҳмһҗмқҳ мһ„мғҒм Ғ мғҒнғңлҠ” 비көҗм Ғ м•Ҳм •м Ғмқҙм—ҲмңјлӮҳ лӮҙмӣҗ мқҙнӢҖ м „л¶Җн„° л°°м•ЎкҙҖмқҙ л§үнһҢ нӣ„ ліөл¶Җ нҢҪл§Ң, кі м—ҙ к·ёлҰ¬кі ліөнҶөмқҙ л°ңмғқн•ҳм—¬ м •л°Җ кІҖмӮ¬ л°Ҹ м№ҳлЈҢлҘј мң„н•ҙ мһ…мӣҗн•ҳмҳҖлӢӨ.
кіјкұ°л Ҙ: л§үм„ұ мҰқмӢқм„ұ мӮ¬кө¬мІҙмӢ м—јмңјлЎң мқён•ң л§җкё°мӢ л¶Җм „мңјлЎң 9л…„ м „л¶Җн„° мЈј 3нҡҢ нҳҲм•ЎнҲ¬м„қ м№ҳлЈҢ мӨ‘мқҙм—Ҳкі нҳҲм•• мЎ°м Ҳмқ„ мң„н•ҙ лІ нғҖм°ЁлӢЁм ңмқё celiprololмқ„ 9л…„м§ё ліөмҡ© мӨ‘мқҙм—ҲлӢӨ.
к°ҖмЎұл Ҙ: нҷҳмһҗмқҳ лӘЁм№ңлҸ„ Bнҳ• к°„м—јм—җ мқҳн•ң к°„кІҪнҷ”к°Җ мһҲм—Ҳкі л§җкё°мӢ л¶Җм „мңјлЎң нҳҲм•ЎнҲ¬м„қ мӨ‘мқҙм—ҲлӢӨ.
진찰 мҶҢкІ¬: лӮҙмӣҗ мӢң нҳҲм•• 140/79 mmHg, л§Ҙл°• 120нҡҢ/분, нҳёнқЎмҲҳ 22нҡҢ/분, мІҙмҳЁ 38.8в„ғ, мқҳмӢқмқҖ лӘ…лЈҢн•ҳмҳҖкі л§Ңм„ұ лі‘мғүмқ„ лқ„кі мһҲм—ҲлӢӨ. ліөл¶Җ нҢҪл§Ң л°Ҹ ліөл¶Җ м „л°ҳм—җ кұём№ң м••нҶөмқҙ мһҲм—Ҳкі мһҘмқҢмқҖ к°җмҶҢн•ҳм—¬ мһҲм—ҲлӢӨ. мһ…мӣҗ лӢ№мқј л§үнһҢ л°°м•ЎкҙҖмқ„ м ңкұ°н•ҳмҳҖкі лҸ„кҙҖмқ„ м ңкұ°н•ң мһҗлҰ¬м—җм„ң л°©к·Җ лғ„мғҲк°Җ лӮҳлҠ” к°ҖмҠӨмҷҖ н•Ёк»ҳ нҳҲм•Ў м–‘мғҒмқҳ 분비물мқҙ лӮҳмҳӨкі мһҲм—ҲлӢӨ.
кІҖмӮ¬мӢӨ мҶҢкІ¬: л§җмҙҲнҳҲм•ЎкІҖмӮ¬м—җм„ң л°ұнҳҲкө¬ 3,600/mm3, нҳҲмғүмҶҢ 6.7 g/dL, нҳҲмҶҢнҢҗ 113,000/mm3мҳҖкі мғқнҷ”н•ҷкІҖмӮ¬м—җм„ң мҡ”мҶҢ м§ҲмҶҢ 47.8 mg/dL, нҒ¬л Ҳм•„нӢ°лӢҢ 10.4 mg/dL, AST 19 IU/L, ALT 16 IU/L, мҙқ лӢЁл°ұ 5.9 g/dL, м•Ңл¶ҖлҜј 2.7 g/dL, мҙқ л№ҢлҰ¬лЈЁл№Ҳ 0.5mg/dL, C л°ҳмқ‘лӢЁл°ұ 7.05 mg/dLмқҙм—ҲлӢӨ. к°„м—ј л°”мқҙлҹ¬мҠӨ н‘ңм§Җмһҗ кІҖмӮ¬лҠ” HBsAg м–‘м„ұ, HBeAb м–‘м„ұ, HBeAg мқҢм„ұ, HBV DNA 893 copies/mLмҳҖлӢӨ. л°°м•Ўлҗң ліөмҲҳкІҖмӮ¬м—җм„ңлҠ” м ҒнҳҲкө¬ 27,500/mm3, л°ұнҳҲкө¬ 400/ mm3, мқҙ мӨ‘ мӨ‘м„ұкө¬к°Җ 79%мқҙм—Ҳкі к· л°°м–‘ кІҖмӮ¬м—җм„ңлҠ” Streptococcus mitisк°Җ лҸҷм •лҗҳм—ҲлӢӨ.
л°©мӮ¬м„ мҶҢкІ¬: ліөл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң м•Ҫ 25 Г— 10 cm нҒ¬кё°мқҳ лҚ©м–ҙлҰ¬к°Җ ліөл¶ҖмӨ‘м•ҷ м „мІҙм—җ мң„м№ҳн•ҙ мһҲм—Ҳкі л‘җкәјмӣҢ진 ліөл§үлӮҙл¶Җм—җ кіөкё°мҷҖ нҳҲм•Ў мқ‘кҙҙлҘј нҸ¬н•Ён•ҳкі мһҲлҠ” мҶҢкІ¬мқҙм—ҲлӢӨ(Fig. 1B).
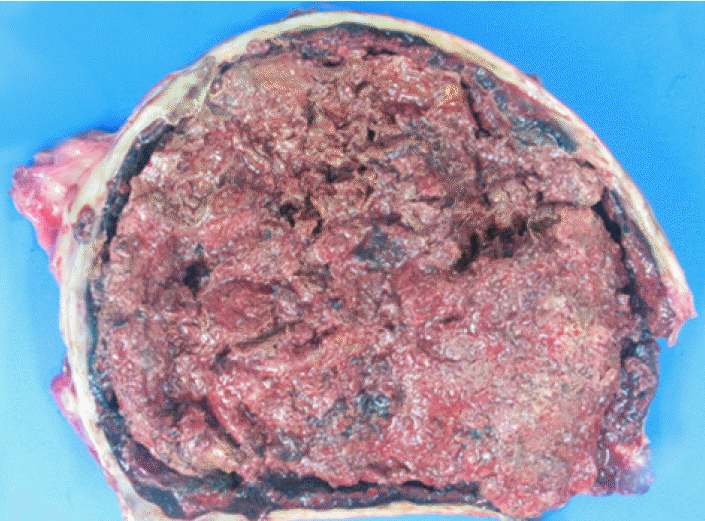
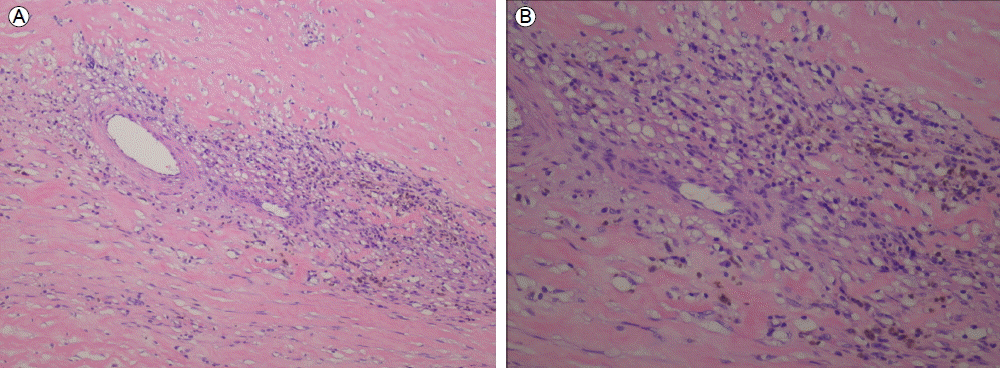
м№ҳлЈҢ л°Ҹ кІҪкіј: кІҪн”јм Ғ л°°м•ЎкҙҖмқ„ лӢӨмӢң мӮҪмһ…н•ҳмҳҖкі л°°м•ЎкҙҖмқ„ нҶөн•ҙ л°©к·Җ лғ„мғҲк°Җ лӮҳлҠ” нҳҲм•Ўм„ұ мӮјм¶ңм•Ўмқҙ лӢӨлҹү л°°м¶ңлҗҳм—ҲлӢӨ. кІҪн—ҳм Ғ н•ӯмғқм ң м№ҳлЈҢ нӣ„ м—ҙмқҖ л–Ём–ҙмЎҢмңјлӮҳ ліөл¶ҖнҢҪл§Ң л°Ҹ ліөнҶөмқҖ м§ҖмҶҚлҗҳм—ҲлӢӨ. мқјл°ҳмҷёкіјмҷҖ нҳ‘진 нӣ„ кёүм„ұ ліөмҰқмқ„ л°°м ңн•ҳкі м¶”нӣ„ мғқкёё мҲҳ мһҲлҠ” ліөк°• лӮҙ н•©лі‘мҰқмқ„ мҳҲл°©н•ҳкё° мң„н•ҙ мӢӨн—ҳм Ғ к°ңліөмҲ мқ„ мӢңн–үн•ҳкё°лЎң кІ°м •н•ҳмҳҖлӢӨ. к°ңліө мӢң ліөл§үмқҖ м „л°ҳм ҒмңјлЎң л‘җк»Қкі лӢЁлӢЁн•ҳмҳҖмңјл©° к°ҖмһҘ нҒ° лҚ©м–ҙлҰ¬лҠ” мң„лЎңлҠ” 비мһҘкіј л’ӨмӘҪмқҖ мһҘ, мһҘк°„л§ү л“ұкіј л¶ҷм–ҙ мһҲм—Ҳмңјл©° мқҙмҷём—җлҸ„ ліөл§ү л°Ҹ мһҘл“Өкіј мң м°©лҗң м—¬лҹ¬ к°ңмқҳ мһ‘мқҖ лҚ©м–ҙлҰ¬л“Өмқҙ кҙҖм°°лҗҳм—ҲлӢӨ. м ңкұ°лҗң мў…кҙҙмқҳ мңЎм•Ҳм Ғ мҶҢкІ¬мқҖ нғҖмӣҗнҳ• л°©м„қ лӘЁм–‘мңјлЎң нҒ¬кё°к°Җ 25 Г— 19 Г— 13 cm, л¬ҙкІҢк°Җ 1,542 gмқҙм—Ҳмңјл©° мЈјмң„м—җ лӢЁлӢЁн•ң н”јл§үмқҙ нҳ•м„ұлҗҳм–ҙ мһҲм—Ҳкі лӮҙл¶ҖлҠ” мҳӨлһҳлҗң нҳҲм•Ў лҚ©м–ҙлҰ¬мІҳлҹј ліҙмқҙлҠ” м°Ңкұ°кё°к°Җ к°Җл“қм°Ё мһҲм—ҲлӢӨ(Fig. 2). мЎ°м§Ғ кІҖмӮ¬м—җм„ңлҠ” л‘җкәјмӣҢ진 ліөл§үлӮҙмқҳ кІҪнҷ”м„ұ 섬мң нҷ”, мқјл¶Җ нҳҲкҙҖмЈјмң„ лҰјн”„кө¬ м№ЁмңӨмқ„ лҸҷл°ҳн•ң 섬мң м•„м„ёнҸ¬мқҳ мҰқмӢқ л°Ҹ нҳҲмғүмҶҢ м№Ём°© мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ(Fig. 3A, 3B). мҲҳмҲ 7мқјм§ёмқҳ л°ңм—ҙ, ліөл¶Җ нҶөмҰқ л“ұмқҳ мһ„мғҒмҰқмғҒмқҖ мҷ„м „нһҲ нҳём „лҗҳм—Ҳмңјл©° 추м Ғ ліөл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒ мҶҢкІ¬мғҒ 비нӣ„нҷ”лҗң ліөл§үмқ„ нҸ¬н•Ён•ң ліөл¶Җ лӮҙл¶Җмқҳ лҚ©м–ҙлҰ¬лҠ” м ңкұ°лҗҳм—ҲлӢӨ(Fig. 1C). мҲҳмҲ 2мЈј нӣ„л¶Җн„° н”„л Ҳл“ңлӢҲмҶ”лЎ мқ„ н•ҳлЈЁ 40 mg нҲ¬м—¬н•ҳкё° мӢңмһ‘н•ҳмҳҖлӢӨ. мҲҳмҲ 5к°ңмӣ”м§ё мӢңн–үн•ң 추м Ғ ліөл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң л‘җкәјмҡҙ ліөл§үмқҖ кұ°мқҳ мӮ¬лқјмЎҢкі мқјл¶Җ ліөмҲҳл§Ң лӮЁм•„ мһҲм—ҲлӢӨ(Fig. 1D). н”„л Ҳл“ңлӢҲмҶ”лЎ мқҖ м җм°Ё к°җлҹүн•ҳмҳҖкі нҳ„мһ¬лҠ” мң м§Җмҡ©лҹүмңјлЎң н•ҳлЈЁ 5 mg ліөмҡ©н•ҳл©ҙм„ң мҷёлһҳ 추м ҒкҙҖм°° мӨ‘мқҙлӢӨ.
мһҘкё°м ҒмңјлЎң ліөл§ү нҲ¬м„қмқ„ н•ҳлҠ” нҷҳмһҗм—җм„ң ліҙмқҙлҠ” ліөл§үмқҳ ліҖнҷ”лҠ” мӨ‘н”јм„ёнҸ¬к°Җ мҶҢмӢӨлҗҳкі л№„м„ёнҸ¬ мҪңлқјм мёө л°Ҹ мҪңлқјм 섬мң м•„м„ёнҸ¬мёөмқҙ нҷ•мһҘлҗҳл©° нҷ•мӢӨн•ң нҳҲкҙҖлі‘мҰқмқҙ л°ңмғқн•ҳлҠ” кІғмқҙлӢӨ. мқҙлҹ° лӘЁл“ кіјм •мқ„ мҙқм№ӯн•ҳм—¬ ліөл§ү кІҪнҷ”мҰқмқҙлқјкі н•ҳл©° мқҙлҠ” кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ мҙҲкё°м—җ ліҙмқҙлҠ” ліҖнҷ”мқҙкі кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмңјлЎң 진н–үн• мҲҳлҸ„ мһҲкі н•ҳм§Җ м•Ҡмқ„ мҲҳлҸ„ мһҲлӢӨ. кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јкіј ліөл§ү кІҪнҷ”мҰқмқҖ нҳ•нғңн•ҷм ҒмңјлЎң 비мҠ·н•ң м җмқҙ л§Һм§Җл§Ң мЎ°м§Ғн•ҷм ҒмңјлЎң ліөл§үмқҳ 섬мң мҶҢ м№Ём°©, м№ҳл°Җмёөмқҳ 비нӣ„ л°Ҹ нҮҙн–үм„ұ ліҖнҷ”лҠ” кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јм—җм„ңл§Ң ліҙмқҙлҠ” мҶҢкІ¬мқҙлӢӨ. кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ мӣҗмқёмқҖ лҢҖл¶Җ분 л§Ңм„ұ ліөл§ү нҲ¬м„қмқҳ н•©лі‘мҰқмңјлЎң 0.5-7.3%м—җм„ң л°ңмғқн•ҳкі 15л…„ мқҙмғҒ ліөл§ү нҲ¬м„қмқ„ н•ң нҷҳмһҗм—җм„ңлҠ” 17.2%к№Ңм§Җ лҶ’мқҖ мң лі‘лҘ мқ„ лӮҳнғҖлӮёлӢӨ[6]. ліөл§ү нҲ¬м„қ н•©лі‘мҰқкіј кҙҖл Ёмқҙ м—ҶлҠ” мӣҗмқёмңјлЎңлҠ” к°„м„ұліөмҲҳ, к°„м„ұ ліөмҲҳк°Җ мһҲлҠ” нҷҳмһҗм—җм„ң ліөл§ү м •л§Ҙ лӢЁлқҪмҲ мқ„ мӢңн–үн•ң кІҪмҡ°, л°ҳліөм Ғмқё ліөмҲҳ мІңмһҗ, м „мӢ м„ұ нҷҚл°ҳм„ұ лЈЁн‘ёмҠӨ, кІ°н•өм„ұ ліөл§үм—ј, к°„мқҙмӢқ, мһҘкё°к°„ лІ нғҖм°ЁлӢЁм ңлҘј мӮ¬мҡ©н•ң кІҪмҡ°, ліөк°• лӮҙ нҷ”н•ҷмҡ”лІ•мқ„ мӢңн–үн•ң кІҪмҡ°, мһ„мӢ м„ұ мңөлӘЁм„ұ м§ҲнҷҳмңјлЎң мһҗк¶Ғм Ҳм ңмҲ мқ„ л°ӣмқҖ кІҪмҡ° к·ёлҰ¬кі мң мңЎмў…мҰқ л“ұкіј лҸҷл°ҳлҗҳм–ҙ л°ңмғқн•ң мҰқлЎҖк°Җ ліҙкі лҗҳм–ҙ мһҲлӢӨ[1-4,7]. к·ёлҹ¬лӮҳ нҳҲм•ЎнҲ¬м„қмқ„ н•ҳлҠ” нҷҳмһҗм—җкІҢм„ң л°ңмғқн•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҖ л§Өмҡ° л“ңл¬јм–ҙм„ң н•ҙмҷём—җм„ңлҠ” ліҙкі лҗң мҳҲк°Җ мһҲмңјлӮҳ[3,5] көӯлӮҙм—җм„ңлҠ” м•„м§Ғк№Ңм§Җ ліҙкі лҗң л°”к°Җ м—ҶлӢӨ.
кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҖ мһҘкё°к°„м—җ кұёміҗ м„ңм„ңнһҲ 진н–үн•ҳлҠ” м§Ҳнҷҳмқҙл©° мһ„мғҒмҰқмғҒмқҙ л°ңмғқн•ҳл©ҙ ліөнҶө, кө¬м—ӯ кө¬нҶ , л°°ліҖ мҠөкҙҖмқҳ ліҖнҷ”, мІҙмӨ‘ к°җмҶҢ к·ёлҰ¬кі кІҪлҜён•ң л°ңм—ҙ л“ұмқҳ 비нҠ№мқҙм Ғ мҰқмғҒмңјлЎң лӮҳнғҖлӮңлӢӨ. лӢӨлҘё мӨ‘мҡ”н•ң мһ„мғҒм Ғ 징нӣ„лЎң нҳҲм„ұ ліөмҲҳ л°Ҹ л°ҳліөм Ғмқё к· л°°м–‘ мқҢм„ұмқё ліөл§үм—јмқҙ л°ңмғқн• мҲҳ мһҲлӢӨ. кІҖмӮ¬мӢӨ мҶҢкІ¬мқҖ м „мӢ м—јмҰқм—җ мқҳн•ң л№ҲнҳҲ, C л°ҳмқ‘лӢЁл°ұ мҰқк°Җ к·ёлҰ¬кі м Җм•Ңл¶ҖлҜјнҳҲмҰқ л“ұмқҙ лӮҳнғҖлӮ мҲҳ мһҲлӢӨ. мһ„мғҒм ҒмңјлЎң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҙ мқҳмӢ¬лҗҳл©ҙ ліөл¶ҖмҙҲмқҢнҢҢ нҳ№мқҖ ліөл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң 1) ліөл§ү 비нӣ„ н”јл§үнҷ” 2) мһҘ нҸҗмғү 3) ліөл§үмқҳ м„қнҡҢнҷ” к·ёлҰ¬кі 4) лҲ„м—җкі м№ҳ лӘЁм–‘мңјлЎң л‘ҘкёҖкІҢ лҚ®лҠ” н”јл§үнҷ” нҳ„мғҒ(cocooning)мқҳ мҶҢкІ¬мқҙ ліҙмқҙл©ҙ 진лӢЁн• мҲҳ мһҲлӢӨ[1,2,4]. нҷ•м§„мқҖ мЎ°м§Ғн•ҷм ҒмңјлЎң ліөл§үмқҳ мӨ‘н”јм„ёнҸ¬ мҶҢмӢӨ л°Ҹ мӢ мғқнҳҲкҙҖмқҳ нҳ•м„ұмқ„ мҰқлӘ…н•ҳлҠ” кІғмқҙлӢӨ[1,2].
лі‘мқёмқҖ м•„м§Ғк№Ңм§Җ лӘ…нҷ•н•ҳм§Җ м•ҠмңјлӮҳ м§ҖкёҲк№Ңм§Җ к°ҖмһҘ л„җлҰ¬ л°ӣм•„л“Өм—¬м§ҖлҠ” к°Җм„ӨмқҖ Kawanishiмқҳ вҖҳTwo-hit hypothesisвҖҷмқҙлӢӨ. мІ« лІҲм§ёлЎң лӢӨм–‘н•ң мӣҗмқём—җ мқҳн•ҙ ліөл§үмқҳ мҶҗмғҒмқҙ л°ңмғқн•ҳл©ҙ vascular endothelial growth factor (VEGF), transforming growth factor beta (TGF-ОІ), plasminogen activator inhibitor type 1 (PAI-1)кіј к°ҷмқҖ мӢёмқҙнҶ м№ҙмқёл“Өмқҙ 분비лҗҳл©ҙм„ң ліөл§үмқҳ мӨ‘н”јм„ёнҸ¬м—җ ліҖнҷ”лҘј мЈјкІҢ лҗңлӢӨ. мқҙнӣ„ ліөл§үм—җ мқјл Ёмқҳ м—јмҰқ л°ҳмқ‘мқҙ мҙүл°ңлҗҳл©ҙм„ң ліөл§ү 섬мң нҷ” л°Ҹ н”јл§үнҷ”к°Җ л°ңмғқн•ҳкі мһҘ мң м°©мқҙ мғқкё°кІҢ лҗңлӢӨ[1]. Naiki л“ұ[8]мқҖ ліөл§ү нҲ¬м„қ нҷҳмһҗм—җ мһҲм–ҙ кі лҶҚлҸ„мқҳ лӢ№мқ„ н•Ёмң н•ң ліөл§ү нҲ¬м„қ м•Ўмқҙ TGF-ОІмқҳ кіјмһү л°ңнҳ„мқ„ мң лҸ„н•ҳкі мқҙкІғмқҙ ліөл§үмқҳ 섬мң нҷ”лҘј мқјмңјнӮӨлҠ” мЈјлҗң л§Өк°ңмқёмһҗлқјкі мЈјмһҘн•ҳмҳҖлӢӨ.
м•„м§Ғк№Ңм§Җ нҳҲм•ЎнҲ¬м„қкіј кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ мқёкіјкҙҖкі„лҘј л°қнһҢ л¬ён—ҢмқҖ м—Ҷм—ҲлӢӨ. к·ёлҹ¬лӮҳ мһҘкё°к°„ нҳҲм•ЎнҲ¬м„қ м№ҳлЈҢлҘј л°ӣмқҖ нҷҳмһҗлҠ” нҲ¬м„қ мӢң лӢЁн•өкө¬мҷҖ кұ°лҢҖм„ёнҸ¬к°Җ нҷңм„ұнҷ”лҗҳм–ҙ Interlukin-1ОІ (IL-1ОІ), tumor necrosis factor- Оұ (TNF-Оұ), Interlukin-6 (IL-6) л°Ҹ TGF-ОІмҷҖ к°ҷмқҖ мӢёмқҙнҶ м№ҙмқёл“Өмқҙ 분비лҗҳкі мқҙ мӨ‘м—җм„ңлҸ„ нҠ№нһҲ TGF-ОІлҠ” лӢЁн•өкө¬мқҳ кё°лҠҘмқ„ к°җмҶҢмӢңмјң л©ҙм—ӯм–өм ң, м—јмҰқл°ҳмқ‘ л°Ҹ 섬мң нҷ”лҘј мң л°ңн•ңлӢӨкі м•Ңл Өм ё мһҲлӢӨ[9]. TGF-ОІлҠ” кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—ј л°ңмғқмқҳ мЈјлҗң л§Өк°ңмқёмһҗмқҙлҜҖлЎң[6,8] нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ңлҸ„ мҰқк°Җлҗң 섬мң нҳ•м„ұ мң лҸ„м„ұ мӢёмқҙнҶ м№ҙмқёмқҙ кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ л°ңмғқкіј м—°кҙҖлҗҳм–ҙ мһҲмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ.
Kawanishi л“ұ[5]мқҖ м•ҢмҪ”мҳ¬м„ұ к°„кІҪнҷ” л°Ҹ ліөмҲҳк°Җ мһҲмңјл©ҙм„ң нҳҲм•ЎнҲ¬м„қмқ„ н•ҳлҠ” нҷҳмһҗм—җм„ң л°ңмғқн•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ мҳҲлҘј ліҙкі н•ҳл©ҙм„ң к°„кІҪнҷ”лЎң мқён•ң л§қмғҒ лӮҙн”јкі„мқҳ кё°лҠҘк°җмҶҢлЎң ліөмҲҳлӮҙмқҳ IL-6 (Interlukin-6), FDP (fibrinogen degradation products), TAT (thrombin-antithrombin III complex)к°Җ мғҒмҠ№лҗң мҶҢкІ¬мқ„ мҰқлӘ…н•ҳмҳҖлӢӨ. лҳҗн•ң McLaughlin л“ұ[3]мқҖ ліөл§ү нҲ¬м„қмқҳ лі‘л Ҙмқҙ м—ҶлҠ” нҳҲм•ЎнҲ¬м„қ нҷҳмһҗм—җм„ң мҳӨлһҳ м§ҖмҶҚлҗҳкі м№ҳлЈҢлҗҳм§Җ м•ҠмқҖ мӢ мһҘм„ұ ліөмҲҳ(nephrogenic ascites)м—җ мқҳн•ҙ л°ңмғқн•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқ„ ліҙкі н•ҳл©ҙм„ң мӢ мһҘм„ұ ліөмҲҳк°Җ кІҪнҷ”м„ұ н”јл§үнҳ• ліөл§үм—јмқҳ мӨ‘мҡ”н•ң мӣҗмқёмқҙлқјкі мЈјмһҘн•ҳмҳҖлӢӨ. ліё мҰқлЎҖм—җм„ңлҠ” нҳҲм•Ў лӮҙ 섬мң нҳ•м„ұ мң лҸ„м„ұ мӢёмқҙнҶ м№ҙмқёмқҳ лҶҚлҸ„лҘј мёЎм •н•ҳм§Җ лӘ»н–Ҳкі лҳҗн•ң ліөмҲҳ лӮҙм—җм„ң IL-6, FDP, TAT л“ұмқҳ м—јмҰқ н‘ңм§Җмһҗмқҳ лҶҚлҸ„лҠ” нҷ•мқён•ҳм§Җ лӘ»н•ҳмҳҖмңјлӮҳ Bнҳ• к°„м—јм—җ мқҳн•ң к°„кІҪнҷ”к°Җ мһҲм—Ҳкі мЎ°м Ҳлҗҳм§Җ м•ҠлҠ” ліөмҲҳ мЎ°м Ҳмқ„ мң„н•ҙ л°ҳліөм Ғмқё ліөмҲҳмІңмһҗлҘј мӢңн–үл°ӣм•ҳкі н•ӯкі нҳҲм•• м•Ҫм ңлЎң лІ нғҖм°ЁлӢЁм ңмқё celiprololмқ„ мһҘкё°к°„ ліөмҡ©н•ң м җ л“ұмқҙ кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—ј л°ңмғқмқҳ мң„н—ҳмқёмһҗлЎң мһ‘мҡ©н•ҳмҳҖмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ. лІ нғҖм°ЁлӢЁм ңлҠ” ліөл§ү мӨ‘н”јм„ёнҸ¬мқҳ мғқм„ұ л°Ҹ мңӨнҷңм ң м—ӯн• мқ„ н•ҳлҠ” н‘ңл©ҙ нҷңм„ұм ңмқҳ 분비лҘј м Җн•ҙн•ңлӢӨкі м•Ңл Өм ё мһҲлӢӨ[2-4].
м№ҳлЈҢлҠ” мҳҒм–‘ кіөкёү л“ұмқҳ ліҙмЎҙм Ғ м№ҳлЈҢ, мҠӨн…ҢлЎңмқҙл“ң нғҖлӘ©мӢңнҺң к·ёлҰ¬кі мҲҳмҲ м Ғ м№ҳлЈҢк°Җ мһҲлӢӨ. ліҙмЎҙм Ғ м№ҳлЈҢм—җлҸ„ л¶Ҳкө¬н•ҳкі м§ҖмҶҚм Ғмқё мһҘ нҸҗмҮ„ мҰқмғҒмқҙ мһҲлҠ” кІҪмҡ°, мҳҒм–‘ мғҒнғңлҘј мң м§Җн• мҲҳ м—ҶлҠ” кІҪмҡ°, л©ҙм—ӯм–өм ңм ңм—җ нҡЁкіјк°Җ м—ҶлҠ” кІҪмҡ° к·ёлҰ¬кі л°ҳліөм Ғмқё ліөл§үм—јмқҳ л°ңмғқмқҖ мҲҳмҲ м Ғ м№ҳлЈҢмқҳ м Ғмқ‘мҰқмқҙ лҗңлӢӨ. 비көҗм Ғ мЎ°кё°м—җ мһҘ м Ҳм ңмҲ мқҙ м•„лӢҢ ліөл§ү м Ҳк°ңмҲ мқҙлӮҳ мң м°© л°•лҰ¬мҲ мқ„ мӢңн–үн•ҳлҠ” кІғмқҙ лҸ„мӣҖмқҙ лҗ мҲҳ мһҲмңјлӮҳ мһ¬л°ңлҘ мқҙ 비көҗм Ғ лҶ’лӢӨкі м•Ңл Өм ё мһҲлӢӨ[4,10]. м№ҳлЈҢ м•Ҫл¬јлЎңлҠ” мҠӨн…ҢлЎңмқҙл“ңмҷҖ к°ҷмқҖ л©ҙм—ӯм–өм ңм ң, нғҖлӘ©мӢңнҺңкіј к°ҷмқҖ н•ӯ섬мң нҷ”м ңм ңк°Җ нҡЁкіјк°Җ мһҲлҠ” кІғмңјлЎң ліҙкі лҗҳм–ҙ мһҲмңјлӮҳ лӘ…нҷ•н•ҳкІҢ нҷ•лҰҪлҗҳм–ҙ мһҲм§Җ м•ҠлӢӨ[4,6]. нғҖлӘ©мӢңнҺңмқҖ TGF-ОІмқҳ кіјлӢӨ л°ңнҳ„мқ„ м–өм ңн•ЁмңјлЎңмҚЁ н•ӯкІҪнҷ”, н•ӯ섬мң нҷ” мһ‘мҡ©мқ„ н•ҳм—¬ кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јм—җ лҢҖн•ң м№ҳлЈҢ нҡЁкіјлҘј лӮҳнғҖлӮёлӢӨкі м•Ңл Өм ё мһҲлӢӨ[6]. көӯлӮҙм—җм„ңлҠ” Jung л“ұ[4]мқҙ ліөк°•кІҪмңјлЎң мң м°© л°•лҰ¬мҲ мқ„ н•ң нӣ„ нғҖлӘ©мӢңнҺңкіј н”„л Ҳл“ңлӢҲмҶ”лЎ мқ„ мӮ¬мҡ©н•ң нӣ„ кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҙ нҳём „лҗң мҳҲлҘј ліҙкі н•ҳмҳҖлӢӨ. ліё мҰқлЎҖм—җм„ңлҠ” мҙҲкё° м№ҳлЈҢлЎң нғҖлӘ©мӢңнҺңмқ„ мӮ¬мҡ©н•ҳмҳҖмңјлӮҳ мһ„мғҒм ҒмңјлЎң нҳём „мқҙ м—Ҷм–ҙ мҲҳмҲ м Ғ м№ҳлЈҢ нӣ„ мҠӨн…ҢлЎңмқҙл“ң мӮ¬мҡ©мңјлЎң мһ„мғҒкІҪкіјк°Җ нҳём „лҗҳм—ҲлӢӨ.
ліё мҰқлЎҖлҠ” к°„кІҪнҷ”к°Җ мһҲкі нҳҲм•ЎнҲ¬м„қ м№ҳлЈҢлҘј л°ӣкі мһҲлҠ” нҷҳмһҗм—җм„ң л°ңмғқн•ң кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ көӯлӮҙ мөңмҙҲ мҰқлЎҖмқҙлӢӨ. м•„м§Ғк№Ңм§Җ кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқҳ мӣҗмқёкіј л°ңмғқ кё°м „мқҖ лӘ…нҷ•н•ҳкІҢ м•Ңл Өм ё мһҲм§Җ м•ҠмңјлӮҳ ліё нҷҳмһҗм—җм„ңлҠ” л°ҳліөм Ғмқё ліөмҲҳмІңмһҗ, лІ нғҖм°ЁлӢЁм ңмқҳ ліөмҡ© к·ёлҰ¬кі к°„кІҪнҷ”к°Җ мң„н—ҳмқёмһҗлЎң мһ‘мҡ©н–Ҳмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ. л”°лқјм„ң ліөл§ү нҲ¬м„қмқҳ кіјкұ°л Ҙмқҙ м—ҶлҠ” нҳҲм•Ў нҲ¬м„қ нҷҳмһҗлқј н•ҳлҚ”лқјлҸ„ л°ҳліөм Ғмқё ліөмҲҳмІңмһҗлҘј мӢңн–үл°ӣм•ҳкұ°лӮҳ ліөмҲҳк°Җ мһҲмңјл©ҙм„ң ліөнҶө л°Ҹ ліөл¶Җ нҢҪл§Ңмқ„ нҳёмҶҢн•ҳкі мһҘ мң м°© л°Ҹ мһҘ нҸҗмғүмқҳ мҰқкұ°к°Җ ліҙмқҙкұ°лӮҳ мӢ мһҘм„ұ ліөмҲҳ л“ұмқҳ мһ„мғҒм–‘мғҒмқ„ ліҙмқҙлҠ” кІҪмҡ° кІҪнҷ”м„ұ н”јл§үм„ұ ліөл§үм—јмқ„ к°җ별진лӢЁмңјлЎң кі л Өн•ҙм•ј н•ңлӢӨ.
REFERENCES
1. Gandhi VC, Humayun HM, Ing TS, et al. Sclerotic thickening of the peritoneal membrane in maintenance peritoneal dialysis patients. Arch Intern Med 1980;140:1201вҖ“1203.


2. Kawaguchi Y, Kawanishi H, Mujais S, Topley N, Oreopoulos DG. Encapsulating peritoneal sclerosis: definition, etiology, diagnosis, and treatment: International Society for Peritoneal Dialysis Ad Hoc Committee on Ultrafiltration Management in Peritoneal Dialysis. Perit Dial Int 2000;20(Suppl 4):S43вҖ“55.
3. McLaughlin K, Butt G, Madi A, McMillan M, Mactier R. Sclerosing peritonitis occurring in a hemodialysis patient. Am J Kidney Dis 1996;27:729вҖ“732.


4. Jung JY, Jang WI, Yoon JH, et al. Successful treatment of sclerosing encapsulating peritonitis with tamoxifen and prednisolone. Korean J Nephrol 2009;28:685вҖ“692.
5. Kawanishi H, Watanabe H, Moriishi M, Tsuchiya S. Encapsulating peritoneal sclerosis-like findings in a hemodialysis patient without a history of peritoneal dialysis. Adv Perit Dial 2003;19:176вҖ“179.

6. Guest S. Tamoxifen therapy for encapsulating peritoneal sclerosis: mechanism of action and update on clinical experiences. Perit Dial Int 2009;29:252вҖ“255.


7. Suh WN, Lee SK, Chang H, et al. Sclerosing encapsulating peritonitis (abdominal cocoon) after abdominal hysterectomy. Korean J Intern Med 2007;22:125вҖ“129.



8. Naiki Y, Maeda Y, Matsuo K, et al. Involvement of TGFbeta signal for peritoneal sclerosing in continuous ambulatory peritoneal dialysis. J Nephrol 2003;16:95вҖ“102.

(A) A large amount of ascites surrounded by fibrotic tissue fills nearly the entire abdomen. (B) A 20 Г— 10-cm mass in the anterior mid abdomen; it was composed of thickened peritoneum containing air and debris like blood clots. (C) Decreased ascites and resolution of the thickened peritoneum. (D) The loculated fluid collection in the anterior mid-peritoneal cavity has disappeared.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




