서 론
제1형 신경섬유종증은 종양억제인자인 neurofibromin을 발현시키는 Neurofibromin 1 (NF1) 유전자의 돌연변이에 의해 유발되는 질환으로, 약 3,000-4,000명당 한 명꼴로 나타나며 50% 정도는 생식세포의 변이에 의해 산발적으로 나타난다[1]. 가장 흔한 임상 증상은 담갈색의 반점, 신경성 섬유종, 홍채의 lisch nodule과 액와부나 서혜부의 주근깨지만 이외에도 신체 내 다기관을 침범하여 다양한 임상양상을 보일 수 있다. 폐고혈압은 제1형 신경섬유종증에서 드물게 발생하지만 불량한 임상경과를 보일 수 있는 합병증의 하나로서 보고되고 있으며[2-4] 국내에서는 아직 사례보고가 없는 상태로, 저자들은 제1형 신경섬유종증 환자에서 폐질환이나 폐색전증, 좌심 질환 등의 동반 없이 발견된 폐고혈압의 사례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 38세 남자 환자
주 소: 호흡곤란
현병력: 내원 8개월 전 운동 시 호흡곤란을 주소로 내원하여 시행한 검사상 여출성의 양측 흉수가 확인되어 심장, 간, 콩팥, 갑상선 기능 검사 및 자가면역질환에 대한 추가 검사를 하였으나 특이 소견을 보이지 않았었다. 이에 대해 이뇨제 치료 후 증상이 호전되어 퇴원하였으나 환자의 순응도가 낮아 이후에는 외래 추적관찰되지 않고 있던 중, 내원 20여일 전부터 다시 호흡곤란이 악화되어 응급실로 내원하였다. 발열이나 기침, 가래 등의 호흡기 증상은 없었다.
과거력: 2002년 좌측 엉덩이의 종괴에 대해 조직 검사를 시행하였고 임상 증상 및 조직 검사 결과를 바탕으로 제1형 신경 섬유종을 진단받았다. 고혈압이나 당뇨병, 폐질환의 과거력은 없었고 내원 6개월 전까지는 하루에 Furosemide 120mg, Spironolactone 50 mg을 복용하였으나 이후에는 환자 자의로 복용 중지한 상태였다.
가족력 및 사회력: 특이 사항 없었다.
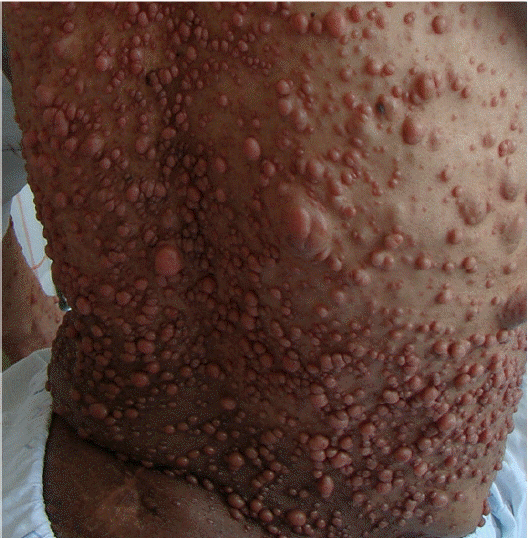
이학적 소견: 내원 당시 급성 병색을 보였으며 혈압 125/74 mmHg, 맥박101/분, 호흡수 21/분, 체온은 36.5℃, 산소포화도 97%였다. 두경부 진찰에서 경정맥 울혈 소견이 보였다. 흉부 청진에서 심음은 규칙적이었으며 심잡음은 청진되지 않았고 양측 폐하엽에서 수포음이 청진되었다. 복부는 다소 팽만되어 있었으나 압통 및 반발 압통은 없었고 종괴 및 간 비종대도 없었다. 양하지에서는 1+의 함요 부종이 관찰되었다. 등, 배, 사지에서 다수의 담갈색 반점과 액와부 주근깨를 확인할 수 있었고 다발성 결절이 전신에 있었다(Fig. 1). 신경학적 검사에서 특이 소견은 없었다.
검사 소견: 말초혈액검사에서 백혈구 3,350/mm3 (호중구 55.2%), 혈색소 10.7 g/dL, 혈소판 242,000/mm3이었고 Creactive protein은 2.52 mg/dL로 증가되어 있었다. 생화학검사에서 혈청 BUN/Cr 16.6/0.87 mg/dL AST/ALT 28/15 IU/L, 총 단백/알부민 6.1/3.0 g/dL, Na/K 138/4.3 mmEq였다. 동맥혈 가스 검사에서는 pH 7.520, pCO2 25.6 mmHg, pO2 80.0mmHg, HCO3 20.5 mmol/L, SaO2 96.3%로 호흡성 알칼리혈증의 소견이 보였다. T3 112.3 ng/dL, 유리 T4 1.1 ng/dL, TSH 5.94 mIU/L, TSH 수용체 항체 6.0%로 무증상의 갑상선 기능 저하증(subclinical hypothyroidism)이 의심되었다. CK-MB 및 Troponin T는 각각 3.78 ng/mL, 0.010 ng/mL로 정상 범위였으나 proBNP는 4775.0 pg/mL로 상승되어 있었다.
방사선 소견: 흉부 단순방사선 사진에서 중등도의 심비대와 폐울혈, 우측 우세의 양측 흉수 소견이 있었다. 양폐야에 폐실질 병변은 관찰되지 않았다(Fig. 2).
심전도 검사: 분당 98회의 정상 동율동에 불완전 우각차단 소견이 관찰되었다.
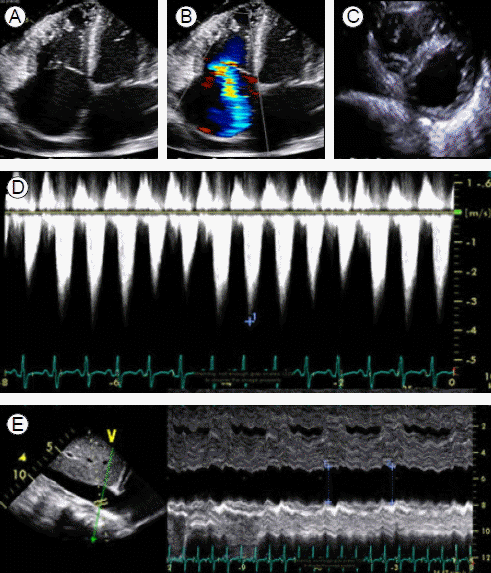
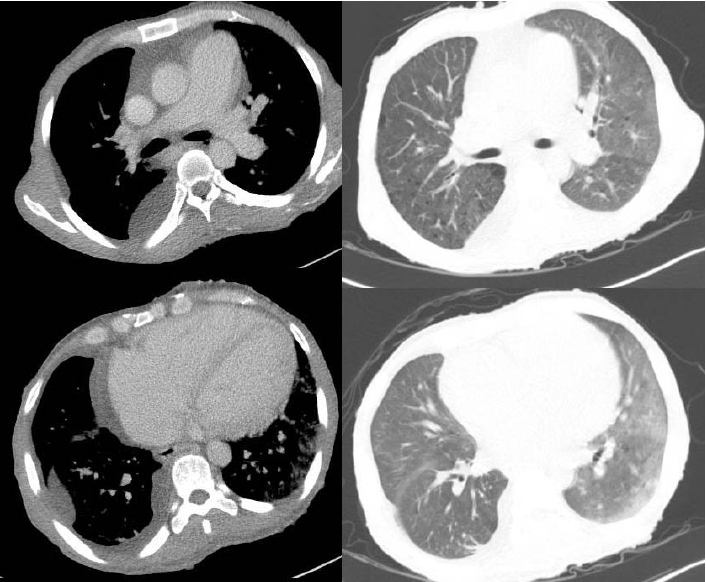
경과: 진단 및 치료 목적으로 흉수 배액을 하였다. 흉수액의 성분 검사에서 적혈구 40/mm3, 백혈구 70/mm3 (호중구 10%, 림프구 75%), pH 7.4, 단백질 2.1 g/dL, 알부민 1.2 g/dL, LDH 120 U/L으로 여출성의 흉수 소견을 보였다. 흉수 세균 배양 검사, 결핵균 PCR 및 배양 검사 등의 미생물 검사에서 동정된 균은 없었고 흉수 세포 검사에서 악성 세포는 관찰되지 않았다. 경흉부 심초음파에서 국소적 벽운동 이상 소견은 보이지 않았고 수축기 구축률도 55-58%로 보존되어 있었다. 판막의 이상 소견은 관찰되지 않았다. 심첨부 4방단면(apical 4 chamber view)에서 우심방 및 우심실의 확장과 풍부한 우심실 내 육주형성(trabeculation)이 보였고 늑골하 단면(subcostal view)에서 우심실 벽의 두께는 6-7 mm로 측정되었다. 우심실수축기압은 70 mmH로 상승되어 있었고 이완기 동안 D 형태의 좌심실이 관찰되며 이와 함께 중등도 이상의 삼첨판역류, 하대정맥 확장 및 다혈색(plethora) 소견이 동반되어 있었다(Fig. 3). 폐고혈압 원인에 대한 추가적인 검사를 위해 시행한 흉부 전산화단층촬영에서 폐실질의 병변이나 폐혈관색전증의 증거는 보이지 않았다(Fig. 4). 폐기능검사는 전신 쇠약 및 호흡곤란으로 시행하지 못하였다. 저자들은 폐고혈압의 진단을 위해 심도자술을 계획하였으나 보호자가 없는 상황에서 전신 상태 저하 및 침습적 시술에 대한 부정적인 견해를 이유로 환자 본인이 시술에 동의하지 않아 심도자술을 진행할 수 없었다. 따라서 심초음파 검사 결과를 바탕으로 판단을 해야만 하였으나 여러 차례 검사한 승모판 유입 속도 및 승모판륜 속도에 대한 도플러에서 E/E’이 10 미만으로 측정되었기 때문에 간접적으로 폐모세혈관쐐기압이 상승되어있지 않을 가능성이 높을 것으로 추정하고 신경섬유종증에 동반한 폐동맥 고혈압에 준해 치료를 시작하였다. 부종조절을 위해 저염식이 및 수분제한 등의 보존적 치료와 함께 이전과 동일한 용량으로 이뇨제 치료(furosemide 120 mg, spironolactone 50 mg)를 시작하였으나 증상의 호전이 없어 하루에 furosemide 600 mg, spironolactone 150 mg까지 증량하였고 nifedipine 60 mg을 1일 1회, bosentan 125 mg을 1일 2회로 나누어 총 4주간 투여하였다. 그러나 호흡곤란이 지속되고 치료 4주 후 추시한 심초음파에서도 내원 시와 비교하여 개선된 소견이 없어 bosentan을 하루 250 mg로 증량하여 1일 2회로 나누어 5주간 추가적으로 투여하고 심초음파를 추시하였다. 이 검사에서도 이전과 변화 없어 bosentan은 중단하고 중심정맥관을 통하여 treprostinil을 1.25 ng/kg/min 용량으로 투여하기 시작하였다. 구토, 설사, 근육통, 골통 등의 약물 부작용으로 2.50 ng/kg/min의 용량 이상으로 증량하지 못하는 상태에서 호흡곤란 증상 및 심초음파상의 호전 소견이 없어 treprostinil도 투여 18일째 중단하고 이뇨제와 nifedipine만 유지하였다. 이후 급성 신부전으로 진행하며 폐부종이 악화되어 인공호흡기 치료 및 혈액투석을 시작하였으나 입원 치료를 시작한지 14주째에 사망하였다. 환자 연고자 부재로 보호자의 동의가 이루어지지 않아 부검은 시행하지 못하였다.
고 찰
폐고혈압이란 폐동맥압 상승과 우심실 부전, 호흡곤란 등의 임상증상을 특징으로 가지는 여러 질환들을 총칭한다. 폐고혈압의 임상양상 및 병리적 특징에 대한 이해가 넓어지면서 여러 차례 분류 변경이 이루어졌고 최근에는 2008년에 다나 포인트 분류(Dana point classification)가 발표되었다. 이 분류에서 제1형 신경섬유종증은 sarcoidosis, pulmonary Langerhanscell histiocytosis, lymphangioleiomyomatosis 등과 함께 5군인 불명확한 여러 기전에 의한 폐고혈압군에 포함되었다[5].
제1형 신경섬유종증에서의 폐고혈압 발생률은 명확하지 않으며 국내에서는 현재까지 보고된 사례가 없었다. 최근 신경섬유종과 관련된 폐고혈압 8예를 모아 이들의 임상적, 기능적, 방사선학적, 혈역학적 특징을 분석한 연구에서 여성(8명 중 7명이 여성), 고령(53-68세, 진단 시 평균 나이 62세), 신경섬유종증의 경과 중 후기에 폐고혈압이 우세하게 나타나는 모습을 보였다[2].
제1형 신경섬유종증에서 폐고혈압이 발생하는 기전은 아직 명확히 규명되지 않았다. 그러나 보고된 증례들의 대부분에서 폐실질질환이 없거나 있더라도 경한 정도였고 만성 혈전색전증, 결체 조직 질환, 선천성 심질환, HIV 감염 등과 같은 폐동맥고혈압의 알려진 위험인자들을 가지고 있는 경우들도 적다는 사실은 폐고혈압이 폐혈관 침범과 관련하여 발생할 가능성을 추측하게 하였다[2,6]. 또한 신경섬유종증과 관련하여 발생하는 혈관병증의 경우 주로 대동맥, 신동맥, 장간동맥 같은 체동맥(systemic artery)과 관련되며 조직병리학적으로 범발성의 혈관 내피 비후나 총상형(Plexiform) 병변의 특징을 가지는데, 폐고혈압이 진단된 신경섬유종증 환자의 일부에서 이루어진 폐동맥 조직 검사에서 이와 유사한 소견을 보여 신경섬유종증에서의 폐고혈압이 혈관병증에 의한 발생할 것이라는 가설에 힘을 실어주고 있다[3,7].
폐동맥고혈압의 초기 증상은 대부분 경미하고 다른 질환들에서도 관찰되는 비특이적인 증상들이기 때문에 임상에서는 활동 시의 호흡곤란, 실신, 협심증과 같은 증상을 보이는 환자에서 폐고혈압의 가능성을 의심하고 심전도, 흉부 단순 촬영, 경흉부 심초음파, 폐기능 검사, 흉부 전산화단층촬영 등의 다양한 검사를 통해 이에 대한 확인을 하는 것이 필요하다. 폐동맥고혈압의 확진(gold standard)과 혈역학적 이상 정도의 평가, 약물 반응 검사를 위해 우심장 심도자술(right heart catheterization)이 시행될 수 있으나[8] 침습적이고 약물 반응 검사시 저혈압이나 심부전과 같은 합병증이 있을 수 있어 적응증을 잘 가려야 할 것이다.
제1형 신경섬유종에서의 폐고혈압 치료는 아직 따로 정립된 바가 없어 일반적인 폐동맥 고혈압의 치료를 따르고 있다. 일반적으로 폐고혈압 환자에서 피임, 예방접종, 가벼운 걷기 운동 정도의 육체활동을 권장하며 과도한 육체적 소모는 제한하고 있다. 저산소증이 동반될 경우 폐혈관 수축을 일으킬 수 있으므로 동맥혈 산소압이 60 mmHg 미만일 경우 장기간의 산소 치료의 적응이 되며 용적 과부하를 줄이기 위하여 염분섭취제한 및 이뇨제를 사용하게 되고 낮은 심박출량이나 심방 부정맥을 보이는 경우에는 디곡신 사용이 추천된다. 고용량의 칼슘통로차단제는 급성 약물반응검사(acute drug testing, acute vasoreactivity test)에서 적절한 반응을 보일 경우 사용하게 된다. ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension에서는 표적물질에 대한 치료제들이 대거 포함되었는데, Prostanoid인 Epoprostenol, Iloprost, Treprostinil, Beraprost, Endothelin 수용체 길항제인 Bosentan, Sitaxentan, Ambrisentan, Phosphodiesterase-5 억제제인 Sildenafil, Tadalafil이 이에 속한다[8]. 진행된 폐고혈압에서는 폐이식을 고려해 볼 수 있다. 그러나 신경섬유종 환자의 약 20%에서 중추신경계 종양이 발생한다고 보고되고 있으며[9] 이식 후 사용하는 면역억제제가 종양 발생을 증가시킬 수 있다는 견해도 있어 이식을 결정하는 데에 신중하여야 하겠지만 제1형 신경섬유종증 자체가 이식의 비적응증은 아니며 폐이식의 성공 사례도 보고된 바 있다[10].




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






