척추관절염의 개념 및 개관
The Concept and Overview of Spondyloarthritis
Article information
Trans Abstract
The spondyloarthritis (SpA) is a group of chronic inflammatory rheumatic diseases in association with HLA-B27. They share the clinical features including sacroiliitis, spondylitis, oligoarthritis, enthesitis and extra-articular involvement. Recently ASAS proposed new classification criteria sets of axial and peripheral SpA. They were designed to include non-radiographic SpA, thus can guide the early diagnosis of disease before the structural damage occurs. SpA has a strong genetic predisposition. Non-MHC genes, such as IL23R and ERAP1, as well as HLA-B27 were confirmed as susceptibility genes through several GWAS. Major pathology in SpA is entheseal inflammation and new bone formation. Intrinsic ability of HLA-B27 to trigger innate immune response and several proinflammtory cytokines may contribute to the inflammation in SpA. New bone formation could be explained by a mechanism, partly or completely independent of the inflammatory process. (Korean J Med 2013;85:229-239)
서 론
척추관절염(spondyloarthritis)은 질환의 원형인 강직성 척추염(ankylosing spondylitis)과 이와 임상적, 유전적 특징을 공유하는 건선 관절염(psoriatic arthritis), 반응성 관절염(reactive arthritis), 염증성 장질환 관련 관절염(inflammatory bowel disease-associated arthritis), 유년기 발병 척추관절염(juvenile-onset spondyloarthritis), 미분화 척추관절염(undifferentiated spondyloarthritis) 등을 포함하는 만성 염증성 류마티스 질환이다[1]. 이 질환들은 공통적으로 천장관절염(sacroiliitis) 및 척추염(spondylitis), 주로 하지를 비대칭적으로 침범하는 소수관절염, 부착부염(enthesitis), 그리고 포도막염(uveitis), 건선(psoriasis), 염증성 장질환과 같은 근골격외 장기 이환 등의 임상적 특징을 보이며 유전적으로 HLA-B27과 밀접히 연관되어 있다.
최근에 발표된 국제척추관절염평가학회(Assessment of SpondyloArthritis international Society, ASAS)의 정의에 의하면 주요 증상이 척추 증상이냐 말초관절 증상이냐에 따라 척추관절염은 크게 축형 척추관절염(axial spondyloarthritis)과 말초형 척추관절염(peripheral spondyloarthritis)으로 나뉜다[2,3]. 축형 척추관절염 중에서 방사선학적 천장관절염을 보이는 경우는 기존의 강직성 척추염에 해당하고 보이지 않는 경우는 비방사선학적(non-radiographic) 축형 척추관절염이라고 한다. 비방사선학적 축형 척추관절염 환자들은 과거 미분화 척추관절염 환자로 분류되었다.
역 사
강직성 척추염은 선사시대부터 존재한 것으로 추정된다. 서구의 문헌에서 강직성 척추염에 대한 최초의 임상적 기술은 17세기 후반부터 발견되지만 강직성 척추염에 대한 보다 분명한 임상적 기술은 19세기 후반 3명의 유럽 신경학자 Adolph Strumpell, Vladmir Bechterew, Pierre Marie에 의해 각각 이루어졌다. 특히 Pierre Marie 등은 강직성 척추염에 대한 임상적 기술을 완성하는데 필요한 병리 및 해부학적 관찰을 제공하였다. 1930년대 방사선 촬영의 도입과 함께 강직성 척추염에서의 천장관절염과 인대골증식(syndesmophyte)에 대한 기술이 이루어졌다[4].
미국의 의사들은 1950년대까지 척추관절염을 류마티스 관절염의 한 유형으로 보고 류마티스 척추염(rheumatoid spondylitis)이라는 용어를 사용하였다. 그러나 발견된 류마티스 인자가 임상에 적용되고 해상도 높은 방사선 촬영기법이 나오면서 이 두 질환은 점점 분명하게 분리되기 시작하였다. 1963년 미국 류마티즘협회는 공식적으로 강직성 척추염이라는 용어를 승인하게 되었다[5].
1974년 Moll 등은 강직성 척추염, 건선 관절염, 라이터 질환(Reiter’s disease), 장관절병증(intestinal arthropathies) 등을 통합하여 류마티스 관절염과는 구별되는 혈청음성 척추관절염(seronegative spondyloarthritis)이라는 개념을 제안하였다[6]. 그들이 주창한 개념은 이상의 질환들이 류마티스 인자 음성, 방사선학적 천장관절염, 피부 질환과 점막 증상, 가족 내 집적 발병 등의 특징을 공유한다는 임상적 관찰에 근거하였다. 이후 HLA 검사와 동물모델의 결과는 이들의 통합 개념을 더욱 강력히 지지하였다. 강직성 척추염과 관련된 HLA-B27이 다른 척추관절염 질환과도 밀접한 연관을 보였고 HLA-B27 유전자 이식 쥐는 사람의 척추관절염 질환군과 유사한 다양한 증상들을 발현하였다[7].
유병률
척추관절염의 유병률은 민족마다 차이가 있으며 이 차이는 HLA-B27의 유병률과 직접적으로 관련되어 있다. 최근 역학 조사에서는 척추관절염의 유병률이 류마티스 관절염의 유병률보다 높은 수치를 보여주기도 한다. 서구에서 척추관절염의 유병률은 0.3-2.5%로 보고되고 있고 척추관절염의 하부 유형 중에는 강직성 척추염과 미분화 척추관절염이 가장 흔하다. 강직성 척추염의 유병률은 0.1-1.4%로 알려져 있다[8].
임상양상
임상 증상
척추관절염 환자의 주요한 근골격증상은 천장관절염/척추염으로 인한 등통증, 말초관절염, 부착부염, 손발가락염(dactylitis) 등이 있다. 피부나 점막, 눈, 또는 장 점막을 침범하여 근골격외 증상을 나타내기도 한다. 질병의 가족력이 존재하여 1도 및 2도 친척에서 척추관절염뿐만 아니라 포도막염, 건선, 염증성 장질환 등이 종종 발견된다. 척추관절염의 통증은 비스테로이드성 항염제(non-steroidal anti-inflammatory drug, NSAID) 치료로 비교적 좋은 반응을 보이는데 항염증용량으로 등통증이 24-48시간 이내에 상당한 호전을 보이는 것이 특징이다.
등통증은 질병 발생 시 가장 흔한 증상으로 70% 환자에서 나타난다. 척추관절염에 의한 등통증은 흔히 보는 해부학적 구조 이상에 연유한 기계적 등통증과 구분하여 염증성 등통증이라고 부른다. 최근의 한 보고는 염증성 등통증은 인구의 5% 정도의 유병률을 보이고 만성 등통증 환자의 삼분의 일을 차지하고 있다고 한다[9]. Calin 등[10]은 등통증에 대해 40세 미만 발생, 잠행적 발병, 3개월 이상 지속, 조조경직, 운동으로 호전의 5개 항목 중 4개 이상을 만족하면 염증성 등통증으로 간주할 수 있다고 하였다. 최근 ASAS는 염증성 등통증을 새롭게 정의했는데 이 정의는 축형 척추관절염 및 말초형 척추관절염의 분류기준 중 하나로 포함되었다(Table 1) [11].
척추관절염의 말초 관절염은 보통 급성으로 발생하고 하지, 특히 무릎과 발목을 잘 침범한다. 관절염은 비대칭적이고 1-3개의 관절을 흔히 침범한다. 무릎과 발목의 관절염은 상당한 종창을 동반할 수 있다.
부착부(entheses)는 인대, 건, 관절낭, 근막 등이 뼈에 붙는 부위를 말한다. 이 부위의 염증을 부착부염이라 하는데 척추 관절염의 특징 중 하나이다. 발뒤꿈치 부착부염이 가장 흔하며 아킬레스건 또는 발바닥근막이 종골(calcaneus)에 붙는 부위에 통증과 압통이 생기고 종창을 동반하기도 한다. 부착부염이 잘 생기는 다른 위치로는 엉덩뼈 능선(iliac crests), 큰 돌기(greater trochanters), 팔꿈치의 위관절융기(epicondyles), 정강뼈 고원(tibial plateaus), 흉골의 갈비연골 접합부(costochondral junctions), 윗팔뼈 거친면(humeral tuberosities), 흉골병 관절(manubrial-sternal joints), 후두(occiput), 척추의 가시돌기 (spinous processes) 등이 있다[12].
손발가락염은 척추관절염의 또 다른 특징으로 관절에 국한되어 붓는 활막염(synovitis)과는 달리 손가락, 발가락 전체가 붓는다. 굴곡건, 건막, 주변 연부조직으로의 염증 침범 때문에 미만성 종창이 발생한다. 통증과 압통이 미미할 수도 있다. 손발가락염은 척추관절염 외에 감염이나 사르코이드증(sarcoidosis), 겸상 세포병(sickle cell disease), 결절성 통풍(tophaceous gout) 등에서도 나타날 수 있다[13].
척추관절염의 대표적인 근골격외 증상으로 전방 포도막염(홍채염)이 있다[14]. 전방 포도막염은 강직성 척추염 환자의 20%에서 발생한다. 전방 포도막염이 생기면 환자는 눈의 발적, 통증, 눈부심을 호소한다. 국소 스테로이드로 대개 염증이 호전되지만 치료가 실패하면 영구적인 시력장애를 초래할 수도 있다. 그 외에도 건선이나 염증성 장질환 같은 근골격외 증상이 동반되기도 한다. 염증성 장질환을 동반하지 않은 척추관절염 환자의 60%에서도 장점막의 염증 병변을 보이는데 대개 증상은 없다. 장 염증과 말초 관절염의 정도는 밀접한 관련성을 보인다[15].
임상경과
강직성 척추염은 가장 중증의 척추관절염 형태라 할 수 있는데 강직성 척추염 환자 상당수에서 장애를 초래하는 척추 강직이 일어나기 때문이다. 10-15년 만에 최대 70% 환자에서 척추 강직이 일어났다는 보고도 있다. 강직성 척추염은 일반 인구에 비해 사망률이 1.5-4배 높고 40세 이후 생존율도 10% 이상 감소하는 것으로 알려져 있다[16].
척추관절염의 임상경과는 하부유형마다 다르지만 척추관절염의 모든 하부유형이 척추 침범 증상을 보일 수 있고 강직성 척추염으로 진행할 수 있다. 건선 관절염 환자의 25%, 염증성 장질환 관련 관절염 환자의 10-20%가 방사선학적 천장관절염을 보인다. 반응성 관절염 환자의 대부분은 호전되지만 20%는 강직성 척추염으로 진행한다[17]. 미분화 척추관절염 환자의 10년 장기 추적결과를 보면 진단의 변화가 없는 경우는 17%였고 상당수가 관해되거나(23%) 강직성 척추염으로 진행하였다(24%) [18]. 한편 비방사선학적 축형 척추관절염의 경우 어느 정도가 강직성 척추염으로 발전하는지는 아직 확실하지 않다.
검사실 소견
HLA-B27는 강직성 척추염 환자의 90% 이상에서, 미분화 척추관절염 환자의 약 70%에서 양성이다. HLA-B27 검사는 척추관절염이 의심되면 흔하게 시행되지만 정상 인구집단에서도 상당수에서 양성이기 때문에 이 자체가 진단적이지는 않다. HLA-B27 검사는 특히 천정관절염이 영상검사에서 확인되지 않는 축형 척추관절염 환자에서 진단에 도움이 된다. HLA-B27이 음성이고 영상검사에서 천장관절염이 없으면 척추관절염의 가능성은 떨어진다. 척추관절염의 일부 환자에서 적혈구 침강속도(erythrocyte sedimentation rate, ESR)와 C-반응단백질(C-reactive protein, CRP)이 증가한다.
영상 소견
천장관절, 척추, 침범된 말초관절 및 부착부의 단순 방사선 촬영사진은 진행된 척추관절염의 경우에는 진단에 도움이 될 수 있다. 그러나 초기 질환 혹은 미분화 척추관절염에서는 의미 있는 변화를 찾지 못할 가능성이 높다.
천장관절의 변화는 척추관절염의 특징적인 소견 중 하나로 진단을 위해 척추관절염이 의심되는 모든 환자는 골반 전후 단순 방사선 촬영을 한다. 단순 방사선 촬영에서 보이는 천장관절의 변화는 표 2와 같다[19]. 양측성으로 2등급 이상 이거나 편측성으로 3등급 이상이면 방사선학적 천장관절염이 있는 것으로 정의한다[20].
강직성 척추염 환자의 경우 위 아래 척추체를 연결하는 인대가 골화되어 인대골증식을 형성한다. 인대골증식이 있으면 대부분 방사선학적 천장관절염을 이미 갖고 있다. 인대골증식은 척추의 측면 단순 방사선 촬영에서 쉽게 관찰할 수 있다. 인대골 증식은 상부 요추에서 시작되어 질환이 진행할수록 점점 확대되고, 나중에는 전 척추체가 인대골 증식으로 연결되어 대나무 모양(bamboo spine)으로 보일 수 있다.
말초관절의 단순 방사선 촬영에서는 대개 특별한 소견이 없다. 류마티스 관절염에서 보이는 미란은 드물고 발뒤꿈치의 부착부염은 솜털 같은 미란을 보일 수 있다.
천장관절을 볼 수 있는 골반뼈 자기공명영상(magnetic resonance imaging, MRI)은 척추관절염이 의심되지만 단순 방사선 촬영에서 천장관절염을 보이지 않는 환자에서 진단에 도움이 될 수 있다. MRI는 천장 관절의 활동성 염증에 대한 정보를 준다. 천장관절의 활동성 염증 병변은 연골아래 또는 관절주변에서 T1-가중영상에서는 나오지 않지만 STIR(short t inversion recovery) 영상 혹은 T2 지방흡수영상에서 보이는 골수부종으로 나타난다. 활막염, 부착부염, 관절낭염 소견이나 지방축적, 경화, 미란, 골성 강직 같은 구조적 병변은 진단에 도움은 되지만 이것으로 활동성 천장관절염을 진단하지는 않는다[21]. MRI의 골수부종에 대한 민감도는 제한적이다. 조직학적으로 천장관절염이 확인된 환자에서 MRI로 천장관절염을 진단하고자 할 때, 특이도는 100%였지만 민감도는 38%였다. 그러나 MRI 소견이 음성이면서 조직학적으로 천장관절염이 있었던 환자는 10년 추적검사에서 MRI 소견이 양성이었던 환자에 비해 방사선학적 천장관절염으로 진행할 빈도가 적었다[22]. 이것은 방사선학적 천장관절염의 발생이 MRI로 관찰된 염증의 정도와 관련 있음을 시사한다.
컴퓨터 단층 촬영(computed tomography, CT)는 단순 방사선 촬영보다 구조적 변화를 좀 더 민감하게 찾을 수 있지만 MRI와 비교할 때는 차이가 없다. 또한 CT는 MRI와 달리 염증이나 지방 침착을 찾을 수 없고 방사선 노출의 위험이 있다. 뼈 섬광조영술(scintigraphy)은 염증 부위에서 섭취가 증가하지만 너무 비특이적이어서 진단에 도움이 되지 않는다.
진단과 의뢰
분류기준
척추관절염의 분류기준은 진단이 아닌 역학 및 임상 연구에 사용하기 위해 만들어진 것이지만 진단에 도움을 줄 수 있다. 대개 실제 임상진료에서 진단은 분류기준을 이용하는 전문가의 임상적 판단에 의거하여 이루어진다.
척추관절염과 관련된 최초의 분류기준은 1961년 로마 회의에서 만들어진 강직성 척추염 기준이다[23]. 이 기준은 이후 방사선학적 천장관절염을 기준에 포함하는 등 여러 수정을 거쳐 수정 뉴욕 기준이라고 알려진 1984년 형태로 정착되었다(Table 3) [20]. 그러나 이 기준은 척추 증상에만 초점을 두고 척추관절염의 다른 증상들을 제외했으며 방사선학적 천장관절염을 보이지 않는 초기 질환을 배제한다는 한계가 있었다. 1990년대 척추관절염 질환군 전체에 대한 분류기준으로 Amor 기준(Table 4) 및 유럽 척추관절병증 연구그룹(European Spondyloarthropathy Study Group, ESSG) 기준(Table 5)이 제안되었다[24,25]. 이 두 가지 기준은 강직성 척추염의 수정 뉴욕기준과 달리 천장관절염을 진단의 사전 조건이 아닌 한 요소로 간주하고 척추관절염의 다양한 특징들을 기준에 포함시킴으로써 척추관절염 환자들을 보다 포괄적으로 분류할 수 있도록 하였다. 이 기준들의 타당성은 여러 인구집단에서 확인되었고, 민감도는 70-90%, 특이도는 90-100%에 도달하였다[26]. 그러나 이 기준들을 조기, 경증 또는 의증 환자들에 적용할 때는 결과가 좋지 않았다.
2000년대 MRI와 종양괴사인자(tumor necrosis factor, TNF) 차단제가 도입되면서 척추관절염의 진단과 치료에 새로운 지평이 열렸다. MRI를 이용하면 단순 방사선 촬영에서의 이상이 나타나기 전 천장관절이나 척추의 염증 소견을 발견할 수 있었다. 종양괴사인자 차단제는 강직성 척추염에서 척추 통증과 기능, 염증 조절에 탁월한 효과를 보였고 특히 질환의 초기 환자에서 반응이 월등하였다. 척추관절염에서 방사선학적 변화가 오기 전 조기 질환에 대한 관심이 확대되었고 기존의 기준들이 갖고 있는 문제를 극복한 새로운 분류기준의 필요성이 증대되었다.
이에 따라 ASAS는 대규모의 단면 연구를 통해 두 개의 주요한 증상, 즉 척추 및 말초 증상에 따라 축형 및 말초형 척추관절염의 기준을 새롭게 제안하였다[2,3]. 2009년 출판된 축형 척추관절염의 기준은 척추관절염의 다양한 임상적 특징과 천장관절의 MRI 소견, HLA-B27 결과를 기준에 포함시켜 축형 질환의 전 범위를 포괄하였다(Table 6). 특히 강직성 척추염의 분류기준에서 제외되었던 단순 방사선 촬영에서 천장관절염을 보이지 않는 단계(non-radiographic disease)를 포함하였다. 축형 척추관절염의 새로운 기준은 대규모 국제 코호트에서 타당성이 검증되었고 민감도 83%, 특이도 84%로 Amor 기준 및 ESSG 기준과 비교할 때 민감도는 비슷하였고 특이도는 좀 더 우수하였다[2]. 2011년에는 척추증상 대신 말초관절염이나 부착부염, 손발가락염과 같은 말초 증상이 주증상인 환자를 대상으로 한 말초형 척추관절염 분류 기준이 제안되었다(Table 7). 이 기준의 민감도는 78%, 특이도 83%로 기존의 Amor 기준이나 ESSG 기준보다 민감도에서 특히 우수하였다[3]. 축형 및 말초형 척추관절염의 새로운 분류기준을 진단 목적으로 일상 진료에서 적용할 수 있을지는 아직 타당성이 검증되지 않았다.
의뢰기준
만성 등통증은 척추관절염의 주요한 초기증상이지만 등통증은 일반 인구에서 매우 흔한 증상이다. 만성 등통증의 5% 정도만이 축형 척추관절염에서 기인한다. 또한 척추관절염 질환의 초기에는 방사선학적 천장관절염 같은 분명한 소견이 관찰되지 않는다. 이로 인해 강직성 척추염의 진단은 증상 발현 이후 보통 5-10년이나 지연되는 것으로 알려져 있다. 진단 지연은 적절한 치료가 개입할 초기의 기회를 놓치거나 불필요한 진단 및 치료 시술로 이어질 수 있다. 따라서 조기 진단이 가능한 적절한 진단기준을 갖는 것 외에 질환초기에 진단이 의심되는 환자가 전문가에게 의뢰되는 것이 중요하다. 유럽 여러 나라에서 이루어진 연구에 의하면 일차 진료의사가 적절한 기준에 따라 축형 척추관절염 의심 환자를 류마티스 전문의에게 의뢰했을 때 진단율이 최대 2.5배까지 증가하였다[27]. 한 연구에서는 45세 이하에서 발병한 만성 등통증 환자에서 통증이 염증성이거나 HLA-B27 양성 또는 방사선학적 천장관절염이 관찰되면 류마티스 전문의에게 의뢰할 것을 제안하였다[28].
유전 및 발병기전
유전
가족연구, 쌍생아연구, 유전위험모형연구는 유전적 요인이 강직성 척추염 감수성의 대부분을 차지하고 있을 보여주었다. 가족연구를 통해 연구자들은 유전적 위험인자가 강직성 척추염의 감수성의 80-90%가 된다고 평가하였다[29].
가장 주요한 유전적 위험인자는 HLA-B27이다. HLA-B27은 강직성 척추염 환자의 90% 이상에서 존재하고 HLA-B27 유전자이식 쥐에서 척추관절염 유사 질환이 자연 발생하는 것은 HLAB27의 지배적인 영향을 시사한다[7]. 그러나 일반 HLA-B27 양성자의 5%에서 발병하는 척추관절염이 강직성 척추염 환자의 친척 중 HLA-B27 양성자에서는 20%에서 발생한다는 사실은 다은 유전자의 부과적인 기여를 암시한다[30].
현재까지 전유전체 연관연구(Genome-wide association study, GWAS) 등을 통해서 HLA-B27를 제외하고 강직성 척추염과의 연관성이 있다고 알려진 주요한 유전자들은 다음과 같다. ERAP1, IL23R, 염색체 2p15와 21q22의 유전자 사막이라고 알려진 지역, KIF21B, IL1R2, ANTXR2, RUNX3, IL12B, LTBR, TNFRSF1A, TBKP1, TRADD, CARD9, PTGER4, STAT3. 이상의 유전자들의 생성물들은 세포 내 항원 가공(HLA-B27, ERAP1), interleukin23-interleukin17 (IL23-IL17) 경로(IL23R, IL12B, STAT3, PTGER4), NFkB 경로(CARD9), TNF 경로(LTBR, TNFRSF1A, TBKP1, TRADD), IL1 경로(IL1R2)와 관련되어 있어 이러한 기능경로가 강직성 척추염 발병에 기여할 것을 시사한다[31].
발병기전
척추관절염의 특징적인 병리 소견은 부착부의 염증과 골생성이다. HLA-B27을 비롯한 감수성 유전자들의 생성물과 여러 병인적 시토카인(cytokine)이 척추관절염의 염증에 주요한 역할을 할 것으로 추정한다. 또한 류마티스 관절염과 다른 척추관절염의 독특한 병리인 골증식에 대해서도 최근 여러 기전이 제시되고 있다.
HLA-B27의 역할
척추관절염의 발병에 HLA-B27이 하는 역할에 대해서는 현재까지 여러 가설이 존재한다(Fig. 1) [32].
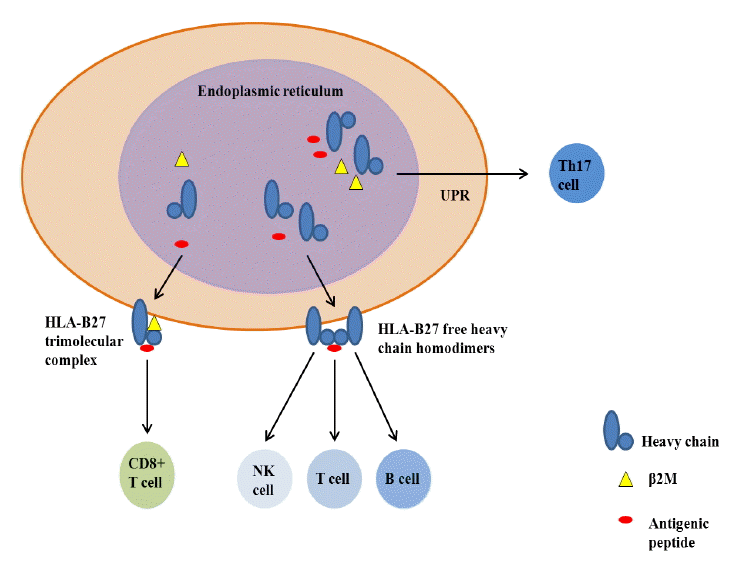
Three different hypotheses as to how HLA-B27 might induce disease processes (adapted from reference 40) [40]. The HLA-B27 heavy chains are combined and folded with β-2-microglobulin (β2M) and antigenic peptide which are formation of trimolecular peptide complex in the endoplasmic reticulum, and then are expressed on the cell surface. A self-peptides displayed by folded HLA-B27 heavy chain/β2M complexes could be targeted by autoreactive CD8+ T cells because they resemble microbial peptides (the arthritogenic-peptide hypothesis). The HLA-B27 heavy chain misfolds in the endoplasmic reticulum, forming HLA-B27 free heavy chain homodimers and other misfoldings. Accumulated misfolded HLA-27 molecules may causes a proinflammatory response (the unfolded-protein- response hypothesis). HLA-B27 free heavy chains migrate to the cell surface, where they can be recognized by the receptors on NK and T cells (the free-heavy-chain hypothesis).
관절염유발 펩타이드(arthritogenic peptide) 가설
HLA-B27은 I종 주조직적합성복합체(major histocompatibility complex class I, MHC I)에 속한다. MHC I은 항원제공세포 내에서 외부 항원(펩타이드)와 결합하여 세포표면에 발현한 뒤 항원을 CD8+ T 세포에 제시하는 역할을 한다. 자가 펩타이드의 경우 정상적으로는 면역반응이 일어나지 않지만(면역관용), 자가 펩타이드가 병원체에서 유래한 펩타이드와 유사하면 그 병원체에 의한 감염이 면역관용을 깨드려 면역반응이 일어난다. HLA-B27이 이와 같은 관절염 유발 펩타이드를 CD8+ T 세포에 제공한다는 것은 척추관절염의 병태생리로 오랫동안 고려되었다. 실제로 위장관 및 비뇨기 감염에 의해 척추관절염의 일종인 반응성 관절염이 유발되고 염증관절에서 연골의 자가 단백뿐만 아니라 세균 항원에 반응하는 HLA-B27 제한 CD8 T 세포 클론이 존재한다[33]. 그러나 HLA-B27 유전자이식 쥐에서 질환 발병에 CD8+ T 세포는 필요하지 않고 인체에서 항연골 반응은 질환 특이적이 않다는 사실이 알려지면서 최근 이 가설은 힘을 잃었다[34]. 2개의 추가적인 가설이 등장하였는데, 이것들은 HLA-B27이 전통적인 항원제공보다는 선천면역(innate immunity) 반응을 유발하는 자가염증(autoinflammatory) 기능을 갖고 있다고 주장한다.
미접힘단백반응(unfolded protein response, UPR) 가설
항원성 펩타이드는 세포 내 소포체(endoplasmic reticulum, ER)에서 HLA 분자의 중쇄(heavy chain)와 베타2 미세글로불린(beta2 microglobulin, β2M)과 함께 복합체를 형성하고 접힘(folding)을 통해 3차원적 구조로 만들어진다. HLA-B27은 다른 HLA 분자보다 접힘 속도가 늦어 펩타이드와 결합체를 이루기 전에 HLA-B27의 접힘 이상(misfolding)을 일으키고 이것이 ER에서 UPR이라는 세포 내 신호전달 반응을 유발하여 염증세포의 이상 반응과 시토카인 생성을 야기한다. 대식세포에서 UPR은 전염증성 Th17세포를 활성화시키는 IL-23생성을 유발할 수 있다. 실제로 척추관절염의 활막 조직에서 UPR 표지 발현이 증가되어 있다고 보고되어 있다[35]. 그러나 HLA-B27 유전자이식 쥐에서 UPR을 감소시키는 β2M의 과발현이 관절염과 척추염을 억제하기보다는 악화시켰다는 상충된 보고도 있다[36].
한편 펩타이드는 HLA-B27과 복합체를 형성하기 전 ER에서 아미노펩티다제(aminopeptidase)에 의해 적절한 길이로 다듬어진다. 그 중 하나가 최근 강직성 척추염과 유전적으로 연관성이 있는 것으로 알려진 ERAP1이다. ERAP1의 결함은 HLA 분자의 접힘 속도를 더욱 늦추어 펩타이드의 비정상적 전달에 관여할 가능성이 있다.
자유중쇄(free heavy chain) 가설
HLA-B27 중쇄에서 β2M 분리된 자유중쇄가 세포 표면에 단량체(monomer)로 혹은 서로 결합된 동종이합체(homodimer)로 발현되면 killer immunoglobulin-like 수용체(KIRs)에 의해서 인지되어 자연 살해(natural killer, NK)세포나 T세포가 작동된다는 가설이다[37]. HLA-B27 양성 척추관절염 환자에서 KIR3DL2를 발현하는 NK세포와 T세포의 역가가 상승되어있고 동종이합체의 결찰에 의해서 직접 활성화될 수 있다고 알려져 있다[38].
시토카인
종양괴사인자
종양괴사인자가 척추관절염 발병에서 주요한 역할을 할것이라는 추정은 임상적으로 종양괴사인자 차단제의 치료효과와 더불어 TNFR1, TRADD, TBKBP1 등 TNF 경로와 관련된 여러 유전자가 강직성 척추염과 관련되어 있다는 연구 결과와 부합된다. 그러나 종양괴사인자가 어떻게 척추관절염을 발생시키는지는 불확실하다. TNF 과발현 모형들이 천장관절염을 유발하고 한 모형은 기질세포로의 TNFR1 신호 전달이 주요한 역할을 함을 보여주었지만[39] 이런 모형들은 다발성 미란성 관절염이 주증상이어서 근본적으로 척추관절염과 차이가 있었다.
IL23과 IL17
Th17세포에서 분비되는 강력한 전염증성 시토카인인 IL17은 척추관절염을 포함한 많은 염증성 관절염의 핵심 매개물로 보고되었다. IL23은 Th17세포의 IL23수용체를 통하여 Th17 세포의 확장과 분화, IL-17의 분비에 관여한다[40]. GWAS연구를 통해 척추관절염과 IL23R와의 관련성이 밝혀졌고 HLA-B27에 의한 UPR이 IL23 생성을 항진한다는 증거들도 있다[41]. 또한 KIL3DL2+ CD4+ T세포가 HLA-B27 자유 중쇄에 의해서 IL17을 생산하고 이런 세포들이 척추관절염 환자의 말초혈액과 활액에 풍부하다고 알려졌다[42]. 최근엔 동물실험을 통해 IL23이 부착부에 상주하는 특정 T 세포에 작용하여 부착부염을 일으킬 뿐만 아니라 IL22 매개성 골증식을 야기할 수 있음이 시사되었다[43].
골미란과 골생성
류마티스 관절염에서 종양괴사인자 차단제는 활막의 염증 호전과 더불어 관절에서의 골미란을 예방한 결과들을 보여주었다. 그러나 강직성 척추염에서의 임상 및 동물시험에서 종양괴사인자 차단은 염증을 상당부분 조절하였지만 부착부에서의 골미란 조절은 일정하지 않았고 척추의 인대골 증식의 형성을 감소시키지 못했다[44]. 따라서 염증과 골파괴가 짝을 이루고 있는 류마티스 관절염과는 달리 강직성 척추염에서는 부착부 골미란과 인대골 증식의 형성은 염증과 완전히 짝을 이루는 것은 아닌 것으로 받아들여 진다. 영상학 및 조직학적 연구에 따르면 골파괴 및 미란은 축형 및 말초형 척추관절염 모두에서 현저하다. 연골 및 골파괴의 세포 및 분자 경로가 병변 부위에서 활성화되어 있고 류마티스 관절염에서와 마찬가지로 종양괴사 인자에 상당히 의존적이다[45]. 강직성 척추염 환자에서 규명된 골파괴 인자로는 cathepsin K와 matrix metalloproteinase 1 (MMP1)이 알려져 있다[46].
강직성 척추염에서의 골형성은 2개의 주요한 분자경로에 의해 조절되는 것으로 알려져 있다. 하나는 TGFβ (transforming growth factor β)군에 속하는 BMP군(bone morphogenic proteins)에 의해서 이루어지는 것으로 이 경로는 연골세포에서 분비되는 noggin과 골세포 특이적인 단백 sclerostin 같은 내인성 억제제에 의해 음성적으로 조절된다[47]. 다른 하나는 Wnt(wingless) 군이 중심에서 작동하는 경로로서 Wnt는 간엽세포(mesenchymal cell)를 골아세포(osteoblast) 계열의 세포로 분화를 유도한다[48]. Wnt 경로에 대한 내생적인 억제자로서는 Dickkopf-related protein 1 (DKK1)이 있다. 강직성 척추염 환자의 아킬레스 부착부에서 BMP 활성화 증가[49], 골세포에서 sclerostin의 감소[50], 혈청에서 DKKI의 혈청 농도의 감소가 보고된 바 있다 [51]. 한편 최근의 한 연구에서는 부착부에 상주하는 IL23+ T 세포가 IL22를 통해 Wnt, BMP 등의 골형성 유전자를 유도할 수 있음을 보여주었다[43].
염증과 완전히 혹은 부분적으로 분리된 척추관절염의 골증식식에 대해서는 두 가지 설명이 존재한다(Fig. 2). 첫째는 골증식을 염증의 간헐적 성격과 관련지어 설명한다[52]. 질환의 초기에 종양괴사 인자는 골파괴를 유도함과 동시에 DKK1을 상향 조절함으로써 Wnt 경로에 의한 골재 형성을 억제하지만 질환의 후기에는 Wnt 경로에 대한 제동 장치가 풀리면서 반응성 골증식을 유발하게 된다는 것이다. 그러나 이 가설은 대부분의 인대 골증식은 염증이 발견되지 않는 부위에 위치하며[53] 여러 모형에서 새로운 골형성이 파골세포와 무관하게 이루어지고 종양괴사인자 차단이 강직성 부착부염을 막지 못한 사실을 설명하지 못한다. 둘째는 염증 또는 조기 미란성 변화와 무관하게 BMP를 포함한 기질 경로의 직접적인 활성화가 골재형성을 이끈다는 주장이다[54]. 이 가설은 활막-부착부 복합체에서의 기계적 스트레스가 염증과 조직 재형성경로를 각각 유발한다고 주장한다. 첫째 가설은 조기 항염증 치료가 구조적 손상을 예방할 것을 예견하는 반면 둘째 가설은 기질 경로에 대한 독립적인 치료가 척추관절염의 최적의 관리를 위해 필요함을 시사한다.

New bone formation mechanism in spondyloarthritis. The tissue inflammation might be developed by triggers. In an early disease phase, TNF inhibit remodeling by the Wnt pathway. When the inflammation has subsided, the Wnt pathway might be reactivated and the osteoproliferation could be started. The direct activation of stromal pathways could lead to new bone formation independent of inflammation, in which BMP signaling is thought to have a key role. The Wnt pathway is controlled negatively by DKK1, and the inhibitors of BMP pathway are noggin and sclerostin. TNF, tumor necrosis factor; BMP, bone morphogenic protein; DKK1, Dickkopf-related protein 1.
결 론
척추관절염은 천장관절염/척추염, 소수관절염, 부착부염 같은 근골격 증상과 포도막염, 건선, 장점막 질환 및 HLA-B27 유전자와의 연관성을 공유하고 있는 만성 염증성 류마티스 질환이다. 척추관절염의 진단기준은 없지만 다양한 분류기준이 진단에 도움을 줄 수 있다. 최근 ASAS는 방사선학적 천장관절염이 보이지 않는 단계를 포함하여 포괄적이고 체계적으로 척추관절염을 분류할 수 있는 축형 및 말초형 척추관절염 분류기준을 제안하였다. 척추관절염은 유전 요소가 지배적인 질환이며 가장 강력한 연관 유전자는 HLA-B27이다. 최근 MHC 유전자 자리 바깥에 위치한 질환 감수성 유전자로 ERAP1, IL23R 등이 발견되었다. 척추관절염의 주요병리는 부착부의 염증과 골생성이다. 척추관절염의 염증 발생을 설명하기 위해 HLA-B27과 관련된 여러 기전이 제안되었다. HLA-B27 이외의 질환 감수성 유전자 생성물들은 HLA-B27 분자의 과정이나 시토카인 경로에 관여할 것으로 추정된다. 한편 척추관절염의 골생성을 조절하는 염증 과정과는 완전히 혹은 부분적으로 분리된 기전이 존재한다.






