ýä£ Ùíá
Û©ëýä▒ ýÀîý×Ñýù╝ýØÿ 80-90%ÙÑ╝ ý░¿ýºÇÝòÿÙèö Û░äýºêýä▒ ýÀîý×Ñýù╝ýØÇ ÙîÇÙÂÇÙÂä Ù│┤ýí┤ýáü ý╣ÿÙúîÙºîý£╝Ùí£ÙÅä Ýÿ©ýáäÙÉ£Ùïñ. ÛÀ©Ùƒ¼Ùéÿ Û©ëýä▒ ýÀîý×Ñýù╝ýØÿ 10-20%ÙÑ╝ ý░¿ýºÇÝòÿÙèö Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝ýØÇ ýé¼ÙºØÙÑáýØ┤ 14-25%ýùÉ ýØ┤ÙÑ┤Û│á[1] Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝ýØÿ 20-35%ýùÉýä£ Û░Éýù╝ýØ┤ ÙÅÖÙ░ÿÙÉá ýêÿ ý×êýû┤ ýé¼ÙºØÙÑáýØ┤ ÙìöýÜ▒ ýªØÛ░ÇÙÉ£Ùïñ. Ýè╣Ý×ê ýØ┤Ùôñ ÝÖÿý×ÉýùÉýä£ Û┤┤ýé¼ÙÉ£ ýÀîý×Ñ ÙÂÇý£äýØÿ 2ý░¿ýáüýØ© Û░Éýù╝ýØÇ Ýî¿ÝÿêýªØÛ│╝ Ùïñý×ÑÛ©░ ÙÂÇýáäý£╝Ùí£ Ù░£ýáä ÙÉÿÙ»ÇÙí£ ýáòÝÖòÝò£ ýºäÙï¿Û│╝ ÙìöÙÂêýû┤ ýñæý×¼ýáü ýï£ýêáýØ┤Ùéÿ ýêÿýêáýáü ý╣ÿÙúîÛ░Ç ÝòäýÜöÙí£ Ýò£Ùïñ. ÙÿÉÝò£ Û©ëýä▒ ýÀîý×Ñýù╝ Ù░£ýâØ Ýøä 4ýú╝Û░Ç ýºÇÙéÿÙ®┤ ÛÁ¡ýåî Ýò®Ù│æýªØÙôñ, ýªë Û░Çýä▒Ùé¡ýóà(pseudocyst), ýÀîý×ÑÙåìýûæ(pancreatic abscess)Ùô▒ýØ┤ Ù░£ýâØÝòá ýêÿ ý×êÙïñ.
ýÿêÝøäÛ░Ç ÙÂêÙƒëÝò£ Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝Û│╝ ýÀîý×Ñ ýú╝ý£ä ÛÁ¡ýåî Ýò®Ù│æýªØÙôñýùÉ ÙîÇÝò£ ýä©ýï¼Ýò£ Û┤ÇÙª¼ýÖÇ ý╣ÿÙúîÛ░Ç Û©ëýä▒ ýÀîý×Ñýù╝ ÝÖÿý×ÉýØÿ ýé¼ÙºØÙÑáýØä Û░Éýåîýï£ÝéñÙèö Ùì░ ÙºñýÜ░ ýñæýÜöÝòÿÙïñ. Ùé┤ýï£Û▓¢ý┤êýØîÝîî(endoscopic ultrasound)ÙÑ╝ ýØ┤ýÜ®Ýò£ Ù░░ýòíýêáýØ┤ ÙÅäý×àÙÉÿÙ®┤ýä£ ýÀîý×Ñýù╝ýØÿ Ýò®Ù│æýªØýØÿ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîÛ░Ç Û©ëýåìÝòÿÛ▓î Ù░£ýáäÝòÿÛ│á ý×êÛ│á ýÀîý×ÑýºêÝÖÿýØÿ ý╣ÿÙúîýùÉ ýñæýÜöÝò£ ý×ÉÙª¼ÙºñÛ╣ÇýØä ÝòÿÛ│á ý×êÙïñ. Û│╝Û▒░ýùÉÙèö Û░Éýù╝ýä▒ ýÀîý×ÑÛ┤┤ýé¼ýØÿ ý╣ÿÙúîÙí£ ýêÿýêáýáü Û┤┤ýé¼ýá£Û▒░ýêáýØ┤ ÙºÄýØ┤ ýï£ÝûëÙÉÿýùêýºÇÙºî ýÁ£ÛÀ╝ýùÉÙèö Ù│┤ýí┤ýáü ý╣ÿÙúîýÖÇ ÙìöÙÂêýû┤ Ùé┤ýï£Û▓¢ýáü ÙÿÉÙèö Û▓¢Ýö╝ýáü Ù░░ýòíýêá Û░ÖýØÇ ýñæý×¼ýáü Ù░░ýòíýêáýØ┤ ýØ┤ýÜ®ÙÉÿÛ│á ý×êÙïñ. Û©ëýä▒ ýÀîý×Ñýù╝ ýñæýùÉýä£ ýøÉýØ©ýØä ý░¥ýòä Ýò┤Û▓░Ýòá ýêÿ ý×êÙèö Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØÇ Ùé┤ýï£Û▓¢ýáü ýù¡Ýûëýä▒ Ùï┤Û┤Çýí░ýÿüýêá(endoscopic retrograde cholnagiopancreatograph, ERCP)Û│╝ Ùé┤ýï£Û▓¢ýáü Û┤äýò¢ÛÀ╝ ýáêÛ░£ýêá(endoscopic sphincterotomy)Ùí£ ý╣ÿÙúîýÖÇ ý×¼Ù░£ýØä ÙºëýØä ýêÿ ý×êÙïñ. Ù│©Û│áýùÉýä£Ùèö Û©ëýä▒ ýÀîý×Ñýù╝ýØÿ Ýò®Ù│æýªØýØ© Û░Çýä▒Ùé¡ýóà, Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝, Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýùÉ ÙîÇÝò£ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîýùÉ ÙîÇÝòÿýù¼ ýòîýòäÙ│┤Û│áý×É Ýò£Ùïñ.
Ù│© Ùíá
ýÀîý×Ñ Û░Çýä▒Ùé¡ýóà
ýÀîý×Ñ Û░Çýä▒Ùé¡ýóà ýºäÙï¿
Û©ëýä▒ ýÀîý×Ñýù╝ýùÉýä£ Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØ┤ ÝòäýÜöÝò£ Û▓¢ýÜ░Ùèö ý×äýâüýáü ýªØýâüýØä ý£áÙ░£ÝòÿÙèö Û░Çýä▒Ùé¡ýóàýØ┤ ÙîÇÝæ£ýáüýØ© ýáüýØæýªØýØ┤Ùïñ. Û©ëýä▒ ýÀîý×Ñýù╝ Ýøä Ù░£ýâØÝòÿÙèö Û░Çýä▒Ùé¡ýóàýØÇ ýÀîý×ÑýïñýºêýØÿ Û┤┤ýé¼ ýùåýØ┤ ýú╝ýÀîÛ┤ÇýØ┤Ùéÿ ýÀîý×Ñ Ùé┤ ýÀîÛ┤ÇÛ░ÇýºÇýùÉýä£ ýÀîýªÖýØ┤ ýºÇýåìýáüý£╝Ùí£ ý£áý£ÙÉÿýû┤ Ýÿòýä▒ÙÉ£Ùïñ. 2013Ùàä ýâêÙí£ Û░£ýáòÙÉ£ Û©ëýä▒ ýÀîý×Ñýù╝ Atlanta ÙÂäÙÑÿýùÉýä£Ùèö Û░Çýä▒Ùé¡ýóàýØä Û©ëýä▒ Û░äýºêýä▒ ýÀîý×Ñýù╝ 4ýú╝ ÝøäýùÉ Ù░£ýâØÝòÿÙèö ýù╝ýªØýä▒ Ù▓¢ý£╝Ùí£ ý×ÿ ÙæÿÙƒ¼ýï©ýØ© ýêÿýòíÛ│áý×ä(acute fluid collection)ý£╝Ùí£ ýáòýØÿÝòÿÛ│á ý×êÙïñ(Table 1) [2].
ýñæý×¼ýáü Ù░░ýòíýêáýØä Û▓░ýáòÝòÿÛ©░ ýáä Û│áÙáñÝò┤ýò╝ Ýòá ýáÉýØÇ Ùé¡ýóàýä▒ ýóàýûæÛ│╝ Û░ÉÙ│äýØ┤Ùïñ. Û░Çýä▒Ùé¡ýóàýØ┤ Ù¬¿Ùôá ýÀîý×ÑÙé¡ýóàýØÿ ýò¢ 75%ÙÑ╝ ý░¿ýºÇÝòÿÛ│á ý×êýºÇÙºî ýÀîý×Ñýù╝ýØÿ Û©░ýÖòÙáÑýØ┤ Ù¬àÝÖòÝòÿýºÇ ýòèý£╝Ù®┤ ýÀîý×Ñ Ùé¡ýóàýä▒ ýóàýûæ, ýäáý▓£ýáü Ùé¡ýóà Ùô▒Û│╝ Û░ÉÙ│äýØ┤ ýë¢ýºÇ ýòèÙïñ. Ù│ÁÙÂÇ(computerized tomography, CT)Ùéÿ ý×ÉÛ©░Û│ÁÙ¬àýÿüýâü Û▓Çýé¼ýùÉýä£ ýí░ýºüÝîîÝÄ©(debris)ýØÿ ýí┤ý×¼Ùèö Û░Çýä▒Ùé¡ýóàýØä ýï£ýé¼ÝòÿÛ▒░Ùéÿ Ùé¡ýóàýØÿ Ù│Çýù░ ýäØÝÜîÝÖö, Ùé¡ýóàÙé┤ Û▓®Ù▓¢ýØ┤Ùéÿ ýåîýù¢Ù¬¿ýûæ(lobulated) ÝÿòÝâ£Ùèö Ùé¡ýóàýä▒ ýóàýûæýØ╝ Û░ÇÙèÑýä▒ýØ┤ ÙåÆÙïñ. Û░ü Ùé¡ýóàýØÿ ýáäÝÿòýáüýØ© Ýè╣ýºòýáü ýåîÛ▓¼ýØ┤ Û┤Çý░░ÙÉÿÙ®┤ ýºäÙï¿ýØ┤ ýû┤ÙáÁýºÇ ýòèýºÇÙºî ýØ┤Ùƒ¼Ýò£ Ýè╣ýºòýáüýØ© ýåîÛ▓¼ýØ┤ Û┤Çý░░ÙÉÿÙèö Û▓¢ýÜ░Ùèö 50% ýØ┤ÝòÿýØ© Û▓âý£╝Ùí£ ýòîÙáñýºÇÛ│á ý×êÙïñ[3]. Ùé┤ýï£Û▓¢ý┤êýØîÝîîÙèö Ùï¿ý©Áý┤¼ýÿüýùÉýä£ Û┤Çý░░ÝòÿÛ©░ ýû┤ÙáñýÜ┤ Ùé¡ýóà Ùé┤ Û▓®Ù▓¢, Ù▓¢ý×¼ýä▒ Û▓░ýáê, Ùé¡ýóàÙ▓¢ýØÿ ÝÿòÝâ£ÙÑ╝ Ù│┤Ùïñ ýä©Ù░ÇÝòÿÛ▓î Û┤Çý░░Ýòá ýêÿ ý×êÙïñ. Ýò£ ÙïñÛ©░Û┤Ç ýù░ÛÁ¼ýùÉ Ùö░ÙÑ┤Ù®┤ Ùé┤ýï£Û▓¢ý┤êýØîÝîîÙí£ Ù╣äýóàýûæýä▒ Ùé¡ýóàÛ│╝ ýóàýûæýä▒ Ùé¡ýóàýØä Û░ÉÙ│äÝòá ýêÿ ý×êÙèö ýáòÝÖòÙÅäÙèö 40-93%Ùí£ ÙïñýûæÝòÿýÿÇÙïñ[4]. Ùé¡ýóà Ù│æÙ│ÇýØÿ Û░ÉÙ│äýØ┤ ýë¢ýºÇ ýòèýØä ÙòîÙèö Ùé┤ýï£Û▓¢ý┤êýØîÝîîÙÑ╝ ýØ┤ýÜ®Ýò£ Ùé¡ýòí ý▓£ý×ÉÙí£ Ùé¡ýòíýØÿ ý£íýòêýáü ýåîÛ▓¼, ýâØÝÖöÝòÖýáü ÙÂäýäØ, ýáÉÙÅä Û▓Çýé¼, ýóàýûæ Ýæ£ýºÇý×É Û▓Çýé¼, ýä©Ýż Û▓Çýé¼ Ùô▒ý£╝Ùí£ Û░ÉÙ│äýØä ýï£ÙÅäÝòá ýêÿ ý×êÙïñ. ýÀîý×Ñ Ùé¡ýóà ýòíýùÉÙèö ýä©ÝżýêÿÛ░Ç ýáüýû┤ýä£ ýºäÙï¿ýØ┤ ýû┤ÙáñýÜ┤ Ùï¿ýáÉýØ┤ ý×êÙïñ. Ùé¡ýòíýØÿ ý▓£ý×ÉýòíýùÉýä£ Û░Çýä▒Ùé¡Û│╝ ýáÉýòíýä▒ Ùé¡ýóàýØÿ Û░ÉÙ│äýØÇ ýáÉýòíýåîýù╝ýâëýØ┤Ùéÿ ýáÉÙÅäýØÿ ý©íýáòýùÉýä£ ýûæýä▒ýØ┤ ÙéÿýÿñÙ®┤ ýáÉýòíýä▒ Ùé¡ýóàýä▒ ýóàýûæý£╝Ùí£ ýºäÙï¿Ýòá ýêÿ ý×êÙïñ. Û░Çýä▒Ùé¡ýóàýùÉýä£Ùèö ýù╝ýªØ ýä©ÝżÛ░Ç ý×êý£╝Ùéÿ ýâüÝö╝ýä©ÝżÙèö Ù│┤ýØ┤ýºÇ ýòèÛ│á ýáÉýòíÛ│╝ ýáÉÙÅäÙÅä ýùåý£╝Ù®░ Ùé¡ýòíýØÿ ýòäÙ░ÇÙØ╝ýá£ýÖÇ Ùª¼ÝîîýᣠÙåìÙÅäÛ░Ç ÙåÆÙïñ.
Û░Çýä▒Ùé¡ýóà Ù░░ýòíýêáýØÿ ýáüýØæýªØ
Û│╝Û▒░ýùÉÙèö Û░Çýä▒Ùé¡ýóà Ù░░ýòíýêáýØÿ ýáüýØæýªØýØä ýªØýâüýùÉ ýâüÛ┤ÇýùåýØ┤ 6ýú╝ ýØ┤ýâü ýºÇýåìÙÉÿÛ▒░Ùéÿ 6 cm ýØ┤ýâüýØ© Û░Çýä▒Ùé¡ýóàý£╝Ùí£ ýØ©ýïØÝòÿýÿÇÙïñ. ÛÀ©Ùƒ¼Ùéÿ Û░Çýä▒Ùé¡ýóàýØä ý×ÑÛ©░Û░ä ýÂöýáüÛ┤Çý░░Ýò£ ýù░ÛÁ¼ýùÉ Ùö░ÙÑ┤Ù®┤ 86%ýùÉýä£ ý×ÉÙ░£ýáü ýåîýïñýØ┤ ý×êýùêÛ│á Ýò®Ù│æýªØ Ù░£ýâØÙÑáýØÇ 3-9%ýØ┤Ù»ÇÙí£ ý×ÑÛ©░Û░ä Û┤Çý░░ýØ┤ ýòêýáäÝòÿÛ│á ÝÜ¿Û│╝ýáüýØ┤ýùêÙïñ[5]. ÙÿÉÝò£ Ùé¡ýóàýØÿ Ýü¼Û©░Û░Ç Û░Çýä▒Ùé¡ýóàýØÿ Ýò®Ù│æýªØ Ù░£ýâØýùÉ ýñæÙîÇÝò£ ýÿüÝûÑýØä ýú╝ýºÇ ýòèýòÿÙïñ[5,6]. Ùö░ÙØ╝ýä£ Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØ┤ ÝòäýÜöÝò£ ýáüýØæýªØýØÇ Û░Çýä▒Ùé¡ýóàý£╝Ùí£ ýØ©Ýò┤ Ù│ÁÝåÁýØ┤ Ù░£ýâØÝòÿÙèö Û▓¢ýÜ░, Û░Çýä▒Ùé¡ýóàýØÿ Ýü¼Û©░Û░Ç ýáÉýáÉ ý╗ñýºê Ùòî, Û░Éýù╝ýä▒ Û░Çýä▒Ùé¡ýóà, Û░Çýä▒Ùé¡ýóà Ùé┤ ý£Ýÿê, Û░Çýä▒Ùé¡ýóàýùÉ ýØÿÝò£ ý×ÑýØ┤Ùéÿ ý┤ØÙï┤Û┤ÇýØÿ ÝÅÉýçäÛ░Ç ý×êÙèö Û▓¢ýÜ░ýØ┤Ùïñ.
Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØÿ Ù░®Ù▓ò
Û░Çýä▒Ùé¡ýóàýØÇ Û▓¢ý£áÙæÉ(transpapillary)ýÖÇ Û▓¢Ù▓¢(transmural) Û▓¢Ùí£ÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ Ù░░ýòíÝòá ýêÿ ý×êÙïñ. ýû┤Ùûñ Û▓¢Ùí£ÙÑ╝ ýØ┤ýÜ®Ýòá Û▓âýØ©ýºÇÙèö Û░Çýä▒Ùé¡ýóàýØÿ Ýü¼Û©░, ý£ä ÙÿÉÙèö ýï¡ýØ┤ýºÇý×ÑÛ│╝ýØÿ ýáæÛÀ╝ ýáòÙÅä, ÛÀ©Ùª¼Û│á ýÀîÛ┤ÇÛ│╝ Û░Çýä▒Ùé¡ýØÿ ýù░Û▓░ ý£áÙ¼┤ýùÉ Ùö░ÙØ╝ Û▓░ýáòÙÉ£Ùïñ. Ùé┤ýï£Û▓¢ýáü Û▓¢Ù▓¢ýáü Ù░░ýòíýêáýØä ýï£ÝûëÝòÿÛ©░ ýáä ÙïñýØîÛ│╝ Û░ÖýØÇ ýáÉýØä ÝÅëÛ░ÇÝòÿýù¼ýò╝ Ýò£Ùïñ. ý▓½ýº©, ýóàýûæýä▒ Ùé¡ýóàÛ│╝ Û░ÉÙ│äýØ┤ ÝòäýÜöÝòÿÙïñ. Ùæÿýº©, Û░Çýä▒Ùé¡ýóàýØ┤ ý£ä ÙÿÉÙèö ýï¡ýØ┤ýºÇý×ÑýØä ýÖ©ÙÂÇýùÉýä£ ýòòÙ░òÝòÿÙèöýºÇ ÙÿÉÙèö ýú╝ý£äýùÉ ÝÿêÛ┤ÇýØ┤ ýí┤ý×¼ÝòÿÙèöýºÇÙÑ╝ ÝÅëÛ░ÇÝò┤ýò╝ Ýò£Ùïñ. ýàïýº©, Û░Çýä▒Ùé¡ýóà Ùé┤ýùÉ Û│áÝÿòýØÿ ýí░ýºüÝîîÝÄ©ýØ┤ Ù¬¿ýù¼ ý×êÙèö ýºÇÙÅä ÝÅëÛ░ÇÝò┤ýò╝ Ýò£Ùïñ. ÙäÀýº©, Û░Çýä▒Ùé¡ýóàýØ┤ ýÀîý×Ñýòö, ý×ÉÛ░ÇÙ®┤ýù¡ýä▒ ýÀîý×Ñýù╝, ÛÀ©Ùª¼Û│á ýÀîý×ÑýØÿ ýáÉýòíÙï┤Û┤Çýóà Ùô▒ýùÉ ýØÿÝò£ ýÀîý×Ñýù╝ý£╝Ùí£ Ù░£ýâØÝòÿýÿÇÙèöýºÇÙÅä Û│áÙáñÝò┤ýò╝ Ýò£Ùïñ[7].
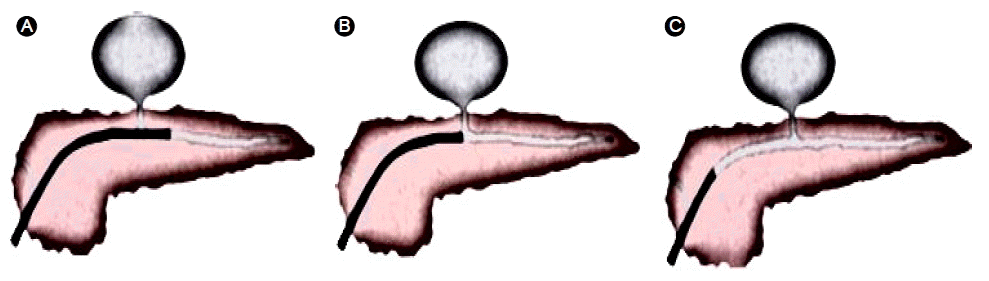
Û▓¢ý£áÙæÉýáü Ù░░ýòíýêáýØÇ ÝöîÙØ╝ýèñÝï▒ Ù░░ýòíÛ┤ÇýØä ýÀîÛ┤ÇýùÉ ýé¢ý×àÝòÿýù¼ Ù░░ýòíÝòÿÙèö Ù░®Ù▓òý£╝Ùí£ Û░Çýä▒Ùé¡ýóàýØ┤ ýú╝ýÀîÛ┤ÇÛ│╝ ýù░Û▓░ýØ┤ ÙÉÿýû┤ ý×êýØäÙòî ýé¼ýÜ®ÙÉá ýêÿ ý×êÙïñ. ÙÿÉÝò£ Û░Çýä▒Ùé¡ýØ┤ ý£äý×ÑÛ┤Çý£╝Ùí£ÙÂÇÝä░ 1 cm ýØ┤ýâü Ùû¿ýû┤ýá© ý×êÛ▒░Ùéÿ Û▓¢Ù▓¢ýáü Ù░®Ù▓òýØ┤ Ù╣äýáüýØæýªØýØ┤ ÙÉÿÙèö Û▓¢ýÜ░ýùÉÙÅä ýØ┤ýÜ®ÙÉá ýêÿ ý×êÙïñ. ýØ┤ Ù░®Ù▓òýØÇ Û©ëýä▒Ù│┤ÙïñÙèö ýÀîÛ┤ÇýùÉ Ù│æÙ│ÇýØ┤ ý┤êÙ×ÿÙÉÿÙèö Ùºîýä▒ýÀîý×Ñýù╝Û│╝ ýù░Û┤ÇÙÉ£ Û░Çýä▒Ùé¡ýóàýùÉýä£ ÙºÄýØ┤ ýï£ÝûëÝò£Ùïñ. Ù░░ýòíÛ┤ÇýØä Û░Çýä▒Ùé¡ýóà Ùé┤Ùí£ ýºüýáæ ýé¢ý×àÝòÿÙèö Ù░®Ù▓òÛ│╝ ýÀîÛ┤Ç Ùêäý£ýºÇýáÉýØä Û░ÇÙí£ýºêÙƒ¼ ýé¢ý×àÝòÿÙèö Ù░®Ù▓òýØ┤ ý×êÙïñ. ýÁ£ÛÀ╝ ýù░ÛÁ¼Û▓░Û│╝ýùÉ Ùö░ÙÑ┤Ù®┤ ýÀîÛ┤ÇýùÉýä£ Ùêäý£ÙÉÿÙèö ÙÂÇý£äÙÑ╝ Û░ÇÙí£ýºÇÙÑ┤Ùèö Ù░®Ù▓òýØ┤ Û░Çý×Ñ ÝÜ¿Û│╝ýáüýØ┤Ùïñ(Fig. 1) [8]. Û▓¢ý£áÙæÉýáü Ù░░ýòíýêáýØÇ Û▓¢Ù▓¢ýáü Ù░░ýòíýêáýùÉýä£ Ù░£ýâØÝòá ýêÿ ý×êÙèö ý£ÝÿêÛ│╝ ý▓£Û│ÁýØä Ýö╝Ýòá ýêÿ ý×êÙèö ý×ÑýáÉýØ┤ ý×êýºÇÙºî Ù░░ýòíÛ┤ÇýùÉ ýØÿÝò£ ýáòýâü ýÀîÛ┤ÇýØÿ ýåÉýâüýØä ý£áÙ░£ÙÉÿÛ▒░Ùéÿ Û░Çýä▒Ùé¡ ýåîýïñÙÑáýØ┤ Ùé«ýØÇ Ùï¿ýáÉýØ┤ ý×êÙïñ.
Û▓¢Ù▓¢ýáü Ù░░ýòíýêáýØÇ Ùé┤ýï£Û▓¢ý┤êýØîÝîî ý£áÙÅäÝòÿ Û▓¢Ù▓¢Ù░░ýòíýêá(EUSguided transmural drainage, ETD)Û│╝ EUS ý£áÙÅä ýùåýØ┤ ýï£ÝûëÝòÿÙèö Û▓¢Ù▓¢Ù░░ýòíýêá(non-EUS-guided transmural drainage, NETD)Ùí£ ÛÁ¼ÙÂäÝòá ýêÿ ý×êÙïñ. NETDÙèö ý£äÙéÿ ýï¡ýØ┤ýºÇý×ÑýùÉýä£ Û░Çý×Ñ ý£ÁÛ©░ÙÉ£(bulging) ÙÂÇý£äÙÑ╝ Ùº╣Ù¬® ý▓£ý×É(blind puncture)Ýòÿýù¼ Ù░░ýòíÝòÿÙèö Ù░®Ù▓òý£╝Ùí£ ý▓£ý×ÉÙÂÇý£äýØÿ ÝÿêÛ┤ÇýØä Ù│╝ ýêÿ ýùåýû┤ ý£ÝÿêýØÿ ý£äÝùÿýØ┤ Ýü¼Ùïñ. Ù░ÿÙ®┤ýùÉ ETDÙèö ý┤êýØîÝîîÙí£ ý▓£ý×É ÙÂÇý£äýØÿ ýú╝ý£ä ÛÁ¼ýí░Ù¼╝Û│╝ Ù¬®Ýæ£ ÙÂÇý£äÙÑ╝ ýïñýï£Û░äý£╝Ùí£ Û┤Çý░░ÝòÿÙ®┤ýä£ ý▓£ý×ÉÙÑ╝ ÝòÿÛ©░ ÙòîÙ¼©ýùÉ ýú╝ý£ä ý×ÑÛ©░ýØÿ ýåÉýâüýØä ýÿêÙ░®Ýòá ýêÿ ý×êÛ│á Ùé┤ýï£Û▓¢ý┤êýØîÝîîýØÿ ÙÅäÝöîÙƒ¼ Û©░ÙèÑýØ┤ ý×êýû┤ Ù¬®Ýæ£Ù¼╝Û│╝ ý£äý×Ñ ýé¼ýØ┤ýùÉ ýí┤ý×¼ÝòÿÙèö ÝÿêÛ┤ÇýØä ÝÖòýØ©Ýòÿýù¼ ÝÿêÛ┤Ç ýåÉýâüýØä Ýö╝Ýòá ýêÿ ý×êÙïñ. ÙÿÉÝò£ Ùé┤ýï£Û▓¢ýùÉýä£ ý£ÁÛ©░Û░Ç ýòêÙÉ£ ýòíý▓┤ Û│áý×äýØ┤Ùéÿ Ùé¡ýóàÙÅä ý┤êýØîÝîîÙí£ ýïñýï£Û░äý£╝Ùí£ Û┤Çý░░ÝòÿÙ®┤ýä£ ýòêýáäÝòÿÛ▓î ý▓£ý×ÉÝòá ýêÿ ý×êÙïñÙèö ý×ÑýáÉýØ┤ ý×êÙïñ.
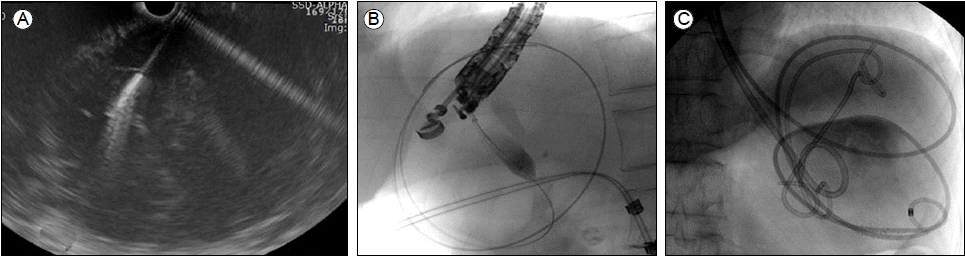
Ùé┤ýï£Û▓¢ý┤êýØîÝîîÙÑ╝ ýØ┤ýÜ®ÝòÿÙèö Û▓¢Ù▓¢ýáü Ù░░ýòíÙ▓òýØÇ ýäáÝÿò Ù░░ýù┤ Ùé┤ýï£Û▓¢ý┤êýØîÝîîÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ Û░Çýä▒ Ùé¡ýóàýØ┤Ùéÿ Ùåìýûæ ÙÂÇý£äÙÑ╝ ý░¥ýØÇ ÙïñýØî Ùé¡ýóàÛ│╝ ý£äý×ÑÙ▓¢ýØ┤ ýÁ£Ùï¿Û▒░Ùª¼ýØ┤Ù®┤ýä£ ÝÿêÛ┤ÇýØ┤ ýùåÙèö ÙÂÇý£äÙÑ╝ ýäáýáòÝòÿýù¼ 19-gauge ýä©ý╣¿ÝØíýØ©ýÜ®(Fine needle aspiration, FNA) ýú╝ýé¼ý╣¿ýØä ýØ┤ýÜ®Ýòÿýù¼ Ùé¡ýØä ý▓£ý×ÉÝò£Ùïñ(Fig. 2). ÙïñýØîý£╝Ùí£ ýú╝ýé¼ý╣¿ Ùé┤Ùí£ ý£áÙÅäý▓áýäáýØä ýé¢ý×àÝòÿÛ│á ýØ┤ ý▓áýé¼ÙÑ╝ Ùö░ÙØ╝ýä£ cystostomeýØ┤Ùéÿ 6Fr bougieÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ ý▓£ý×ÉÙÂÇý£äÙÑ╝ ÝÖòý×ÑÝò£Ùïñ. ýØ┤Ýøä 8-10 mm balloonýØä ÝåÁÛ│╝ýï£ý╝£ ÝÖòý×ÑÝò£ Ýøä 2-3Û░£ýØÿ double pigtail catheterÙéÿ Ù╣äÙé¡Ù░░ýòíÛ┤Ç(nasocystic catheter)ÙÑ╝ ýé¢ý×àÝò£Ùïñ. Ùé¡ýóà Ùé┤ýùÉ Û┤┤ýé¼ÙÉ£ Ù¼╝ýºêýØ┤Ùéÿ Û│áÙªäýØ┤ ÙºÄýØ┤ ý×êýØä ÙòîÙèö nasocystic catheterÙÑ╝ ÝåÁÝòÿýù¼ ýâØÙª¼ýïØýù╝ýêÿÙí£ ýä©ý▓ÖÛ│╝ Ù░░ýòíýØ┤ ÝòäýÜöÙí£ Ýòá ýêÿ ý×êÙïñ.
Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØÿ ý╣ÿÙúî ýä▒ýáüÛ│╝ Ýò®Ù│æýªØ
Û░Çýä▒ Ùé¡ýóàÛ│╝ ýÀîý×Ñ ÙåìýûæýØÿ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúî ýä▒ýáüýØÇ 91-100%Ùí£ ÙºñýÜ░ ÙåÆÛ▓î Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[9]. Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØÇ Û░£Ù│ÁýêÿýêáÙ│┤ÙïñÙèö Ùì£ ý╣¿ýèÁýáüýØ┤Û│á ýáäýïáÙºêýÀ¿Û░Ç ÝòäýÜö ýùåÙïñÙèö ý×ÑýáÉýØ┤ ý×êÙïñ. ÙÿÉÝò£ ýï£ýêáÙí£ ýØ©Ýò£ Ýò®Ù│æýªØ Ù░£ýâØÙÑáýØ┤ Ùé«Û│á ÝÜîÙ│ÁýØ┤ Ù╣áÙÑ┤Ù®░ Ù╣äýÜ®ýØ┤ ýáÇÙá┤ÝòÿÙïñ[10,11]. Û▓¢Ýö╝ýáü Ù░░ýòíýêáýØÇ Ù╣äý╣¿ýèÁýáüýØ© ýï£ýêáýØ┤ýºÇÙºî Ýö╝ÙÂÇ Ù░ûý£╝Ùí£ Ù░░ýòíÛ┤ÇýØ┤ Ùà©ý£ÙÉÿÛ│á Ýö╝ÙÂÇ-ýÀîÙú¿ Ýÿòýä▒ Ù╣êÙÅäÛ░Ç 11-39%Ùí£ ÙåÆýØÇ Ùï¿ýáÉýØ┤ ý×êÙïñ[12,13]. Ù░ÿÙ®┤ýùÉ Ùé┤ýï£Û▓¢ýØä ýØ┤ýÜ®Ýò£ Û▓¢Ù▓¢ýáü ý╣ÿÙúîÙèö Û▓¢Ýö╝ýáü Ù░░ýòíýêáýùÉýä£ Ù░£ýâØÝòá ýêÿ ý×êÙèö ÛÁ¡ýåî Ýò®Ù│æýªØÙôñ, ýªë ý£Ýÿê, 2ý░¿ Û░Éýù╝, ý×ÑÛ©░Û░ä Ù░░ýòíý£╝Ùí£ ýØ©Ýò£ ýÀî-Ýö╝ÙÂÇ ÙêäÛ│ÁýØä Ýö╝Ýòá ýêÿÙÅä ý×êÙïñ. Û▓¢Ýö╝ýáü Ù░░ýòíýêáýØÇ Ùé┤ýï£Û▓¢ýáü ýáæÛÀ╝ýØ┤ ýû┤ÙáñýÜ┤ ÙÂÇý£äýùÉ ýòíý▓┤Û│áý×äýØ┤ ý×êÛ▒░Ùéÿ ýòíý▓┤Û│áý×äýØÿ ÙºëýØ┤ ýòäýºü Ùì£ ýä▒ýêÖÙÉÿýùêýØä Ùòî Ù│┤ýí░ýáüý£╝Ùí£ ýØ┤ýÜ®ÙÉá ýêÿ ý×êÙïñ.
ETDýÖÇ NETDÙÑ╝ ÝøäÝûÑýáüý£╝Ùí£ Ù╣äÛÁÉÝò£ Û│╝Û▒░ ýù░ÛÁ¼ýùÉýä£Ùèö EUSý£áÙÅä ý£áÙ¼┤ýùÉ ýâüÛ┤ÇýùåýØ┤ ýä▒Û│ÁÙÑáÛ│╝ Ýò®Ù│æýªØýØÿ Ù░£ýâØÙÑáýØÇ ý░¿ýØ┤Û░Ç ýùåÙïñÙèö Ù│┤Û│áÙÅä ý×êýùêÙïñ[14]. ýØ┤ ýù░ÛÁ¼Ùèö ýÖ©ÙÂÇ ýòòÙ░òýØ┤ Û┤Çý░░ÙÉÿýºÇ ýòèÙèö Û▓¢ýÜ░ýùÉÙèö Ùé┤ýï£Û▓¢ý┤êýØîÝîî ý£áÙÅäÝòÿýùÉ ýï£ýêáýØä ýï£ÝûëÝòÿýù¼ ÙîÇýâü ÝÖÿý×ÉÛÁ░ýØÿ ýäáÝâØ ý╣ÿýÜ░ý╣¿(bias)ýØ┤ Ù¼©ýá£ýáÉý£╝Ùí£ ýºÇýáüÙÉÿýùêÙïñ. ÝòÿýºÇÙºî ýÁ£ÛÀ╝ýØÿ ýáäÝûÑýáü ýù░ÛÁ¼ÙôñýùÉýä£Ùèö ETDýØÿ ýï£ýêá ýä▒Û│ÁÙÑáýØ┤ NETDýùÉ Ù╣äÝò┤ýä£ Ùìö ÙåÆýòÿÙïñ. Varadarajulu Ùô▒[15]ýØÿ ýù░ÛÁ¼ýùÉ Ùö░ÙÑ┤Ù®┤ Û░Çýä▒Ùé¡ýóà Ù░░ýòíýêáýØÿ ýï£ýêá ýä▒Û│ÁÙÑáýØ┤ NETDÙèö 33%, ETD 100%Ùí£ Ýü░ ý░¿ýØ┤ÙÑ╝ Ù│┤ýÿÇÙïñ. ÙïñÙÑ© ýáäÝûÑýáü ýù░ÛÁ¼ýùÉýä£ÙÅä NETDýÖÇ ETDýØÿ ýä▒Û│ÁÙÑáýØ┤ Û░üÛ░ü 72%ýÖÇ 94%Ùí£ ýØÿÙ»©ý×êÙèö ý░¿ýØ┤Û░Ç ý×êýùêÛ│á, Ù╣äÙíØ Ýò®Ù│æýªØ Ù░£ýâØý£¿ýØ┤ ÙæÉ ÛÁ░ Û░äýùÉ ÝåÁÛ│äýáü ý░¿ýØ┤Ùèö ýùåýùêý£╝Ùéÿ NETDÛÁ░ýùÉýä£Ùèö ýí░Û©ê ÙåÆýØÇ Û▓¢ÝûÑýØä Ù│┤ýÿÇÙïñ[16].
Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØÿ Ýò®Ù│æýªØý£╝Ùí£ Û░Éýù╝(0-8%), ý£Ýÿê(0-9%), ý▓£Û│Á(0-5%), Û░Çýä▒Ùé¡ýóàýØÿ ý×¼Ù░£(6-14%)ýØ┤ Ù░£ýâØÝòá ýêÿ ý×êÙïñ[17-19]. Û░Çý×Ñ Ù╣êÙÅäÛ░Ç ÙåÆýØÇ Û▓âýØÇ Û░Éýù╝ýØ┤Û│á ýØ┤Ùèö Ù░░ýòí ýèñÝàÉÝè©ýØÿ ÝÅÉýçäÙéÿ ýØ┤ÝâêÙí£ ýØ©Ýò£ ÙÂêýÖäýáä Ù░░ýòíý£╝Ùí£ Û░Çýä▒Ùé¡ýóàýØÿ ýÿñýù╝ýùÉ ýØÿÝò┤ ýú╝Ùí£ Ù░£ýâØÝò£Ùïñ. Ùé┤ýï£Û▓¢ý┤êýØîÝîî ý£áÙÅäÝòÿ Ù░░ýòíýêáýùÉ ýé¼ýÜ®Ýòá ýêÿ ý×êÙèö ÝöîÙÑ┤ýèñÝï▒ Ù░░ýòíÛ┤ÇýØÇ 7-8.5Fr ÛÁ¼Û▓¢ÙºîýØä ýé¼ýÜ®Ýòá ýêÿ ý×êýû┤ Ùé¡ýóà Ùé┤ ýí░ýºüÝîîÝÄ©ýØ┤ ÙºÄÛ▒░Ùéÿ Û│áÙªäýØ┤ ý×êýØä Û▓¢ýÜ░ýùÉÙèö ýÖäýáäÙ░░ýòíýùÉ Ýò£Û│äÛ░Ç ý×êýû┤ Ù╣äÙé¡ Ù░░ýòíÛ┤Ç(nasocystic catheter)ÙÑ╝ ýé¢ý×àÝò┤ýä£ ýú╝Û©░ýáüýØ© ýä©ý▓ÖýØ┤ ÝòäýÜöÝòÿÙïñ. ýÁ£ÛÀ╝ýùÉÙèö ýØ┤ÙÑ╝ ÛÀ╣Ù│ÁÝòÿÛ│áý×É ÝöîÙØ╝ýèñÝï▒Û┤ÇÙ│┤Ùïñ ýºüÛ▓¢ýØ┤ Ýü░ ýÖäýáäÝö╝Ù│Á Û©êýåìÛ┤Ç(Fully corvered self-expanding metal stent)ýØä Û░Çýä▒Ùé¡ýùÉ ýé¢ý×àÝòÿýù¼ Ù░░ýòíÝòÿÙèö Ù│┤Û│áÙôñÙÅä ý×êÙïñ[20,21]. Penn Ùô▒[20]ýØÇ ýØ┤ Ù░®Ù▓òý£╝Ùí£ 100%ýØÿ Ù░░ýòí ýä▒Û│ÁÙÑáÛ│╝ 85%ýØÿ Û░Çýä▒Ùé¡ýóàýØÿ ýåîýïñÙÑáýØä Ù│┤Û│áÝòÿýÿÇÙïñ. Ù░░ýòíÛ┤Ç ýØ┤ÝâêýØä ÙºëÙèö ýòäÙá╣(dumbbell) ÝÿòÝâ£ýØÿ Û©êýåìÛ┤ÇýØä Û░Çýä▒Ùé¡ýóàýùÉ ýáüýÜ®Ýòÿýù¼ ÝÜ¿Û│╝ýáüý£╝Ùí£ Ù░░ýòíÝòÿýÿÇÙïñÙèö Ù│┤Û│áÙÅä ý×êÙïñ[22].
ý£ÝÿêýØÇ ÝÖÿý×ÉýØÿ ýé¼ÙºØýØä ý┤êÙ×ÿÝòá ýêÿ ý×êÙèö Ýò®Ù│æýªØýØ┤Ù»ÇÙí£ ýú╝ýØÿÛ░Ç ÝòäýÜöÝòÿÙïñ. Ýè╣Ý×ê ý£äÙèö ÝÿêÛ┤ÇýØ┤ ÝÆìÙÂÇÝòÿÛ▓î Ù░£Ùï¼ÙÉÿýû┤ ý×êýû┤ Û▓¢Ù▓¢ýáü Ù░░ýòíýêáýØä ýï£ÝûëÝòÿÙ®┤ ý£ÝÿêýØÿ ý£äÝùÿýä▒ýØ┤ ÙåÆýºÇÙºî EUS ý£áÙÅäÝòÿýùÉ ÙÅäÝöîÙƒ¼Ùí£ ÝÿêÛ┤ÇýØä ÝÖòýØ©ÝòÿÙ®┤ýä£ ý▓£ý×ÉÝòÿÙ®┤ ý£ÝÿêýØÿ ý£äÝùÿýä▒ýØä Û░Éýåîýï£Ýé¼ ýêÿ ý×êÙïñ. ÙÿÉÝò£ ýï£ýêá ýáä Ù│ÁÙÂÇ CTýùÉýä£ Û░Çýä▒ÙÅÖÙºÑÙÑÿÛ░Ç ý×êÙèöýºÇ Ù░ÿÙô£ýï£ ÝÖòýØ©Ýòÿýù¼ ÙîÇÙƒëý£ÝÿêýØä ýÿêÙ░®Ýòÿýù¼ýò╝ Ýò£Ùïñ. ý▓£Û│ÁýØä ýÁ£ýåîÝÖöýï£ÝéñÛ©░ ý£äÝò┤ýä£Ùèö Ù│æÙ│ÇýØÿ Ùé¡Ù▓¢ýØ┤ ý×ÿ ýä▒ýêÖÙÉÿýû┤ ý×êýû┤ýò╝ ÝòÿÛ│á Û░Çýä▒Ùé¡ýóàÛ│╝ ý×ÑÙ▓¢ ýé¼ýØ┤Û░Ç 10 mm Ù»©ÙºîýùÉýä£ ýï£ýêáýØ┤ ýï£ÝûëÙÉÿýû┤ýò╝ Ýò£Ùïñ.
Û░Éýù╝ýä▒ ýÀîý×Ñ ÛÂñýé¼(Infected pancreatic necrosis)
Û░Éýù╝ýä▒ ýÀîý×Ñ Û┤┤ýé¼ ýºäÙï¿
ýÀîý×ÑÛ┤┤ýé¼Ùèö ýÀîý×Ñ ýïñýºêýØ┤ ÝÜîýâØ ÙÂêÛ░ÇÙèÑÝòÿÛ▓î ýáäÙ░ÿýáü ÙÿÉÙèö ÛÁ¡ýåîýáüý£╝Ùí£ ÝîîÛ┤┤ÙÉÿÛ│á ÙîÇÛ░£ ýÀîý×Ñýú╝ý£ä ýºÇÙ░®ýí░ýºüýØÿ Û┤┤ýé¼ýÖÇ ÙÅÖÙ░ÿÙÉ£Ùïñ(Table 1). ÛÂñýé¼ýä▒ ýÀîý×Ñýù╝ýØÿ 2/3Ùèö ÙîÇÙÂÇÙÂä Ù¼┤ÛÀáýä▒ý£╝Ùí£ ÙîÇÛ░£ Ù│┤ýí┤ýáü ý╣ÿÙúîÛ░Ç Û░ÇÙèÑÝòÿÙïñ. Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝ýùÉýä£ 2ý░¿ýáü Û░Éýù╝ýØÇ ýû┤ÙèÉ ýï£Û©░ýùÉÙÅä Ù░£ýâØÝòá ýêÿ ý×êýºÇÙºî Ù│┤ÝåÁ ýªØýâü Ù░£Ýÿä ýò¢ 2-4ýú╝ ýé¼ýØ┤ýùÉ ýú╝Ùí£ Ù░£ýâØÝò£Ùïñ. Ù│ÁÙÂÇ ýÿüýâüýùÉýä£ ýÀîý×Ñ Û┤┤ýé¼ ÙÂÇý£äýùÉ Û│ÁÛ©░ýØîýÿüýØ┤ Û┤Çý░░ÙÉÿÙ®┤ Û░òÙáÑÝòÿÛ▓î Û░Éýù╝ýØä ýØÿýï¼Ýòá ýêÿ ý×êÙïñ. Û│╝Û▒░ýùÉÙèö Û░Éýù╝ýä▒ ýÀîý×Ñ ÛÂñýé¼ýØÿ ý╣ÿÙúîÙí£ ýªëÛ░üýáüýØ© ýêÿýêáýáü Û┤┤ýé¼ýá£Û▒░ýêáýØ┤ ÝòäýÜöÝòÿýù¼ Ù│ÁÙÂÇ CT ÙÿÉÙèö ý┤êýØîÝîî ý£áÙÅäÝòÿ ýä©ý╣¿ÝØíýØ©(fine needle aspiration, FNA)ýØä ÝåÁÝò£ ÛÀáÙÅÖýáòýØ┤ ÝòäýêÿýáüýØ┤ýùêÙïñ. ÛÀ©Ùƒ¼Ùéÿ ýÁ£ÛÀ╝ýùÉÙèö Ýî¿ÝÿêýªØýØ┤ ýùåý£╝Ù®┤ Ýò¡ýâØýá£ýÖÇ Ù│┤ýí┤ýáü ý╣ÿÙúîÙºîý£╝Ùí£ÙÅä Û░Éýù╝ýä▒ ýÀîý×Ñýù╝ýØÿ ý╣ÿÙúîÙÅä Û░ÇÙèÑÝòÿÛ│á ýÁ£ýåîý╣¿ýèÁ ýñæý×¼ýï£ýêá, ýªë Ùé┤ýï£Û▓¢ýáü ÙÿÉÙèö Û▓¢Ýö╝ýáü Ù░░ýòíýêá Ùô▒ýØ┤ ýêÿýêáÙ│┤Ùïñ ýÜ░ýäáýáüý£╝Ùí£ ýï£ÝûëÙÉÿÛ│á ý×êÙïñ. Ùö░ÙØ╝ýä£ ýñæý×¼ýáü ýï£ýêáýØä ýï£ÝûëÝòá Ùòî ýä©ÛÀáÛ│╝ Û│░ÝîíýØ┤ ÛÀáýú╝ýØÿ Ù░░ýûæýØ┤ ýØ┤Ùú¿ýû┤ýºê ýêÿ ý×êýû┤ Ùï¿ýê£Ýò£ ýºäÙï¿ÙºîýØä ý£äÝò£ FNAýØÿ ÝòäýÜöýä▒ýØ┤ ýáÉý░¿ Û░ÉýåîÙÉÿÛ│á ý×êÙïñ.
Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáÛ│╝ Û┤┤ýé¼ ýá£Û▒░ýêá
Û│╝Û▒░ýùÉÙèö Û░Éýù╝ýä▒ ýÀîý×Ñ Û┤┤ýé¼ýØÿ ý╣ÿÙúîÙèö Û┤┤ýé¼ÙÉ£ ýÀîý×ÑýØ┤Ùéÿ ýÀîý×Ñ ýú╝ý£ä ýí░ýºüýØä ýá£Û▒░ÝòÿÙèö Û▓âýØ┤ Û©░Ù│©ýáüýØ© ý╣ÿÙúîÙ▓òýØ┤Û│á ýú╝Ùí£ Û░£Ù│ÁýØä ÝåÁÝò£ ýí░Û©░ ýêÿýêáýØ┤ ýï£ÝûëÙÉÿýùêÙïñ. ýù¼Ùƒ¼ Û░ÇýºÇ ýêÿýêá Ù░®Ù▓òýùÉ Ùö░ÙØ╝ýä£ ýêÿýêá Ýøä Û▓¢Û│╝Û░Ç ÙïñÙÑ┤ýºÇÙºî ýØ┤ÝÖÿý£¿ 40-89%, ýé¼ÙºØÙÑá 10-47%Ùí£ ÙåÆýòÿÙïñ[23,24]. ýØ┤Ùƒ¼Ýò£ ýí░Û©░ ýêÿýêáýØÿ ÙåÆýØÇ ýé¼ÙºØÙÑáÛ│╝ ýØ┤ÝÖÿý£¿ ÙòîÙ¼©ýùÉ ýÁ£ÙîÇÝò£ Ýò¡ýâØýá£ýÖÇ Ù│┤ýí┤ýáü ý╣ÿÙúîÙÑ╝ ýï£ÝûëÝòÿÛ│á Ýÿ©ýáäýØ┤ ýùåýØä Ùòî Ùé┤ýï£Û▓¢ýáü ÙÿÉÙèö Û▓¢Ýö╝ýáü ý╣ÿÙúîÛ░Ç ýï£ÝûëÙÉÿÛ│á ý×êÙïñ. Û░Çýä▒Ùé¡ýóàýØÿ Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáÛ│╝ Ù╣äýèÀÝòÿÛ▓î Ùé┤ýï£Û▓¢ ý┤êýØîÝîî ý£áÙÅäÝòÿýùÉ ý£äÙéÿ ýï¡ýØ┤ýºÇý×Ñ Ù▓¢ýØä ÝåÁÝòÿýù¼ Û░Éýù╝ÙÉ£ Û┤┤ýé¼ Ù│æÙ│ÇýØä ý▓£ý×ÉÝò£ Ýøä Û▓¢Ù▓¢ýáü ÝåÁÙí£ÙÑ╝ ÝÖòý×ÑÝòÿýù¼ ÝöîÙØ╝ýèñÝï▒ Ù░░ýòíÛ┤ÇÛ│╝ Ù╣äÛ░òÙ░░ýòíÛ┤ÇýØä ýé¢Û┤ÇÝòÿýù¼ Ù░░ýòíÝò£Ùïñ. ÝòäýÜöýùÉ Ùö░ÙØ╝ýä£Ùèö ÝÖòý×ÑÙÉ£ Û▓¢Ù▓¢ýáü ÝåÁÙí£ÙÑ╝ ÝåÁÝòÿýù¼ Ùé┤ýï£Û▓¢ýØä ýé¢ý×àÝò£ ÙïñýØî Û┤┤ýé¼ýá£Û▒░ýêáýØä ýï£ÝûëÝòÿÛ©░ÙÅä Ýò£Ùïñ. Û░Éýù╝ýä▒ ýÀîý×ÑÛ┤┤ýé¼ýùÉýä£ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîýùÉ Û┤ÇÝò£ 10Û░£ýØÿ Ù¼©ÝùîÙôñýØä ý▓┤Û│äýáüý£╝Ùí£ ÙÂäýäØÝò£ Ù│┤Û│áýùÉýä£ ýé¼ÙºØÙÑáýØÇ 5%, ýØ┤ÝÖÿý£¿ýØÇ 27%ýÿÇÛ│á[25], Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîýØÿ ýä▒Û│ÁÙÑáýØÇ 73-92%Ùí£ Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[11,19]. ýÁ£ÛÀ╝ Û©ëýä▒ Û┤┤ýé¼ýä▒ Û░Éýù╝ýä▒ ýÀîý×Ñýù╝ ÝÖÿý×ÉÙôñýØä ÙîÇýâüý£╝Ùí£ Ýò£ Ùé┤ýï£Û▓¢ýáü Û┤┤ýé¼ýá£Û▒░ýêáÛ│╝ ýêÿýêáýáü ý╣ÿÙúîýØÿ Ù¼┤ý×æý£ä ýáäÝûÑýáü Ù╣äÛÁÉ ýù░ÛÁ¼ýùÉýä£ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîÛ░Ç ýêÿýêáýáü ý╣ÿÙúîýùÉ Ù╣äÝò┤ýä£ ýé¼ÙºØÙÑá, ýú╝ýÜö Ýò®Ù│æýªØ Ù░£ýâØÙÑá, ýÀîÙú¿ Ýÿòýä▒ýØ┤ ýØÿÙ»© ý×êÛ▓î ýáüýùêÙïñÛ│á Ù│┤Û│áÝòÿýÿÇÙïñ[26].
Û┤┤ýé¼ýä▒ ýÀîý×Ñýù╝ ÝÖÿý×ÉýùÉýä£ ýÁ£ÙîÇÝò£ Ù│┤ýí┤ýáü ý╣ÿÙúîÙÑ╝ ÝòÿÙ®┤ýä£ ýñæý×¼ýáü ýï£ýêá ÙÿÉÙèö ýêÿýêáýáü ý╣ÿÙúîÙèö ýÀîý×Ñýù╝ Ù░£ýâØ 4-6ýú╝ ÝøäÙí£ ýÁ£ÙîÇÝò£ ýù░Û©░Ýò┤ýò╝ ýé¼ÙºØÙÑáÛ│╝ Ýò®Ù│æýªØýØä ýñäýØ╝ ýêÿ ý×êÙïñ[27,28]. ýÀîý×Ñýù╝ Ù░£ýâØ 4ýú╝Û░Ç ýºÇÙéÿÙ®┤ Û┤┤ýé¼ýí░ýºüýØ┤ ýé┤ýòäý×êÙèö ýí░ýºüý£╝Ùí£ÙÂÇÝä░ Û▓¢Û│ä ÛÁ¼ÙÂäýØ┤ ý×ÿ ÙÉÿÛ│á ýòíÝÖöÙÉÿÙ»ÇÙí£(wall-off necrosis) Ùé┤ýï£Û▓¢ýáü ýï£ýêáýØ┤Ùéÿ ýêÿýêá ýñæ ý£Ýÿê Ùô▒Û│╝ Û░ÖýØÇ Ýò®Ù│æýªØýØä ýñäýØ╝ ýêÿ ý×êÙïñ. ÙÿÉÝò£ ýé┤ýòäý×êÙèö ýí░ýºüýØÿ ýáêýá£ÙÑ╝ ýÁ£ýåîÝÖö Ýòÿýù¼ ýï£ýêá Ýøä Ùé┤ÙÂäÙ╣ä Û©░ÙèÑÛ│╝ ýÖ©ÙÂäÙ╣ä Û©░ÙèÑýØÿ ý×ÑýòáÙÑ╝ ýÿêÙ░®Ýòá ýêÿ ý×êýØä Ù┐ÉÙºî ýòäÙïêÙØ╝ ýï£ýêá Ýøä ýù╝ýªØýØä Û░Éýåîýï£Ýé¼ ýêÿ ý×êÛ│á ýâêÙí£ýÜ┤ Ùïñý×ÑÛ©░ ÙÂÇýáäÛ│╝ Û░ÖýØÇ Ýò®Ù│æýªØýØä ÙºëýØä ýêÿ ý×êÙïñ[29-31].
Ùé┤ýï£Û▓¢ýáü Ù░░ýòíÙ▓òýØÇ ýä▒Û│ÁýáüýØ© Ù░░ýòíýØä ý£äÝò┤ýä£Ùèö ÙºÄýØÇ Ý܃ýêÿýØÿ ýï£ýêáÛ│╝ ýï£Û░äýØ┤ ÝòäýÜöÝòÿÛ│á Û░ÇÙèö Ù░░ýòíÛ┤Çý£╝Ùí£ Û│áÝÿòýØÿ Û┤┤ýé¼ýí░ýºüÝîîÝÄ©(debris)ÙôñýØ┤ Ù░░ýòíÙÉÿÙèö Ùì░ ýá£Ýò£ýáÉýØ┤ ý×êýû┤ Û┤æÙ▓öý£äÝò£ Û┤┤ýé¼ÙÑ╝ ý╣ÿÙúîÝòÿÙèö Ùì░Ùèö Ýò£Û│äýáÉýØ┤ ý×êÙïñ. ýØ┤ÙÑ╝ ÛÀ╣Ù│ÁÝòÿÛ│áý×É Ýö╝Ù│ÁÙÉ£ Û©êýåìÛ┤ÇýØä ý£äÙéÿ ý×ÑÛ│╝ Û░Éýù╝ÙÉ£ Û┤┤ýé¼Ù│æÙ│Ç ýé¼ýØ┤ýùÉ ýé¢ý×àÝòÿýù¼ Ù░░ýòíýØä ýøÉÝÖ£ÝòÿÛ▓î ÝòÿÛ│á Ùé┤ýï£Û▓¢ýØ┤ Û©êýåìÛ┤ÇýØä ÝåÁÝòÿýù¼ Û┤┤ýé¼ÙÉ£ ÙÂÇý£äÙí£ ýáæÛÀ╝ýØä ýë¢Û▓î Ýòÿýù¼ Û┤┤ýé¼ýá£Û▒░ýêáýØä ýï£ÝûëÝòÿÛ©░ÙÅä Ýò£Ùïñ[32]. ÙÿÉÝò£ Ù│ÁÛ░òÛ▓¢ýØä ýØ┤ýÜ®Ýò£ Û┤┤ýé¼ýá£Û▒░ýêáýØÇ ý×æýØÇ ýâüý▓ÿÙÑ╝ ÝåÁÝòÿýù¼ Û┤æÙ▓öý£äÝòÿÛ▓î Û┤┤ýé¼ÙÂÇý£äÙÑ╝ ýá£Û▒░Ýòá ýêÿ ý×êÙèö ý×ÑýáÉýØ┤ ý×êÙïñ[33]. Û░Éýù╝ýä▒ ýÀîý×ÑÛ┤┤ýé¼ ÝÖÿý×ÉýùÉýä£ Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáÙí£ Û░Éýù╝ÙÉ£ Û┤┤ýé¼ÙÂÇý£äÙÑ╝ Ù░░ýòíÝòÿÛ│áÙÅä ý×äýâüýáüýØ© ýªØýâüÛ│╝ ýªØÝøäýØÿ Ýÿ©ýáäýØ┤ ýùåý£╝Ù®┤, ÙïñýØî Ùï¿Û│äÙí£ Ù│ÁÛ░òÛ▓¢ýØ┤Ùéÿ Ùé┤ýï£Û▓¢ýØä ýØ┤ýÜ®Ýò£ ýÁ£ýåî ý╣¿ýèÁ Û┤┤ýé¼ýá£Û▒░ýêáýØä ýÂöÛ░Çýáüý£╝Ùí£ ýï£ÝûëÝòÿÙèö Ùï¿Û│äýáü(Step-up) ýáæÛÀ╝Ù░®ýïØýØ┤ ýØ┤ýÜ®ÙÉá ýêÿ ý×êÙïñ[34].
Ùé┤ýï£Û▓¢ýØä ýØ┤ýÜ®Ýò£ Û▓¢Ù▓¢ýáü Ù░░ýòíýêáýùÉýä£ Û░Çý×Ñ Û▓¢Û│äÝò┤ýò╝ Ýòá Ýò®Ù│æýªØýØÇ ý£Ýÿê, ý▓£Û│Á, Û│ÁÛ©░ ýâëýáäýªØýØ┤Ùïñ. Ùï¿ýê£Ýò£ Û░Çýä▒Ùé¡ýóàýØÿ Û▓¢ýÜ░ýùÉÙèö ýú╝ýÜö Ýò®Ù│æýªØÙôñýØÿ Ù░£ýâØýØ┤ Ùô£Ù¼╝ýºÇÙºî Ùé┤ýï£Û▓¢ýáü Û┤┤ýé¼ýí░ýºü ýá£Û▒░ýêáýùÉýä£Ùèö 3-4%ýùÉýä£ ý▓£Û│ÁýØ┤ Ù░£ýâØÝòÿýÿÇÙïñÛ│á Ù│┤Û│áÝòÿÛ│á ý×êÙïñ[35]. ýÁ£ÙîÇÝò£ Ùé┤ýï£Û▓¢ýáü Û▓¢Ù▓¢ýáü ÝåÁÙí£ÙÑ╝ Ýÿòýä▒ÝòÿÛ©░ ý£äÝò┤ýä£ ÝÆìýäá ÝÖòý×ÑýêáýØä ýï£ÝûëÝòá ÙòîÙèö ýä£ýä£Ý×ê ÝÆìýäáýØÿ ýºüÛ▓¢ýØä ý×æýØÇ Û▓âÙÂÇÝä░ Ýü░ Û▓âý£╝Ùí£ Ù░öÛ¥©ýû┤ýò╝ ÝòÿÛ│á Û│ÁÛ©░ýØÿ ýåíÛ©░Ùèö CO2 Û░ÇýèñÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ Û│ÁÛ©░ ýâëýáäýªØýØä ýÿêÙ░®ÝòÿÙÅäÙíØ ÝòÿÛ│á Û┤┤ýé¼ÙÉ£ ýí░ýºüýØä ýá£Û▒░Ýòá ÙòîÙèö ÝÿêÛ┤ÇýØ┤ ýåÉýâüÙÉÿýºÇ ýòèÙÅäÙíØ ýú╝ýØÿÝò┤ýò╝ Ýò£Ùïñ[11]. Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáýØ┤ Ù¼©Ýùîýáüý£╝Ùí£ ýä▒Û│ÁÙÑáýØ┤ ÙåÆÛ▓î Ù│┤Û│áÙÉÿÛ│á ý×êýºÇÙºî ÙîÇÙÂÇÙÂäýØÿ Ù│┤Û│á Ù│æýøÉÙôñýØ┤ Û▓¢ÝùÿýØ┤ ÝÆìÙÂÇÝò£ Ù│æýøÉÙôñýØ┤ýùêÙïñ. Ùö░ÙØ╝ýä£ ýØ┤ ýï£ýêáýØÇ Û▓¢ÝùÿýØ┤ ÙºÄýØÇ ýáäÙ¼©ýáüýØ© ýï£ýêáý×ÉýùÉ ýØÿÝò┤ýä£ ýï£Ýûë ÙÉÿýû┤ýò╝ ÝòÿÛ│á ýØ┤ ýï£ýêáýØ┤ ýïñÝî¿ÝòÿýÿÇýØä ÙòîÙÑ╝ ÙîÇÙ╣äÝò┤ýä£ Ù│┤ýí░Ýòá ýêÿ ý×êÙèö ýÖ©Û│╝ýØÿýé¼Û░Ç ý×êÛ▒░Ùéÿ ýñæý×¼ýáü ýï£ýêáýØ┤ Û░ÇÙèÑÝò£ Ù│æýøÉýùÉýä£ ýï£ÝûëÙÉá ÝòäýÜöÛ░Ç ý×êÙïñ. Û▓¢ýÜ░ýùÉ Ùö░ÙØ╝ýä£Ùèö Ùé┤ýï£Û▓¢ ý╣ÿÙúî ýÖ©ýùÉ ýñæý×¼ýáü Ù░®ýé¼ýäáýáü ýï£ýêáÛ│╝ ýêÿýêáýáü ý╣ÿÙúîÛ░Ç Ùìö ýóïýØÇ ýäáÝâØýØ┤ ÙÉá ýêÿ ý×êÙïñ.
Ùï┤ýäØýä▒ ýÀîý×Ñýù╝
Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØÇ Ùï┤ýäØýùÉ ýØÿÝò┤ ý£áÙæÉÙÂÇýØÿ Û│ÁÝåÁÛ┤ÇýØ┤ ÙºëÝÿÇ ýÀîý×ÑýòíýØÿ Ù░░ý£ýùÉ ý×ÑýòáÛ░Ç Ù░£ýâØÝòÿÛ▒░Ùéÿ Ùï┤ÙÅäýù╝Û│╝ Û┤ÇÙá¿ÙÉ£ ýù╝ýªØýØ┤ ýÀîý×ÑýùÉÛ╣îýºÇ ýºüýáæýáüý£╝Ùí£ ýÿüÝûÑýØä Ù░£ýâØÝòÿÙ»ÇÙí£ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîÛ░Ç ÝòäýÜöÝò£ ýºêÝÖÿýØ┤Ùïñ. Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØ┤ ýØÿýï¼Ýòá ýêÿ ý×êÙèö ý×äýâüýáü ýåîÛ▓¼ýØÇ Ýÿêýòí Û▓Çýé¼ýùÉýä£ Ù╣îÙª¼Ùú¿Ù╣ê, ýòîý╣╝Ùª¼ýØ©ýé░ÙÂäÝò┤ýÜöýåî, ╬│GTP, ALT, ALT, AST ýñæýùÉ ýä© Û░£ ýØ┤ýâü ýªØÛ░ÇÙÉ£ Û▓¢ýÜ░, Ù│ÁÙÂÇ ý┤êýØîÝîîÙéÿ Ù│ÁÙÂÇ CTýùÉýä£ Ùï┤ýäØýØ┤ Ù│┤ýØ┤Û▒░Ùéÿ ý┤ØÙï┤Û┤ÇýØÿ ÝÖòý×ÑýØ┤ Û┤Çý░░ÙÉÿÙèö Û▓¢ýÜ░ýØ┤Ùïñ. Ù│ÁÙÂÇ CTýùÉýä£ ý┤ØÙï┤Û┤ÇýùÉ Ùï┤ýäØýØ┤ ýáòÝÖòÝòÿÛ▓î Û┤Çý░░ÙÉÿýºÇ ýòèýØä ÙòîÙèö ERCP ýáäýùÉ Ùìö Ù»╝Û░ÉÙÅäÛ░Ç ÙåÆýØÇ MRCPÙéÿ EUS Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòá ýêÿ ý×êÙïñ[36].
Û©ëýä▒ Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØ┤ ýØÿýï¼ÙÉá Ùòî ERCPÙÑ╝ ýï£ÝûëÝòÿÙèö ýï£Û©░ÙÑ╝ Û▓░ýáòÝòÿÙèö Û▓âýØÇ ýïñýᣠý×äýâüýùÉýä£ ýû┤ÙáñýÜ┤ Ù¼©ýá£ýØ┤Ùïñ. ýïñýá£Ùí£ ýí░Û©░ýùÉ ERCPýÖÇ ý£áÙæÉÙÂÇ ýáêÛ░£ýêáýØä ýï£ÝûëÝòÿÙèö Û▓âýØ┤ Û│╝ýù░ ýû╝ÙºêÙéÿ ýØ┤Ùí£ýÜ┤ Û░ÇýùÉ ÙîÇÝò£ Ù¼┤ý×æý£ä ÙîÇýí░ÛÁ░ ýù░ÛÁ¼(randomized controlled trial)ýùÉ ÙîÇÝò£ Ù®öÝâÇ ÙÂäýäØýùÉ Ùö░ÙÑ┤Ù®┤ Û▓¢ýªØýØÿ ýÀîý×Ñýù╝ ÛÁ░Û│╝ ýñæýªØýØÿ ýÀîý×Ñýù╝ ÛÁ░ý£╝Ùí£ ÙéÿÙêäýû┤ ÙÂäýäØ ÝòÿýÿÇýØä Ùòî ýñæýªØýØÿ ýÀîý×Ñýù╝ ÛÁ░ýùÉýä£ ýé¼ÙºØÙÑáýØÿ Û░ÉýåîÙèö Ù│┤ýØ┤ýºÇ ýòèýòÿý£╝Ùéÿ Ýò®Ù│æýªØýØÿ Ù░£ýâØýØä ýØÿÙ»© ý×êÛ▓î ýñäýÿÇÙïñ[37]. ýÁ£ÛÀ╝ýùÉ Cochrane libraryýùÉýä£ Ù░£Ýæ£Ýò£ Ù®öÝâÇ ÙÂäýäØýùÉ Ùö░ÙÑ┤Ù®┤ Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØÿ ýí░Û©░ ERCP ýï£ÝûëýùÉ ÙîÇÝò┤ Û░üÛ░üýØÿ ýä©ÙÂÇ ÛÀ©Ùú╣ý£╝Ùí£ ÙéÿÙêäýû┤ ÙÂäýäØÝòÿýÿÇýØä Ùòî ýñæýªØýØÿ ýÀîý×Ñýù╝ ÝÖÿý×ÉýùÉýä£Ùèö ýé¼ÙºØÙÑáÛ│╝ Ýò®Ù│æýªØ Ù░£ýâØÙÑáýùÉ ý░¿ýØ┤Û░Ç ýùåýùêý£╝Ùéÿ, Ùï┤ÙÅäýù╝ýØ┤ ý×êÙèö ÝÖÿý×ÉÙèö ýé¼ÙºØÙÑáÛ│╝ Ýò®Ù│æýªØýØ┤, Ùï┤ÙÅä ÝÅÉýçäÛ░Ç ý×êÙèö ÝÖÿý×ÉÙèö ÛÁ¡ýåîýáü Ýò®Ù│æýªØýØ┤ ýØÿÙ»© ý×êÛ▓î Û░ÉýåîÝòÿýÿÇÙïñ[38]. ýï£ýêá ýï£Û░äýùÉ ÙîÇÝò£ Ù╣äÛÁÉ ýù░ÛÁ¼ýùÉýä£Ùèö Ù░£ýâØ Ýøä 24-48ýï£Û░ä ýØ┤Ùé┤ýùÉ ýï£ÝûëÝò£ ÛÁ░ýùÉýä£ 48ýï£Û░ä ýØ┤ÝøäýùÉ ýï£ÝûëÝò£ ÛÁ░ýùÉ Ù╣äÝò┤ ýí░Û©░ Ýò®Ù│æýªØýØ┤ Ùé«ýòÿÛ│á ýáäÙ░ÿýáüýØ© Ýò®Ù│æýªØýØÿ Ù░£ýâØÙÅä Ùé«ýòÿÙïñ[39]. ýù¼Ùƒ¼ ÙéÿÙØ╝ýØÿ Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ ýºäÙúîýºÇý╣¿ÙôñýùÉýä£Ùèö Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØ┤ Û░òÙáÑÝ×ê ýØÿýï¼ÙÉÿÙèö ÝÖÿý×ÉÛ░Ç Ùï┤ÙÅäýù╝ýØ┤ ý×êÛ▒░Ùéÿ, Ùï┤ÙÅä ÝÅÉýçäÛ░Ç ýºÇýåìÙÉÿÙèö Û▓¢ýÜ░ ýí░Û©░ýùÉ ERCPÙÑ╝ ýï£ÝûëÝòá Û▓âýØä ýÂöý▓£Ýò£Ùïñ[28,36,40].
Û▓░ Ùíá
ýñæýªØ Û©ëýä▒ ýÀîý×Ñýù╝ýùÉýä£ Ýò®Ù│æýªØý£╝Ùí£ Û░Çýä▒Ùé¡ýóà, Ùåìýûæ, Û░Éýù╝ýä▒ ýÀîý×Ñ Û┤┤ýé¼Û░Ç Ù░£ýâØÝòá ýêÿ ý×êÙïñ. ÙîÇÙÂÇÙÂäýØÿ Û░Çýä▒Ùé¡ýóàýØÇ ý×Éýù░ýáüý£╝Ùí£ ýåîýïñÙÉÿýºÇÙºî Û░Çýä▒Ùé¡ýóàýØÿ ýóàÙîÇÙí£ ý×äýâüýáüýØ© ýªØýâüÙôñýØ┤ ý£áÙ░£ÙÉÿýû┤ Ù░░ýòíýØ┤ ÝòäýÜöÝòá ýêÿ ý×êÙïñ. ýÁ£ÛÀ╝ýùÉÙèö ýÀîý×Ñýú╝ý£ä ýêÿýòíÛ│áý×ä ÝÖÿý×ÉýùÉýä£ Ùé┤ýï£Û▓¢ý┤êýØîÝîî ý£áÙÅäÝòÿ Ù░░ýòíýêáýØ┤ ýñæýÜöÝò£ ý╣ÿÙúîÙ▓òýØ┤ ÙÉÿýùêÙïñ. ýØ┤ Ùé┤ýï£Û▓¢ý┤êýØîÝîî ý£áÙÅäÝòÿ Ù░░ýòíÙ▓òýØÇ ýêÿýêáýáü ý╣ÿÙúîÙ│┤Ùïñ Ùì£ ý╣¿ýèÁýáüýØ┤Û│á ýïñýï£Û░äý£╝Ùí£ Ù│æÙ│ÇýØä Û┤Çý░░ÝòÿÙ®┤ýä£ ýï£ýêáýØä Ýòá ýêÿ ý×êýû┤ ý£äÙéÿ ýï¡ýØ┤ýºÇý×Ñý£╝Ùí£ ÙÅîý£ÙÉÿýºÇ ýòèÙèö Ù│æÙ│ÇÙÅä ýï£ýêáÝòá ýêÿ ý×êÛ│á. ýï£ýêáÙí£ ýØ©Ýò£ ý£ÝÿêÛ│╝ ý▓£Û│ÁýØä ýñäýØ╝ ýêÿ ý×êÙïñ. ýØ┤ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîÙ▓òýØÇ Û░Çýä▒Ùé¡ýóàÛ│╝ Ùåìýûæ ÝÖÿý×ÉýùÉýä£ ý╣ÿÙúî ýä▒Û│ÁÙÑáýØ┤ 90%ýùÉ ýØ┤ÙÑ©Ùïñ. Û░Éýù╝ýä▒ ýÀîý×Ñ Û┤┤ýé¼ýùÉ ÝÖÿý×ÉýùÉýä£ ý┤êÛ©░ýùÉÙèö Ýò¡ýâØýᣠÝê¼ýù¼ýÖÇ Ù│┤ýí┤ýáü ý╣ÿÙúîÙÑ╝ Ýòÿýù¼ Û┤┤ýé¼ýá£Û▒░ýêáýØä Û░ÇÙèÑÝòÿÙ®┤ ýÁ£ÙîÇÝò£ ýºÇýù░ÝòÿÛ│á ý×äýâüýáü ýâüÝÖ®ýØ┤ ýòàÝÖöÙÉÿÛ▒░Ùéÿ Ýî¿ÝÿêýªØý£╝Ùí£ ýºäÝûëÝòÿÙèö ýåîÛ▓¼ýØ┤ Ù│┤ýØ┤Ù®┤ Û┤┤ýé¼ ÙÂÇý£äýØÿ Ù░░ýòíýêáÛ│╝ Û┤┤ýé¼ýá£Û▒░ýêáýØ┤ ýï£ÝûëÙÉá ýêÿ ý×êÙïñ. Û©ëýä▒ ýÀîý×Ñýù╝ Ù░£Ù│æ Ýøä 4-6ýú╝Û░Ç ýºÇÙéÿÙ®┤ ýáòýâü ýÀîý×ÑÛ│╝ Û┤┤ýé¼ÙÉ£ ýÀîý×ÑýØÿ Û▓¢Û│äÛÁ¼ÙÂäýØ┤ ÙÂäÙ¬àÝò┤ýºÇÛ│á Û┤┤ýé¼ ÙÂÇÙÂäýØ┤ ýòíÝÖöÙÉÿÙ»ÇÙí£ Ùé┤ýï£Û▓¢ýáü Ù░░ýòíýêáÛ│╝ Û┤┤ýé¼ýá£Û▒░ýêáýØ┤ ýÜ®ýØ┤Ýòá ýêÿ ý×êÙïñ. ýÀîý×Ñ Û┤┤ýé¼Û░Ç Û┤æÙ▓öý£äÝòÿÛ│á ýñæýªØýØÿ Û░Éýù╝ýØ┤ ÙÅÖÙ░ÿÙÉÿÙ®┤ Ùé┤ýï£Û▓¢ýáü ý╣ÿÙúîÙºîý£╝Ùí£ ýä▒Û│ÁýáüýØ© ý╣ÿÙúîÙÑ╝ Ù│┤ý×ÑÝòá ýêÿ ýùåý£╝Ù»ÇÙí£ ýÿüýâü ýñæý×¼ýï£ýêá Ùï┤Ùï╣ ýØÿýé¼Ùéÿ ýÖ©Û│╝ýØÿýÖÇ ýáüÛÀ╣ýáüýØ© ýåîÝåÁýØ┤ ÝòäýÜöÙí£ Ýò£Ùïñ. Û©ëýä▒ ýÀîý×Ñýù╝ ýñæ ýøÉýØ©ýØ┤ ÝÖòýØ©ýØ┤ ÙÉÿÙ®┤ ý╣ÿÙúîÛ░Ç Û░ÇÙèÑÝò£ Ùï┤ýäØýä▒ ýÀîý×Ñýù╝ýØ┤ Û░òÙáÑÝ×ê ýØÿýï¼ÙÉÿÙèö ÝÖÿý×ÉÛ░Ç Ùï┤ÙÅäýù╝ýØ┤ ý×êÛ▒░Ùéÿ Ùï┤ÙÅä ÝÅÉýçäÛ░Ç ýºÇýåìÙÉÿÙèö Û▓¢ýÜ░ ýí░Û©░ýùÉ ERCPÙÑ╝ ýï£ÝûëÙÉÿýû┤ýò╝ Ýò£Ùïñ.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






