클로피도그렐 저항성
Clopidogrel Resistance
Article information
Trans Abstract
Platelet activation and aggregation play important roles in ischemic event occurrences in high-risk patients with coronary artery disease (CAD). Dual antiplatelet therapy with aspirin and a P2Y12 receptor inhibitor is a key strategy to prevent major adverse cardiovascular events in CAD patients undergoing percutaneous coronary intervention (PCI) or those with acute coronary syndrome (ACS). Interindividual variability in response to aspirin and clopidogrel administration along with the influence of different polymorphisms on platelet reactivity has been demonstrated in healthy subjects or CAD patients. Reduced pharmacodynamic effect and reduced clinical efficacy of clopidogrel have been well documented in PCI or ACS patients carrying a loss-of-function allele of the CYP2C19 gene. In addition, accumulating data from numerous clinical studies underscore the importance of "high on-treatment platelet reactivity (HPR)" as a prognostic risk factor. However, the influence of HPR and/or genotype on clinical outcomes must be assessed in the context of the overall disease risk level (ACS vs. non-ACS, diabetes vs. non-diabetes, and old age), post-PCI time (early vs. late) and ethnicity. (Korean J Med 2013;85:1-9).
서 론
혈소판의 활성화 및 응고 과정은 고위험군 관상동맥 질환(coronary artery disease, CAD)을 가진 환자에서 허혈성 임상사건 발생에 중요한 역할을 한다. 혈소판의 중요한 이차 활성화 물질인 thromboxane A2 (TXA2)와 adenosine diphosphate(ADP)는 함께 혈소판 활성화에 관여하지만 ADP-P2Y12 혈소판 수용체 사이의 상호작용은 다른 활성화 물질에 대한 반응을 증가시켜 혈소판 glycoprotein IIb/IIIa 수용체의 활성화를 지속적으로 유지하는 중요한 역할을 한다[1]. 따라서 고위험군 환자에 대한 약물 치료는 아스피린(aspirin)에 의한 TXA2 생성의 억제와 P2Y12 수용체 억제제에 의한 ADPP2Y12 상호작용을 막는 것을 근간으로 하고 있다.
아스피린과 P2Y12 수용체 억제제인 클로피도그렐(clopidogrel) 복합요법은 최근까지 관상동맥 중재술(percutaneous coronary intervention, PCI)을 시행하거나 급성 관상동맥 증후군(acute coronary syndrome, ACS)을 앓은 고위험군의 CAD 치료에 널리 이용되어 왔다. 저용량의 아스피린(매일 100 mg 복용)은 혈소판의 cyclooxygenase-1 효소의 억제에 매우 효과적이지만[2], 클로피도그렐은 개개인에 따라 혈소판 억제 효과가 매우 다양하고 일부 환자에서는 여전히 혈소판 활성화가 증가되어 있어 이를 통해 CAD 환자에서 허혈성 임상사건의 발생이 증가한다는 연구 결과가 축적되면서 "클로피도그렐 저항성(clopidogrel resistance)"은 임상적으로 중요한 개념이 되고 있다[3].
이 종설에서는 한국인을 주된 대상으로 하여 "클로피도그렐 저항성"의 원인, 임상적 의의, 치료 및 향후 연구 방향 등에 대해 알아보고자 한다.
본 론
혈소판 기능검사의 의의
"클로피도그렐 저항성"이라는 개념이 임상에 도입되기까지 혈소판 기능검사의 역할은 중대하였다. 당뇨 환자를 치료할 때 혈당을 측정하거나 고혈압 환자에게 강압제 처방 후 혈압을 측정하거나 또는 심방세동 환자에게 항응고제인 와파린(warfarin)를 사용할 때 PT INR를 측정하는 것은 환자에게 치료 효과를 충분히 하면서 약제 사용과 관련된 부작용을 줄일 수 있는 중요한 역할을 한다. 마찬가지로 항혈소판제의 사용은 혈소판 응집과 관련된 허혈성 임상사건을 줄일수 있지만 동시에 이와 관련된 출혈의 위험성을 증가할 수 있기 때문에 일부 고위험군 환자에서 혈소판 기능검사에 준한 "맞춤형 치료"는 충분한 매력을 갖는다.
1960년대 초기부터 광투과성 혈소판 응집검사(light transmittance aggregometry, LTA)가 항혈소판제의 효과를 측정하기 위해 사용되었다. 이 검사는 현재도 표준검사법으로 여겨지고 있으나 검사기기 및 검사법의 표준화가 어려워 실제 임상에서 사용하기 어렵다는 단점이 있다. 1990년대 말부터 실제 임상에서 쉽고 신뢰할 만하게 사용될 수 있는 pointof-care 혈소판 기능검사법들이 나오면서 임상적 적용이 용이해졌다(Table 1). 혈소판의 P2Y12 pathway 활성도를 특정하게 측정할 수 있는 VASP-P assay (vasodilator-stimulated phosphoprotein phosphorylation assay)나, point-of-case 검사인 multiple electrode 혈소판 응집검사 또는 VerifyNow P2Y12 assay 등이 실제 임상에서 활발히 이용되고 있다. 이들 검사는 LTA 표준검사 결과와 유의한 관련성을 보여주었고[4-7] 여러 연구에서 임상사건의 발생과도 관련성을 보여주었다[3]. 그리고 보다 강력한 P2Y12 억제제가 개발되어 임상에서 이용하게 된 현 시점에서 동반될 수 있는 주요한 출혈의 위험을 예측할 수 있다는 장점을 가진다.
"High on-clopidogrel platelet reactivity (HPR)" 이란?
지금은 모든 약제에 대한 반응은 일반적으로 정규분포를 보이는 것을 상식적인 영역으로 생각되지만, 1997년 미국 식약청(Food and Drug Administration, FDA)이 클로피도그렐에 대한 임상사용을 허가한 후 약 6년이 지나서야 Gurbel 등[8]에 의해 이 약제에 대한 개개인의 반응이 다양하다는 연구가 처음 나온 것은 다소 놀라운 일이다. 이후 수많은 연구들이 초기 보고를 지지하였고[3] 한국인을 대상으로 한 혈소판 기능검사에서도 같은 연구결과를 보여주었다[4-7].
초기 연구들은 클로피도그렐 사용 전후의 혈소판 기능 결과를 비교하여 반응 정도에 따라 "클로피도그렐 저항성"을 정의하였다[8,9]. 하지만 실제 임상에서 치료 전후의 혈소판 기능검사를 시행하는 것은 어려워 이 "클로피도그렐 저항성"의 임상적 의의에 대한 평가가 쉽지 않은 상황이었다. 이후 혈소판 기능검사를 이용한 수 많은 임상결과가 축적되면서 "클로피도그렐 저항성"보다는 클로피도그렐을 사용 중 보이는 혈소판 기능이 고위험군 CAD 환자의 허혈성 임상사건 발생과 더 유의한 관련성이 있다는 것을 알게 되어 "고혈소판 활성도(high on-clopidogrel platelet reactivity, HPR)"라는 개념이 현재 임상에서 이용되고 있다(Fig. 1) [3].

Postulated therapeutic zone of platelet reactivity in Korean patients on dual antiplatelet therapy. HPR, high on-treatment platelet reactivity; LPR, low on-treatment platelet reactivity; LTA, light transmittance aggregometry; MEA, multiple electrode aggregometry; PRU, P2Y12 reaction unit; VASP, vasodilatorstimulated phosphoprotein.
"HPR"의 원인
클로피도그렐 자체는 비활성화된 prodrug이므로 생물학적 활성화 과정이 반드시 필요하다(Fig. 2A). 클로피도그렐은 대사 과정의 비효율성 때문에 항혈소판 억제능이 충분히 발현되기까지 상당한 시간이 걸리고 또한 억제 효과도 충분치 않다. 클로피도그렐의 대사 과정을 살펴보면 장에서 흡수된 약제의 대부분(-85%)이 carboxylesterase-1에 의해 가수분해되어 비활성화되고 약 15%의 약제만이 간에서 cytochrome P450(CYP)에 의해 2단계의 산화과정을 거쳐 활성화된다[10]. 2-oxo-clopidogrel을 만드는 첫 번째 산화과정에 CYP2C19, CYP1A2, 그리고 CYP2B6가 관여되고 활성화된 대사체(R130964)를 만드는 두 번째 산화과정에 CYP3A4, CYP2B6, CYP2C19, 그리고 CYP2C9이 관여된다. 산화와 관련된 여러 CYP 효소 중 CYP2C19이 가장 주된 역할을 하고, 다음으로 CYP3A4/5가 주된 역할을 하는 것으로 알려져 있다. 그리고 혈소판이 간을 통과하면서 활성화된 클로피도그렐과 이황화물(disulfide) 결합을 통해 혈소판의 P2Y12 수용체가 비가역적으로 결합하게 된다. 전체적으로 보면 복용한 클로피도그렐의 일부(5% 미만)만 혈소판 P2Y12 receptor와 결합하게 되므로 흡수 및 대사과정 중에 발생하는 약물 상호작용, 흡수 및 대사과정에 필요한 효소의 유전자 변이형 및 환자의 임상상에 따른 P2Y12 receptor density 등에 의해 다양한 영향을 통해 약물효과가 많은 차이를 보일 수 있다. 2세대 thienopyridine 제재인 클로피도그렐과 달리 3세대 thienopyridine 제재인 프라수그렐(prasugrel)은 대사과정의 효율성이 대폭 향상된 약제이다[11]. 프라수그렐은 장에서 흡수된 후 약 70%에서 carboxylesterase-2에 의해 가수분해가 진행되어 R95913으로 대사된다. 이어 간에서 CYP3A4, CYP2B6, CYP2C9 그리고 CYP2C19을 통해 한 차례의 산화과정을 거쳐 활성화된 대사체인 R138727을 만들게 된다. 따라서 프라수그렐은 클로피도그렐에 비해 15-30배에 달하는 높은 bioavailability를 보여 약물 복용 후 빠르고 강력한 항혈소판효과를 보이게 된다.
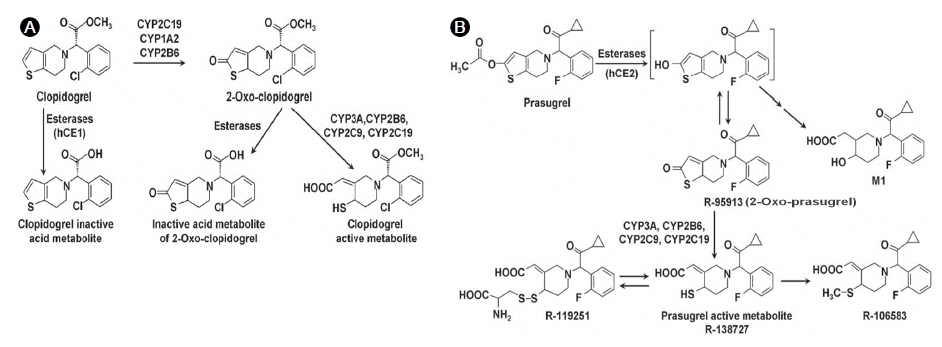
Metabolic pathway for clopidogrel (A) and prasugrel (B). CYP, cytochrome P450; hCE, human carboxylesterase.
앞에서 설명했듯이 다양한 인자들이 클로피도그렐 치료중 "HPR" 발생과 관련된 것으로 알려져 있다(Table 2) [3]. 또 클로피도그렐 효과에 영향을 미치는 여러 위험인자를 같이 가지고 있는 경우 "HPR"의 위험성과 그에 동반된 임상사건의 발생 가능성이 더 증가될 수 있으므로 고위험군 환자 치료시 유의해야 하겠다[12]. 한국인을 대상으로 한 연구결과들을 보면 여러 임상적 인자들에 비해 CYP2C19 gene의 기능 저하 대립유전자(loss-of-function allele, *2~*8)를 가지고 있는 경우 가장 유의하게 "HPR"의 발생과 관련된 것으로 알려져 있다[13-18]. 예를 들면, Kim 등[13]은 2009년 동양인 환자들을 대상으로 CYP2C19 genotype과 "HPR" 관련성에 대한 결과를 최초로 발표하였다. 이 연구에서 CYP2C19*2/*3 변이 유전자를 가진 한국인 심근경색 환자는 정상인에 비해 클로피도그렐 치료 중 2.3배 증가된 "HPR" 위험성을 가졌다. CYP2-C19*2/*3 변이 유전자의 영향은 클로피도그렐을 증량하여도(매일 150 mg 복용) 유지되어 정상 유전자를 가진 환자에 비해 CYP2C19*2/*3 변이 유전자를 가진 환자에서 "HPR" 위험성을 5.5배까지 증가시켰다[19]. 또한 한국인에서 CYP2C19*2/*3변이 유전자를 가지는 경우 PCI 후 클로피도그렐 치료 중 허혈성 임상사건의 발생 위험성이 증가되었다(위험도, 2.5-3.1배)[18,20].
"HPR"의 임상적 의의 및 "East Asian Paradox"
클로피도그렐이 가지고 있는 약력학적 그리고 약동학적 한계로 인해 생기는 "HPR" (전체 환자의 20-35% 정도)은 일부 고위험군 PCI 환자에서 허혈성 임상사건의 발생과 관련될 수 있다[3]. 혈소판 기능검사가 임상에 본격적으로 도입된 후 20,000명 이상의 환자들을 포함한 임상연구 결과는 "HPR"과 PCI 후 허혈성 임상사건 위험도의 밀접한 관련성을 보여준다[21-24]. 하지만 "HPR"의 허혈성 임상사건 발생에 대한 기여도는 환자군의 특성 및 시간에 따라 다를 수 있다.
1) "HPR"의 영향은 PCI를 시행하는 동안 또는 시행 후 초기(1-3달)에 더 두드러진다. "HPR"과 관련된 스텐트 혈전증 발생은 초기에 더욱 밀접하게 관찰되었다[25,26].
2) ADAPT-DES (Assessment of Dual AntiPlatelet Therapy with Drug-Eluting Stents) 연구[23]는 8,500명 이상의 약물용출 스텐트 시술을 받은 환자를 포함한 가장 큰 규모의 등록 연구로서 "HPR"과 스텐트 혈전증의 관련성을 1년 동안의 관찰 기간 동안 지속적으로 보여주었지만(위험도, 2.5배), 이런 관련성은 ACS 환자에서만 관찰되었다. PCI를 시행한 한국인을 대상으로 한 관찰연구[27,28]에서도 "HPR"과 임상사건의 관련성은 ACS 또는 심근경색 환자에서만 관찰되었다.
3) "HPR"와 PCI 후 발생하는 심근손상의 관련성은 당뇨 환자에서만 관찰되었다[29].
4) "East Asian Paradox" [30]: 서양인에서 25% 정도 관찰되는 CYP2C19*2/*3 변이 유전자 유병률이 동부 아시아인들(한국, 일본 및 중국)에서는 60-65% 가까이 관찰된다. 따라서 이와 관련되어 한국인에서는 클로피도그렐에 대한 반응이 서양인에 비해 상당히 감소되어 있다[13-18]. 서양인들을 대상으로 하여 확인된 "HPR" 기준을 한국인에게 그대로 적용하면 전체 환자의 40-60%가 "HPR"를 가지게 된다[4-7]. 하지만 PCI 후 한국인이 클로피도그렐 치료 중 서양인에 비해 예후가 나쁘다는 임상적 증거는 현재 없는 상황이다. 최근에 한국인을 대상으로 시행된 연구 결과를 보면[27,31-35] receiver operating characteristic (ROC) curve 분석을 통해 확인된 "HPR" 기준점은 253-289 PRU (P2Y12 reaction unit by VerifyNow assay)으로 서양인을 대상으로 확인된 208-235 PRU에 비해서는 상당히 높은 값을 보여준다(Table 3). 이 현상을 설명할 만한 명확한 근거는 현재 없는 상황이나 인종 간에 따라 다른 thrombogenecity가 주요한 원인으로 고려되고 있다[30]. 또한 한국인에서는 환자의 허혈성 및 출혈성 임상사건의 발생을 줄이기 위해 필요한 혈소판 활성도의 therapeutic zone이 서양인과는 다를 수 있다는 중요한 임상적 근거를 제시하고 있다.
"HPR"과 관련된 위험은 극복될 수 있는가?
기존에 사용하던 클로피도그렐이 가지고 있는 한계성을 개선한 여러 약제나 강화요법들이 임상에서 적용되게 되면서 "HPR"이 가지고 있는 위험성을 극복하기 위한 연구들이 최근에 진행되었다. 하지만 대규모 무작위배정 연구인 GRAVITAS(Gauging Responsiveness with A Verify Now assay-Impact on Thrombosis And Safety), ARCTIC (Assessment by a Double Randomization of a Conventional Antiplatelet Strategy versus a Monitoring-guided Strategy for Drug-Eluting Stent Implantation and of Treatment Interruption versus Continuation One Year after Stenting), 그리고 TRIGGER-PCI (Testing Platelet Reactivity in Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel)[36-38] 등은 모두 "HPR"이 있는 환자에서 강화요법의 임상적 효과를 규명하는 데 실패하였다. 세 연구 모두 급성 심근경색 환자의 비율이 상대적으로 낮아 임상사건 발생의 위험이 낮은 환자를 포함하였고 GRAVITAS와 ARCTIC 연구는 상대적인 항혈소판 효과가 적은 클로피도그렐 용량 강화요법을 사용하였고 그리고 ARCTIC 연구에서는 많은 경우에 연구지침을 어겼다는 한계성 등이 제시되었다. 이들 연구와 달리 작은 규모의 무작위 배정 연구들에 대한 meta-analysis는 "HPR"을 가지고 있는 환자에서 표준요법보다 강화요법을 사용할 경우 심혈관계 사망률과 스텐트 혈전증을 유의하게 감소시키고 주요한 출혈 위험성은 증가하지 않음을 보여 주었다[23]. 흥미롭게도 이런 강화요법의 효과는 고위험군 환자에서 더 두드러졌다.
결 론
클로피도그렐은 아직도 CAD 환자의 약물치료에 있어 아스피린과 함께 중요한 역할을 담당하고 있다. 클로피도그렐 치료 중 관찰되는 모든 "클로피도그렐 저항성" 또는 "HPR"에 대해 강화요법을 일괄적으로 사용하는 것은 현재까지의 연구결과를 볼때 합리적인 선택은 아니라고 생각된다. CAD 환자가 "HPR"를 가짐으로 인해 유발될 수 있는 허혈성 임상사건의 위험성이 높은 경우(예: 스텐트 시술을 시행한 ACS환자, 복잡 PCI를 시행한 당뇨ㆍ심부전ㆍ재협착 환자 등) 강화요법을 고려해 볼 수 있다. 즉, 강화요법에 따른 출혈 위험증가에 비해 허혈성 임상사건 발생 감소효과가 더 큰 경우가 좋은 적응증이 되겠다. 또한 이전 와파린 경험을 통해 배운 것처럼 동양인처럼 출혈경향이 높은 경우엔 보다 조심스러운 접근이 필요하다.
다양한 기전을 가진 많은 새로운 약제가 임상에 도입되고 있는 상황에서 출혈 위험성을 높일 수 있는 LPR (low on-treatment platelet reactivity)에 대한 관심과 연구도 중요하다(Fig. 1, Table 4) [36,38-47]. 이전의 보다 다양하고 관대한 출혈 기준보다 세밀하게 표준화된 출혈기준(Bleeding Academic Research Consortium, BARC)을 이용하여 출혈사건을 보다 정량화하여 새로운 약제나 조합의 임상효과 및 위험도를 보다 적절하게 평가해야 한다[48].
최근 5년 사이에 항혈소판제제 및 혈소판 기능검사에 대해 많은 발전이 있어 왔고 이를 통해 환자의 허혈성 임상 사건 발생에 대한 통찰이 넓혀져 왔다. 하지만 환자 개개인의 상황에 맞는 맞춤형 치료로까지 나아가기 위해서 앞으로도 해결되어야 할 부분 또한 많이 남아 있다.
1) Genotyping이나 혈소판 기능검사의 도입을 통한 맞춤형 치료가 도움이 될 수 있는 환자를 어떻게 선택할 것인가(risk scoring)? 또 이런 치료 방법들의 비용-가치적 타당성은 있는가?
2) "HPR" 또는 therapeutic window zone의 영향이나 범위는 시간 및 질환의 활성도에 따라 어떻게 변화하는가?
3) Therapeutic window zone 개념은 말초혈관 질환이나 허혈성 뇌졸중 환자에게도 적용될 수 있는가?
4) 항혈소판제 및 항응고제의 병용은 가능한가? 가능하다면 어떤 병합요법으로 할 것이며 치료의 효과와 안정성을 어떤 지표에 준해 확인할 수 있는가?
5) East Asian Paradox의 원인은 무엇인가? Thrombogenecity를 측정할 수 있는 방법은 있는가? Thrombogenecity marker를 어떻게 한국인 환자 치료에 적용할 것인가?


