식도에 발생한 원발성 신경내분비암 1예
Primary Neuroendocrine Carcinoma of the Esophag
Article information
Abstract
식도 신경내분비암종은 매우 드물고 예후가 나쁘다. 또한 질환의 희귀성으로 인해 치료체계가 확립되지 않은 질환이다. 식도 악성종양의 대부분을 차지하는 상피세포암과는 치료방법 및 임상경과가 달라 정확한 감별 진단이 필요하다. 이에 저자들은 연하곤란을 이유로 시행한 상부위장관 내시경에서 식도의 종양이 발견되어 내시경적 조직 생검 시행 후 신경내분비암종으로 진단되어 식도 절제술로 치료한 61세 여자 환자 증례를 보고하는 바이다.
Trans Abstract
Esophageal neuroendocrine carcinomas are very rare and have a poor prognosis. In addition, the optimum treatment has not been established due to the rarity of the condition. An accurate differential diagnosis is important because treatments and clinical courses differ from those of esophageal squamous cell carcinomas. We report a case of a 61-year-old female who underwent endoscopy for dysphagia and was diagnosed with a neuroendocrine carcinoma of the esophagus, which was successfully resected by esophagectomy. (Korean J Med 2013;84:827-830)
서 론
위장관계 신경내분비종양은 신경세포에서 관찰되는 synaptophysin, neuron-specific enloase와 chromogranin A 등의 단백질을 가지고 있으며 광범위한 신경내분비계에서 발생한다. 이러한 신경내분비 세포는 소화기관에 가장 많이 분포하고 있으며 소화기관에서 발생하는 전체 종양 중 신경내분비종양이 차지하는 비율은 충수돌기를 제외하고 부위에 따라 1%에서 24%에 이르는 것으로 알려져 있다[1]. 소화관에서 발생하는 신경내분비종양은 직장, 위, 십이지장, 충수, 소장, 대장, 담낭의 빈도순으로 발생하는 것으로 국내에서 보고되었으나[2] 현재까지 식도에서 발생한 증례에 대한 보고는 찾기 어려웠다. 저자들은 연하곤란을 이유로 내원하여 시행한 상부위장관 내시경 검사에서 발견된 원발성 식도 신경내분비암종 1예를 경험하였기에 보고하는 바이다.
증 례
61세 여자 환자가 2개월 전부터 지속된 연하곤란을 주소로 개인의원에서 상부위장관 내시경 시행 후 식도의 종괴 병변이 보여 정밀 검사를 위해 내원하였다. 과거력이나 가족력의 특이 사항은 없었다. 내원 당시 체온 36.5℃, 호흡수 14회/분, 맥박 75회/분, 혈압 120/70 mmHg이었으며 급성 혹은 만성 병색은 보이지 않았다. 복부 진찰 시 상복부의 경미한 압통 외에 특이 소견은 없었다. 말초혈액검사에서 혈색소 12.7 g/dL, 백혈구 8,690/mm3이었으며, 혈소판은 346 k/mm3이었고 적혈구침강속도는 7 mm/hr였다. 암종배아항원은 2.54 ng/mL로 정상범위였으며 다른 혈청 생화학 검사, 혈액 응고검사, 혈청 전해질 검사, 소변 및 대변 검사에서 이상 소견은 없었다. 상부위장관 내시경에서 상악 중절치 25 cm에서부터 30 cm에 걸쳐서 궤양을 동반한 돌출된 종괴 병변(Fig. 1)이 관찰되어 조직 검사를 시행하였다. 흉부 컴퓨터단층촬영에서 중부 식도 내강에 5 × 3 cm 크기의 소엽모양의 경계를 보이며 주위 식도벽의 비후를 동반한 종괴 병변을 관찰할 수 있었고 종격동 및 폐문부의 림프절 병변은 없었으며 기관지 및 폐의 이상 소견은 관찰할 수 없었다(Fig. 2). 양전자 방출 단층 촬영 및 전신 뼈 스캔에서도 이상 소견은 없었다. 상부 위장관 내시경을 통한 조직 검사에서 핵세포질비가 증가한 작고 둥근 세포들이 점막에 국한하여 침윤한 소견을 관찰할 수 있었다. 종양 세포는 크로모그래닌 염색에 양성이었으며 Ki-67 지수는 20% 이상, 유사분열은 10개의 고배율 시야에서 20개 이상 나타나 세계보건기구 분류에 따라 신경내분비암종의 진단 기준에 부합하였다. 환자의 수술 전 병기는 T1N0M0으로 수술 치료를 계획하였고, 식도절제술 및 위식도 문합술을 시행하였다. 수술로 제거된 종양(Fig. 3)은 중부식도 내강에 약 5 × 3 cm 크기의 소엽 모양의 경계를 보이며 궤양을 동반하고 있었다. 또한 종양세포의 현미경 소견(Fig. 4)은 내시경적 조직 생검의 병리 소견과 동일하였다. 수술 시 흉부 림프절의 전이 소견은 볼 수 없었고 종양은 식도에 국한되어 있어 수술 후 병기는 T1N0M0로 수술 전과 같았으며 화학요법이나 방사선요법은 병행하지 않았다.

Chest CT findings. Chest CT scan shows a 5 × 3-cm lobulating mass (arrows) and surrounding esophageal wall thickening in the middle of the esophagus. There is no mediastinal or hilar lymphadenopathy.
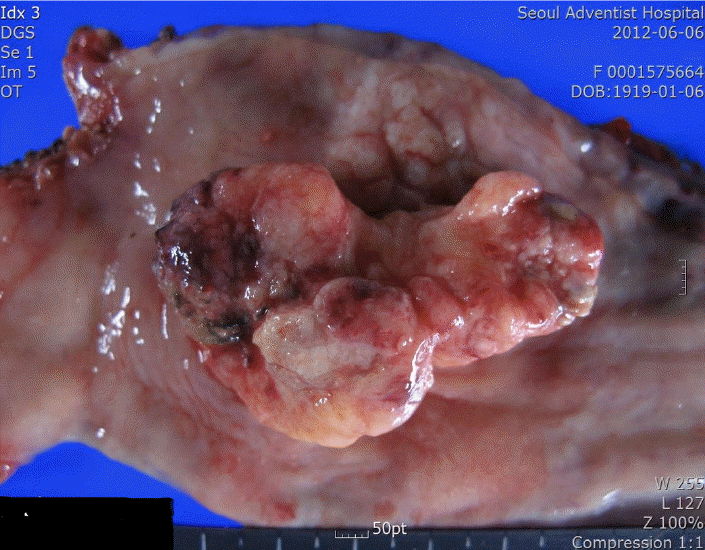
Gross finding of the resected tumor. The 5 × 3-cm lobulated tumor is protruding from the inner wall of the middle portion of the esophagus and several ulcerations are evident on the surface.
고 찰
위장관 신경내분비종양의 부위별 발생 빈도는 외국에서 소장, 충수돌기, 직장, 대장 순으로 보고하였으나, 국내에서는 직장, 위, 십이지장 순으로 차이가 있다[2,3]. 이러한 차이는 내시경 시행 빈도 때문으로 보이며 다른 종양처럼 신경내분비종양의 진단에 위장관 내시경의 역할이 중요하다는 간접적 증거라 할 수 있겠다. 특히 식도 신경내분비암종은 카시노이드증후군 동반이 적고 무증상이거나 비특이적인 증상을 나타내는 경우가 많아서 조기 발견이 어려워 발견 당시 진행기인 경우가 많기 때문에[4] 질환의 발견에 내시경이 중요한 역할을 할 수 있다고 생각한다. 본 증례에서 환자는 종양의 크기로 인한 연하곤란을 주소로 내원하였으나 T1N0M0 병기로 림프절 및 원격전이 없이 식도에 국한된 경우였다.
최근에 식도 신경내분비암종의 개념과 진단 기준에 변화가 있었다. 2010 세계보건기구 기준에 따르면 식도 신경내분비종양은 유사분열과 Ki-67지수를 포함한 세포증식의 정도에 따라 신경내분비종양 G1, G2, 소세포 그리고 대세포 신경내분비암종(G3)으로 구분한다[5]. 본 증례에서 25/10 HPF의 유사분열이 암세포에서 관찰되었으며 Ki-67지수는 30%였다. 이는 2010 세계보건기구 기준에 따라 신경내분비종양의 G3 등급에 해당된다.
대부분의 소화기관 내에 발생한 신경내분비암종은 암세포가 점막층의 심층부나 점막하층에 위치하여 내시경 생검만으로 적절한 조직을 얻어 진단하기는 어렵다[3]. 또한 식도 내에 상피세포암종과 신경내분비암종의 충돌종양이 보고된 바 있으며[6] 이런 경우 병리 의사가 신경내분비종양의 가능성을 고려하지 않고 생검 조직의 면역조직화학염색을 하지 않거나 생검 부위에 신경내분비암종 부위가 포함되지 않으면 상피세포암종으로 오인될 가능성도 있다. 따라서 내시경 검사에서 식도암이 의심되어 생검을 할 때 이러한 점도 고려하고 병리 의사와의 긴밀한 협조가 필요할 것으로 사료된다.
다른 위장관 부위에 발생한 신경내분비암종과는 대조적으로 식도 신경내분비암종은 별도로 체계화된 병기 분류가 없으며 식도암의 TNM 병기를 사용하고 있다. 생존율에 대한 통계적 유의성은 확보되지 않았으나 예후는 병기와 연관성을 보인다. 특히 종양이 원격전이 없이 국소해부학적 위치에 제한된 경우 더 좋은 예후를 보였다[4,7]. 보고에 따라 다양하나 식도 신경내분비암종의 중앙 생존기간은 5-12개월로 식도의 상피세포암이나 선암과 비교했을 시 예후가 더 나쁜 것으로 알려져 있다[4,8,9].
본 증례에서는 종양이 국소해부학적 위치에 제한되어 있는 경우로 방사선 요법이나 항암화학요법의 역할이 아직 증명되지 않아 저자들은 전통적인 수술 단일요법을 치료 방법으로 선택하였다. 하지만 최근 식도 신경내분비암종의 치료는 폐의 소세포암에서의 항암요법에 근거한 화학요법이 주를 이루고 있으며 방사선 치료법 및 수술을 통한 복합요법에 대한 연구도 이루어지고 있다[4].
내시경 생검을 통한 조직학적 진단이 용이한 식도 상피세포종양과 달리, 식도 신경내분비종양은 상피하종양이므로 내시경 조직 생검만으로 진단이 쉽지 않은 경우가 있다. 그러나 신경내분비암종은 상피세포암과 치료 및 예후가 다르기 때문에 적극적인 내시경 검사 및 병리학적인 검토를 통한 정확한 진단이 필요하다.

