강직성 척추염 환자에서 Infliximab 투여 후 헤노흐-쇤라인 자색반 1예
Henoch-Shönlein Purpura in a Patient with Ankylosing Spondylitis after Infliximab Therapy
Article information
Abstract
저자들은 강직성 척추염 환자에서 infliximab을 사용한 이후 발생한 헤노흐-쇤라인 자색반을 진단하고 약제 중단 및 스테로이드 요법으로 재발 없이 성공적으로 치료하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Tumor necrosis factor alpha (TNF-α) inhibitors are used widely to treat patients with active rheumatoid arthritis and ankylosing spondylitis (AS). Although various cutaneous reactions can occur as side effects of TNF-α inhibitors, systemic vasculitis requiring withdrawal of the agent and immunosuppressive drugs is rare. A 59-year-old male with AS who had been treated with infliximab for 60 months visited us with complaints of palpable purpura on both legs and severe abdominal pain. Abdominal computed tomography showed diffuse wall thickening of the proximal jejunum and ileum and a skin biopsy revealed leukocytoclastic vasculitis. The patient was diagnosed with Henoch-Schönlein purpura (HSP). Infliximab was discontinued and systemic steroid therapy at 0.5 mg/kg resulted in prompt resolution of the HSP. Here, we report the first case of HSP in a patient with AS after infliximab treatment. (Korean J Med 2013;84:764-768)
서 론
Infliximab은 종양괴사인자 알파(Tumor necrosis factor alpha)와 결합하여 기능을 억제하는 키메라 단일클론항체로서, 고전적 치료에도 지속적으로 활성도가 높게 유지되는 강직성 척추염 및 류마티스 관절염의 치료에 사용된다. Infliximab을 비롯한 종양괴사인자 알파 억제제를 사용할 경우, 결핵과 종양의 발생 이외에도 두드러기, 주입관련 반응에서부터 건선, 습진피부염 및 피부 감염에 이르기까지 다양한 피부 부작용이 보고되고 있다[1]. 대부분의 피부 부작용은 피부에 국한된 형태로 나타나며, 전신을 침범하는 혈관염으로 발생하는 경우는 드물고, 특히 강직성 척추염 환자에서 나타난 증례에 대한 국내보고는 없었다. 저자들은 6년 전 강직성 척추염으로 진단 후 infliximab으로 치료를 하던 중 자색반과 복통을 보였던 59세 남자에서 전신 혈관염으로 나타난 헤노흐-쇤라인 자색반을 경험하고 성공적으로 치료하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 59세, 남자
주 소: 내원 3일 전부터 시작된 복통과 자색반
현병력: 환자는 10년 전부터 염증성 요통과 조조강직이 있었으나 특별한 치료 없이 지내다가 증상이 악화되어 6년 전에 본원 내원하였고, 단순 골반 사진에서 양측 천장골염이 관찰되어서 강직성 척추염으로 진단되었다(Fig. 1). 비스테로이스성 소염진통제와 설파살라진 사용에도 불구하고 증상의 호전이 없고 질병활성도가 높아서 60개월 전부터 총 20회의 infliximab 300 mg를 투여받던 중 3일 전부터 배꼽 주위에서 시작된 복통이 점차 악화되었고 양측 하지에 다발성 홍반성 구진이 발생되어서 응급실로 내원하였다.
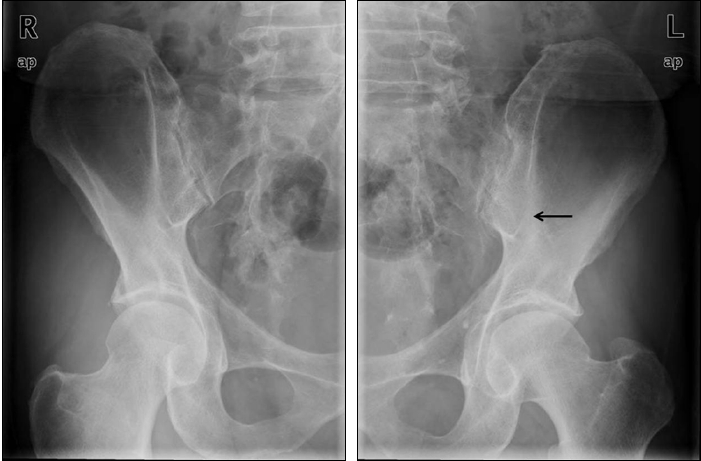
Pelvic radiography shows irregular joint space and narrowing of the sacroiliac joints and subchondral sclerosis (arrow).
과거력: 강직성 척추염 이외에 다른 질환은 없음. 내원 전에 상기도 감염의 증상은 없었음. 흡연력은 10갑/년이었고, 음주력은 없음.
가족력: 없음.
이학적 소견: 내원 당시 혈압 130/80 mmHg, 맥박 63회/분, 호흡수 18회/분, 체온 36.6℃였다. 외관상 급성 병색을 보였으나 의식은 명료하였다. 두경부상 이상 소견은 관찰되지 않았으며 흉부 청진에서 특이 소견은 없었다. 복부 소견에서 복부 팽창과 복수는 없었고, 정상 장음이었으며, 배꼽 주위로 약간의 압통이 있었으나 반발통은 없었다. 양측 하지에 다발성 홍반성 구진과 자색반이 관찰되었다(Fig. 2). 양측 고관절 내회전 시 통증이 있었으나 다른 관절의 압통이나 부종은 없었다. 흉곽 팽창 3 cm, 쇼버 검사는 3 cm 팽창을 보였다.
검사실 소견: 말초혈액검사에서 백혈구 7,460/mm3(호중구 65.8%, 림프구 23.6% 단핵구 10.1%), 혈색소 14.4 g/dL, 혈소판 199,000/mm3이었다. 혈액응고 검사 PT 11.0 sec, aPTT 40.2 sec, 일반생화학 검사에서 AST 24 IU/L, ALT 13 IU/L, ALP 57 IU/L, LDH 482 IU/L, 총 단백 7.2 g/dL, 알부민 4.2 g/dL, 총 빌리루빈 0.72 mg/dL이었으며, 혈청 전해질 검사에서 Na 135.6 mEq/L, K 4.34 mEg/L로 정상이었다. 소변 검사에서 혈뇨나 단백뇨는 관찰되지 않았으나, 적혈구 침강계수 36 mm/hr, C 반응단백 2.24 mg/dL로 상승되어 있었다. HLA B27은 양성이었고, 항핵항체 1:160 양성, 항 이중가닥 DNA 항체 64 IU/mL (정상치 0-20)로 상승되어 있었으나 항호중구성 세포질 항체(anti-neutrophil cytoplasmic antibody, ANCA)는 음성이었다. 면역글로불린 검사에서 IgA 338.4 mg/dL (정상치 70-400), IgG 1059.2 mg/dL (정상치 700-1600), IgM 159 mg/dL (정상치 40-230)으로 정상이었고 C3 98 mg/dL (정상치 90- 180), C4 21.9 mg/dL (정상치 10-40 mg/dL)이었다.
방사선 소견: 복부 단순 방사선 촬영에서는 특이 소견이 관찰되지 않았으나, 복부 전산화단층 촬영에서 근위부 공장과 회장의 미만성의 장벽비후가 관찰되었다(Fig. 3).

Abdominal computed tomography shows diffuse wall thickening of the proximal jejunum (arrow in A) and ileum (arrow in B).
병리조직 소견: 양측 하지의 자색반에 대해서 피부생검을 시행하였다. 광학현미경에서 진피 표층의 혈관 주변으로 중성구와 호중구의 침윤이 뚜렷하고 혈관 밖으로 적혈구의 유출이 관찰되는 백혈구 파괴성 혈관염(leukocytoclastic vasculitis) 소견이 관찰되었다(Fig. 4).

Punch biopsy of skin shows perivascular neutrophilic infiltration and conspicuous nuclear dust with marked red cell extravasation, consistent with leukocytoclastic vasculitis (arrows, H&E × 200).
치료 및 임상경과: 피부의 자색반, 복통과 피부 조직소견으로 저자들은 헤노흐-쇤라인 자색반으로 진단하였고, infliximab 투여를 중단한 이후 금식 및 수액 투여를 하면서 프레드니솔론 0.5 mg/kg를 경구투여하였다. 투여 3일째부터 복통은 다소 호전되었으나, 자색반은 합쳐지면서 커지는 양상을 보였다. 투여 6일째 복통은 소실되었으며 자색반의 범위과 크기도 감소하였고, 투여 12일째 자색반이 대부분 소실되었다. 이후 환자는 퇴원하였고, 프레드니솔론은 감량하였다. 4개월이 지난 현재까지 환자는 infliximab은 재투여하지 않고 필요 시 소염 진통제만 복용하고 있으며, 다른 증상 없이 외래에서 추적관찰 중이다.
고 찰
종양괴사인자 알파 억제제의 하나인 infliximab은 1999년 미국 식약청에서 승인되었으며, 2007년 한국 식약청에서 승인된 이후 강직성 척추염과 류마티스 관절염 이외에도 건선 관절염, 크론병과 궤양성 대장염에서도 널리 사용되고 있다. Infliximab을 포함한 종양괴사인자 알파 억제제 사용이 증가함에 따라 다양한 피부 부작용들이 보고되고 있으며 헤노흐-쇤라인 자색반 형태로 나타난 경우도 보고되었으나[2-6], 강직성 척추염 환자에서 발생한 경우는 매우 드물다. 2004년 Mohan 등[7]이 종양괴사인자 알파 억제제 사용 이후 발생한 백혈구 파괴성 혈관염 35예를 보고하였으나, infliximab을 투여한 강직성 척추염 환자에서 발생한 경우는 1예에 불과했다.
헤노흐-쇤라인 자색반은 소혈관을 침범하는 전신 혈관염으로서 자색반, 복통, 관절염, 위장관 출혈과 신염이 잘 동반된다. 주로 소아에서 발생 빈도가 높으나, 성인에서 발병할 경우 신장 침범이 더 심하고 예후가 나쁜 것으로 알려져 있다. 발생 원인은 불명확하지만 상기도 감염이나 약제 복용 이후 발생이 가능한 것으로 알려져 있고, IgA가 발병기전에 중요한 역할을 하는 것으로 보고되고 있다[5]. 진단적인 혈액검사는 없으며, 대부분의 경우 미국 류마티스 학회 분류기준에[8] 따라서 임상적으로 진단하게 되고, 조직학적으로 세정맥, 모세혈관, 세동맥에 IgA 면역복합체의 침착과 같은 특징적인 소견이 관찰되면 진단에 도움이 된다. 본 증례의 경우, 비록, 조직 검사에서 면역 화학 검사를 시행하지 못하여 IgA 면역복합체의 침착을 확인할 수는 없었으나, 저자들은 촉지 자색반과 복통, 조직 검사에서 백혈구 파괴성 혈관염으로 헤노흐-쇤라인 자색반을 진단할 수 있었다.
이제까지 보고된 대부분의 증례에서 종양괴사인자 알파 억제제 사용 시작 후 12개월 이내에 헤노흐-쇤라인 자색반이 나타났으나, 크론병 환자에서 adalimumab 투여 18개월 이후에 발생한 경우도 있었다(Table 1). 또한, Mohan 등[7]의 보고에서 보듯이 etanercept를 투여한 이후 103주째 백혈구 파쇠성 혈관염이 발생한 경우도 있었다. 본 증례에서는 infliximab 치료를 시작한 이후 60개월째 헤노흐-쇤라인 자색반이 발생하였는데, 이는 이전의 증례와 비교했을 때 비교적 늦게 발생한 경우에 해당하므로 infliximab이 헤노흐-쇤라인 자색반의 원인인지에 대하여 의문이 있을 수 있다. 하지만 면역복합체의 침착을 통한 혈관염이 드물지 않게 동반되는 류마티스 관절염이나 다른 자가면역질환과는 달리 강직성 척추염에서는 헤노흐-쇤라인의 자색반의 동반이 흔하지 않다는 점을 고려할 때, 저자들은 infliximab에 의하여 헤노흐-쇤라인 자색반이 발생한 것으로 추정하였다. Infliximab을 중단한 이후에 헤노흐-쇤라인 자색반이 호전되었고 현재까지 특별한 재발이 없는 점도 이를 뒷받침한다.

Henoch-Shönlein purpura after tumor necrosis factor-alpha inhibitors: summary of cases in the literature
헤노흐-쇤라인 자색반을 포함하여, 종양괴사인자 알파 억제제 사용 이후에 발생하는 면역학적 부작용의 기전은 아직 밝혀지지 않았으나, 종양괴사인자 알파 억제제에 대한 항체가 일부의 역할을 할 것으로 추정된다[7]. 더욱이 infliximab은 키메라 단일클론항체이므로 다른 종양괴사인자 알파억제제보다 약제에 대한 항체가 더 잘 형성되는 것으로 알려져 있다. 이런 항체는 infliximab을 반복 투여할 경우 더욱 잘 형성되며, 주입관련반응의 증가와 반복 투여할 경우 infliximab의 효과가 저하되는 것과 연관성이 있는 것으로 보고되고 있다. 비록 본 증례에서는 infliximab에 대한 항체를 측정하지는 못하였으나, 장기간 투여한 이후 헤노흐-쇤라인 자색반이 발생하였으므로 약제에 대한 항체가 자색반 발생에 역할을 하였을 것으로 추측한다. 하지만 주입관련 반응을 제외한 다른 부작용과 infliximab과의 인과관계는 명확하지 않으므로 추후 이를 규명할 연구가 필요하다.
헤노흐-쇤라인 자색반의 발생 및 질병활성도에 대한 종양괴사인자 알파의 역할은 아직 불분명하다. Wu 등[9]은 헤노흐-쇤라인 환자 중 신염이 동반된 군의 종양괴사인자 알파의 생성을 억제하는 lipoxin A2의 혈청 및 소변 농도가 단순히 자색반만 있는 군보다 낮다고 보고했다. 또한 Ha 등[10]은 헤노흐-쇤라인 환자에서 혈청 내 종양괴사인자 알파의 상승이 사구체 세포의 형태학적인 변화 및 질병활성도의 증가를 일으킨다고 기술했다. 상기 연구를 종합하면 헤노흐-쇤라인 자색반의 중증도나 질별활성도에 대해서는 종양괴사인자 알파가 역할을 하는 것 보이지만, 본 증례를 포함하여 종양괴사인자 알파 억제제를 사용한 이후 발생한 헤노흐-쇤라인 증례를 고려할 때 종양괴사인자 알파는 적어도 헤노흐-쇤라인의 발생에는 큰 기여를 하지 못하는 것으로 보인다.
Infliximab을 비롯한 종양괴사인자 알파 억제제를 장기간 사용할 경우 높은 빈도의 환자에서 항핵항체나 항 이중가닥 DNA 항체가 양성으로 검출되지만 명확한 전신홍반 루푸스가 발생하는 경우는 흔하지 않다. 또한 종양괴사인자 알파 억제제 사용으로 유도된 항핵항체와 항 이중가닥 DNA 항체의 임상적 의의도 아직 불분명하다. 본 증례의 환자에서도 항핵항체와 항 이중가닥 DNA 항체 모두 양성으로 검출되었으나 전신홍반 루프스를 시사하는 다른 증상은 관찰되지 않았다. 비록 진단 당시 항핵항체와 항 이중가닥 DNA 항체가 측정되지 않았기 때문에 이런 자가항체들이 infliximab으로 인해서 유도된 것인지는 분명하지 않으나, 장기간의 infliximab 치료로 인해서 면역원성(immunogenicity)의 변화가 유도된 것으로 추측한다.
이상에서 아직까지 발생 기전은 분명하지 않으나, 강직성 척추염 환자에서 infliximab을 투여할 때 헤노흐-쇤라인 자색반과 같은 전신 혈관염이 발생할 수 있으므로 주의를 요한다. 이는 투여 1년 이내뿐만 아니라 수년이 지난 후에도 발생할 수 있음을 염두에 두어야 할 것으로 생각한다. 추후 종양괴사인자 알파 억제제 사용에 따른 면역원성 및 사이토카인의 변화와 헤노흐-쇤라인 자색반의 연관성에 대한 연구가 필요할 것으로 생각한다.
