 |
 |
| Korean J Med > Volume 84(5); 2013 > Article |
|
Abstract
The incidence of venous thromboembolism (VTE) including deep vein thrombosis (DVT) and pulmonary embolism (PE) is increasing in Korea. In addition, awareness of VTE according to the incidence is improving, but how long VTE should be treated and how effective VTE patients should be managed with warfarin is not well defined. Recently, various new oral anticoagulants (NOACs) were introduced in clinical practice. The duration of anticoagulation, quality control of warfarin, and practical use of NOACs in VTE would be reviewed with evidences. (Korean J Med 2013;84:659-669)
ĻĄŁļé┤ ņĀĢļ¦źĒśłņĀäņ”Ø(VTE, venous thromboembolism)ņØś ņŚ░Ļ░äļ░£ņāØļźĀ(annual incidence)ņØĆ ņØĖĻĄ¼ 10ļ¦ī ļ¬ģļŗ╣ 2004ļģä ņĀĢļ¦źĒśłņĀäņ”Ø 8.8ļ¬ģ, ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”Ø(DVT, deep vein thrombosis) 3.9ļ¬ģ, ĒÅÉņāēņĀäņ”Ø(PE, pulmonary embolism) 3.7ļ¬ģņŚÉņä£ 2008ļģä ņĀĢļ¦źĒśłņĀäņ”Ø 13.8ļ¬ģ, ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”Ø 5.3ļ¬ģ, ĒÅÉņāēņĀäņ”Ø 7.0ļ¬ģņ£╝ļĪ£ ļ¦żļģä ņ”ØĻ░ĆĒĢśļŖö ņČöņäĖņØ┤Ļ│Ā(p= 0.0001) ņŚ░ļĀ╣ņ”ØĻ░Ć, ĒŖ╣Ē׳ 60ņäĖ ņØ┤ņāüņŚÉņä£ ĻĖēĻ▓®ĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņØĖļŗż. ĻĄŁļé┤ņØś Ļ▓ĮņÜ░ 7,300ļ¬ģļŗ╣ 1ļ¬ģņØś ļ╣äņ£©ļĪ£ ņä£ņ¢æņØś 1,000ļ¬ģļŗ╣ 1-2ļ¬ģņØś ļ░£ņāØļźĀĻ│╝ ļ╣äĻĄÉĒĢśļ®┤ ĒśäņĀĆĒ׳ ļé«ņ¦Ćļ¦ī 5ļģäĻ░ä ņĀĢļ¦źĒśłņĀäņ”ØņØś ļ░£ņāØļźĀņØ┤ 57% ņ”ØĻ░ĆĒĢśņśĆņØīņØä Ļ│ĀļĀżĒĢśļ®┤ ņ¦ĆņåŹņĀüņØĖ Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļŗż[1]. ĒÅÉņāēņĀäņ”ØņØś ņØ╝ņ░©ņĀü ņ╣śļŻī(primary therapy)ļŖö ĒśłņĀäņÜ®ĒĢ┤ļź╝ ĒåĄĒĢ£ ĒśłņĀäņØä ļČäĒĢ┤ĒĢśļŖö Ļ▓ā Ēś╣ņØĆ ņāēņĀäņĀ£Ļ▒░ņłĀļĪ£ ĒÅÉņāēņĀäņØä ņĀ£Ļ▒░ĒĢśļŖö Ļ▓āņØ┤Ļ│Ā, ņØ┤ņ░©ņĀü ņśłļ░®(secondary prevention)ņØĆ ņČöĻ░ĆņĀüņØĖ ĒśłņĀäĒśĢņä▒ņØä ļ¦ēĻ│Ā ņØ┤ļ»Ė ĒśĢņä▒ļÉ£ ĒśłņĀäņØĆ ļé┤ņ×¼ņĀüņØĖ ĒśłņĀäņÜ®ĒĢ┤ ĻĖ░ņĀä(endogenous fibrinolytic mechanism)ņØä ĒåĄĒĢ┤ ņ×¼ļ░£ņØä ļ░®ņ¦ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│Ėļ¼ĖņŚÉņä£ļŖö ņØ┤ņ░©ņĀü ņśłļ░®ņØä ņżæņŗ¼ņ£╝ļĪ£ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ĻĖ░ņłĀļÉĀ Ļ▓āņØ┤ļŗż.
ņĀĢļ¦źĒśłņĀäņ”ØņØĆ ņ¦äļŗ© ņŗ£ ĒĢŁņØæĻ│ĀņĀ£ ņ╣śļŻī ņżæļŗ© ĒøäņØś ņ×¼ļ░£ņ£äĒŚśļÅäņŚÉ ļö░ļØ╝ ļČäļźśļÉśĻ│Ā ņØ┤ņŚÉ ļö░ļØ╝ ņ╣śļŻī ĻĖ░Ļ░äņØ┤ ļŗ¼ļØ╝ņ¦ĆĻ▓ī ļÉ£ļŗż. ņ×¼ļ░£ņ£äĒŚśļÅäļŖö ņ£Āļ░£ņØĖņ×É ņ£Āļ¼┤ņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ ņØ╝ņŗ£ņĀüņØĖ ņ£äĒŚśņØĖņ×ÉĻ░Ć ņ׳ļŖö ņĀĢļ¦źĒśłņĀäņ”Ø(provoked VTE)Ļ│╝ ņØ╝ņŗ£ņĀü ņ£äĒŚśņØĖņ×ÉĻ░Ć ņŚåļŖö ņĀĢļ¦źĒśłņĀäņ”Ø(unprovoked VTE)ņ£╝ļĪ£ ļéśļē£ļŗż. ņØ╝ņŗ£ņĀü ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ļŖö ņĀĢļ¦źĒśłņĀäņ”Ø(provoked VTE)ņØĆ ņłśņłĀ Ēøä ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░Ļ│╝ ņłśņłĀĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ņŚÉņä£ ņ×¼ļ░£ ņ£äĒŚśļÅäĻ░Ć ļŗżļź┤Ļ▓ī ļéśĒāĆļéś, ņĄ£ĻĘ╝ 1Ļ░£ņøö ņØ┤ļé┤ ņłśņłĀņØä ļ░øņĢśļŹś ņ£äĒŚśņØĖņ×ÉĻ░Ć ņ׳ņŚłļŹś Ļ▓ĮņÜ░ļŖö ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ļŖö ņĀĢļ¦źĒśłņĀäņ”Ø(provoked VTE by surgery), ņŚÉņŖżĒŖĖļĪ£Ļ▓É ņ╣śļŻī, ņ×äņŗĀ, ļŗżļ”¼ņÖĖņāü, 8ņŗ£Ļ░ä ņØ┤ņāüņØś ļ╣äĒ¢ēĻ│╝ Ļ░ÖņØĆ ņØ╝ņŗ£ņĀüņØĖ ļ╣äņłśņłĀņĀü ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ņŚłļŹś Ļ▓ĮņÜ░ļŖö ļ╣äņłśņłĀņĀü ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ļŖö ņĀĢļ¦źĒśłņĀäņ”Ø(provoked VTE by a non-surgical reversible risk factor)ļĪ£ ļČäļźśļÉśņŚłļŗż[2]. ĒĢŁņØæĻ│Āņ╣śļŻī ņżæļŗ© Ēøä ņ×¼ļ░£ļźĀņØĆ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ ļŹö ļåÆņ£╝ļ®░ ņżæļŗ© Ēøä 1ļģä ļ░Å 5ļģä ņ×¼ļ░£ļźĀņØĆ ĻĘĖļ”╝ 1Ļ│╝ Ļ░Öļŗż[2].
ņĢģņä▒ņóģņ¢æĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņĢöĻ┤ĆļĀ© ņĀĢļ¦źĒśłņĀäņ”Ø(cancer associated VTE)ņ£╝ļĪ£ ļČäļźśĒĢ£ļŗż.
ņĀĢļ¦źĒśłņĀäņ”ØņØĆ ņĄ£ņåī 3Ļ░£ņøö ņØ┤ņāüņØś ņןĻĖ░Ļ░äņØś ņ╣śļŻīļź╝ ĒĢäņÜöļĪ£ ĒĢśļ®░ ņ┤łĻĖ░ ņ╣śļŻī 3Ļ░£ņøöņØĆ ĻĖēņä▒ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ╣śļŻī, 3Ļ░£ņøö ņØ┤ĒøäņŚÉļŖö ņāłļĪ£ņÜ┤ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£ņØä ļ░®ņ¦ĆĒĢśļŖö ļŹ░ ĻĘĖ ļ¬®ņĀüņØ┤ ņ׳ļŗż[2]. ņ┤łņ╣śļŻī ĻĖ░Ļ░äņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļĪ£ Agnelli ļō▒[3]ņØĆ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”ØņŚÉņä£ 3Ļ░£ņøö ņ╣śļŻī Ēøä ņżæļŗ©ĻĄ░Ļ│╝ 3Ļ░£ņøö ņ╣śļŻī Ēøä 9Ļ░£ņøö ņČöĻ░Ć ņ╣śļŻī Ēøä ņżæļŗ©ĻĄ░ņØä 3ļģä ņØ┤ņāü ņČöņĀüĒĢśņŚ¼ ņ×¼ļ░£ļźĀņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņ×¼ļ░£ļźĀņØĆ 3Ļ░£ņøö ņ╣śļŻīĻĄ░Ļ│╝ 9Ļ░£ņøö ņČöĻ░Ć ņ╣śļŻīĻĄ░ņŚÉņä£ Ļ░üĻ░ü 0.7%ņÖĆ 8.3%ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ¦Ćļ¦ī(p= 0.003) ĒĢŁņØæĻ│Āņ╣śļŻī ĻĖ░Ļ░äņØä ĒżĒĢ©ĒĢ£ 3ļģä ņØ┤ņāüņØś ņČöņĀüņŚÉņä£ ļłäņĀü ņ×¼ļ░£ļźĀņØĆ Ļ░üĻ░ü 15.7%ņÖĆ 15.8%ļĪ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢä 3Ļ░£ņøö ņØ┤ņāüņØś ņŚ░ņןņ╣śļŻīņØś ĒÜ©Ļ│╝ļŖö ņ╣śļŻī ņżæļŗ© Ēøä ņ£Āņ¦ĆļÉśņ¦Ć ņĢŖņĢśņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ņĄ£ĻĘ╝ Boutitie ļō▒[4]ņØĆ ņĢöĻ┤ĆļĀ© ņĀĢļ¦źĒśłņĀäņ”ØņØä ņĀ£ņÖĖĒĢ£ ņ▓½ ļ▓łņ¦Ė ļ░£ņāØĒĢ£ ņĀĢļ¦źĒśłņĀäņ”Ø ĒÖśņ×ÉņØś ĒĢŁņØæĻ│Ā ņ╣śļŻī ĻĖ░Ļ░äĻ│╝ Ļ┤ĆļĀ©ļÉ£ 7Ļ░£ņØś ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŚ░ĻĄ¼ļź╝ ļČäņäØĒĢśņŚ¼ ņ×¼ļ░£ ņ£äĒŚśņØä Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ļŖö ņĄ£ņåīĒĢ£ņØś ĒĢŁņØæĻ│Ā ņ╣śļŻī ĻĖ░Ļ░äņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņ×¼ļ░£ļźĀņØĆ 1) ņøÉņ£äļČĆ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”Ø(distal DVT)ņŚÉņä£ ĻĘ╝ņ£äļČĆ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”Ø(proximal DVT)ļ│┤ļŗż ļé«ņĢśņ¦Ćļ¦ī(hazard ratio [HR] 0.49, 95% confidence interval [CI] 0.34-0.71), 2) ĒÅÉņāēņĀäņ”ØĻ│╝ ĻĘ╝ņ£äļČĆņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”ØņØĆ ņ£Āņé¼ĒĢśņśĆĻ│Ā(HR 1.19, 95% CI 0.87-1.63), 3) ņØ╝ņŗ£ņĀüņØĖ ņ£äĒŚśņØĖņ×É(ņĄ£ĻĘ╝ ņłśņłĀ, ņäØĻ│ĀļČĢļīĆ Ļ│ĀņĀĢ, ņĄ£ĻĘ╝ ņ×ģņøÉļ│æļĀź)Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ņØ╝ņŗ£ņĀüņØĖ ņ£äĒŚśņØĖņ×ÉĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ļ│┤ļŗż ļé«ņĢśņ£╝ļ®░(HR 0.55, 95% CI 0.41-0.74), 4) 1Ļ░£ņøö Ēś╣ņØĆ 1.5Ļ░£ņøöļĪ£ ļŗ©ĻĖ░Ļ░ä ņ╣śļŻīĒĢ£ Ļ▓ĮņÜ░Ļ░Ć 3Ļ░£ņøö ņØ┤ņāü ņ╣śļŻīĒĢ£ Ļ▓ĮņÜ░ļ│┤ļŗż ļåÆņĢśņ¦Ćļ¦ī(HR 1.52, 95% CI 1.14-2.02), 5) 3Ļ░£ņøö ņ╣śļŻī Ēøä ņżæļŗ©ĒĢ£ Ļ▓ĮņÜ░Ļ░Ć 6Ļ░£ņøö ņØ┤ņāü ņ╣śļŻīĒĢ£ Ļ▓ĮņÜ░ņÖĆ ņ£Āņé¼ĒĢśņśĆļŗż(HR 1.19, 95% CI 0.86-1.65). Ļ▓░ĻĄŁ 3Ļ░£ņøö ĒĢŁņØæĻ│Ā ņ╣śļŻī ņżæļŗ© ĒøäņØś ņ×¼ļ░£ļźĀņØĆ ļ╣äņŖĘĒĢśņśĆņ¦Ćļ¦ī, ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö ĻĘ╝ņ£äļČĆ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”ØĻ│╝ ĒÅÉņāēņĀäņ”ØņØĆ ņ╣śļŻīĻ░Ć ņżæļŗ©ļÉśļ®┤ ņ¢ĖņĀ£ļōĀņ¦Ć ņ×¼ļ░£ņØś ņ£äĒŚśņØ┤ ļåÆņĢäņ¦äļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.
2012ļģäņŚÉ ļ░£Ēæ£ļÉ£ 9ļ▓łņ¦Ė American College of Chest Physicians(ACCP) Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØĆ ņĄ£ņåī 3Ļ░£ņøö ņØ┤ņāüņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ▓½ ļ▓łņ¦Ė ņ¦äļŗ©ņØ┤ļŹöļØ╝ļÅä ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö ĻĘ╝ņ£äļČĆ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”ØĻ│╝ ĒÅÉņāēņĀäņ”ØņØĆ ņČ£Ēśłņ£äĒŚśņØ┤ ļåÆņØĆ Ļ▓ĮņÜ░ļź╝ ņĀ£ņÖĖĒĢśĻ│ĀļŖö 3Ļ░£ņøöņØä ņ┤łĻ│╝ĒĢ£ ņŚ░ņןņ╣śļŻī(extended treatment)ļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż(Table 1) [2].
ĒĢŁņØæĻ│ĀņĀ£ ņ╣śļŻī ņżæļŗ© Ēøä ņĀĢļ¦źĒśłņĀäņ”Ø ņ×¼ļ░£ņØś ņ£äĒŚśņØĆ ĻĖēņä▒ņĀĢļ¦źĒśłņĀäņ”ØņØ┤ ņ¢╝ļ¦łļéś ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ╣śļŻīļÉśņŚłļŖöņ¦Ć(ņ╣śļŻīņØś ĻĖ░Ļ░ä)ņÖĆ ĒÖśņ×É Ļ░£Ļ░£ņØĖņØś ņ×¼ļ░£ ņ£äĒŚśļÅäņŚÉ ļö░ļźĖļŗż. ĒśłņĀäļ░£ņāØņØś Ļ│Āņ£äĒŚśĻĄ░ņŚÉņä£ ņŗ£Ē¢ēļÉśļŖö ĒĢŁņØæĻ│ĀņĀ£ņØś ņŚ░ņןņ╣śļŻī(extended treatment)ļŖö Ēł¼ņŚ¼ ņżæļŗ©ņØ╝ņØä ņĀĢĒĢśņ¦Ć ņĢŖĻ│Ā 3Ļ░£ņøöņØä ņ┤łĻ│╝ĒĢśņŚ¼ ĒĢŁņØæĻ│Āņ╣śļŻīļź╝ ņ¦ĆņåŹĒĢśļŖö Ļ▓āņØä ļ¦ÉĒĢśļ®░ Ļ░ü ĒÖśņ×ÉņØś ņČ£Ēśłņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŖöņ¦Ć Ēś╣ņØĆ ĒÖśņ×ÉņØś ņäĀĒśĖļÅäĻ░Ć ļ│ĆĒĢśņśĆļŖöņ¦Ćļź╝ 1ļģäņŚÉ 1ĒÜīņÖĆ Ļ░ÖņØ┤ ņĀĢĻĖ░ņĀüņØĖ ņ×¼ĒÅēĻ░Ćļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ╣śļŻīļź╝ ņ£Āņ¦ĆĒĢĀ Ļ▓āņØĖņ¦Ćļź╝ Ļ▓░ņĀĢĒĢśļŖö Ļ▓āņØ┤ļŗż[2].
Schulman ļō▒[5]ņØĆ ļæÉ ļ▓łņ¦Ė ļ░£ņāØĒĢ£ ņĀĢļ¦źĒśłņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ 6Ļ░£ņøö ņ╣śļŻī Ēøä ņżæļŗ©ĻĄ░Ļ│╝ ļ¼┤ĻĖ░ĒĢ£ ņ╣śļŻīĻĄ░ņØä ņ┤Ø 4ļģäĻ░ä ņČöņĀüĒĢśņŚ¼ Ļ░üĻ░ü 20.7%ņÖĆ 2.6%Ļ░Ć ņ×¼ļ░£ĒĢśņśĆĻ│Ā 6Ļ░£ņøö ņ╣śļŻī Ēøä ņżæļŗ©ĻĄ░ņŚÉņä£ ļ╣äĻĄÉņ£äĒŚśļÅäĻ░Ć 8ļ░░ ņ”ØĻ░ĆļÉ©ņØä ļ│┤Ļ│ĀĒĢśņŚ¼ ņ×¼ļ░£ĒÖśņ×ÉņŚÉņä£ ņŚ░ņןņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. 9ļ▓łņ¦Ė ACCP Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ņ×¼ņ╣śļŻīņØś Ļ▓ĮņÜ░ ņČ£Ēśłņ£äĒŚśņØ┤ ļåÆņØĆ Ļ▓ĮņÜ░ļź╝ ņĀ£ņÖĖĒĢśĻ│ĀļŖö ņŚ░ņןņ╣śļŻīļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż(Table 1) [2].
Ēśäņ×¼Ļ╣īņ¦Ć ņ╣śļŻī ĻĖ░Ļ░äņŚÉ ļīĆĒĢ£ ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļōżņØĆ ņĀĢĒĢ┤ņ¦ä ĻĖ░Ļ░ä ļé┤ņŚÉ ņĄ£ņåīĒĢ£ņØś ņ╣śļŻī ĻĖ░Ļ░äņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ņ¢┤ņä£ ĒÖśņ×É Ļ░£ņØĖņØś ņČ£Ēśłņ£äĒŚśņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ»╝Ļ░ÉĒĢśĻ▓ī ĒÅēĻ░ĆļÉśņ¦Ć ļ¬╗ĒĢśņśĆņ¦Ćļ¦ī ņČ£Ēśłņ£äĒŚśļÅä ĒÅēĻ░ĆļŖö ņŚ░ņןņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢśĻ│Ā ĒÅēĻ░ĆĒĢĀ ļĢī ļīĆļŗ©Ē׳ ņżæņÜöĒĢ£ ĒÅēĻ░ĆņÜöņåīņØ┤ļŗż. 9ļ▓łņ¦Ė ACCP Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ņČ£ĒśłņØś ņ£äĒŚśņØĖņ×É(Table 2) ļ░Å ņØ┤ņŚÉ ļö░ļźĖ ņČ£Ēśłļ░£ņāØ ņ£äĒŚśņØ┤ ņ”ØĻ░ĆļÉśļ»ĆļĪ£ ņĀĢĻĖ░ņĀüņØĖ ĒÅēĻ░ĆĻ░Ć ĒĢäņÜöĒĢ©ņØä Ļ░ĢņĪ░ĒĢśņśĆļŗż(Fig. 2) [2].
UFHņØĆ ņØæĻ│ĀĒÜ©ņåī(clotting enzyme)ņØś ļŖÉļ”░ ņ¢ĄņĀ£ņĀ£(slow inhibitor)ņØĖ antithrombin IIIņŚÉ Ļ▓░ĒĢ®ĒĢśĻ▓ī ļÉśļ®┤ ļ╣ĀļźĖ ņ¢ĄņĀ£ņĀ£(rapid inhibitor)ļĪ£ ņĀäĒÖśļÉ©ņ£╝ļĪ£ņŹ© ĒĢŁņØæĻ│Ā ņ×æņÜ®ņØä ļéśĒāĆļéĖļŗż. UFHņØś ņāØļ¼╝ĒĢÖņĀü ļ░śĻ░ÉĻĖ░(biologic half-life)ļŖö ņÜ®ļ¤ē ņØśņĪ┤ņĀü(dose-dependent) ņØ┤ņ¢┤ņä£ 25 units/kg, 100 units/kg, 400 units/kgļĪ£ ņĀĢļ¦źņŻ╝ņé¼ Ēøä Ļ░üĻ░ü 30ļČä, 60ļČä, 150ļČäņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ¦Ćļ¦ī ņØ╝ļ░śņĀüņØĖ ņ╣śļŻī ņÜ®ļ¤ēņŚÉņä£ņØś ļ░śĻ░ÉĻĖ░ļŖö 30-60ļČäņ£╝ļĪ£ ņ¦¦ĻĖ░ ļĢīļ¼ĖņŚÉ ņ╣©ņŖĄņĀü ņŗ£ņłĀ ņĀä ņ£ĀņÜ®ĒĢśļŗż[6]. UFHņØĆ ņŗĀņןņ£╝ļĪ£ ļ░░ņäżļÉśņ¦Ć ņĢŖņ£╝ļ»ĆļĪ£ ņŗ¼ĒĢ£ ņŗĀĻĖ░ļŖźņĀĆĒĢś(CrCl, creatinine clearance < 20 mL/min)ņØĖ Ļ▓ĮņÜ░ņŚÉļÅä ņĀ£ļé┤ņČĢņĀü(bioaccumulation)ņØ┤ ļÉśņ¦Ć ņĢŖņĢä ņŗĀĻĖ░ļŖź ņĀĆĒĢś ĒÖśņ×ÉņŚÉņä£ ņ£ĀņÜ®ĒĢśļŗż[7].
LMWHņØś ļČäņ×Éļ¤ēņØĆ UFHņØś 1/3ņĀĢļÅäņØ┤ļŗż. LMWHņØĆ factor XaņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ĒŖĖļĪ¼ļ╣ł(thrombin)ņŚÉ ļīĆĒĢ£ ņ¢ĄņĀ£ĒÖ£ņä▒(inhibitory activity)ņØ┤ Ļ░ÉņåīĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ņĢĮņĀ£ Ļ░ä anti-Xa/anti-IIa ņ░©ņØ┤ņŚÉ ļö░ļØ╝ ņ×äņāüĻ▓░Ļ│╝ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ĻĘ╝Ļ▒░Ļ░Ć ļČłņČ®ļČäĒĢśļŗż. LMWHņØś ņĢĮļ¼╝ļÅÖļĀźĒĢÖņĀü ĒŖ╣ņä▒ņØĆ ņĢĮ 90%ņØś ņāØņ▓┤ņØ┤ņÜ®ļźĀ(bioavailability), ņśłņĖĪ Ļ░ĆļŖźĒĢ£ ņÜ®ļ¤ē-ļ░śņØæ(dose response)ņ£╝ļĪ£ ļ¬©ļŗłĒä░ļ¦üņØ┤ ĒĢäņÜö ņŚåņ£╝ļ®░ ņןņŗ£Ļ░äņØś ļ░śĻ░ÉĻĖ░ļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓āņØ┤ļŗż(Table 4). Ēł¼ņŚ¼ņÜ®ļ¤ēņØĆ Ēæ£ 5ņÖĆ Ļ░Öļŗż[6].
LMWHņØĆ ņĢĮļ¼╝ņØ┤ ņŗĀņןņ£╝ļĪ£ ļ░░ņäżļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ĒśäņĀĆĒĢ£ ņŗĀņן ĻĖ░ļŖź ņØ┤ņāü(CrCl Ōēż 30 mL/min)ņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ļŖö ļ¬©ļŗłĒä░ļ¦ü ļ░Å ņÜ®ļ¤ēņĪ░ņĀłņØ┤ ĒĢäņÜöĒĢśļŗż. LMWHņØś anti-Xa ņ▓Łņåīņ£©(clearance of the anti-Xa)Ļ│╝ CrClĻ│╝ļŖö Ļ░ĢļĀźĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳Ļ│Ā(R = 0.85, p< 0.001) [8] enoxaparin Ļ┤ĆļĀ© ņŚ░ĻĄ¼ņŚÉņä£ ņ╣śļŻīņÜ®ļ¤ēļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŚ¼ļ¤¼ ļ▓łņØś Ēł¼ņŚ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņśłļ░®ņĀü ņÜ®ļ¤ēņŚÉņä£ļÅä anti-Xa ņ▓Łņåīņ£©ņØ┤ 39% ņ”ØĻ░ĆļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[9,10]. ņØ┤ļŖö ņŻ╝ņÜöņČ£Ēśł(major bleeding)ņØä 2ļ░░ ņØ┤ņāü(odds ratio [OR] 2.25, 95% CI 1.19-4.27) ņ”ØĻ░Ćņŗ£ņ╝£ ņČ£ĒśłĒĢ®ļ│æņ”ØņØä Ļ░Éņåīņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ņä£ļŖö Ļ░Éļ¤ēņØ┤ ĒĢäņÜöĒĢśļŗż[11].
AntithrombinņŚÉ Ļ│Āņ╣£ĒÖöļĀź(high-affinity)ņØä ļ│┤ņØ┤ļŖö anti-Xa pentasaccharideņØĖ fondaparinuxļŖö ĒĢśļŻ© ĒĢ£ ļ▓ł Ēö╝ĒĢśņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ļÉśĻ│Ā ļ¬©ļŗłĒä░ļ¦üņØ┤ ĒĢäņÜö ņŚåļŗż. ļ░śĻ░ÉĻĖ░ļŖö 17ņŗ£Ļ░äņ£╝ļĪ£ ļ░śĻ░ÉĻĖ░Ļ░Ć 4ņŗ£Ļ░äņØĖ LMWHņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ĻĖĖļŗż. ņ╣śļŻīņÜ®ļ¤ēņØĆ ņ▓┤ņżæņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ 50 kg ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ 5 mg, 50-100 kgņØĖ Ļ▓ĮņÜ░ 7.5 mg, 100 kgņØä ņ┤łĻ│╝ĒĢśļŖö Ļ▓ĮņÜ░ 10 mgņØä Ēł¼ņŚ¼ĒĢ£ļŗż. ņĢĮļ¼╝ņØ┤ ņŗĀņןņ£╝ļĪ£ ļ░░ņäżļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ņŗĀņןĻĖ░ļŖź ņØ┤ņāüņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ Ļ░Éļ¤ēļÉśņ¢┤ņĢ╝ ĒĢśĻ│Ā ņŗ¼ĒĢ£ ņŗĀĻĖ░ļŖź ņĀĆĒĢś(CrCl Ōēż 30 mL/min) ĒÖśņ×ÉņŚÉņä£ļŖö ĻĖłĻĖ░ņØ┤ļŗż[6]. ņĀĢļ¦źĒśłņĀäņ”ØņŚÉņä£ņØś ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ņĢłņĀäņä▒ņØĆ LMWHĻ│╝ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż[12,13].
ņÖĆĒīīļ”░ņØĆ ĒśłņĢĪņØæĻ│ĀņØĖņ×É(coagulation factors) II, VII, IX, XņØś carboxylation ĒÖ£ņä▒ĒÖöļź╝ ņĀĆĒĢ┤ĒĢśļŖö ņĢĮņĀ£ļĪ£ ņÖäņĀäĒĢ£ ĒĢŁņØæĻ│Ā ĒÜ©Ļ│╝ļŖö ņĄ£ņåī 5ņØ╝ņØä ĒĢäņÜöļĪ£ ĒĢ£ļŗż. ļ¬©ļŗłĒä░ļ¦üņØĆ prothrombin time (PT) International Normalized Ratio (INR)ņØä ņé¼ņÜ®ĒĢśĻ│Ā ņĀĢļ¦źĒśłņĀäņ”Ø ņ╣śļŻīņØś ļ¬®Ēæ£ INR (target INR)ņØĆ 2.5ņØ┤Ļ│Ā ļ▓öņ£äļŖö 2.0-3.0ņØ┤ļŗż. ņÖĆĒīīļ”░ņØĆ ĻĖēņä▒ ņĀĢļ¦źĒśłņĀäņ”Ø ļÅÖņĢł ļŗ©ļÅģņ£╝ļĪ£ Ēł¼ņŚ¼ļÉśļ®┤ Ļ│╝ņØæĻ│Ā(hypercoagulability)Ļ░Ć ņ┤łļלļÉĀ ņłś ņ׳ņ¢┤ ņĄ£ņåī 5ņØ╝Ļ░ä UFH, LMWH, Ēś╣ņØĆ fondaparinuxļź╝ ņżæļ│Ą Ēł¼ņŚ¼ĒĢśņŚ¼ ņ┤łĻĖ░ņØś ņØæĒśłņ┤ēņ¦äĒÜ©Ļ│╝(procoagulant effect)ļź╝ ņżæĒÖöĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ņÖĆĒīīļ”░ņØĆ ņĢĮļ¼╝ Ļ░ä ņāüĒśĖņ×æņÜ®Ļ│╝ ņĢĮļ¼╝-ņØīņŗØ Ļ░ä ņāüĒśĖņ×æņÜ®ņ£╝ļĪ£ ņÖĆĒīīļ”░ ļīĆņé¼ņŚÉ ļ¦ÄņØĆ ņśüĒ¢źņØä ņŻ╝ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀüņĀłĒĢ£ ņÜ®ļ¤ēņĪ░ņĀłņØ┤ ņ¢┤ļĀĄĻ│Ā ņśüņ¢æņØ┤ ļČłļ¤ēĒĢśĻ▒░ļéś ņןĻĖ░Ļ░äņØś ĒĢŁņāØņĀ£ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉļŖö ļ╣äĒāĆļ»╝ K Ļ▓░ĒĢŹņāüĒā£ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®░ ņŚ░ļĀ╣ņ”ØĻ░Ć, ņĀäņŗĀņ¦łĒÖś(systemic illness), ĒØĪņłśņןņĢĀ, ņäżņé¼ņÖĆ Ļ░ÖņØĆ ļÅÖņŗ£ņØ┤ĒÖśņ¦łĒÖś(comorbidity)Ļ│╝ Ļ░ÖņØĆ ļ│Ćņłś ļśÉĒĢ£ ņÖĆĒīīļ”░ ņÜ®ļ¤ē ņÜöĻĄ¼ļ¤ēņØä Ļ░Éņåī ņŗ£Ēéżļ»ĆļĪ£ ņäĖņŗ¼ĒĢ£ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż.
ņ╣śļŻīĻĄ¼Ļ░äļé┤ ņŗ£Ļ░ä(time in therapeutic range, TTR)ņØĆ ņĀäņ▓┤ ņ╣śļŻīĻĖ░Ļ░ä ņżæ ņ╣śļŻīĻĄ¼Ļ░ä ļé┤ņŚÉ ĒżĒĢ©ļÉ£ INR Ļ░ÆņØ┤ ņ¢╝ļ¦łļéś ļ¦ÄņĢśļŖöņ¦Ćļź╝ ļ░▒ļČäņ£©ļĪ£ Ēæ£ņŗ£ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ╣äĒāĆļ»╝ K ĻĖĖĒĢŁņĀ£ ņ╣śļŻīņØś ņ¦łņĀü ĒÅēĻ░Ćļ░®ļ▓ĢņØ┤ļŗż. ĒÅēĻ░Ćļ░®ļ▓ĢņØĆ ņŚ░ņåŹņĀüņ£╝ļĪ£ ņĖĪņĀĢļÉ£ ļæÉ Ļ░£ņØś INR Ļ░Æļōż Ļ░äņŚÉļŖö ņ¦üņäĀņØś Ļ┤ĆĻ│äĻ░Ć ņ׳ņØīņØä Ļ░ĆņĀĢĒĢśĻ│Ā ņĖĪņĀĢļÉśņ¦Ć ņĢŖņØĆ ļéĀņØś INR Ļ░ÆņØä Ļ│äņé░ĒĢśņŚ¼ ņ¢╝ļ¦łļéś ļ¦ÄņØĆ ļéĀņØ┤ ņ╣śļŻī ĻĄ¼Ļ░ä ļé┤ņŚÉ ņ׳ņŚłļŖöņ¦Ćļź╝ Ļ│äņé░ĒĢ£ļŗż(patient-time approach) [14]. TTR Ļ░ÆņØ┤ ņ╗żņ¦łņłśļĪØ ņ╣śļŻī ĻĄ¼Ļ░äņØä ņל ņ£Āņ¦ĆĒĢśņśĆņØīņØä ņØśļ»ĖĒĢśļ®░ ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ņŚÉņä£ 60% ņØ┤ņāüņØä ņĀüņĀłĒĢ£ ņĪ░ņĀłņØś ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśĻ│Ā ņ׳ļŗż.
ņ¦łņĀüĻ┤Ćļ”¼ ņĀĢļÅäĻ░Ć ņ×äņāüĻ▓░Ļ│╝ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ Veeger ļō▒[15]ņØĆ ļ╣äĒāĆļ»╝ K ĻĖĖĒĢŁņĀ£ļĪ£ ĒĢŁņØæĻ│Āņ╣śļŻīļź╝ ļ░øļŖö 2,304ļ¬ģņØś ņĀĢļ¦źĒśłņĀäņ”Ø ĒÖśņ×ÉļōżņŚÉņä£ ĒĢśņ£ä 1/4ņØĖ TTR < 45% ĻĘĖļŻ╣ņØś Ļ▓ĮņÜ░ ņāüņ£ä 1/2ņØĖ TTR > 65% ĻĘĖļŻ╣ņŚÉ ļ╣äĒĢ┤ ĒśłņĀäĒĢ®ļ│æņ”Ø ļ░Å ņŻ╝ņÜöņČ£Ēśł ĒĢ®ļ│æņ”ØņØś ņ£äĒŚśņØ┤ 2.8ļ░░ ļåÆņĢä(relative risk [RR] 2.8, 95% CI 1.9-4.3) (ņĀłļīĆ ņŚ░Ļ░ä ļ░£ņāØļźĀ: ĒśłņĀäĒĢ®ļ│æņ”Ø 16.0% vs. 4.6%, ņŻ╝ņÜö ņČ£ĒśłĒĢ®ļ│æņ”Ø 8.7% vs. 1.9%) TTRņØĆ ņ×äņāüņĀü Ļ▓░Ļ│╝ņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļĪ£ņä£ Ļ▓░ņĀĢņĀü ņŚŁĒĢĀņØä ĒĢśņśĆņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī ĒśłņĀä ļ░Å ņČ£ĒśłĒĢ®ļ│æņ”ØņØĆ ļŗżņ¢æĒĢ£ ņøÉņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØļÉĀ ņłś ņ׳ņ¢┤ TTR ļŗ©ļÅģņ£╝ļĪ£ļŖö ĒśłņĀä ļ░Å ņČ£ĒśłĒĢ®ļ│æņ”Ø ļ░£ņāØņØś ļīĆļ”¼Ļ▓░Ļ│╝(surrogate outcome)ļĪ£ ņé¼ņÜ®ļÉśĻĖ░ļŖö ņ¢┤ļĀĄļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[16].
ņÖĆĒīīļ”░ ņÜ®ļ¤ēņĪ░ņĀłņØś Ļ┤Ćļ”¼ļ¬©ļŹĖņØĆ Ļ▓ĮĒŚśņŚÉ ņØśĒĢ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö ņÜ®ļ¤ēņĪ░ņĀłņŚÉ ļ╣äĒĢ┤ ĒĢŁņØæĻ│ĀĒü┤ļ”¼ļŗē(anticoagulation clinics), ņ╗┤Ēō©Ēä░ ĒöäļĪ£ĻĘĖļשņØä ĒåĄĒĢ£ ņÜ®ļ¤ēņĪ░ņĀł, INRņ×ÉĻ░Ć ļ¬©ļŗłĒä░ļ¦ü(patient self-testing) ļ░Å ņ×ÉĻ░ĆņĪ░ņĀł(patient self-management) ļ¬©ļŹĖņØä ņØ┤ņÜ®ĒĢśļŖö Ļ▓āņØ┤ Ļ┤Ćļ”¼ Ē¢źņāüņØä Ļ░ĆņĀĖņś¼ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś[17] Ēśäņ×¼ ĻĄŁļé┤ņŚÉņä£ļŖö ņØśļŻīĻĖ░Ļ┤ĆņŚÉ ļö░ļØ╝ ņé░ļ░£ņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŖö ņŗżņĀĢņØ┤ļŗż.
TTRņØĆ ņÜ®ļ¤ēņĪ░ņĀłņØś Ļ┤Ćļ”¼ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ņ¢┤ Kim ļō▒[18]ņØĆ ĒśłņĀäĒü┤ļ”¼ļŗēņØś Ļ▓ĮĒŚśņĀü ņÜ®ļ¤ēņĪ░ņĀłņŚÉņä£ ņÜ®ļ¤ēņĪ░ņĀł ņĢīĻ│Ā ļ”¼ļō¼ņ£╝ļĪ£ ņĀäĒÖś Ēøä 67.2%ņŚÉņä£ 73.2% (p< 0.001)ļĪ£ ņ”ØĻ░ĆļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. Niewlaat ļō▒[19]ņØĆ ļÅÖņØ╝ĒĢ£ ņÜ®ļ¤ēņĪ░ņĀł ņĢīĻ│Āļ”¼ļō¼ņØä ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņ╗┤Ēō©Ēä░ļź╝ ņØ┤ņÜ®ĒĢ£ ņÜ®ļ¤ēņĪ░ņĀłņŚÉ ļ╣äĒĢ┤ņä£ļÅä ņŚ┤ļō▒ĒĢśņ¦Ć ņĢŖļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņŚ¼(TTR 71.0%, 71.9%, p= 0.002) ĒĢŁņØæĻ│ĀĒü┤ļ”¼ļŗēņØ┤ļéś ņ╗┤Ēō©Ēä░ ĒöäļĪ£ĻĘĖļשņØ┤ ņŚåļŖö ņØśļŻīņØĖņŚÉĻ▓īļÅä Ļ░äļŗ©ĒĢ£ ņÜ®ļ¤ēņĪ░ņĀł ņĢīĻ│Āļ”¼ļō¼ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÜ©Ļ│╝ņĀü Ļ┤Ćļ”¼Ļ░Ć Ļ░ĆļŖźĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ņĀĢļ¦źĒśłņĀäņ”Ø Ēæ£ņżĆņ╣śļŻīļ▓ĢņØĖ Ēæ£ņżĆĒŚżĒīīļ”░ ļ░Å ņÖĆĒīīļ”░ņØś Ļ▓ĮņÜ░ ņ×”ņØĆ ĒśłņĢĪņØæĻ│ĀĻ▓Ćņé¼(Ēæ£ņżĆĒŚżĒīīļ”░ņØś Ļ▓ĮņÜ░ aPTT, activated partial thromboplastin time, ņÖĆĒīīļ”░ņØś Ļ▓ĮņÜ░ INR) ļ¬©ļŗłĒä░ļ¦ü ļ░Å ņ¦ĆņåŹņĀüņØĖ ņÜ®ļ¤ēņĪ░ņĀłņØ┤ ĒĢäņÜöĒĢśļŗż. ņŻ╝ņé¼ņĀ£ņØĖ Ēæ£ņżĆĒŚżĒīīļ”░ņØĆ ĒÖśņ×ÉņŚÉĻ▓ī ļČłĒÄĖĻ░ÉņØä ņ┤łļלĒĢĀ ņłś ņ׳Ļ│Ā ņÖĆĒīīļ”░ņØĆ ņ╣śļŻī ļ▓öņ£äĻ░Ć ņóüĻ│Ā 36-42 ņŗ£Ļ░äņ£╝ļĪ£ ļ░śĻ░ÉĻĖ░Ļ░Ć ĻĖĖņ¢┤ ĒĢŁņØæĻ│Ā ĒÜ©Ļ│╝ņØś ļ░£Ēśä ļ░Å ņāüņćäņŚÉ ņĢĮ 5ņØ╝ņØ┤ ņåīņÜöļÉśļ®░ ļŗżņ¢æĒĢ£ ņØīņŗØ ļ░Å ņĢĮņĀ£ņÖĆņØś ņāüĒśĖņ×æņÜ®ņØ┤ ņ׳ņ¢┤ ņäĖņŗ¼ĒĢ£ ņŻ╝ņØśļź╝ ĒĢäņÜöļĪ£ ĒĢśļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ņĄ£ĻĘ╝ ņØ┤ļ¤¼ĒĢ£ ļŗ©ņĀÉņØä ļ│┤ņÖäĒĢśņŚ¼ Ļ▓ĮĻĄ¼Ēł¼ņŚ¼Ļ░Ć Ļ░ĆļŖźĒĢśĻ│Ā ĒśłņĢĪĻ▓Ćņé¼ ļ¬©ļŗłĒä░ļ¦üņØ┤ ĒĢäņÜö ņŚåĻ│Ā ņÜ®ļ¤ē ņĪ░ņĀłņØ┤ ĒĢäņÜö ņŚåņ£╝ļ®░ ņØīņŗØ Ēś╣ņØĆ ņĢĮņĀ£ņÖĆņØś ņāüĒśĖ ņ×æņÜ®ņØ┤ ņĀüņØĆ ņØ┤ņāüņĀüņØĖ ĒĢŁņØæĻ│ĀņĀ£Ļ░Ć Ļ░£ļ░£ļÉśņ¢┤ ņé¼ņÜ® ņżæņØ┤Ļ▒░ļéś ņé¼ņÜ®ņØä ņĢ×ļæÉĻ│Ā ņ׳ļŗż(Table 6).
ņ”ØņāüņØ┤ ņ׳ļŖö ĻĖēņä▒ ņĀĢļ¦źĒśłņĀäņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚśņŚÉņä£ ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļōżņØĆ ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ņĢłņĀäņä▒ņŚÉņä£ Ēæ£ņżĆ ņ╣śļŻīņØĖ ņÖĆĒīīļ”░ņØä ņĀüņĀłĒ׳ ņÜ®ļ¤ē ņĪ░ņĀłĒĢśņśĆņØä ļĢī(TTR, 55-65%)ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņŚ┤ļō▒ĒĢśņ¦Ć ņĢŖņĢśņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[22-24]. ĒÅÉņāēņĀäņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Rivaroxaban ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░(EINSTEIN-PE) INR ļ¬©ļŗłĒä░ļ¦üņØ┤ ĒĢäņÜöĒĢ£ ņÖĆĒīīļ”░ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ 50%ņØś ņŻ╝ņÜö ņČ£Ēśł Ļ░ÉņåīĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż(Tables 8 and 9).
ņ×¼ļ░£ņØś Ļ│Āņ£äĒŚśĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ĻĖēņä▒ĻĖ░ ņ╣śļŻī Ēøä 6Ļ░£ņøö ņØ┤ņāü ņŚ░ņןņ╣śļŻī(extended therapy)ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ĻĘĖ ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ņĢłņĀäņä▒ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[23,25,26]. ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļŖö ņ£äņĢĮņØä Ēł¼ņŚ¼ĒĢ£ ņÜ░ņøöņä▒ Ļ▓Ćņ”ØņŚÉņä£ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£Ļ░ÉņåīņŚÉļŖö ĒśäņĀĆĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņśĆņ¦Ćļ¦ī ņČ£ĒśłņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ņ╝░Ļ│Ā, DabigatranĻ│╝ ļīĆņĪ░ĻĄ░ņ£╝ļĪ£ ņÖĆĒīīļ”░ņØä Ēł¼ņŚ¼ĒĢ£ ļ╣äņŚ┤ļō▒ņä▒ Ļ▓Ćņ”Ø(REMEDY)ņŚÉņä£ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£Ļ░ÉņåīņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ¦Ćļ¦ī ņÖĆĒīīļ”░ņŚÉ ļ╣äĒĢ┤ ņČ£ĒśłņØś ņ£äĒŚśņØä 50% Ļ░Éņåīņŗ£ņ╝░ļŗż(Tables 8 and 10).
ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļŖö ņØ┤ļ»Ė ņĢīļĀżņ¦ä ņןņĀÉ ņØ┤ņÖĖņŚÉļÅä ĒÜ©Ļ│╝ņØś ļ░£Ēśä ļ░Å ņāüņćäĻ░Ć ļ╣Āļź┤Ļ▓ī ļéśĒāĆļéśĻĖ░ ļĢīļ¼ĖņŚÉ ņłśņłĀ ļ░Å ņŗ£ņłĀņØś Ļ▓ĮņÜ░ Ļ░ĆĻĄÉņ╣śļŻī(bridging therapy) ņŚåņØ┤ ņĢĮņĀ£Ēł¼ņŚ¼ļź╝ ņĄ£ņåīĒĢ£ 24ņŗ£Ļ░ä ņØ┤ņĀäņŚÉ ņżæļŗ©ņØä ĒĢ©ņ£╝ļĪ£ņŹ© ĒśłņĀäņ£äĒŚś ļ░Å ņČ£Ēśłņ£äĒŚśņØä ņĄ£ņåīĒÖöĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņĢĮņĀ£ņØś ņŻ╝ļÉ£ ļ░░ņäżĻ▓ĮļĪ£Ļ░Ć ņŗĀņןņ£╝ļĪ£ ņŗĀĻĖ░ļŖź ņĀĆĒĢś ĒÖśņ×ÉņŚÉņä£ļŖö ĒĢŁņØæĻ│Ā ĒÜ©Ļ│╝ņØś ņåīņŗżĻ╣īņ¦Ć ļŹö ļ¦ÄņØĆ ņŗ£Ļ░äņØä ĒĢäņÜöļĪ£ ĒĢśļ»ĆļĪ£ ņČ£Ēśł Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØĆ Ļ│Āņ£äĒŚśĻĄ░ Ēś╣ņØĆ ņÖäņĀäĒĢ£ ņ¦ĆĒśłņØä ĒĢäņÜöļĪ£ ĒĢśļŖö ņŻ╝ņÜö ņłśņłĀ ļ░Å ņŗ£ņłĀ ņĀä ņżæļŗ© ĻĖ░Ļ░äņØä ņŚ░ņןĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż(Table 11) [27].
ļŹö ņØ┤ņāü ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļź╝ Ēł¼ņŚ¼ĒĢĀ ņłś ņŚåņØä ļĢīļŖö ņÖĆĒīīļ”░ņ£╝ļĪ£ņØś ņĀäĒÖśņØä ĒĢśņŚ¼ņĢ╝ ĒĢśļŖöļŹ░ ņØ┤ļĢī Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢĀ ņé¼ĒĢŁņØĆ ņÖĆĒīīļ”░ņØś ĒĢŁņØæĻ│ĀĒÜ©Ļ│╝Ļ░Ć ļéśĒāĆļéśĻĖ░Ļ╣īņ¦Ć ņĢĮ 5ņØ╝ņØ┤ ņåīņÜöļÉ£ļŗżļŖö ņĀÉĻ│╝ ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ņØś ņŗĀņןĻĖ░ļŖźņŚÉ ļö░ļźĖ ņ×æņÜ®ņŗ£Ļ░äņØä Ļ│ĀļĀżĒĢśņŚ¼ Ēł¼ņŚ¼ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż(Table 12) [27].
ņĢĮļ¼╝ Ļ░äņØś ņāüĒśĖņ×æņÜ®ņ£╝ļĪ£ dabigatranņØĆ ņןļ▓Į(intestinal wall)ņØä ĒåĄĒĢ┤ ņĀäļŗ¼ļÉśļŖö P-glycoprotein (P-gp)ņŚÉ ņØśņĪ┤ņĀüņ£╝ļĪ£ P-gP ņ£ĀļÅäņĀ£(inducer) Ēś╣ņØĆ ņĀĆĒĢ┤ņĀ£(inhibitor)ņÖĆ ņāüĒśĖņ×æņÜ®ņØä ĒĢśĻ│Ā, rivaroxabanņØĆ P-gPņÖĆ microsomal enzyme CYP3A4ņØś ņ£ĀļÅäņĀ£ Ēś╣ņØĆ ņĀĆĒĢ┤ņĀ£ņÖĆ ņāüĒśĖņ×æņÜ®ņØä ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ░Éļ¤ē Ēś╣ņØĆ ņ”Øļ¤ēņØ┤ ĒĢäņÜöĒĢśļŗż[27]. P-gPņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö ņĢĮņĀ£ļŖö ņĄ£ņåīĒĢ£ 64Ļ░Ćņ¦ĆņØś ņĢĮņĀ£Ļ░Ć ņĢīļĀżņĀĖ ņ׳ņ¦Ćļ¦ī ņŗżņĀ£ļĪ£ ļ¬ć Ļ░Ćņ¦ĆņØś ņĢĮņĀ£ļ¦īņØ┤ ĒĢ©Ļ╗ś Ēł¼ņŚ¼ņŗ£ ņ×äņāüņĀüņ£╝ļĪ£ ņżæņÜöĒĢ£ ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż(Table 13).
ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØĆ ņČ£ĒśłĒĢ®ļ│æņ”Ø ļ░£ņāØņ£äĒŚśņØ┤ ņ×Āņ×¼ļÉśņ¢┤ ņ׳ņ£╝ļ»ĆļĪ£ ĒĢŁņØæĻ│ĀņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśļŖö ņ×äņāüņØśņé¼ļŖö ņĢĮņĀ£ņØś ņ×æņÜ®ĻĖ░ņĀä, ļ░░ņäżĻ▓ĮļĪ£ ļ░Å ļ░śĻ░ÉĻĖ░ļź╝ ņłÖņ¦ĆĒĢśĻ│Ā ņ׳ņ¢┤ņĢ╝ ĒĢ£ļŗż. ņČ£ĒśłņØä ņŚŁņĀäņŗ£ĒéżļŖö ņĢĮņĀ£ņØś ņäĀĒāØņØĆ ņĢĮņĀ£ņØś ņĢĮļ”¼ĒĢÖņĀü ņ×æņÜ®, ņØæĻĖēņāüĒÖ®ņŚÉ ļīĆĒĢ£ ņ×äņāüņĀü ĒīÉļŗ©, ņČ£ĒśłņØś ņŗ¼Ļ░üĒĢ£ ņĀĢļÅäņŚÉ ļö░ļØ╝ ņäĀĒāØļÉĀ ņłś ņ׳ļŗż. ņČ£ĒśłņØä ņŚŁņĀäņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņäĀĒāØņ£╝ļĪ£ 1) ņĢĮņĀ£Ēł¼ņŚ¼ ņżæļŗ© Ēøä Ļ┤Ćņ░░, 2) ļ¬ģļ░▒ĒĢ£ reversal agent Ēł¼ņŚ¼(ņśł, ņÖĆĒīīļ”░Ļ│╝ ļ╣äĒāĆļ»╝ K), 3) FFP(Fresh Frozen Plasma), aPCCs (activated Prothrombin Complex Concentrate)ņÖĆ Ļ░ÖņØĆ ņČöĻ░ĆņĀüņØĖ ĒśłņĢĪņØæĻ│ĀņØĖņ×É ļīĆņ▓┤ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØ┤ļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ņØś reversal agentļŖö ļČłļČäļ¬ģĒĢśņ¦Ćļ¦ī Ēśäņ×¼ ņäĀĒāØļÉĀ ņłś ņ׳ļŖö ļīĆņ▓┤ņĀ£ļŖö Ēæ£ 14ņÖĆ Ļ░Öļŗż[28].
ĻĄŁļé┤ņŚÉņä£ļŖö ņĀĢļ¦źĒśłņĀäņ”ØņØś ņśłļ░® ļ░Å ņ╣śļŻīņŚÉ ļīĆĒĢ┤ rivaroxabanņØ┤ ņŖ╣ņØĖņØä ļ░øņØĆ ņāüĒā£ņØ┤Ļ│Ā ļ│┤ĒŚśĻĖēņŚ¼ļŖö Ēśäņ×¼ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”ØņØś ņśłļ░® ļ░Å ņ╣śļŻīņŚÉ ļīĆĒĢ┤ņä£ rivaroxabanļ¦īņØ┤ ņØĖņĀĢļ░øņØĆ ņāüĒā£ņØ┤ļŗż.
ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļŖö ĒśłņĢĪĻ▓Ćņé¼ ļ¬©ļŗłĒä░ļ¦üņØä ĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ĒÖśņ×ÉņØś ņĢĮņĀ£ ļ│ĄņÜ®ņŚÉ ļīĆĒĢ£ ņł£ņØæļÅä ļ░Å ņ╣śļŻīņŗżĒī©ļź╝ ĒÅēĻ░ĆĒĢĀ ņłś ņŚåņ£╝ļ®░ ņÜ®ļ¤ēļ│ĆĒÖöļź╝ ĒåĄĒĢ£ ĒĢŁņØæĻ│ĀņĀ£ Ļ░ĢļÅäļź╝ ņĪ░ņĀłĒĢĀ ņłś ņ׳ļŖö ĻĖ░ņżĆņØ┤ ņĀ£ņŗ£ļÉ£ ļ░ö ņŚåļŗż. Ļ│ĀĻ░ĆņØś ņĢĮņĀ£ļ╣äĻ░Ć ņåīņÜöļÉśļŖö Ļ▓ā ļśÉĒĢ£ ņĢĮņĀ£ ņé¼ņÜ®ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ ņ¦ĆņĀüļÉśĻ│Ā ņ׳ļŗż.
ĻĄŁļé┤ ņĀĢļ¦źĒśłņĀäņ”ØņØś ļ░£ņāØ ļ╣łļÅäļŖö 2008ļģä 7,300ļ¬ģļŗ╣ 1ļ¬ģņØ┤ ļ░£ņāØĒĢśņśĆļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłņ¦Ćļ¦ī ņĀÉņ░© ņ”ØĻ░ĆĒĢśļŖö ņČöņäĖļĪ£ ņ¦ĆņåŹņĀüņØĖ Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļŗż. ņĀĢļ¦źĒśłņĀäņ”ØņØś ĒĢŁņØæĻ│Āņ╣śļŻī ĻĖ░Ļ░äņØĆ ņĄ£ņåī 3Ļ░£ņøö ņØ┤ņāüņ£╝ļĪ£ ņČ£Ēśłņ£äĒŚśņØ┤ Ēü¼ņ¦Ć ņĢŖĻ│Ā ņ×¼ļ░£ņØś ņ£äĒŚśņØ┤ Ēü░ Ļ▓ĮņÜ░ ņŚ░ņןņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļ®░ ņĀĢĻĖ░ņĀüņØĖ ĒÅēĻ░ĆĻ░Ć ĒĢäņÜöĒĢśļŗż. Ēæ£ņżĆņ╣śļŻīņØĖ ņÖĆĒīīļ”░ņØä Ēł¼ņŚ¼ĒĢśļŖö Ļ▓ĮņÜ░ ņ╣śļŻī ĻĄ¼Ļ░ä ļé┤ ņŗ£Ļ░äņØä ĒåĄĒĢ┤ ņ╣śļŻīņØś ņ¦łņĀü Ļ┤Ćļ”¼ļź╝ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳Ļ│Ā Ēæ£ņżĆĒÖöļÉ£ ņÜ®ļ¤ēņĪ░ņĀł ņĢīĻ│Āļ”¼ļō¼ņØä ņØ┤ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ņ¦łņĀü Ē¢źņāüņØä Ļ░ĆņĀĖņś¼ ņłś ņ׳ļŗż. ļśÉĒĢ£ Ēæ£ņżĆ ĒĢŁņØæĻ│Āņ╣śļŻīņĀ£ņØĖ ņÖĆĒīīļ”░ņØś ļŗ©ņĀÉņØä ļ│┤ņÖäĒĢ£ ņāłļĪ£ņÜ┤ Ļ▓ĮĻĄ¼ņÜ® ĒĢŁņØæĻ│ĀņĀ£ļŖö ļ¬©ļŗłĒä░ļ¦ü ņŚåņØ┤ļÅä ņ×¼ļ░£ ļ░Å ņČ£Ēśł ļ░£ņāØļźĀņŚÉņä£ Ēæ£ņżĆ ņ╣śļŻīņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņ£Āņé¼ĒĢśĻ▒░ļéś ņÜ░ņøöĒĢśņśĆņ£╝ļ®░ ņŗĀĻĖ░ļŖźņןņĢĀĻ░Ć ņ׳ļŖö ĒÖśņ×ÉņŚÉĻ▓ī Ēł¼ņŚ¼ĒĢĀ ļĢīļŖö Ļ░Éļ¤ē ļ░Å ĻĖ░Ļ░ä ņŚ░ņן ļō▒ ņäĖņŗ¼ĒĢ£ ņŻ╝ņØśļź╝ ņÜöĒĢ£ļŗż.
REFERENCES
1. Jang MJ, Bang SM, Oh D. Incidence of venous thromboembolism in Korea: from the Health Insurance Review and Assessment Service database. J Thromb Haemost 2011;9:85ŌĆō91.


2. Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl):e419SŌĆō494S.

3. Agnelli G, Prandoni P, Santamaria MG, et al. Three months versus one year of oral anticoagulant therapy for idiopathic deep venous thrombosis: Warfarin Optimal Duration Italian Trial Investigators. N Engl J Med 2001;345:165ŌĆō169.


4. Boutitie F, Pinede L, Schulman S, et al. Influence of preceding length of anticoagulant treatment and initial presentation of venous thromboembolism on risk of recurrence after stopping treatment: analysis of individual participantsŌĆÖ data from seven trials. BMJ 2011;342:d3036.

5. Schulman S, Granqvist S, Holmstr├Čm M, et al. The duration of oral anticoagulant therapy after a second episode of venous thromboembolism: the Duration of Anticoagulation Trial Study Group. N Engl J Med 1997;336:393ŌĆō398.


6. Garcia DA, Baglin TP, Weitz JI, Samama MM; American College of Chest Physicians. Parenteral anticoagulants: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 suppl):e24SŌĆō43S.

7. Schulman S. Advances in the management of venous thromboembolism. Best Pract Res Clin Haematol 2012;25:361ŌĆō377.


8. Goudable C, Saivin S, Houin G, et al. Pharmacokinetics of a low molecular weight heparin (Fraxiparine) in various stages of chronic renal failure. Nephron 1991;59:543ŌĆō545.


9. Becker RC, Spencer FA, Gibson M, et al. Influence of patient characteristics and renal function on factor Xa inhibition pharmacokinetics and pharmacodynamics after enoxaparin administration in non-ST-segment elevation acute coronary syndromes. Am Heart J 2002;143:753ŌĆō759.


10. Sanderink GJ, Guimart CG, Ozoux ML, Jariwala NU, Shukla UA, Boutouyrie BX. Pharmacokinetics and pharmacodynamics of the prophylactic dose of enoxaparin once daily over 4 days in patients with renal impairment. Thromb Res 2002;105:225ŌĆō231.


11. Lim W, Dentali F, Eikelboom JW, Crowther MA. Meta-analysis: low-molecular-weight heparin and bleeding in patients with severe renal insufficiency. Ann Intern Med 2006;144:673ŌĆō684.


12. B├╝ller HR, Davidson BL, Decousus H, et al. Subcutaneous fondaparinux versus intravenous unfractionated heparin in the initial treatment of pulmonary embolism. N Engl J Med 2003;349:1695ŌĆō1702.


13. B├╝ller HR, Davidson BL, Decousus H, et al. Fondaparinux or enoxaparin for the initial treatment of symptomatic deep venous thrombosis: a randomized trial. Ann Intern Med 2004;140:867ŌĆō873.



14. Rosendaal FR, Cannegieter SC, van der Meer FJ, Bri├½t E. A method to determine the optimal intensity of oral anticoagulant therapy. Thromb Haemost 1993;69:236ŌĆō239.


15. Veeger NJ, Piersma-Wichers M, Tijssen JG, Hillege HL, van der Meer J. Individual time within target range in patients treated with vitamin K antagonists: main determinant of quality of anticoagulation and predictor of clinical outcome: a retrospective study of 2300 consecutive patients with venous thromboembolism. Br J Haematol 2005;128:513ŌĆō519.


16. Van Walraven C, Oake N, Coyle D, Taljaard M, Forster AJ. Changes in surrogate outcomes can be translated into clinical outcomes using a Monte Carlo model. J Clin Epidemiol 2009;62:1306ŌĆō1315.


17. Holbrook A, Schulman S, Witt DM, et al. Evidence-based management of anticoagulant therapy: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl):e152SŌĆō184S.

18. Kim YK, Nieuwlaat R, Connolly SJ, et al. Effect of a simple two-step warfarin dosing algorithm on anticoagulant control as measured by time in therapeutic range: a pilot study. J Thromb Haemost 2010;8:101ŌĆō106.


19. Nieuwlaat R, Hubers LM, Spyropoulos AC, et al. Randomised comparison of a simple warfarin dosing algorithm versus a computerised anticoagulation management system for control of warfarin maintenance therapy. Thromb Haemost 2012;108:1228ŌĆō1235.


20. Adam SS, McDuffie JR, Ortel TL, Williams JW Jr. Comparative effectiveness of warfarin and new oral anticoagulants for the management of atrial fibrillation and venous thromboembolism: a systematic review. Ann Intern Med 2012;157:796ŌĆō807.


21. Weitz JI, Eikelboom JW, Samama MM; American College of Chest Physicians. New antithrombotic drugs: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl):e120SŌĆō151S.

22. Schulman S, Kearon C, Kakkar AK, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009;361:2342ŌĆō2352.

23. Bauersachs R, Berkowitz SD, Brenner B, et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363:2499ŌĆō2510.


24. B├╝ller HR, Prins MH, Lensin AW, et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012;366:1287ŌĆō1297.


25. Agnelli G, Buller HR, Cohen A, et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368:699ŌĆō708.


26. Schulman S, Kearon C, Kakkar AK, et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013;368:709ŌĆō718.


Estimated cumulative risk of recurrent VTE after stopping anticoagulant therapy. Estimated annualized risk of recurrence in cancer-associated VTE: 15%.
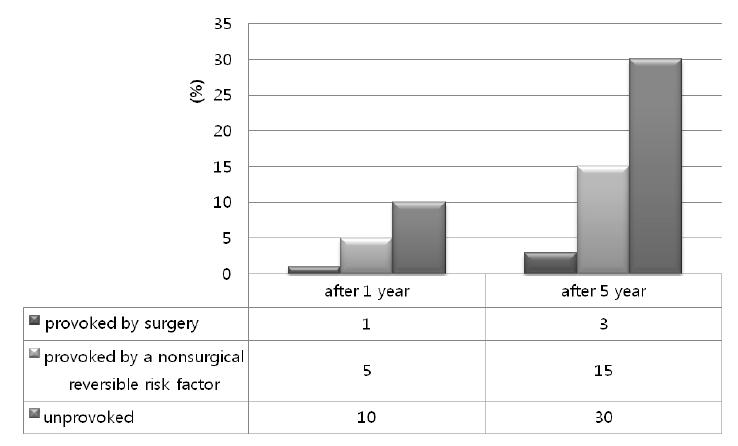
Figure┬Ā1.
Estimated absolute risk of major bleeding, %. Bleeding without anticoagulation (baseline risk), the increase with anticoagulation (increased risk), and the sum of these.
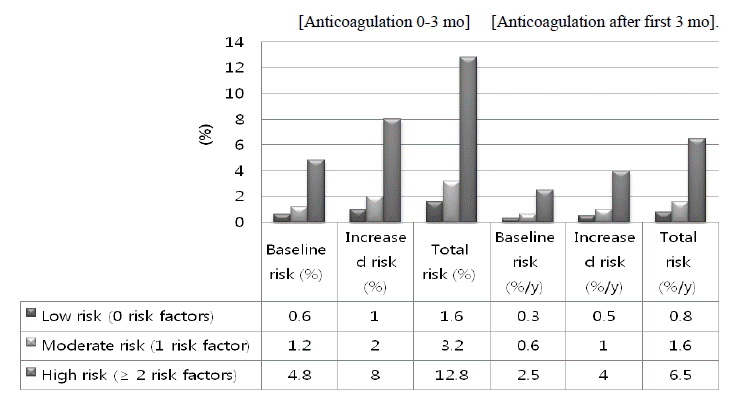
Figure┬Ā2.
Coagulation enzyme targets for the new oral anticoagulants. TF, tissue factor; DTI, direct thrombin inhibitor.
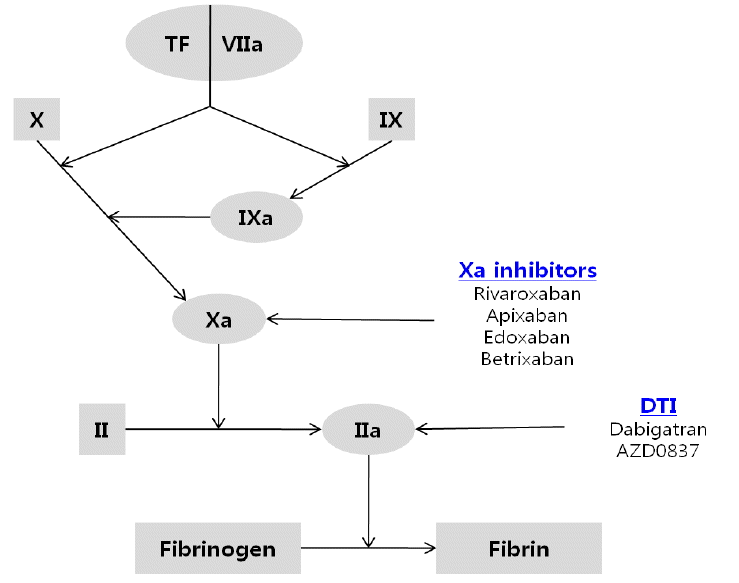
Figure┬Ā3.
Table┬Ā1.
Summary of recommendations regarding the duration of anticoagulation in patients with VTE (ACCP 9th Edition)
Table┬Ā2.
Risk factors for bleeding with anticoagulant therapy (ACCP 9th Edition)
Table┬Ā3.
Dose adjustment nomogram of unfractionated heparin
Table┬Ā4.
Biologic consequences of reduced binding of LMWH to plasma proteins and cells
Table┬Ā5.
Usual dosage and target ranges for VTE treatment of LMWH
| Agents | Dosage | Target range (anti-Xa units/mL)a |
|---|---|---|
| Dalteparin (Fragmin®) | 200 IU/kg once daily | 1.05 |
| Enoxaparin (Clexane®) | 1 mg/kg twice daily | 0.6-1.0 |
| Nadroparin (Fraxiparin®) | 85.5 IU/kg twice daily | 0.5-1.1 |
| Tinzaparin (Innohep®) | 175 IU/kg once daily | 0.85 |
Table┬Ā6.
Properties of an ideal anticoagulant versus currently available agents
Table┬Ā7.
Comparison of the pharmacologic properties of the new oral anticoagulants
Table┬Ā8.
Phase III studies for VTE treatment
Table┬Ā9.
Results with the new oral anticoagulants in comparison with vitamin K antagonists for initial treatment of VTE
Table┬Ā10.
Results with the new oral anticoagulants in comparison with vitamin K antagonists or placebo for extended treatment of VTE
Table┬Ā11.
Timing of interruption of dabigatran or rivaroxaban before surgery or invasive procedures
| Calculated creatinine clearance, mL/min | Half-life, hours |
Timing of last dose before surgery |
|
|---|---|---|---|
| Standard risk of bleedinga | High risk of bleedingb | ||
| Dabigatran | |||
| ŌĆā> 80 | 13 (11-22) | 24 h | 2 d |
| ŌĆā50 < Ōēż 80 | 15 (12-34) | 24 h | 2 d |
| ŌĆā30 < Ōēż 50 | 18 (13-23) | 2 d | 4 d |
| ŌĆāŌēż 30 | 27 (22-35) | 4 d | 6 d |
| Rivaroxaban | |||
| ŌĆā> 30 | 12 (11-13) | 24 h | 2 d |
| ŌĆāŌēż 30 | Unknown | 2 d | 4 d |
Table┬Ā12.
Suggested strategy for conversion from dabigatran or rivaroxaban to warfarin
| Calculated creatinine clearance, mL/min | Dabigatran: start day with warfarina | Rivaroxaban: start day with warfarina |
|---|---|---|
| > 50 | Day-3 | Day-4 |
| 31-50 | Day-2 | Day-3 |
| 15-30 | Day-1 | Day-2 |
Table┬Ā13.
Drug interactions with at least 50% change in the exposure to dabigatran or rivaroxaban
| Mechanism |
Dabigatran |
Rivaroxaban |
||
|---|---|---|---|---|
| Interacting drug | Δ Exposure, % | Interacting drug | Δ Exposure, % | |
| P-gp inhibition | Ketoconazolea | 150 | Ketoconazolea | 160 |
| Quinidine | 53 | |||
| Amiodarone | 60 | |||
| Verapamil | ~50b | |||
| P-gp induction | Rifampicin | -67 | Rifampicin | -50 |
| St John.s wort | ND | St John.s wort | ND | |
| CYP3A4 inhibition | Ketoconazolea | 160 | ||
| Clarithromycin | 50 | |||
| Ritonavir | 50 | |||
| CYP3A4 induction | Rifampicin | -50 | ||
| St John.s wort | ND | |||
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 19,443 View
- 619 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



