이형 협심증 환자의 장기적 임상 예후에 영향을 미치는 인자
Predictive Factors for Long-term Clinical Outcomes in Patients with Variant Angina
Article information
Abstract
목적:
한국에서는 혈관 연축에 의하여 발생하는 변이형 협심증이 서양에 비하여 많으며, 이에 대한 국내 환자의 장기적 임상 예후에 관한 보고는 많지 않은 실정이다
방법:
1996년부터 2011년까지 전남대학교 병원 심장센터 심도자실에서 ergonovine 유발검사를 시행하였던 1,162예 중 양성 결과를 보였던 686예를 대상으로 40.2 ± 38.0개월간 추적관찰 기간 중 반복적인 흉통, 재입원, 심근경색증, 심장사, 관상동맥 조영술이 필요하였던 경우를 심장사건으로 정의하고 이가 발생하였던 153예(I군: 52.4 ± 11.0 세, 남:여 = 103:50)와 발생하지 않았던 533예(II군: 51.6 ± 10.7 세, 남:여 = 350:183)로 분류하였다. 양 군 간에 임상적 소견, 검사실 소견, 관상동맥 조영술 등을 비교하였다.
결과:
흡연력은 I군에서 II군보다 높았으며(45.8% vs. 36.3%, p = 0.037), 저밀도 지단백 콜레스테롤(119.4 ± 35.3 vs. 111.1 ± 32.2 mg/dL, p = 0.010) 수치도 I군에서 높았다. Cox 비례 위험 모형을 이용한 분석에서 유의한 심장사건 예측인자는 흡연이었다(HR 1.80, 95% CI 1.036-3.126, p = 0.037).
결론:
한국인 변이형 협심증 환자에서 흡연이 심장사건 발생의 유일한 예측인자이었다.
Trans Abstract
Background/Aims:
The incidence of variant angina (VA) is relatively high in Korea compared with western countries, but itslong-term clinical outcomes are not well defined.
Methods:
Patients who underwent ergonovine provocation tests at the cardiac catheterization laboratory of Chonnam NationalUniversity Hospital between 1996 and 2011 were enrolled in this study (n = 1162). Of them, 686 patients with positive ergonovineprovocation tests were divided into two groups: patients with cardiac events (Group I: 153 patients, 52.4 ± 11.0 years, M: F = 103:50) and those without (Group II: 533 patients, 51.6 ± 10.7 years, M: F = 350: 183). The mean follow-up duration was 40.2 ± 38.0months. Cardiac events were defined as cardiac death, recurrent ischemia, rehospitalization, myocardial infarction, and follow-upangiography. Clinical findings, laboratory and coronary angiographic characteristics were compared between the groups.
Results:
A history of smoking was more common in Group I than in Group II (45.8% vs. 36.3%, p = 0.037). The levels oflow-density lipoprotein cholesterol (119.4 ± 35.3 vs. 111.1 ± 32.2 mg/dL, p = 0.010) were higher in Group I than in Group II.According to Cox proportional hazard regression analysis, the major predictive factor for cardiac events during clinical follow-upwas smoking (HR 1.80, 95% CI 1.036-3.126, p = 0.037).
Conclusions:
A history of smoking was the only independent risk factor for cardiac events during a long-term clinical follow-up inKorean patients with variant angina. (Korean J Med 2013;84:522-530)
서 론
최근에 한국에서도 식이 습관의 변화, 평균 수명의 증가에 따른 고혈압 및 당뇨병의 증가로 인하여 협심증, 심근경색증과 같은 관상동맥 질환이 급증하고 있다. 특히 흡연율이 높은 한국에서는 혈관 연축에 의하여 발생하는 변이형 협심증이 많을 것으로 생각하며, 이에 대한 국내 환자의 특성을 관찰한 여러 보고가 있었으나[1-10], 장기적 임상경과에 관한 보고는 많지 않은 실정이다[5,8].
변이형 협심증은 1959년에 Prinzmetal 등[11]에 의하여 알려졌으며, 새벽 또는 아침에 잘 발생하는 안정시의 흉통과 심전도에서 ST 분절의 상승 등의 특징적인 증상을 보이고, 심한 경우에는 급성 심근경색증, 중증 부정맥 혹은 급사 등이 일어날 수 있다[12,13]. 한국인에서 발생하는 변이형 협심증의 경우에 서양과는 달리 의미 있는 관상동맥 질환을 가진 경우가 드물고 대부분 경미한 관상동맥 질환을 가지고 있어서, 자연경과에도 차이가 있을 것으로 생각한다.
본 연구에서는 이형 협심증의 진단 하에 ergonovine provocation test를 시행하였던 환자들을 전향적으로 등록한 후에 양성 결과를 보인 환자들을 대상으로 임상경과를 관찰하여 심장사건이 발생한 군과 발생하지 않은 군으로 나누어 각 군의 임상적 특징과 장기 예후 및 예후에 영향을 주는 인자들을 파악하였다.
대상 및 방법
연구 대상
1996년부터 2011년까지 전남대학교병원 심장센터 심도자실에서 관상동맥 조영술 및 ergonovine 연축유발검사를 시행하였던 1,162예(51.2 ± 11.5세)의 환자를 전향적으로 등록한 후 양성 결과를 보인 686예의 환자들을 대상으로 40.2 ± 38.0개월간 임상적 추적관찰 기간 중 심장사건 발생 유무에 따라서 2군으로 분류하였다. 심장사건 발생은 약물 요법에 반응하지 않는 흉통으로 인하여 재입원, 추적관상동맥 조영술 실시, 심근경색증, 사망 등으로 하였다. I군은 임상적 추적관찰 기간 중 심장사건이 발생하였던 군으로서 153예이었고 평균 나이는 52.4 ± 11.0세, 남자 103예, 여자 50예이었다. II군은 심장사건이 발생하지 않았던 환자로서 533예이었고 평균 나이는 51.6 ± 10.7세, 남자 350예, 여자 183예이었다.
연구 방법
임상적 특징은 환자의 나이, 성별, 신장, 체중, 신체질량지수, 비만률 등을 조사하였고 당뇨병, 고혈압, 이상지질혈증, 가족력, 흡연력 등에 대하여 분석하였고, 흡연력은 비흡연군, 흡연군으로 구분하였다.
당뇨병은 8시간 이상 금식 후에 측정한 공복 혈당이 126 mg/dL 이상 혹은 경구 당부하 검사 2시간 후 혈당이 200 mg/dL 이상인 경우를 당뇨병이라 하였다[14]. 경구용 혈당강하제를 복용하고 있거나 인슐린 주사를 맞고 있는 환자도 당뇨병 환자로 분류하였다. 고혈압은 평균 수축기/이완기 혈압이 140/90 mmHg 이상 혹은 고혈압 기왕력이 있거나 항고혈압제를 복용하고 있는 경우에 고혈압이라 진단하였다[15].
이상지질혈증은 총 콜레스테롤이 240 mg/dL 이상, 중성지방이 200 mg/dL 이상, 저밀도지단백 콜레스테롤 130 mg/dL 이상, 고밀도 지단백 콜레스테롤이 40-50 mg/dL 이하일 때 혹은 지질저하제를 복용하고 있을 때에 이상지질혈증이라 진단하였다[16].
임상양상은 안정형 협심증, 불안정형 협심증, 심근경색증으로 구분하였다. 변이형 협심증은 불안정형 협심증에 포함하였다. 심근경색증의 진단은 30분 이상의 전형적인 흉통, 심전도 상 인접한 2개 이상의 분절에서 1 mm 이상의 ST분절의 지속적인 상승과 혈청 검사에서 creatine kinase, troponin이 양성인 경우로 하였다.
대상 환자 중 경구 항협심제를 투약하고 있었던 환자는 24시간 이상 투여를 중단한 후 관상동맥 조영술을 실시하였으며, 모든 환자들은 검사 전 아스피린은 300 mg을 투여하였다.
심초음파에서 좌심실 구혈율은 좌심실의 확장기말 용적에서 수축기말 용적을 빼고 확장기말 용적으로 나누어 측정하였다[17].
관상동맥 조영술은 주로 5 내지 6 French 관상동맥 도자(Judkins 또는 Amplatz catheter)를 이용하여 요골동맥 혹은 대퇴동맥을 통해 시술하였다. 관상동맥 조영술 실시 후 Philips사의 H5000 혹은 Allura 디지털 정량적 분석 프로그램을 이용하여 병변 최소 내경(minimal luminal diameter, MLD)을 측정 후, 병변의 최소 내경이 대조 내경(reference diameter, RD)보다 50% 이상 협착이 있는 경우에 유의한 협착이 있다고 정의하였다. 관상동맥 협착이 50% 이하로 유의한 협착이 없었던 환자들을 대상으로 ergonovine provocation test를 실시하였다.
관상동맥 연축 유발 검사는 관상동맥을 하나씩 선택하여 검사하였으며, 자발적 경련이 없는 경우 ergonovine을 관상동맥 내로 투여하고, 각 정주 후 2분 후에 조영술을 시행하였다. 투여량은 양성소견이 있을 때까지 1996년부터 2010년 1월까지는 3분 간격으로 5 μg, 10 μg, 30 μg을 관상동맥 내로 투여하였고, 2010년 2월부터 투여용량을 변경하여 우측관상동맥은 10 μg, 20 μg, 40 μg으로 투여하였고, 좌측관상동맥은 20 μg, 40 μg, 80 μg으로 순차적으로 증량 투여하였다[18]. 연축 유발 검사로 내경의 75% 이상의 감소와 흉통 등의 임상증상 및 심전도에서 해당하는 유도에 ST 분절의 상승이 있는 경우를 양성으로 하고, nitroglycerin을 관상동맥 내로 투여하여 경련의 소실여부를 확인 후 변이형 협심증으로 확진하였다. 경련 소실 후 50% 이상의 기저 관상동맥 병변이 있는 경우는 본 연구의 대상에서 제외하였다.
운동은 1주일간 하루 총 30분 이상 걷는 운동을 3회 이상을 시행한 경우로 정의하였고 가벼운 운동, 출퇴근이나 여가 시간에 걷기 혹은 요가 등도 운동 시간으로 포함시켰다[19].
통계 분석 방법
모든 연속변수는 ‘평균 ± 표준편차’로 나타내었다. 양 군 내의 명목 변수의 비교는 Chi-square test로 분석하였고, 연속변수와 범주형 변수의 비교는 각각 Student's t-test와 Chi-square test를 이용하여 분석하였다. 양 군 간에 유의한 차이를 보이는 모든 변수 및 임상적으로 의미가 있다고 판단되는 변수에 관하여 Cox 비례 위험 모형(proportional hazard model)을 이용하여 회귀분석을 시행하였다. 모든 자료의 p 값이 0.05 이하인 경우, 통계적으로 유의하다고 판정하였다.
결 과
대상 환자의 임상적 특징
I군에서 발생한 심장사건은 심근경색증이 6예, 심장사 3예, 반복적인 흉통 10예, 재입원하여 임상적 관찰 및 치료를 하였던 66예, 입원 후 추적 관상동맥 조영술이 요구되었던 환자가 68예로서, 전체 대상 환자 중 153예에서 심장사건이 발생하였다.
I군에서 II군보다 추적관찰 기간이 길었으며, 연령 및 성별, 신장 등은 양 군 간에 차이는 없었으며, 체중 및 체질량 지수, 비만율 등도 양 군 간에 차이는 없었다.
과거력에서 고혈압, 당뇨병, 고지혈증, 가족력, 관상동맥 질환 병력 등은 차이가 없었으나, 흡연력은 I군에서 II군보다 높았다(45.8% vs. 36.3%, p = 0.037) (Table 1).
초음파 및 검사실 소견
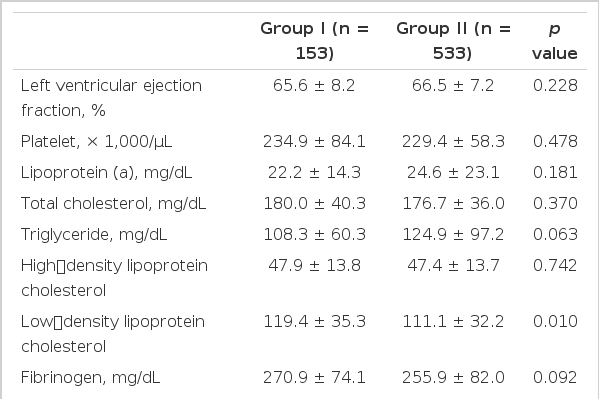
좌심실 구혈율은 양 군 간에 차이가 없었으며, 혈소판, 리포프로테인 리틀에이, 총 콜레스테롤, 고밀도 지단백 콜레스테롤 수치도 양 군 간에 차이가 없었으나, 중성지방 및 저밀도 지단백 콜레스테롤 등은 I군에서 II군보다 높았다. 피브리노겐, 혈당, creatine kinase-MB, troponin I, high sensitivity C-reactive protein, N-terminal pro-brain natriuretic peptide 등은 차이가 없었다(Table 2).
관상동맥 조영술 소견
각 군 사이에 혈관 연축이 발생한 예에서 완전 폐쇄병변, 다혈관 연축, 미만성 연축 등은 양 군 간에 차이가 없었다. 기저 병변이 있었던 예와 스텐트 시술 예 및 심근교가 동반되었던 예는 양 군 간에 차이가 없었다(Table 3).
생활 습관 개선 비교
I군에서 운동을 하였던 예(35.9% vs. 24.0%, p = 0.005), 스트레스 조절을 하였던 예(39.9% vs. 30.2%, p = 0.001), 추후 금연하였던 예(29.4% vs. 21.4%, p = 0.048), 식이요법을 하였던 예(27.5% vs. 19.3%, p = 0.039)가 더 많았다(Table 4).
흡연 유무에 따른 심장사건 발생 비교
심근경색증, 재발성 허혈, 추적 관상동맥 조영술 등은 양 군 간에 차이가 없었으나, 흡연을 하였던 군에서 사망률이 더 높아서(2.1% vs. 0.3%, p = 0.036), 전체 심장사건 발생은 흡연군에서 비흡연군보다 높았다(29.5% vs. 22.3%, p = 0.045) (Table 5).
심장사건 발생에 대한 위험인자
심장사건 발생에 대한 Cox 비례 위험 모형을 이용한 분석을 시행하였으며, 심장사건 발생의 독립적인 예측인자는 흡연력이었고, 나이, 남성, 고혈압, 당뇨병, 이상지질혈증, 좌심실 구혈율, 연축에 의한 관상동맥 완전폐쇄, serum creatinine, 저밀도 지단백 콜레스테롤, 고밀도 지단백 콜레스테롤, 비만, 스타틴 사용 여부 등은 유의한 예측인자가 아니었다(Table 6).
Statin 종류 및 투여 용량에 따른 효과 분석
Statin의 용량 및 종류는 atorvastatin이 전체의 12.4%에서 투여되어 가장 많은 환자에서 사용되었으며, rosuvastatin과 simvastatin은 각각 8.3%와 6.5%에서 사용되었다(Table 7). 가장 많이 사용되었던 세 가지 스타틴 사이에 주요심장사건 발생의 차이는 없었다(3.8% vs. 4.6% vs. 5.6%, p = 0.931). Atorvastatin은 상용량인 20 mg보다는 절반 용량인 10 mg을 70명(66.0%)이 사용하고 있었고, rosuvastatin은 80.6%의 환자가 상용량인 10 mg을 사용하였으며, simvastatin은 54.5%의 환자에서 상용량인 20 mg을 사용하고 있었다. 하지만 스타틴 용량에 있어서 저용량을 사용한 군과 상용량 이상을 사용한 군 사이에 주요 심장사건 발생율 차이는 존재하지 않았다(3.8% vs. 5.2%, p = 0.734).
고 찰
이 연구에서는 비교적 많은 한국인 이형 협심증 환자를 장기적으로 관찰하여 임상적 특징을 파악하고자 하였으며, 그 결과 22.3% 환자에서 재발성 흉통, 심근경색증, 사망, 재입원 혹은 추적 관상동맥 조영술 등 심장사건이 발생하였다. 또한 흡연이 한국인 이형 협심증의 장기적 예후와 관계됨을 알 수 있었다. 즉, 이형 협심증은 비교적 양호한 임상경과를 보이지만 많은 환자에서 심장사건이 발생할 수 있으므로 금연으로 이형협심증을 예방하고 적극적인 금연 교육으로 장기적 임상 예후를 개선시킬 수 있는 여지가 있음을 알 수 있었다.
변이형 협심증의 병태생리는 nitric oxide의 생성 감소, endothelial derived relaxing factors와 endothelial derived contracting factors의 불균형, 혈관 내피세포의 손상, 혈관 내 염증반응의 증가 등에 의한 관상동맥의 연축으로 생각되고 있으며, 경동맥 내막 두께의 상승이 관찰되어 조기 동맥경화병변으로도 간주되고 있다[20,21]. 한국인의 경우에 서양과는 달리 관상동맥 초음파 검사에 의하면 대부분 경미한 죽상반을 가지고 있으며[22], 자연경과도 안정형 혹은 불안정 협심증과는 차이가 있을 것으로 생각되어 생활습관 개선 등이 중요하며, 특히 흡연율이 높은 한국에서는 흡연과 관련된 혈관 연축에 의하여 발생하는 이형 협심증이 많을 것으로 생각되나 이에 대한 국내 환자의 임상적 특성에 관련한 보고는 매우 드문 실정이며[4], 한국형 이형 협심증 재발 방지를 위한 연구가 부족한 실정이다.
흡연은 이형 협심증 발생의 원인으로서 작용한다는 국내 보고가 있고[23], 본 연구의 결과에서 흡연이 이형 협심증 환자의 심장사건에 대한 유의한 예측인자였으며, 흡연군에서 재입원율, 심근경색증 등은 차이가 없었지만 사망율은 비흡연군보다 유의하게 높았다. 또한 흡연이 Cox 비례 위험 모형을 이용한 다변량 분석에서도 장기적 예후를 예측하는데 가장 중요한 인자였으므로 무엇보다도 금연이 이형 협심증의 발생을 줄일 수 있을 것으로 사료된다. 더욱이 이형 협심증 환자에서 금연교육을 시행하면 금연율을 높일 수 있고 flow-mediated endothelium dependent vasodilation (FMD)로 측정한 혈관내피세포 기능의 향상을 가져오며 혈청 일산화탄소 농도를 낮출 수 있음이 보고되어 있어서[24], 금연이 장기적으로 이형 협심증 환자의 예후를 개선시킬 수도 있을 것으로 생각한다. 273명의 이형 협심증 환자를 12년 동안 임상적으로 추적관찰한 최근의 연구에서도 흡연이 매우 중요한 예후 예측인자임이 최근에 보고된 바 있다[25].
본 연구에서 규칙적인 운동이 심폐기능의 향상을 가져오고 콜레스테롤 수치의 호전과 공복 및 식후 혈당 등의 강하를 도와 혈관 내피 기능 향상 및 이와 관련하여 관상동맥 수축에도 좋은 영향을 줄 것이라 생각하였으나, 오히려 운동을 시행한 군에서 결과가 더 좋지 않음을 확인하였다. 그러나 각종 문헌에도 운동선수에서 반복적인 관상동맥 연축이 있었다는 보고가 있으며[26], 경도의 협착이 있는 관상동맥에서 운동 매개성 관상동맥 연축에 대하여 "Prinzmetal X"라고 칭하며 그 중요성을 강조하기도 하여 본 연구와 일치하는 점을 보였다[27].
본 연구의 결과 단순 분석에서는 저밀도 지단백 콜레스테롤이 심장사건이 발생한 군에서 더 높은 수치를 보였는데, 이상지질혈증의 대표적인 치료약제인 스타틴 치료와 이형 협심증의 예후에 대한 보고는 거의 없는 실정이다. 다만 소수의 이형 협심증 환자에서 칼슘 길항제와 스타틴의 병합 요법이 혈관 연축과 oxidative stress를 줄여서 예후를 개선시킬 수 있음이 보고된 바 있으며[28], 64명의 이형 협심증 환자들에 대한 전향적인 무작위 연구에서 칼슘 길항제와 스타틴의 병합요법을 시행한 후 6개월째 1주일간 칼슘 길항제를 중단하고 시행한 심혈관 조영술에서 fluvastatin을 투여한 군이 그렇지 않은 군보다 acetylcholine 유발 혈관 연축이 더 적게 보고된 바는 있다(48% vs. 79%) [29]. 본 연구에서는 스타틴의 종류 및 용량에 따라서 주요심장사건 발생에 미치는 영향은 거의 없었다. 하지만 많은 환자를 대상으로 한 임상연구는 아직까지 거의 없는 실정이다. 스타틴이 혈관내피세포 기능을 개선시키고 혈관 내 염증반응을 억제하여 이형 협심증 환자의 예후를 개선시킬 가능성은 있으므로 향후 대규모의 전향적인 임상연구가 필요하다고 생각한다.
관찰 대상 환자에서 혈관확장제로서 칼슘 통로차단제는 심장사건 발생을 유의하게 줄이지 못하였지만, 다른 약제들을 찾아보자면 칼슘통로 차단제 및 nitrate뿐만 아니라 nitric oxide donor인 molsidomine과 nicorandil도 변이성 협심증에 효과가 있음이 밝혀진 바 있으며[30], molsidomine은 nitrate tolerance를 보인 환자에서 효과가 좋았다.
본 연구의 제한점은 1,162명의 환자에서 평균 추적관찰 기간은 40.2개월이었으나 6개월 미만의 단기간 추적관찰이 되었던 환자도 94예로서 비교적 많은 편이었으며, 운동, 금연, 스트레스 해소, 규칙적인 운동 요법 등의 생활습관의 변화가 심장사건이 발생한 군에서 더 많이 시행되었기 때문에 심장 사건이 발생한 이후의 경각심에 의한 생활습관의 변화인지 그 시점이 불명확했다는 점, 운동의 종류 및 강도 등과 연관성이 있었는지 자세히 파악할 수 없었다는 점 등이다. 심장사건의 정의에서 재입원의 사유가 모두 허혈성 증상의 악화였는지 정확하게 알 수 없었고, 증상 악화의 기준이 무엇인지 모호하였던 것은 임상가의 주관적인 판단에 의한 것이므로 본 연구의 제한점이라 할 수 있겠다. 또한 진료 시에 담배를 피우는 환자들에 대해 중립을 유지하려고 노력하였으나, 의식하지 못하는 사이에 흡연자들이 증상이 많이 재발할 것이라 생각하고 입원을 더 권유하는 편견이 작용하였을 수도 있어 추후 연구에서 주의할 점이라 생각한다.
결론적으로 한국인 이형 협심증 환자에서 장기간 임상경과를 관찰하였을 때 심장사건이 발생한 환자는 흡연력이 많았고 저밀도 지단백 콜레스테롤 수치가 높았으며, 흡연이 심장 사건 발생과 관계가 깊었다.