мДЬ л°†
1953лЕД CaplanмЭі мЭЉлґА кіСлґАлУ§мЧРмДЬ л•ШлІИнЛ∞мК§кіАм†ИмЧЉк≥Љ мІДнПРм¶ЭмЭі лПЩл∞ШнХЬ мВђл°Ак∞А мЮИмЭМмЭД м≤ШмЭМмЬЉл°Ь л≥ік≥†нХШмШАк≥†, мЭілКФ Caplan м¶ЭнЫДкµ∞мЬЉл°Ь л™Ел™ЕлРШмЧИлЛ§[1]. Caplan м¶ЭнЫДкµ∞(лШРлКФ л•ШлІИнЛ∞мК§мД± мІДнПРм¶Э)мЭА мІДнПРм¶Эк≥Љ нХ®кїШ нШИм≤≠ л•ШлІИнЛ∞мК§ мЭЄмЮРк∞А мЦСмД±мЭЄ л•ШлІИнЛ∞мК§кіАм†ИмЧЉ нЩШмЮРмЧРмДЬ мІДлЛ®лР† мИШ мЮИмЬЉл©∞, к≤∞нХµ л∞П мХЕмД± мҐЕмЦСмЭА л∞∞м†ЬлРШмЦімХЉ нХЬлЛ§[1]. нЩШмЮРлУ§мЭА лМАлґАлґД лЛ§л∞ЬмД± кіАм†ИнЖµмЭД нШЄмЖМнХШк≥†, нЭЙлґАмЧРмДЬ л•ШлІИнЛ∞мК§ к≤∞м†И л∞П мІДнЦЙмД± мҐЕкіімД± мДђмЬ†нЩФ(progressive massive fibrosis)мЩА кµђлґДлРШлКФ мЮСмЭА нБђкЄ∞мЭШ лЛ§л∞ЬмД± к≤∞м†ИмЭі лВШнГАлВШлКФ к≤ГмЭі нКємІХмЭіл©∞, нЭЙлІЙмЧЉмЭілВШ мЛђмЮ•лІЙмЧЉмЭА лУЬлђЉлЛ§[2]. мЭімЩА к∞ЩмЭА нШХнГЬмЭШ м¶ЭнЫДкµ∞мЭА нГДкіС кіСлґАлУ§ мЭімЩЄмЧРлПД мДЭл©імЭілВШ кЈЬмЖМмЧР лЕЄмґЬлРШмЧИлНШ лЛ§мЦСнХЬ мІДнПРм¶Э нЩШмЮРмЧРмДЬлПД лВШнГАлВ† мИШ мЮИлЛ§[3].
м†АмЮРлУ§мЭА кЈЬнПРм¶ЭмЬЉл°Ь мєШл£Мл∞ЫлНШ лПДм§С нЭЙмИШ л∞П мЛђмЮ•лІЙмХ°мЭі л∞ЬмГЭнХШмЧђ нШЄнЭ°к≥§лЮАмЭі мХЕнЩФлРЬ нЩШмЮРл•Љ л≥ік≤М лРШмЧИлЛ§. нЭЙмИШмЩА мЛђмЮ•лІЙмХ°мЧРмДЬ л•ШлІИнЛ∞мК§ мЭЄмЮРк∞А мГБмКєлРШмЦі мЮИк≥† к∞РмЧЉ лУ± мЭімЩЄмЭШ мЫРмЭЄлУ§мЭі л∞∞м†ЬлРШмЦі л•ШлІИнЛ∞мК§мД± мЮ•лІЙмЧЉмЭД мЫРмЭЄмЬЉл°Ь нМРлЛ®нХШмШАк≥†, м†ДмЛ† мК§нЕМл°ЬмЭілУЬ мєШл£М нЫД м¶ЭмГБк≥Љ мЮ•лІЙмЧЉмЭШ нШЄм†ДмЭД л≥імШАлЛ§. л≥Є м¶Эл°АлКФ мЮ•лІЙмЧЉмЬЉл°Ь л∞ЬнШДнХЬ лєДм†ДнШХм†БмЭЄ Caplan м¶ЭнЫДкµ∞мЬЉл°Ь мґФм†ХлРШл©∞, кЈЬнПРм¶ЭмЭД нПђнХ®нХЬ мІДнПРм¶Э нЩШмЮРмЧРмДЬ нЭЙмИШлВШ мЛђмЮ•лІЙмХ°мЭі л≥Сл∞ЬнХ† к≤љмЪ∞ л•ШлІИнЛ∞мК§мД± мЮ•лІЙмЧЉмЭД мЫРмЭЄмЬЉл°Ь к≥†л†§нХімХЉ нХ®мЭД мЛЬмВђнХШмЧђ л≥ік≥†нХШлКФ л∞ФмЭілЛ§.
м¶Э л°А
81мДЄ лВ®мЮР нЩШмЮРк∞А нШЄнЭ°к≥§лЮАмЭД м£ЉмЖМл°Ь мЩЄлЮШмЧР лВімЫРнХШмШАлЛ§. нЩШмЮРлКФ 20лМА нЫДл∞ШлґАнД∞ 10лЕДк∞Д мДЭмЮђл•Љ лґДмЗДнХШлКФ мІБмЧЕмЧР мҐЕмВђнХШмШАк≥†, 30лМА нЫДл∞ШлґАнД∞ мХљ 30лЕД лПЩмХИ нОШмЭЄнКЄ к≥µмЬЉл°Ь мЭЉнХШмШАлЛ§. 30лЕД м†Д нПРк≤∞нХµмЭД мІДлЛ®л∞Ык≥† мєШл£Мл∞ЫмЭА к≥Љк±∞놕мЭі мЮИмЧИлЛ§. 4лЕД м†Д нГА л≥СмЫРмЧРмДЬ кЈЬнПРм¶Эк≥Љ мІДнЦЙмД± мҐЕкіімД± мДђмЬ†нЩФл•Љ мІДлЛ®л∞ЫмХШк≥†, мЭінЫД лІИл•Є кЄ∞мє®мЭі мІАмЖНм†БмЬЉл°Ь мЮИмЧИмЬЉл©∞ лє®л¶ђ к±Јк±∞лВШ к≤љмВђмІД кЄЄмЭД мШ§л•Љ лХМ нШЄнЭ°к≥§лЮАмЭі мЮИмЦі мЩФлЛ§. мХљ 20мЭЉ м†ДлґАнД∞ кЄ∞мє®мЭі лПЩл∞ШлРШл©імДЬ нШЄнЭ°к≥§лЮАмЭі мХЕнЩФлРШмЧИлЛ§. л∞ЬмЧік∞РмЭА нШЄмЖМнХШмІА мХКмХШк≥† к∞ЭлЛімЭШ м¶Эк∞АлВШ нЩФлЖНмД± л≥АнЩФлКФ мЧЖмЧИмЬЉл©∞ к∞ЭнШИлПД мЧЖмЧИлЛ§. нЩЬ놕мІХнЫДлКФ нШИмХХ 136/72 mmHg, лІ•л∞ХмИШ 88/лґД, нШЄнЭ°мИШ 20/лґД, м≤імШ® 36.8вДГмШАк≥†, мВ∞мЖМнПђнЩФлПДлКФ 96%мШАлЛ§. нЭЙлґА м≤≠мІДмЧРмДЬ мЦСмЄ° нПРнХШмЧљмЧР мИШнПђмЭМмЭі лУ§л†ЄмЬЉл©∞ мЛђмЭМмЭА кЈЬмєЩм†БмЭімЧИк≥† мЛђмЮ°мЭМлПД лУ§л¶ђмІА мХКмХШлЛ§. кіАм†ИмЭШ лґАмҐЕ л∞П мХХнЖµмЭА мЧЖмЧИлЛ§. л∞±нШИкµђлКФ 5,300/mm3, нШИмГЙмЖМлКФ 13.7 g/dL, нШИмЖМнМРмЭА 186,000/mm3мШАк≥† к∞ДкЄ∞лК•к≥Љ мЛ†кЄ∞лК•, C-л∞ШмЭСмД± лЛ®л∞± мИШмєШлПД м†ХмГБмЭімЧИлЛ§. нЭЙлґАл∞©мВђмД† мВђмІДмЧРлКФ лґИкЈЬмєЩнХЬ мє®мЬ§мЭі мЦСмЄ° нПРмЭШ м†Дл∞ШмЧР к±Єм≥Р кіАм∞∞лРШл©∞ мЦСмЄ° мГБмЧљмЬЉл°Ь мҐЕкіімД± л≥Сл≥АлПД л≥імЭілВШ 4лЕД м†Дк≥Љ лєДкµРнХШмЧђ нБ∞ л≥АнЩФк∞А мЧЖмЧИк≥†, кЈЬнПРм¶Эк≥Љ мЭімЧР лПЩл∞ШнХЬ мІДнЦЙмД±мҐЕкіімД±мДђмЬ†нЩФ л∞П к≥Љк±∞мЭШ к≤∞нХµ к∞РмЧЉмЬЉл°Ь мЭЄнХЬ л≥Сл≥АмЬЉл°Ь нМРлЛ®лРШмЧИлЛ§. мЭімЩА лЛђл¶ђ мЦСмЄ° к∞ИлєДк∞Ал°ЬлІЙк∞БмЭШ лСФнЩФлКФ мГИл°≠к≤М л∞ЬмГЭнХЬ мЖМк≤ђмЭімЧИк≥†, мЄ°мЩАмЬД мШБмГБмЧРмДЬ нЭЙмИШк∞А нЩХмЭЄлРШмЦі мЪ∞мЄ°мЧРмДЬ нЭЙмИШ м≤ЬмЮРл•Љ мЛЬнЦЙнХШмШАлЛ§. нЭЙмИШмЭШ pHлКФ 7.0, л∞±нШИкµђлКФ 952/mm3мШАлЛ§. л∞±нШИкµђлКФ нШЄм§Скµђ 3%, л¶ЉнФДкµђ 30%, лМАмЛЭмДЄнПђ 66%мЭШ лґДнЪНмЭД л≥імШАлЛ§. нЭЙмИШмЭШ м†ЦмВ∞нГИмИШмЖМнЪ®мЖМ(lactate dehydrogenase)лКФ 506 IU/L, мХМлґАлѓЉмЭА 2.6 g/dLл°Ь мВЉмґЬмХ° мЖМк≤ђмЭімЧИк≥†, нПђлПДлЛємЭА 119 mg/dL, мљЬл†ИмК§нЕМл°§мЭА 19 mg/dLмШАмЬЉл©∞, мХФл∞∞мХДнХ≠мЫР(carcinoembryonic antigen)лПД 2.52 ng/mLл°Ь мГБмКєнХШмІА мХКмХШлЛ§. нЭЙмИШмЭШ мХДлН∞лЕЄмЛ†нГИмХДлѓЄлЕЄнЪ®мЖМ(adenosine deaminase)лКФ 33 IU/L, нХ≠мВ∞кЈ† лПДлІРк≤АмВђлКФ мЭМмД±, мДЄкЈ† л∞∞мЦСк≤АмВђмЧРмДЬ лПЩм†ХлРШлКФ лѓЄмГЭлђЉмЭА мЧЖмЧИлЛ§.
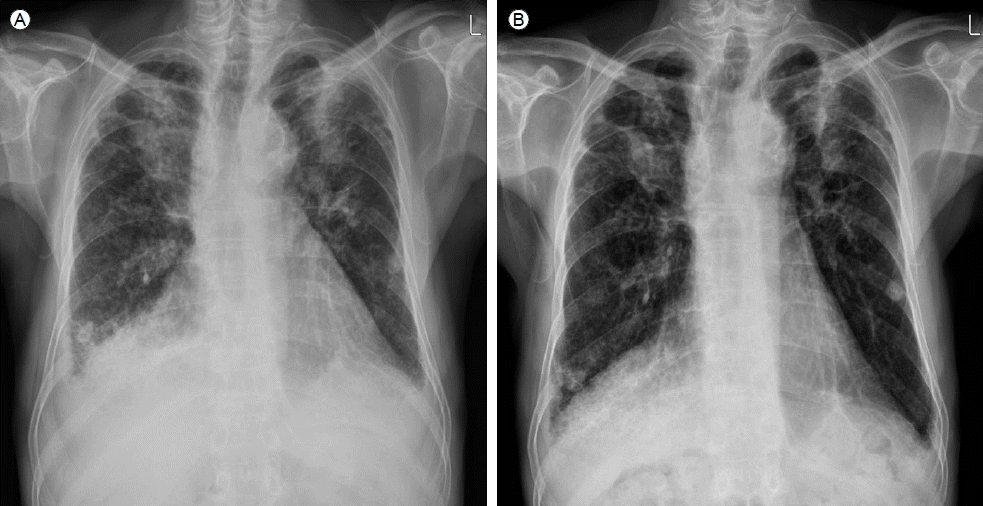
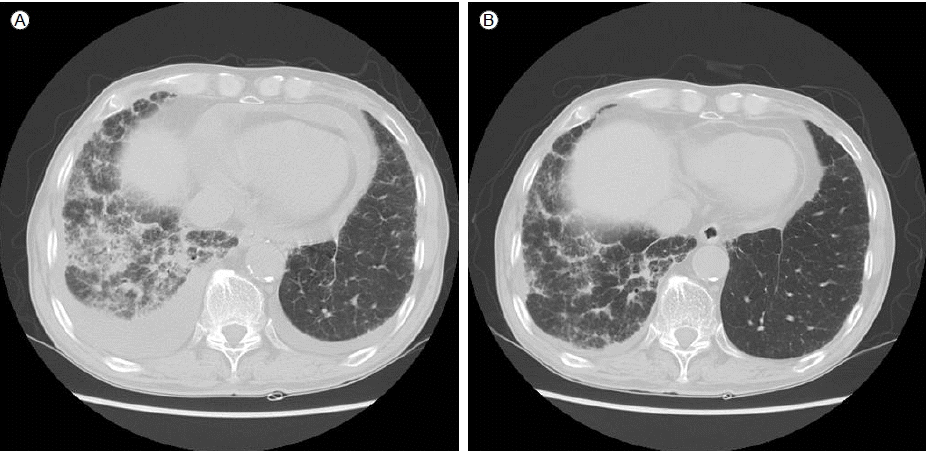
мЭЉм£ЉмЭЉ лТ§ нЩШмЮРлКФ нШЄнЭ°к≥§лЮАмЭі лНФмЪ± мХЕнЩФлРШмЧИлКФлН∞, нЭЙлґАл∞©мВђмД† мВђмІДмЧРмДЬ лСФнХімІД мЦСмЄ° к∞ИлєДк∞Ал°ЬлІЙк∞БмЭА кЈЄлМАл°ЬмШАк≥†, мЛђмЮ•мЭШ мЩЉм™љ к≤љк≥ДлКФ мЭім†Дк≥Љ лєДкµРнХШмЧђ л≥Љл°ЭнХім°МлЛ§(Fig. 1A). нЭЙлґА м†ДмВ∞нЩФлЛ®мЄµміђмШБмЭД мЛЬнЦЙнХШмШАлЛ§. мЪ∞мЄ°мЬЉл°Ь лНФ лІОмЭА мЦСмЭШ нЭЙмИШк∞А кіАм∞∞лРШмЧИк≥†, мЛђмЮ•лІЙмХ°лПД кіАм∞∞лРШмЧИлЛ§. мЪ∞мЄ° нХШмЧљмЬЉл°Ь лІЭмГБнШХмЭШ лґИкЈЬмєЩнХЬ л≥Сл≥АмЭі л≥імЭілКФлН∞, мЭім†ДмЧРлПД мЪ∞нХШмЧљмЭШ л≥Сл≥АмЭА кіАм∞∞лРШк≥† мЮИмЧИмЬЉлВШ л≥Сл≥АмЭШ л≤ФмЬДмЩА м†ХлПДк∞А лНФ мХЕнЩФлРШмЧИлЛ§(Fig. 2A). мЭімЦі мЛЬнЦЙнХЬ мЛђмЮ• міИмЭМнММ к≤АмВђмЧРмДЬ м§СлУ±лПД мЭімГБмЭШ мЛђмЮ•лІЙмХ°мЭД нЩХмЭЄнХШмШАк≥†, мЛђмЮ•лИМл¶Љм¶ЭмЭШ мЖМк≤ђмЭА л≥імЭімІА мХКмХШмЬЉлВШ мІДлЛ® л∞П мєШл£МмЭШ л™©м†БмЬЉл°Ь мЛђмЮ•лІЙ м≤ЬмЮРл•Љ мЛЬнЦЙнХШмШАлЛ§. мґФк∞А к≤АмВђл•Љ мЬДнХі нЭЙмИШ м≤ЬмЮРмЩА лІРміИнШИмХ° м±ДмЈ®лПД лЛ§мЛЬ мЛЬнЦЙнХШмШАлЛ§. нЩШмЮРмЭШ нШИм≤≠ л•ШлІИнЛ∞мК§мЭЄмЮРк∞А 119 IU/mLмЬЉл°Ь мГБмКєнХШмШАмЬЉл©∞, нЭЙмИШмЧРмДЬлКФ 130 IU/mL мЭімГБ, мЛђлВ≠мХ°мЧРмДЬлПД 31 IU/mLмЬЉл°Ь мГБмКєнХі мЮИмЧИлЛ§(Table 1). нШИм≤≠к≥Љ нЭЙмИШмЭШ нХ≠нХµнХ≠м≤і(anti-nuclear antibody)лКФ 1:40мЭімЧИк≥†, мЭімЩЄмЧР нШИм≤≠ нХ≠м§СмД±кµђмДЄнПђмІИнХ≠м≤і(anti-neutrophil cytoplamic antibody), нХ≠RoнХ≠м≤і(anti-Ro antibody), нХ≠LaнХ≠м≤і(anti-La antibody), Anti Scl 70 antibodyлПД мЭМмД±мЭімЧИлЛ§. нЭЙмИШмЩА мЛђмЮ•лІЙмХ°мЭА л™®лСР мВЉмґЬмД± мД±лґДмЭімЧИк≥†, к≤∞нХµмЭілВШ мХЕмД±мҐЕмЦСмЭШ м¶Эк±∞лКФ мЧЖмЧИлЛ§. кЄ∞кіАмІАлВімЛЬк≤љмЭД нЖµнХЬ мДЄм≤ЩмХ° к≤АмВђмЧРмДЬлПД к≤∞нХµкЈ†мЭілВШ мЭімГБ мДЄнПђлКФ кіАм∞∞лРШмІА мХКмХШлЛ§.
л•ШлІИнЛ∞мК§мД± нЭЙлІЙмЧЉк≥Љ мЛђмЮ•лІЙмЧЉмЭі л∞ЬмГЭнХШмЧђ нЩШмЮРмЭШ нШЄнЭ°к≥§лЮАмЭі мХЕнЩФлРЬ к≤ГмЬЉл°Ь нМРлЛ®нХШк≥† нФДл†ИлУЬлЛИмЖФл°† 0.5 mg/kgмЭД нХШл£® нХЬл≤И нИђмЧђнХШкЄ∞ мЛЬмЮСнХШмШАлЛ§. мєШл£М мЛЬмЮС мЭЉм£ЉмЭЉ нЫД нЩШмЮРлКФ нШЄнЭ°к≥§лЮАмЭі нШЄм†ДлРШмЧИк≥†, нФДл†ИлУЬлЛИмЖФл°†мЭД мЬ†мІАнХШл©імДЬ нЗімЫРнХШмШАлЛ§. 4м£Љ нЫД мЛЬнЦЙнХЬ нЭЙлґАл∞©мВђмД† мВђмІДмЧРмДЬлКФ мєШл£М м†Дк≥Љ лєДкµРнХШмЧђ нЭЙмИШк∞А к∞РмЖМнХЬ мЖМк≤ђмЭД л≥імШАк≥†(Fig. 1B), 2к∞ЬмЫФ нЫД мґФм†Бк≤АмВђнХЬ нЭЙлґА л∞©мВђмД†лЛ®мЄµміђмШБмЧРмДЬлПД мЦСмЄ°мЭШ нЭЙмИШк∞А к±∞мЭШ мЖМмЛ§лРШк≥†, мЛђмЮ•лІЙмХ°лПД к∞РмЖМнХЬ л™®мКµмЭі кіАм∞∞лРШмЧИлЛ§. лНФлґИмЦі мЪ∞нХШмЧљмЭШ л≥Сл≥АлПД мєШл£М м†Дл≥ілЛ§ нШЄм†ДлРШмЧИлЛ§(Fig. 2B). нЩШмЮРлКФ мЭінЫД 6к∞ЬмЫФ лПЩмХИ м¶ЭмГБмХЕнЩФ мЧЖмЭі мК§нЕМл°ЬмЭілУЬ к∞РлЯЙнХШл©∞ к≤љк≥ЉкіАм∞∞ м§СмЭілЛ§.
к≥† м∞∞
мЭі м¶Эл°АлКФ кЈЬнПРм¶Э нЩШмЮРмЧРмДЬ нЭЙлІЙмЧЉ л∞П мЛђмЮ•лІЙмЧЉ нШХнГЬл°Ь л•ШлІИнЛ∞мК§мІИнЩШмЭі л≥Сл∞ЬнХ† мИШ мЮИмЭМмЭД л≥імЧђм£Љк≥† мЮИлЛ§. кЈЬнПРм¶ЭмЭД лєДл°ѓнХЬ мІДнПРм¶Эк≥Љ л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЭШ мЧ∞кіАмД±мЭА Caplan м¶ЭнЫДкµ∞мЭД нЖµнХі мЮШ мХМ놧솪 мЮИлЛ§. Caplan м¶ЭнЫДкµ∞мЭА лУЬлђЄ мІИнЩШмЬЉл°Ь CaplanмЭА кЈЄ лєИлПДл•Љ мІДнПРм¶Э нЩШмЮР м§С мХљ 0.4%л°Ь л≥ік≥†нХШмШАлЛ§[1]. кµ≠лВімЭШ л∞ЬмГЭ лєИлПДмЧР лМАнХімДЬлКФ мЧ∞кµђк∞А мЧЖмЬЉл©∞, мХДмІБ м¶Эл°А л≥ік≥†мЭШ мИШм§АмЭілЛ§[3-5]. кЈЬнПРм¶Э нЩШмЮРмЧРмДЬ Caplan м¶ЭнЫДкµ∞мЭі л∞ЬмГЭнХШлКФ к≤љмЪ∞лПД мХМ놧솪 мЮИлКФлН∞, кµ≠лВі л≥ік≥†мЧРмДЬлПД мЭілЯђнХЬ мВђл°Ак∞А мЮИмЧИлЛ§[5]. л•ШлІИнЛ∞мК§кіАм†ИмЧЉк≥Љ мІДнПРм¶ЭмЭі мЧ∞кіАлРШлКФ кЄ∞м†ДмЧР лМАнХімДЬлКФ мХДмІБ м†ХнЩХнЮИ мХМ놧мІАмІА мХКмХШлЛ§[2]. лПЩлђЉ мЛ§нЧШмЧРмДЬ кЈЬмЖМ лґДмІДмЭД нЭ°мЮЕнХШмШАмЭД лХМ л•ШлІИнЖ†мЭілУЬ мЭЄмЮРмЩА мЬ†мВђнХЬ л©імЧ≠ кЄАл°ЬлґИл¶∞мЭШ мГЭмД±мЭі міЙмІДлРЬлЛ§лКФ мЧ∞кµђмЩА[6], мЭЄм≤імЧР мє®нИђнХЬ мЬ†л¶ђкЈЬмЖМк∞А л•ШлІИнЛ∞мК§мЭЄмЮРл•Љ нПђнХ®нХЬ мЧђлЯђ мЮРк∞АнХ≠м≤іл•Љ мГЭмД±нХ† мИШ мЮИлЛ§лКФ л≥ік≥†л•Љ л∞ФнГХмЬЉл°Ь кЈЬмЖМ лУ±мЭШ лґДмІДмЧР лЕЄмґЬлРШл©і мЮРк∞Ал©імЧ≠ л∞ШмЭСмЭі мЬ†л∞ЬлРШлКФ кЄ∞м†ДмЭі мЮИмЭД к≤ГмЬЉл°Ь мґФмЄ°нХ† мИШ мЮИлЛ§[7].
нХЬнОЄ, лЛ§мЦСнХЬ мЮРк∞Ал©імЧ≠мД± мІИнЩШмЧРмДЬ нЭЙлІЙ мВЉмґЬмЭД лПЩл∞ШнХ† мИШ мЮИлЛ§[8]. л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЧРмДЬлПД нЭЙлІЙ мВЉмґЬмЭА нЩШмЮРмЭШ мХљ 20%мЧРмДЬ лВШнГАлВШ лєДкµРм†Б нЭФнХЬ мЖМк≤ђмЭіл©∞[8], мЭЉлґАмЧРмДЬлКФ мЛђмЮ•лІЙмХ°к≥Љ лПЩл∞ШлРШкЄ∞лПД нХЬлЛ§[9]. нЭЙлІЙ мВЉмґЬмЭА л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЭШ мЬ†л≥С кЄ∞к∞ДмЭі кЄЄк≥†, л•ШлІИнЖ†мЭілУЬмЭЄмЮРмЭШ нХ≠м≤і мЧ≠к∞Ак∞А лЖТмЬЉл©∞, л•ШлІИнЛ∞мК§ к≤∞м†ИмЭі мЮИлКФ м§СлЕД лВ®мД±мЧРмДЬ лєДкµРм†Б нЭФнХШк≤М л∞ЬмГЭнХШмІАлІМ, нЩШмЮРмЭШ мХљ 25% м†ХлПДлКФ нЭЙлІЙ мВЉмґЬмЭі кіАм†И м¶ЭмГБл≥ілЛ§ мД†нЦЙнХШк±∞лВШ лПЩмЛЬмЧР лВШнГАлВШкЄ∞лПД нХЬлЛ§[8]. лУЬлђЉк≤МлКФ кіАм†ИмЧЉ мЧЖмЭі л∞ЬмГЭнХЬ л•ШлІИнЛ∞мК§мД± нЭЙмИШк∞А л≥ік≥†лРШкЄ∞лПД нХШмШАлЛ§[10]. л•ШлІИнЛ∞мК§мД± нЭЙмИШмЭШ к≤АмВђмЖМк≤ђмЭА л≥інЖµ pHк∞А 7.20 мЭінХШ, нПђлПДлЛємЭі 50 mg/dL мЭінХШл°Ь лВЃк≥†, LDHк∞А м†ХмГБ нШИм≤≠ мИШмєШмЭШ 2л∞∞ мЭімГБмЭД л≥імЭіл©∞, мљЬл†ИмК§нЕМл°§мЭі 1,000 mg/dL мЭімГБмЬЉл°Ь лІ§мЪ∞ мГБмКєнХШлКФ к≤љмЪ∞к∞А мЮИлЛ§[8]. л•ШлІИнЖ†мЭілУЬмЭЄмЮРмЭШ к≤љмЪ∞ нШИм≤≠ к≤АмВђ мИШмєШмЩА мЬ†мВђнХШк±∞лВШ лЖТмЭА мЦСмГБмЭД л≥імЭіл©∞[8], нЭЙлІЙ мВЉмґЬ лВімЭШ л•ШлІИнЖ†мЭілУЬмЭЄмЮРмЭШ мГБмКємЭА л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЧР мЭШнХЬ нЭЙлІЙ мВЉмґЬмЭШ к∞АлК•мД±мЭД к∞ХнХШк≤М мЛЬмВђнХЬлЛ§[9]. мЮДмГБ м¶ЭмГБк≥Љ нЭЙмИШмЭШ к≤АмВђ мЖМк≤ђмЭі м†ДнШХм†БмЭіл©∞ нЭЙмИШмЭШ л∞∞мЦС к≤АмВђмЧРмДЬ мДЄкЈ† к∞РмЧЉмЭШ м¶Эк±∞к∞А мЧЖлЛ§л©і нЩХмІДмЭД мЬДнХі нЭЙлІЙ мГЭк≤АмЭД л∞ШлУЬмЛЬ мЛЬнЦЙнХ† нХДмЪФлКФ мЧЖлЛ§[8]. лМАлґАлґДмЭА мєШл£Мл•Љ мЪФнХШмІА мХКмЬЉлВШ, м¶ЭмГБмЭД мЬ†л∞ЬнХЬлЛ§л©і нХ≠ л•ШлІИнЛ∞мК§ м†Ьм†Ьл•Љ нИђмЧђнХШл©∞ мЭЉлґАмЧРмДЬлКФ мК§нЕМл°ЬмЭілУЬ нИђмЧђл•Љ к≥†л†§нХ† мИШ мЮИлЛ§[8]. л≥Є м¶Эл°АмЧРмДЬ л≥імЭЄ нЭЙмИШмЭШ мЖМк≤ђ м§С лВЃмЭА pHмЩА мГБмКєлРЬ LDH, л•ШлІИнЛ∞мК§ мЭЄмЮРлКФ л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЧР лПЩл∞ШнХШлКФ нЭЙлІЙ мВЉмґЬ мЖМк≤ђмЧР лґАнХ©нХШмШАмЬЉлВШ, нПђлПДлЛємЭА лВЃмІА мХКмХШлЛ§. л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЧР лПЩл∞ШнХШлКФ нЭЙлІЙ мВЉмґЬмЧРмДЬ нПђлПДлЛємЭі лВЃк≤М мЄ°м†ХлРШлКФ к≤ГмЭі м†ДнШХм†БмЭЄ мЖМк≤ђмЭімІАлІМ, міИкЄ∞мЧРлКФ м†ХмГБ мИШм§АмЭШ нПђлПДлЛє к∞ТмЭі мЄ°м†Х лР† мИШлПД мЮИлЛ§[9]. нПђлПДлЛє м†АнХШмЭШ кЄ∞м†ДмЭА л™ЕнЩХнХШмІА мХКмІАлІМ, нЭЙлІЙмЭШ мЧЉм¶Эл∞ШмЭСмЬЉл°Ь мЭЄнХі нПђлПДлЛємЭШ мЖМл™®к∞А м¶Эк∞АнХШк≥† лСРнД∞мЫМмІД нЭЙлІЙмЭД нЖµнХЬ нПђлПДлЛємЭШ мЭілПЩмЧР мД†нГЭм†БмЭЄ м†ЬнХЬмЭі л∞ЬмГЭнХЬлЛ§лКФ мВђмЛ§мЭі лґАлґДм†БмЬЉл°Ь л∞ЭнШАм†Є мЮИмЬЉл©∞, міИкЄ∞мЧР нПђлПДлЛє м†АнХШ мЖМк≤ђмЭі мЧЖлКФ к≤ГлПД мЭілЯђнХЬ лІ•лЭљмЧРмДЬ мЭінХінХ† мИШ мЮИлЛ§[9]. л≥Є м¶Эл°АмЧРмДЬ нЭЙмИШл°Ь мЛЬнЦЙнХЬ нХ≠мВ∞кЈ† лПДлІРк≤АмВђмЩА л∞∞мЦС к≤АмВђк∞А мДЄ м∞®л°А мЭМмД±мЧИк≥†, мХДлН∞лЕЄмЛ†нГИмХДлѓЄлЕЄнЪ®мЖМ мИШмєШлПД лВЃмХШлЛ§. нЭЙмИШмЭШ мДЄнПђл≥Сл¶ђ мЖМк≤ђк≥Љ кЄ∞кіАмІАнПРнПђмДЄм≤ЩмХ°к≤АмВђл•Љ нЖµнХЬ мДЄнПђл≥Сл¶ђ мЖМк≤ђмЧРмДЬ мХЕмД± мҐЕмЦСмЭШ кЈЉк±∞л•Љ м∞ЊмЭД мИШ мЧЖмЧИк≥†, нЭЙмИШмЩА нШИм≤≠мЭШ мХФл∞∞мХДнХ≠мЫР мИШмєШлПД м†ХмГБ л≤ФмЬДмЭЄ м†РмЬЉл°Ь к≤∞нХµк≥Љ мХЕмД± мҐЕмЦСмЭШ к∞АлК•мД±мЭА л∞∞м†ЬнХ† мИШ мЮИмЧИлЛ§. лШРнХЬ, л∞ЬмЧі л∞П л∞±нШИкµђ м¶Эк∞Ам¶Э, C-л∞ШмЭС лЛ®л∞±мЭШ мГБмКємЭі мЧЖмЧИк≥† нЭЙмИШл°Ь мЛЬнЦЙнХЬ мДЄкЈ† л∞∞мЦС к≤АмВђмЧРмДЬ лѓЄмГЭлђЉмЭі лґДл¶ђлРШмІА мХКмХД к∞РмЧЉмЧР мЭШнХЬ нЭЙмИШмЭЉ к∞АлК•мД±лПД л∞∞м†ЬнХ† мИШ мЮИмЧИлЛ§. мЭілЯђнХЬ мЖМк≤ђлУ§к≥Љ мК§нЕМл°ЬмЭілУЬ нИђмЧђл°Ь нЭЙлІЙмЧЉк≥Љ мЛђмЮ•лІЙмЧЉмЭі лє†л•ік≤М нШЄм†ДлРШмЧИлНШ м†РмЭД мҐЕнХ©нХШмЧђ л≥Љ лХМ, мЭіл≤И м¶Эл°АмЭШ мЮ•лІЙмЧЉмЭА кіАм†ИнЖµмЭі лВШнГАлВШкЄ∞ м†ДмЭШ л•ШлІИнЛ∞мК§кіАм†ИмЧЉмЧР мЭШнХЬ кіАм†ИмЩЄ м¶ЭмГБмЭШ л∞ЬнШДмЭЉ к∞АлК•мД±мЭі лЖТмЭД к≤ГмЬЉл°Ь нМРлЛ®нХ† мИШ мЮИлЛ§.
л•ШлІИнЛ∞мК§мД± нЭЙлІЙ мВЉмґЬк≥Љ мЛђмЮ•лІЙмХ°мЭА Caplan м¶ЭнЫДкµ∞мЭШ нЭФнХЬ м¶ЭмГБмЭі мХДлЛИлЛ§[10]. лШРнХЬ мЭЉлґА Caplan м¶ЭнЫДкµ∞мЭШ к≤љмЪ∞ кіАм†И м¶ЭмГБмЭі лТ§лК¶к≤М лВШнГАлВШлКФ к≤љмЪ∞лПД мЮИлЛ§[10]. л≥Є м¶Эл°АмЧРмДЬлКФ мЩЄлЮШ мґФм†БнХШлКФ 6к∞ЬмЫФ кЄ∞к∞Д лПЩмХИмЧРлКФ кіАм†И м¶ЭмГБмЭі мГИл°ЬмЭі лВШнГАлВШмІА мХКмХШк≥†, мК§нЕМл°ЬмЭілУЬ мєШл£Мк∞А кіАм†Им¶ЭмГБмЭШ л∞ЬнШДмЭД мЦµм†ЬнХШмШАмЭД к∞АлК•мД±мЭі лЖТмЭД к≤ГмЬЉл°Ь мГЭк∞БнХШлВШ мІАмЖНм†БмЭЄ мґФм†БкіАм∞∞мЭі нХДмЪФнХ† к≤ГмЬЉл°Ь л≥імЭЄлЛ§. л≥Є м¶Эл°АлКФ м†ДнШХм†БмЭімІАлКФ мХКмІАлІМ мЮ•лІЙмЧЉмЬЉл°Ь л∞ЬнШДнХЬ Caplan м¶ЭнЫДкµ∞мЬЉл°Ь нМРлЛ®лРЬлЛ§. кЈЬнПРм¶ЭмЭД нПђнХ®нХШлКФ мІДнПРм¶Э нЩШмЮРмЧРмДЬ нШЄнЭ°к≥§лЮАмЭД нШЄмЖМнХШлКФ к≤љмЪ∞ нЭЙлІЙ мВЉмґЬмЭілВШ мЛђмЮ•лІЙмХ° мВЉмґЬмЭі мЮИлКФмІА нЩХмЭЄнХШк≥†, кЈЄ мЫРмЭЄмЭі л•ШлІИнЛ∞мК§мД± мЮ•лІЙмЧЉмЭЉ к∞АлК•мД±мЭД к≥†л†§нХі кіАм†И м¶ЭмГБмЭі мЧЖлНФлЭЉлПД нШИм≤≠к≥Љ мВЉмґЬмХ°мЧРмДЬ л•ШлІИнЖ†мЭілУЬмЭЄмЮРл•Љ мЄ°м†ХнХШлКФ к≤ГмЭі нХДмЪФнХ®мЭД мЛЬмВђнХЬлЛ§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






