간선종과 국소결절성과증식
Hepatocellular Adenoma and Focal Nodular Hyperplasia
Article information
Trans Abstract
Recent advances in imaging technologies have offered us a great chance to detect a variety of focal liver lesions. Accordingly, it is of paramount importance to determine whether these focal liver lesions are malignant or nonmalignant. Some benign hepatic tumors mimicking hepatocellular carcinoma typically develop from either regenerative or dysplastic/neoplastic processes. The most common benign hepatic solid tumors that are not of vascular origin include focal nodular hyperplasia and hepatocellular adenoma. A majority of patients with benign hepatic tumors are often asymptomatic and require no specific treatment. However, surgical resection may be infrequently needed for cases with clinical symptoms or malignant potential. This review will touch on the epidemiology, pathogenesis, clinical features, diagnosis, and management of focal nodular hyperplasia and hepatocellular adenoma. (Korean J Med 2013;84:325-332)
서 론
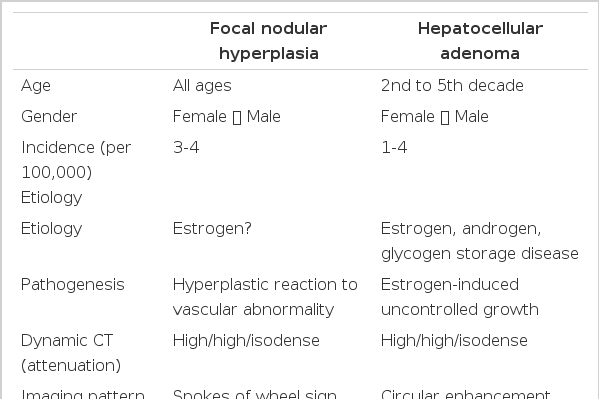
양성 간종양은 간세포암이나 담도암과 같은 악성 간종양과는 달리 건강 검진 시 복부 영상 검사에서 종종 무증상으로 우연히 발견된다. 임상 증상이나 합병증 및 악성화의 위험성이 동반되지 않는 한 대개 특별한 치료는 불필요하다. 영상 검사에서 간내 고형 병변으로 관찰되며 비혈관성으로 분류되는 상피세포 기원의 양성 종양으로는 간선종과 국소결절성과증식 등이 대표적이다. 본고에서는 간세포암과의 감별이 필요한 간선종과 국소결절성과증식의 역학, 병인, 임상 증상, 진단 및 치료 등에 대해 간략히 살펴보고자 한다(Table 1).
간선종
원인 및 역학
간선종은 정상 간에서 발생되는 드문 양성 간세포 종양으로 20-30대 가임기 여성에서 주로 발생하며, 70-80%의 경우 우측 간에서 단일 종괴로 발견된다. 장기간 피임약 사용, 당원축적병, 간선종증의 경우 다발성 종괴로 발생하기도 하며, 크기는 다양하고 복통 등의 임상 증상은 크기가 클수록 나타날 가능성이 높다[1]. 간선종은 대개 경구 피임약과 안드로겐의 사용, 당원축적병 등과 긴밀한 관련성이 있다[1]. 최근 복부 영상 진단 기술의 발전 및 경구 피임약의 도입에 따라 간선종의 발생률은 꾸준히 증가해 왔다[2-5]. 간선종의 발생은 호르몬 치료 용량과 투약 기간에 비례하고[5-9], 연간 발생률은 장기간 피임약 사용 여성에서 인구 백만 명당 30- 40명으로 대조군의 1명에 비해 월등히 높았다[6,10]. 경구 피임약은 간선종의 자연 경과에도 영향을 미치는데 피임약 복용과 관련하여 발생한 간선종일수록 다발성이고 크기가 크며 출혈 위험성이 더 높다[3,9,11,12]. 피임약 중단 후 간선종의 크기가 감소하고 재투약이나 임신 중에는 간선종이 재발될 수 있다고 알려져 있다[6,13-15].
병리
종양 표면이나 내부에 혈관 분포가 풍부하고 피막이 없어 자발적 출혈이 일어나면 간 내로 쉽게 파급된다. 간선종은 국소결절성과증식과 달리 종괴 내 섬유성 중격이나 간문맥 구역, 담소관 등이 관찰되지 않는다[16]. 간선종 내에 쿠퍼세포가 소수 존재하지만 기능이 소실되어 Tc-99m 표지 황교질을 섭취하지 못하므로 동위원소 주사 검사에서 냉결절로 관찰된다[17].
유전형과 표현형에 따른 간선종의 분류법이 최근 제시되었고, HNF1α (hepatocyte nuclear factor 1 alpha) 유전자 변이 선종, β-catenin 유전자 변이 선종, 유전적 변이가 없는 염증성 선종 등 세 개의 아형으로 구분된다[18]. 이 중 악성 변화는 β-catenin 유전자 변이 선종에서만 관찰되며 MRI 영상 소견이 간선종의 조직학적 아형을 구분하는 데 도움이 된다[19,20].
임상 증상
대개 심와부 혹은 우상복부 통증(30-40%)이나 무증상으로 복부 영상 검사 중 우연히 발견되는 경우가 전형적이고, 드물게는 신체 검진 중 종괴(2-4%)가 발견되거나 종괴 파열, 복막강 내 출혈과 연관된 치명적인 저혈압성 쇽으로 발현되기도 한다. 주기적 복통은 간비대, 종양 내 출혈 혹은 괴사 등을 시사하며 저혈압과 관련된 갑작스런 극심한 통증의 발생은 복막강으로 파열을 의미하며, 신속히 발견하여 치료하지 않을 경우 사망률은 20%에 달한다[3,21-23]. 대부분의 연구에서 출혈 고위험 환자군인 유증상 환자들만을 대상으로 하였기 때문에 무증상 간선종 환자들에서 실질적 출혈 위험을 예측하기는 어렵다[23]. 복통의 존재, 장기간 피임약 복용, 피막하 위치 등은 출혈 위험을 증가시킬 수 있는 요인들이다. 30%의 간선종 환자에서 복부 종괴, 25%에서 간비대 소견이 관찰되고, 종양 크기가 커짐에 따라 간내 담도를 압박할 경우 황달이 나타날 수 있다.
간기능검사 이상(7%)은 드물지만 국소결절성과증식에 비해 흔히 나타난다[24]. 특히 종양 내 출혈이나 다발성 간선종이 있는 경우 알칼리성 인산분해효소와 감마 글루타밀 펩티드전이효소가 상승할 수 있고 악성 변화가 없다면 대개 알파태아단백은 정상 범위를 보인다. 간세포암으로의 악성화 위험은 8-13%로 알려져 있어 드물지 않게 일어나는 것으로 추정되며, 추적 영상 검사에서 크기가 증가하거나 혈청 알파태아단백이 증가할 경우 악성화를 의심해 보아야 한다[25,26].
진단
간선종의 진단은 다양한 임상 상황, 복부 영상 검사, 외과적 절제 결과 등을 고려하여 결정된다. 간선종은 간생검 후 출혈성 경향이 있고 진단에 충분한 조직양을 확보하기 어렵기 때문에 경피적 간생검이나 미세침흡인검사는 보통 추천되지 않는다. 간내 국소 병변 중 간선종과 감별이 가장 어려운 질환은 국소결절성과증식이다. 대개 영상 검사 결과를 토대로 감별할 수 있지만, 간혹 확진 및 치료 목적으로 외과적 절제 후 감별 진단이 이루어지기도 한다.
간선종의 진단에 가장 흔히 이용되는 복부 영상 검사 방법은 CT와 MRI이다. 특징적 CT 소견은, 조영증강 전 검사에서 경계가 명확한 저음영, 동맥기에 과혈관성으로 말초 부위로부터 강한 조영증강, 문맥기나 지연기에는 동정맥단락으로 등음영 혹은 저음영을 보인다[1]. 간선종은 크기가 큰 경우 종괴 내 출혈이나 괴사를 동반하기 때문에 균일하지 않은 조영증강을 보일 수 있다.
전형적 MRI 소견은 크기가 작은 경우 T1강조영상에서 약간 저신호 또는 등신호강도, T2강조영상에서 등신호 또는 약간 고신호강도를 보인다. 종괴가 큰 경우 지방이나 출혈이 있는 부위는 T1강조영상에서 고신호, 괴사나 섬유화가 있는 부위는 저신호, T2강조영상에서는 균일하지 않으면서 약간 고신호강도를 보인다. 조영증강 후 동맥기에 균일하지 않은 조영증강을 보이다가 문맥기와 지연기에 등신호강도로 조영 증강 정도가 감소한다[27-29]. Gadobenate dimeglumine (Gd-BOPTA)이나 gadoxetic acid (Gd-EOB-DTPA)와 같은 간세포 특이 조영제가 도입되면서 간선종과 국소결절성과증식의 감별 진단에 도움이 되고 있다. 조영제 주입 후 지연기(hepatobiliary phase)에서 국소결절성과증식은 고신호 혹은 등신호 강도를 보이는 반면 간선종은 저신호강도를 보인다. 간세포 특이 조영제는 활성 간세포에 의해 섭취되어 대사된 후 담도로 배출되기 때문에 활성 간세포가 있고 담관을 가진 종괴(국소결절성과증식)는 고신호강도, 활성 간세포나 담도가 없는 종괴(간선종, 간세포암)는 저신호강도로 보인다[30,31].
치료
간선종의 자연 경과와 예후는 잘 알려져 있지 않으므로 치료 방법은 전적으로 임상 증상, 종양 크기, 개수, 위치, 아형, 그리고 진단의 정확도에 따라 달라진다. 종양의 크기가 5 cm 이상이면 출혈, 8 cm 이상이면 악성화의 가능성이 높다[32]. 5 cm 이하의 간선종은 출혈과 악성화의 위험이 낮으므로 특별히 조치를 취하지 않고 폐경기까지 주기적으로 영상 검사를 시행한다[18,33]. 증상이 있거나 크기가 5 cm보다 클 경우 수술적 절제가 권고된다[32]. 악성화의 위험성은 당원병에 동반된 간선종이나 남자에서 더 높고, HNF1α 유전자 변이 선종은 악성화 가능성은 없으나 출혈이 발생할 수 있다.
경구 피임약을 복용 중인 무증상 여성에서 5 cm 미만의 작은 간선종이 발견될 경우 치료에 대한 논란이 있다. 우선 경구 피임약을 중단한 후 추적 영상 검사와 알파태아단백 반복 측정을 통해 종양의 크기 변화를 관찰한다[34]. 그러나 피임약 중단 후에도 종양의 성장, 파열, 악성 변화 등이 나타날 수 있어 일각에서는 기술적으로 가능하다면 크기와 무관하게 모든 간선종의 절제를 권하고 있다[26]. 특히 피임약 중단 후 6개월 뒤에도 증상이 지속되거나 크기가 커지는 간선종의 경우 반드시 수술적 절제를 고려해야 한다.
임신을 계획 중인 여성이 이미 간선종을 가지고 있다면, 임신 전 간선종 절제를 시행 받을 때까지 우선 임신을 피하도록 권고한다[35,36]. 임신 중 간선종이 파열될 경우 적절한 소생술과 외과적 절제술을 시행해야 한다. 임신 중 간선종의 크기가 커지고 파열 및 출혈 위험을 고려해 크기가 크고 증상이 있다면, 산모와 태아의 위험을 최소화하기 위해 임신 2기에 수술적 절제를 시행한다[37].
간이식은 종양 크기, 개수, 위치로 인해 수술적 절제가 불가능할 경우에만 고려된다[38-41]. 수술적 절제로 인한 사망률은 1% 미만이고 간 주변부에 위치한 간선종은 복강경으로 절제가 가능하다[42]. 간선종 파열로 인한 복막강 내 출혈로 복통이나 저혈압이 발생한 경우 근치적 절제와 지혈술을 모두 시행해야 한다. 응급 수술은 5-8%의 사망률이 수반되므로[43], 수술 전 선택적 동맥 색전술을 통해 지혈과 수술 위험을 줄이는 것을 고려할 수 있다[44,45].
요약하면, 종양 크기가 5 cm 이상이거나 유발하는 약제를 중단 후에도 종양이 감소하지 않거나 악성화 가능성이 있는 경우, 혹은 β-catenin 유전자 변이 선종이나 남자에서 발생한 경우에는 수술적 절제가 권고되고 간혹 고주파 열치료로 수술을 대체할 수도 있다.
국소결절성과증식
원인 및 역학
국소결절성과증식은 비혈관성, 비악성 간종양 중 가장 흔한 간내 국소 병변으로, 1958년 Edmondson에 의해 최초로 보고된 후 1995년 병리적으로 간선종과 다른 재생성 병변의 하나로 분류되었다[46,47]. 일반인 대상의 부검 연구 결과 비혈관종성 병변의 8%가 국소결절성과증식이었다[48]. 간선종에 비해 3-10배 더 흔하고 성인에서 유병률은 0.4-2.6%이며[49,50], 전 연령에 걸쳐 남녀 모두에서 관찰되지만 20-50대에서는 특히 여성에서 8-9배 더 흔하게 발생한다[51]. 80-95%에서 단일 병변이고 주로 우측간에 위치하며 드물게 다발성 결절로 나타난다. 병변의 크기는 다양하게 보고되었으나 진단 당시 크기는 보통 5 cm를 넘지 않는다[48,52,53].
국소결절성과증식의 발생 기전은, 결절의 중앙에서 발견되는 특징적 기형 동맥이나 혈관 손상 후 생기는 간문맥의 과혈류에 대한 간실질의 재생 반응으로 나타나는 간세포의 과증식이라고 이해되고 있다[51,54,55]. 면역조직화학 분석 결과 간혈류의 과관류에 의해 과산소 상태가 발생하고 이로 인해 간성상세포가 활성화되어 중심 반흔이 형성되며 증가된 산소분압에 의해 활성화된 혈관내피성장인자가 비정상적 혈관 증식에 관여할 것으로 생각된다[56].
병리
국소결절성과증식은 피막이 없고 유경성의 경계가 분명한 종괴 형태를 보인다. 특징적 조직 소견은, 비정상적으로 큰 기형 동맥과 말초 부위로 퍼지는 다발성 혈관 분지로 이루어진 섬유성 중격과 종괴 중심에 별 모양 반흔의 존재이다. 전형적 국소결절성과증식은 과증식된 간세포와 쿠퍼세포로 구성된 결절 구조, 간문맥 구역으로 구성된 중심 반흔 및 혈관 기형, 그리고 담소관 증식 등의 현미경적 소견을 보이지만, 간선종과 달리 내부 괴사나 출혈은 관찰되지 않는다. 비전형적 국소결절성과증식은 담소관 증식을 보이지만 결절 구조나 혈관 기형이 동반되지 않으며 중심 반흔도 보이지 않는다. 비전형적 국소결절성과증식에는 간세포판이 위축되고 굴모양혈관의 심한 확장을 보이는 혈관확장형, 간선종과 비슷한 소견을 보이는 혼합과증식선종형, 결절 내 거대세포 이형성을 동반한 아형 등 모두 세 가지로 구분된다[57].
임상 증상 및 진단
국소결절성과증식은 대개 특징적인 영상 검사 결과를 확인하고 다른 감별 진단 등을 배제함으로써 진단된다. 대부분의 경우 무증상이므로 수술, 복부 영상 검사 혹은 부검에서 우연히 발견된다. 간선종과 달리 출혈, 괴사, 경색 등의 급성 증상도 거의 나타나지 않는다[58,59]. 간혹 복부 불쾌감이나 간종괴 촉지 등의 증상을 호소하지만 거의 대부분 간기능검사나 알파태아단백검사는 정상이고 소수에서 경미한 이상을 보인다[24,57,60].
확진은 통상 복부 영상 검사만으로 가능하고 조직 검사는 대개 불필요하다. 일반적으로 복부 초음파 검사만으로는 간선종이나 악성 종양과 감별이 어렵지만 조영제 증강 초음파와 도플러 초음파가 감별 진단에 도움이 되기도 한다[24,61,62].
특징적 CT 소견은, 조영증강 전 검사에서 중심 반흔과 함께 저음영 혹은 등음영을 보이고, 과혈관성 병변이므로 동맥기에 균일한 고음영, 문맥기나 지연기에 등음영 종괴와 고음영 중심 반흔 소견을 보인다. 국소결절성과증식 환자의 20%에서 혈관종을 동반하므로 상술한 CT 소견을 보이면서 혈관종과 같이 발견되면 진단에 도움이 된다[63]. 중심 반흔은 국소결절성과증식에 특징적이지만 섬유층판 간세포암에서도 관찰할 수 있다.
전형적 MRI 소견은, T2강조영상에서 종괴 내 중심 반흔이 혈관으로 인해 고신호강도를 보인다는 것이다[64]. 조영증강 후 종괴는 동맥기에 신속하고 균일한 조영증강을 보이다가 지연기에 등신호강도로 감소하지만 중심 반흔은 지연기에 조영제가 서서히 종괴 내의 섬유성 중격으로 확산됨에 따라 조영증강된다. 지연기에 조영증강되는 중심 반흔이 있고, 피막이 없다는 점이 간선종과 감별점이다[65]. 병변 중심부에 방사상으로 뻗어 있는 중심 반흔은 혈관, 담관, 림프관이 모인 것으로 조영증강 시 동맥기에는 조영증강이 되지 않다가 문맥기와 지연기로 갈수록 조영증강이 되는 특징을 보이며 T2강조영상에서 고신호강도로 보인다는 점에서, 저신호강도로 보이는 섬유층판 간세포암의 섬유성 반흔과는 구별된다. 그러나 크기가 작은 국소결절성과증식의 경우 중심 반흔을 쉽게 발견할 수 없는 경우도 많다. 조영증강 MRI는 높은 진단 민감도(70%)와 특이도(98%)를 보이고[24], 대부분의 환자는 가임기 여성이므로 CT보다 방사선 노출이 적은 MRI가 선호된다.
치료
일반적으로 국소결절성과증식 환자의 자연 경과는 안정적이고 합병증이 거의 없다. 또한 시간에 따라 크기 변화도 거의 없고, 악성화의 근거도 찾기 어렵기 때문에 보존적 치료를 하는 것이 원칙이다[23,24,38,57,64]. 진단이 불확실하면 간생검이 도움이 되기도 하지만 오진 가능성이 있기 때문에 수술적 절제만이 유일한 확진 방법이 된다. 병변의 안정성과 양성 경과를 확인하기 위해 3-6개월 후 추적 영상 검사를 시행하고 이후 추적 검사는 보통 필요하지 않다. 드물지만 증상이 있는, 비전형적 국소결절성과증식이나 진단이 불확실한 경우에만 수술이 고려될 수 있다. 간선종과 달리 국소결절성과증식의 경우 아직까지 경구 피임약과의 뚜렷한 인과관계나 관련성이 입증되지 못했다. 그렇지만 국소결절성과증식 역시 에스트로겐에 반응할 수 있으므로 경구 피임약이 금기는 아닐지라도, 복용 중이라면 6개월에서 1년 뒤 추적 영상 검사를 시행하는 것이 바람직하다. 작은 국소결절성과증식은 성공적인 임신에 중대한 위험을 가하지 않기 때문에 경과관찰이 추천되고, 8 cm보다 큰 경우에만 수술적 절제가 신중하게 고려될 수 있다.
결 론
간선종과 국소결절성과증식은 간세포암과 감별해야 할, 드물지만 중요한 양성 간종양이다. 대부분 기저 간질환 여부와 임상적 상황 및 영상 검사 결과를 종합하여 감별 진단이 가능하지만 때로는 감별이 어려워 확진을 위한 수술적 절제가 필요한 경우도 드물게 발생한다. 이러한 간내 고형 병변의 진단 및 치료를 위한 알고리듬을 반드시 숙지해서 불필요한 검사와 치료가 시행되지 않도록 유념해야 한다(Fig. 1).