포항 지역의 톡소카라증의 임상적, 혈청학적 특징에 관한 연구: 포항의 톡소카라증의 특징
Clinical and Serological Findings in Patients with Toxocariasis in the Pohang Region: The Features of Toxocariasis in Pohang
Article information
Abstract
목적:
톡소카라증은 개회충 또는 고양이회충의 충란을 섭취함으로써 발생하는 질환이며 원충에 대한 여러 가지 알레르기 반응을 통한 다양한 증상을 일으킨다. 저자들은 포항 지역의 톡소카라증의 임상적, 혈청학적 특징을 연구하여 호산구증가증 환자에서 톡소카라증을 더 의심할 수 있게 하는 소견을 알아보고자 본 연구를 시행하였다.
방법:
2008년 8월부터 2011년 5월까지 말초 호산구증가증으로 본 병원에 방문한 145명의 환자들을 대상으로 하였다. Toxocara ELISA 양성군 90명 및 음성군 55명으로 환자군을 분류하였고 나이, 성별, 알레르기 천식, 비염, 폐 또는 간의 호산구 침착 같은 임상양상뿐만 아니라 Immuno-CAP 방법을 사용하여 혈청 총 IgE, 집먼지진드기에 대한 특이 IgE 와 같은 혈청학적 양상을 비교 분석하였다.
결과:
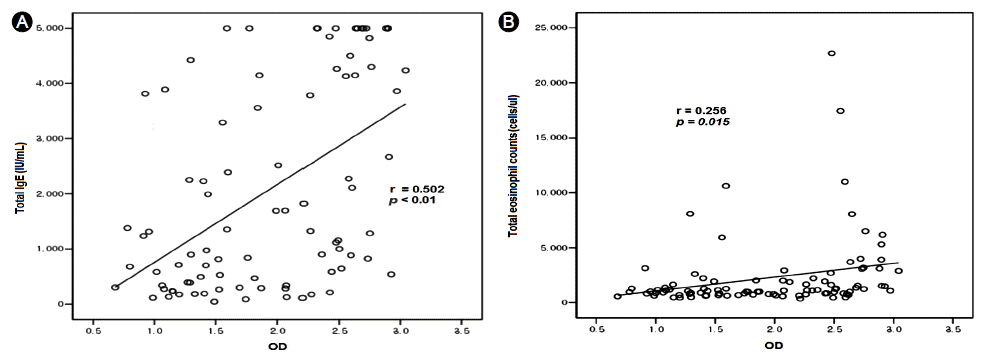
전체 대상 환자 145명 중 Toxocara ELISA 양성 90예 (62.1%) 음성 55예 (37.9%)였다. Toxocara ELISA 양성군에서 평균연령은 54.8±14.5세, 음성군에서 49.2 ± 20.5세로 두 군 간에 연령의 유의한 차이는 없었다(p= 0.081). Toxocara ELISA 양성군에서 남성의 비율은 76.7%, 음성군에서 47.3%로 양성군에서 유의하게 높았다(p< 0.01). 혈청 총 호산구 수(cells/μL)는 Toxocara ELISA 양성군 2,325 ± 361, 음성군 1,407 ± 249로 양성군이 유의하게 많았고 (p= 0.038), 총 IgE (IU/mL)는 Toxocara ELISA 양성군 2,089 ± 196, 음성군 984 ± 199로 양성군이 유의하게 높았다(p< 0.01). Df 양성률은 Toxocara ELISA 양성군 82.3%, 음성군 44.2%로 양성군이 유의하게 높았으며(p< 0.01) Dp 양성률은 Toxocara ELISA 양성군 53.2%, 음성군 42.3%로 두 군 간에 유의한 차이는 없었다(p= 0.224). 폐(p< 0.01)와 간(p< 0.01)의 호산구 침착 및 익히지 않은 소의 간 또는 고기를 섭취한 비율(p< 0.01)은 Toxocara ELISA 양성군에서 높았다. 그러나 폐와 간 침범 사이의 상관관계는 없었다(p= 0.272). 알레르기 천식(p< 0.01)과 비염(p< 0.01)환자의 비율은 Toxocara ELISA 음성군에서 높았다. 아토피는 Toxocara ELISA 양성군에서 유의하게 많았다(p< 0.01). 그리고 Toxocara ELISA의 흡광도와 총 IgE (r = 0.502, p< 0.01), Toxocara ELISA의 흡광도와 총 호산구 수(r = 0.256, p= 0.015) 간에 양의 상관관계가 있었다. 그리고 Df에 대한 특이 IgE가 Dp보다 의미있게 높은 점은(p< 0.01) 포항 지역의 톡소카라증에서 개회충 항원과 Df항원 간의 유사성이 Dp 보다 클 것이라는 것을 시사하고 있다.
결론:
포항 지역의 톡소카라증은 알레르기 천식 또는 비염이 없는 경우가 더 많고 집먼지진드기 중 Df항원에 대한 특이 IgE가 Dp보다 의미있게 높다는 특징을 보이고 있다. 이러한 특징들은 향후 호산구증가증 환자에서 톡소카라증을 진단함에 있어서 유용한 임상적, 혈청학적 소견이 될 수 있을 것으로 생각된다.
Trans Abstract
Background/Aims:
This study was performed to investigate the clinical and serological characteristics of toxocariasis in thePohang region.
Methods:
A total of 145 patients with peripheral eosinophilia (> 450 cells/μL) were enrolled and divided into two groups based onToxocara excretory-secretory IgG enzyme-linked immunosorbent assay (ELISA) positivity, and the clinical features and serologicmarkers were compared between the two groups.
Results:
The seropositive rate of Toxocara was 62.1%. The serum total eosinophils (p= 0.038), total IgE level (p< 0.01), Dermatophagoides farinae (Df) seropositivity rate (p< 0.01), frequency of eosinophilic tissue infiltration in the lung or liver(p< 0.01), and ingestion of raw cow meat or liver (p< 0.01) were higher in seropositive patients than in seronegative patients.However, the presence of asthma and rhinitis (p< 0.01) were more frequent in seronegative patients. Among seropositive patients,positive correlations were observed between serum total IgE, total eosinophils, and the optical density value of the Toxocara IgG ELISA (p< 0.01; p= 0.015, respectively). The specific IgE to Df was significantly higher (p< 0.01) than that to Dermatophagoides pteronyssinus (Dp), suggesting a cross reaction between the Df antigen and the Toxocara antigen.
Conclusions:
Patients who have elevated serum total IgE and have eosinophilia without allergic disease might have toxocariasis.The lower frequency of asthma or rhinitis and a tendency for higher specific IgE to Df than that to Dp could be useful findings forthe diagnosis of toxocariasis in patients with eosinophilia. (Korean J Med 2013;84:203-210)
서 론
톡소카라증은 개회충 또는 고양이회충이 사람을 숙주로 삼아서 발생하게 되는 감염증을 말한다. 상기 기생충의 자연숙주는 개와 고양이이며, 작은창자에 서식하는 성충이 낳은 알이 대변을 통해 외부로 배출되면 사람이 우연히 기생충의 발육란에 오염된 매개체(흙, 채소, 동물의 대변)와 접촉하여 감염증을 일으키게 된다[1]. 한국인의 경우 익히지 않은 소, 돼지의 내장 및 고기를 섭취하는 것도 중요한 감염유발인자 중의 하나이다[2].
톡소카라증의 임상증상은 침범된 장기에 따라 다르게 나타나며 내장유충이행증 및 안구유충이행증으로 크게 분류된다. 내장유충이행증은 대개 5세 미만의 소아에게서 발생하며 발열, 간 비대와 괴사, 비장 비대, 하부호흡기증상, 호산구증가증, 고감마글로불린혈증(IgM, IgG, IgE)을 특징으로 한다[3-5]. 심근염, 신염, 중추신경계의 침범, 아토피성 골수염 또한 보고된 바 있다[6-8]. 은폐성 톡소카라증은 내장유충이행증의 아형으로 장기간 유충의 이행이 이루어질 경우에 발생하게 되며 무증상의 감염증에서부터 대상장기의 경미한 증상까지 다양한 양상을 보인다[9]. 안구유충이행증은 망막의 파괴와 육아종병변을 일으키고 심한 경우 시력의 상실까지도 초래할 수 있다[10].
톡소카라증의 진단은 임상증상 및 혈청학적 검사를 통해서 이루어지게 된다[11]. 호산구증가증에 더불어 연관된 임상증상이 있으면 톡소카라증을 의심하게 되고 확진을 위해 혈청학적 검사를 시행한다. 주로 면역학적 검사를 시행하게 되는데 유충이 분비하는 항원을 포착할 수 있는 ELISA (enzyme-linked immunosorbent assay) 검사법이 민감도와 특이도가 높아 널리 사용되고 있다. 반면 안구유충이행증에서는 내장유충이행증에 비해 혈청학적 검사의 신뢰성이 낮아 잘 시행되지 않으며 안과검진을 시행하여 발견된 소견이 진단기준에 합당하면 진단을 내리게 된다[12]. 호산구증가증을 유발할 수 있는 질환은 선천성과 후천성으로 나누어 지는데, 후천성 호산구증가증은 이차성에 해당되며, 여기에는 알레르기 질환, 감염증, 약물, 악성 종양, 결체조직 질환 등이 속한다[13]. 호산구증가의 정도에 따라 경증, 중등증, 중증 호산구증가증으로 구분하기도 한다[14]. Kwon 등[15]은 한국의 한 대학병원에서 103명의 원인 불명의 호산구증가증 환자에 대해 호산구증가증의 원인을 후향적으로 조사한 보고에서 톡소카라증 환자가 68%로 가장 많았고, 그 다음으로 폐흡충 혹은 간흡충증, 알레르기질환의 순으로 보고한 바 있다.
현재 한국인의 톡소카라증의 혈청학적 소견, 소의 생간 섭취, 장기침윤, 증상과의 관계에 대한 국내 연구들이 발표되었으나 아직 소수에 불과하며 호산구증가증을 유발할 수 있는 다른 인자들을 모두 배제한 뒤 톡소카라증에만 초점을 맞추었던 경향이 있었다. 또한 특정지역에서의 톡소카라증에 대한 임상적, 혈청학적 특징에 관한 보고는 없는 상태이며 톡소카라증과 호산구증가증을 유발할 수 있는 천식, 비염, 그리고 기타 알레르겐, 특히 집먼지 진드기 사이의 연관성에 관한 연구는 아직까지 없는 실정이다. 본 연구는 포항의 한 2차 병원에 내원한 환자 중에 호산구증가증으로 내원하였거나 이로 인하여 의뢰된 환자들을 대상으로 하였다. 포항 지역의 특성상 농촌이 인접해 있고, 비교적 소의 간 혹은 육회 등과 같은 생식을 자주할 것으로 생각되었다. 그리하여 저자들은 포항 지역에서의 톡소카라증의 빈도를 알아보고, 천식 및 비염과의 연관성, 호산구의 폐 혹은 간 침범 여부, 소의 생간 섭취 여부 그리고 선충류와 교차반응이 있다고 알려져 있는 집먼지 진드기 항원과의 교차반응성 등의 혈청학적 특징을 조사하여 호산구증가증으로 내원한 환자에서 개회충 감염을 더욱 의심할 수 있는 임상적, 혈청학적 특징을 알아보고자 연구를 시행하였다.
대상 및 방법
대상
2008년 8월부터 2011년 5월까지 말초 호산구 증가증으로 내원하였거나, 호산구증가증으로 의뢰된 환자 145명을 대상으로 개회충 감염 여부를 조사하였고 의무기록을 후향적으로 분석하였다. 말초 호산구증가증의 정의는 말초 호산구의 수가 450 cells/μL을 초과하는 경우로 정의하였다.
방법
호산구 증가증으로 내원한 환자들 중에 톡소카라증을 가진 호산구 증가증 환자들과 다른 원인에 의한 호산구 증가증 환자들 간의 임상적, 혈청학적 특징을 비교해보고자 개회충 감염 여부에 따라 Toxocara ELISA 양성군과 음성군으로 나누어서 연구를 시행하였다. 개회충 감염은 Toxocara excretory-secretory (TES) IgG ELISA kit (Bordier Affinity Products SA, Crissier, Switzerland)를 이용하여 흡광도를 얻었고, 회사에서 제공하는 한계치를 이용하여 양성과 음성을 판정하였다. 일반적으로 톡소카라증의 진단은 TES IgG를 이용하여 이루어지는데 이 같은 경우 다른 기생충 항원과의 교차반응으로 인하여 위양성이 발생할 가능성이 있다[16]. 이와 같은 한계를 극복하기 위하여 연구자들은 다른 기생충 감염과의 감별을 위해 일반적인 기생충 감염에 대한 혈청 검사와 대변 검사를 시행하였으며, 연구에 포함된 환자들에게서 개회충 이외의 기생충 감염은 발견되지 않았다.
임상양상의 비교
Toxocara ELISA 양성군과 음성군 간의 임상양상의 차이를 알아보고자 나이, 성별, 폐 및 간 전산화단층촬영을 통한 호산구의 폐 혹은 간 침착여부, 알레르기천식 및 비염의 유무, 아토피의 유무 및 익히지 않은 소의 간 혹은 고기를 섭취한 병력을 의무기록을 이용하여 조사하였다. 호산구의 폐 혹은 간 침착 여부는 폐 혹은 간 전산화단층촬영을 시행하여 판정하였다. 호산구의 폐 침착은 다발성의 경계가 불명확하고, 조영증강 소견을 보이며 전이성 암 병변을 배제할 수 있는 단발성 혹은 다발성의 간질성 음영의 침윤 소견을 보일 때 양성으로 판정하였고, 간 침착은 단발성 혹은 다발성의 간질성 음영의 침윤 소견을 보일 때 양성으로 판정하였다. 전산화단층촬영은 복통, 호흡곤란 등의 증상이 존재하거나 간기능 검사(AST, ALT)가 이상을 보이는 경우, 흉부단순방사선촬영에서 미만성의 음영이 보이는 경우의 환자들을 대상으로 주로 시행하였으나 후향적 조사로 연구가 이루어졌기 때문에 모든 환자에서 전산화단층촬영이 시행되지는 않았다. 그리고 알레르기 천식 및 비염의 유무는 환자의 병력을 조사하여 판정하였다. 아토피 유무는 알레르기 피부단자 검사에서 양성이거나 총 IgE 또는 특이 IgE 중 한 가지 이상 증가되어 있을 경우 아토피라고 정의하였다.
혈청학적 양상의 비교
두 군 간의 혈청학적 특징을 비교하기 위하여 Immuno-CAP (Phadia, Uppsala, Sweden)을 이용하여 총 IgE, Dermatophagoides pteronyssinus (Dp)와 Dermatophagoides farinae (Df)에 대한 특이 IgE 및 Dp, Df에 대한 양성유무(양성은 > 0.35 KU/L로 정의)를 조사하였다. 톡소카라증의 유무에 따라 Dp, Df의 양성률과 Dp, Df에 대한 특이 IgE의 차이가 있는지 알아보았다. 특히 Toxocara ELISA 양성군에서 Dp, Df에 대한 특이 IgE의 차이가 있는지 조사하여 Toxocara 항원이 Dp, Df 중 어느 항원과 더 교차반응성이 높은지 추정해보고자 하였다.
통계
두 군 간의 임상적 혈청학적 특징의 차이를 보기 위해 교차분석을 시행하였고, 통계 프로그램으로 SPSS 12.0 (Statistical Package for the Society Science, SPSS Inc., IL, USA)를 이용하였다. 두 군 간의 성별, Dp와 Df의 양성률, 폐 또는 간의 침착, 천식, 비염 및 아토피 유무, 생식 유무의 비교는 카이제곱 검정을 사용하였다. 두 군 간의 나이, 총 IgE, Dp, Df에 대한 특이 IgE, 총 호산구 수의 비교는 t-test를 이용하였고, Toxocara ELISA 흡광도와 총 IgE, 총 호산구 수 간의 상관관계를 알아보고자 Pearson 상관계수를 이용하였다. p 값이 0.05 미만일 때 유의하다고 판정하였다.
결 과
호산구증가증으로 내원한 총 145명의 환자 중에서 Toxocara ELISA 양성을 보인 군은 90명(62.1%)이었고, Toxocara ELISA 음성을 보인 군은 55명(37.9%)이었다.
임상적 양상
Toxocara ELISA 양성군과 음성군 간에 유의한 연령 차이는 없었고(54.8 ± 14.5 vs. 49.2 ± 20.5, p= 0.081) 남성의 비율이 유의하게 높았다(76.7% vs. 47.3%, p< 0.01). 호산구의 폐 침착 비율은 Toxocara ELISA 양성군에서 음성군보다 유의하게 높았으며(50.0% vs. 7.7%, p< 0.01) 호산구의 간 침착 비율도 음성군에 비해 유의하게 높았다(54.8% vs. 9.1%, p< 0.01). 폐와 간 침범 간의 상관관계는 없었다(p= 0.272). 호산구증가증 환자에서 알레르기성 천식(14.4% vs. 43.6%, p< 0.01) 및 비염(10.0% vs. 38.2%, p< 0.01)의 경우는 Toxocara ELISA 양성군보다 음성군에서 유의하게 많았고, 아토피(100% vs. 80%, p< 0.01)는 양성군에서 음성군보다 유의하게 많았다. 익히지 않은 소 간이나 고기를 섭취한 비율은 Toxocara ELISA 양성군이 음성군보다 유의하게 높았다(65.6% vs. 16.4%, p< 0.01) (Table 1).
혈청학적 양상
혈청 총 호산구 수(cells/μL) (2,325 ± 361 vs. 1,407 ± 249, p= 0.038), 총 IgE (IU/mL) (2,089 ± 196 vs. 984 ± 199, p< 0.01) 및 Df 양성률(82.3% vs. 44.2%, p< 0.01)은 Toxocara ELISA 양성군에서 유의하게 높았다(Table 1). Toxocara ELISA 양성군 안에서 Df에 대한 특이 IgE가 Dp에 대한 특이 IgE보다 유의하게 높았으며(3.3 ± 1.5 vs. 8.9 ± 2.0, p< 0.01), Toxocara ELISA 음성군 안에서는 Df와 Dp에 대한 특이 IgE의 유의한 차이는 관찰되지 않았다(Table 2). Toxocara ELISA의 흡광도와 총 IgE (r = 0.502, p< 0.01) (Fig. 1A), Toxocara ELISA의 흡광도와 총 호산구 수(r = 0.256, p= 0.015) (Fig. 1B) 간에 양의 상관관계가 있었다.

Comparison of the specific IgE values between Dp and Df in both the Toxocara ELISA-positive and negative groups
고 찰
톡소카라증에 대하여 국내에서 상당수의 증례보고는 존재하고 있으나 비교적 소수의 환자들을 대상으로 한 임상연구가 있을 뿐이다. Park 등[17]은 우리나라 강원도 농촌지역의 톡소카라증 유병률을 약 5% 정도로 보고하고 있으며 말레이시아 원주민 4.8%, 터키 13%, 브라질 26.9%, 스리랑카 43%, 체코 36% 등으로 지정학적, 인종적 차이에 따라 국가별로 다양한 유병률을 보인다[18-22]. 우리나라는 전통적으로 소의 생간, 육회를 건강 및 미각 등의 이유로 즐겨 섭취하는 사람들이 많으며 해당 식습관이 톡소카라증의 위험도를 증가시킨다고 알려져 있다[2,15]. 본 연구에서는 Toxocara ELISA양성군에서 남성이 차지하는 비율이 높았는데, 이것은 남성이 여성보다 소의 생간을 섭취하는 빈도가 많은 것이 원인 중의 하나로 생각된다.
Toxocara ELISA 양성군에서 폐, 간의 호산구 침윤이 유의하게 많았는데 이러한 양상은 국내외에서 시행된 여러 증례에서도 공통적으로 관찰되는 사항이다[23]. 그러므로 톡소카라증이 의심되거나 진단되었을 때에 폐 혹은 간의 전산화단층촬영을 통하여 호산구의 장기침윤여부를 확인하는 것이 필요할 것으로 생각된다.
본 연구에서 혈청 총 IgE 및 호산구 수는 타 연구와 유사하게 Toxocara ELISA 양성군에서 높았으나, 이와 상이하게 Toxocara ELISA 음성군에서 알레르기 천식과 비염 환자의 비율이 유의하게 높았다. 세균, 바이러스, 원충감염이 많은 개발도상국 어린이들에 비해 상대적으로 감염이 잘 조절되는 선진국 어린이들에게 알레르기 질환의 빈도가 높다는 위생가설을 증명하기 위해 지금까지 많은 연구들이 시행되었다[24]. 세균, 바이러스 등으로 인한 만성적 감염증은 Th1과 Th2 면역반응의 균형을 Th1쪽으로 이동시켜서 Th2 면역반응이 주가 되는 알레르기 질환이 감소하게 된다. 그러나 기생충감염의 경우 알레르기 질환과 동일하게 Th2 면역반응을 주로 일으키므로 이 상황은 위의 연구결과만으로 설명할 수는 없었다[25]. 이에 van den Biggelaar 등[26]은 기생충 감염자는 IL-10 및 TGF-β의 농도가 비감염자에 비교하여 유의하게 높다고 하였고 높은 IL-10 및 TGF-β의 농도는 알레르기 질환의 빈도를 감소시킨다고 하였다. 이것은 Toxocara ELISA 양성군이 알레르기 질환의 빈도가 낮았던 본 연구의 결과를 설명해준다고 할 수 있다. 그러나 이와 반대로 Buijs 등[27]은 Toxocara ELISA 양성인 아동들이 알레르기 질환 이환율이 높다고 하였고 Gonzalez-Quintela 등[28]은 일반적인 성인에서 개회충 노출은 집먼지진드기에 대한 알레르기 감작과 유의한 양의 상관관계가 있다고 보고한 바 있다. 그러나 이러한 연구는 네덜란드, 스페인과 같은 선진국의 인구집단을 대상으로 한 경우로, 선진국의 경우 면역조절의 기능이 개발도상국에 비교하여 떨어질 수가 있는데, 그 이유는 같은 기생충 감염이라 할지라도 감염의 정도의 차이가 중요한 변수로 작용하기 때문이다. 선진국은 개발도상국에 비해 병원체의 부하가 적어서 면역조절체계의 발전 정도가 상대적으로 떨어지게 된다. 면역조절체계가 알레르기 질환의 발생을 억제할 수 있을 정도로 완전히 발달하지 못한 상태에서 발생하는 기생충 감염증은 Th2 면역반응을 조장시켜 알레르기 질환이 증가하게 된다[29,30]. 향후 선진국과 개발도상국 간의 개회충 감염과 알레르기 질환 간의 상관관계에 대한 추가 연구가 필요하리라 생각된다. 아토피는 Toxocara ELISA 양성군에서 많았는데 양성군에는 개회충 감염에 의해 총 IgE가 증가되어 있어 음성군에 비교하여 아토피가 더 흔하게 발견된 것으로 생각된다. 본 연구에서도 Toxocara ELISA 양성군에서 TES IgG의 흡광도와 총 IgE는 양의 상관관계를 보였는데, 이것은 Toxocara ELISA 양성군에서 아토피의 비율이 음성군보다 높은 결과와 연관성이 있다고 할 수 있을 것이다.
본 연구에서 도출된 결과 중에서 특이한 점은 Dp에 대한 특이 IgE는 Toxocara ELISA 양성군 및 음성군 간에 유의한 차이가 없었으나 Df에 대한 특이 IgE가 Toxocara ELISA 양성인 환자들이 Toxocara ELISA 음성인 환자들보다 유의하게 높았다는 사실이다. Toxocara ELISA 양성군 안에서도 Df에 대한 특이 IgE가 Dp에 대한 특이 IgE보다 유의하게 높은 것을 알 수 있었다. 이러한 결과는 개회충 항원과 Df 항원 사이의 유사성이 Dp보다 더 클 것이라고 유추하게 하였다. 개회충과 기타 선충류 간의 교차반응성의 존재는 Ascaris suum의 주 항원 ABA-1와 개회충의 항원 중 하나인 TBA-1의 N-terminal sequence가 유사하다는 연구와 아니사키스와 개회충을 포함한 기타 선충류 간의 교차반응성에 대한 연구에서 확인되고 있다[31,32]. 개회충과 집먼지진드기 간의 교차반응에 대한 연구들을 살펴보면, Johansson 등[33]은 아니사키스와 집먼지진드기 Dp 간의 교차반응성에 대하여 언급한 적이 있으나 그러나 개회충과 Df 간의 교차반응성에 대한 연구는 거의 없다. 본 연구의 결과는 개회충 항원이 Dp보다는 Df와 더 유사하며 Df와의 교차반응성이 Dp보다 더 클 것이라고 예상하게 하였는데, 향후 개회충 항원과 Dp, Df 간의 교차반응성에 대한 추가 연구가 필요할 것으로 생각된다.
본 연구에서 저자들은 포항 지역 인구집단의 톡소카라증의 임상적, 혈청학적 양상을 살펴보았는데, 과거에 발표되었던 연구와 대부분의 양상들은 일치하거나 비슷한 양상을 보이고 있으나 몇 가지 차이점이 있었다. 첫째, Toxocara ELISA 양성군에서 음성군보다 아토피의 비율이 높았으나, 이와 반대로 알레르기 천식과 비염의 비율은 오히려 낮은 특징을 보였다. 둘째, Toxocara ELISA 양성군에서 Dp보다 Df에 대한 특이 IgE가 더 높았는데, 이는 개회충과 Df 항원 간의 교차반응성이 Dp보다 더 클 것이라고 생각할 수 있게 해주었다.
본 연구는 익히지 않은 소의 간이나 고기를 섭취한 병력이 있는 자가 말초 호산구와 혈청 총 IgE가 증가되어 있으면서 알레르기 질환의 병력이 없을 경우 톡소카라증을 의심해야 함을 시사한다. 포항 지역의 톡소카라증은 알레르기성 천식 또는 비염이 없는 경우가 더 많았으며 개회충 항원과 Df 항원 사이의 연관성이 Dp 항원과의 연관성보다 더 높았다. 이러한 특징들은 향후 호산구증가증 환자에서 톡소카라증을 의심할 수 있는 유용한 임상적, 혈청학적 소견이 될 수 있을 것으로 생각된다.