거대세포 바이러스(Cytomegalovirus, CMV)
조혈모세포 이식환자가 CMV-혈청양성인 경우 및 CMV-혈청음성이나 CMV-혈청양성 공여자로부터 이식을 받는 경우는 CMV 감염증 발생 위험군으로서 CMV 질환 예방(CMV disease prevention)의 대상이 된다[2]. CMV 질환의 예방 전략은 크게 예방요법(prophylactic therapy)과 선제요법(preemptive therapy)으로 나눌 수 있다. 예방요법은 이식을 받는 모든 환자에서 생착 시부터 이식 후 100일째까지 항바이러스제를 예방적으로 투여하는 방법으로서, ganciclovir, 고용량 acyclovir, 및 valaciclovir 모두 무작위 대조 임상시험에서 조혈모세포 이식환자의 CMV 감염 위험을 낮추는 효과를 보였다[4-6]. Ganciclovir로 예방요법을 시행할 경우, 첫 5-7일 동안은 공고요법으로 ganciclovir 5 mg/kg를 하루 2회 정주 투여하고 이후 유지 용량으로 ganciclovir 5 mg/kg 하루 1회 정주 투여하며 이식 후 100일째까지 유지한다. Acyclcovir 또는 valacyclovir를 사용하여 예방요법을 하는 경우에는 바이러스 재활성화 여부를 정기적으로 감시해야 하며 재활성화가 확인되면 선제요법을 함께 시행한다[5,6]. 예방요법으로 투여하는 acyclovir는 500 mg을 하루 3회 정맥투여하며, valacyclovir는 2 g을 하루 3-4회 경구투여한다.
선제요법은 CMV 재활성화 여부를 주기적으로 추적검사 하면서, 무증상 CMV 재활성화가 확인되는 경우 단기간 항바이러스제를 투여하는 방법이다. 이때 사용하는 검사 방법으로는 백혈구 내 CMV pp65 항원을 이용한 항원혈증 분석법(antigenemia assay) 또는 CMV DNA 중합효소연쇄반응검사법(CMV-DNA PCR)이 있다[7,8]. 조혈모세포 이식환자는 이식 후 10일째부터 100일째까지 최소 주 1회 혈액검사를 통해 CMV 재활성화 여부를 감시하고 CMV 재활성화가 확인되면 ganciclovir 정맥주사제로 선제치료를 시행한다. 선제요법 기간은 최소 2주 이상 유지하는데 첫 7-14일간은 공고용량으로 ganciclovir 5 mg/kg를 하루 2회 정주 투여하고, 이후 유지용량으로 ganciclovir 5 mg/kg를 하루 1회 정주 투여한다. 2주가 지난 시점에서도 여전히 CMV 바이러스혈증이 있을 경우 음성전환 될 때까지 유지용량을 투여한다[9]. 선제치료가 끝난 후에도 CMV 바이러스혈증은 재발할 수 있으므로 이식 후 100일까지 CMV 재활성화 감시는 계속해야 한다.
현재까지 조혈모세포 이식환자에서 CMV 예방요법 또는 선제요법으로 허가 받은 ganciclovir 제제는 정맥주사제뿐이지만, 최근 선제요법에서 valganciclovir의 이용이 점차 증가하고 있다. Valganciclovir는 ganciclovir의 전구약물로서 경구 투여 약제이며 생체 이용률이 우수하다[10]. Valganciclovir를 이용한 선제요법에 관한 여러 보고에서 CMV 질환의 발생 위험을 감소시키는 데 효과적이고 안전한 약제로 평가되고 있다[11-16]. Valganciclovir로 선제요법을 시행할 경우 공고용량으로 valganciclovir 900 mg을 하루 2회 경구투여하고, 유지 용량으로 900 mg을 하루 1회 경구투여한다[11]. 이처럼 조혈모세포 이식환자에서 valganciclovir는 주로 선제요법으로 사용되어 왔으며, valganciclovir를 이용한 예방요법에 대해서는 아직까지 근거 자료가 충분하지 않다.
CMV-혈청양성 수혜자의 경우 예방요법과 선제요법 모두 CMV 질환 발생 예방 측면에서는 동등한 효과를 가지므로 각 센터별로 검사의 용이성 및 위험-유익성을 고려하여 결정하도록 한다. CMV-혈청음성 수혜자는 가급적 혈청 음성 공여자로부터 이식을 받도록 하고 이식 후 수혈은 백혈구제거 혈액제제를 투여하여야 한다[17-20]. 혈청음성 수혜자가 혈청음성 공여자로부터 이식받을 경우(D-/R-) 백혈구제거 혈액제제를 수혈한다면 CMV 초감염의 위험이 낮으므로[21,22] 예방 전략이 필요하지 않다. 혈청음성 수혜자가 혈청양성 공여자로부터 이식받을 경우(D+/R-) CMV 초감염이 발생할 가능성이 높고 중증 질환으로 발생하므로 예방요법의 대상이 된다[2].
CMV-혈청양성 자가조혈모세포 이식환자의 경우, 전처치로 전신 방사선조사를 받았거나, T 세포를 제거한 이식편을 받은 경우, 이식 전 6개월 이내에 alemtuzumab, fludarabine 또는 2-chlorodeoxyadenosine을 투여받은 경우 CMV 질환의 고위험군이다. 이들 환자에서도 선제요법을 통해 CMV 질환 예방(prevention)이 가능하다[2].
고형장기 이식환자에서 CMV 감염의 영향은 크게 직접적 영향과 간접적 영향 두 가지로 나뉜다. 직접 영향은 침습성 CMV 질환이 발생하는 것으로서 열과 전신증상 및 골수 억제 소견을 나타내는 CMV 증후군과 간염, 심근염, 대장염, 폐렴과 같이 말단장기의 침습성 CMV 질환이 이에 해당한다. 간접 영향은 CMV 재활성화로 인해 여러 가지 면역기전을 통해 이식장기의 기능 저하, 거부 반응, 다른 기회감염의 증가와 같은 현상이 일어나는 것이다[1]. 고형장기 이식환자에서의 CMV 감염 예방전략은 조혈모세포 이식환자와 마찬가지로 예방요법과 선제요법으로 나뉘는데, 그 효과는 발표되는 문헌마다 이식장기의 종류, 수혜자/공여자 혈청양성일치 여부, 사용되는 면역억제제의 강도 및 예방요법 기간 등에 차이가 있어 단편적인 비교가 힘들다.
예방요법과 선제요법의 효과를 직접 비교한 연구는 없으나 간접적으로 분석한 메타분석 결과에서는 두 예방 전략이 CMV 질환 발생의 위험도를 낮추는 효과는 동등하였다[23]. 사망률, 이식편 거부 반응, 이식편 소실, 다른 기회감염 발생 등의 간접적 영향의 예방효과는 선제요법과 예방요법 사이에 차이가 있을 수 있다는 결과를 보이기도 한다. 예를 들어 CMV 예방요법은 선제요법에 비해 간접 영향을 줄이는 효과로 이식편 생존율이 향상될 수 있으나[24,25] 만기 CMV 감염증의 증가, 지속적인 항바이러스제 투여로 인한 의료비 상승, 약제 독성 및 내성의 위험이 증가할 수 있으므로[26] 각 센터별로 검사의 용이성 및 위험-유익성을 고려하여 결정하도록 한다. 하지만 혈청음성 수혜자가 혈청양성 공여자로부터 이식받는 경우(D+/R-)와 유도 요법으로 항림프구항체를 사용하는 경우 CMV 질환 발생의 위험도가 높으므로 선제요법보다는 예방요법이 선호된다. 폐이식, 소장이식 및 소아 이식환자에서는 선제요법에 대한 연구가 아직 부족하다.
고형장기 이식환자에서 CMV 예방요법을 하는 경우, 기간은 3-6개월간 시행하며, 폐이식 및 소장이식환자는 최소 6개월을 권고한다[26]. 예방요법에 사용되는 항바이러스제는 경구 valganciclovir와 정주용 ganciclovir 모두 동등하게 추천되지만[26-28] 비용절감 및 재원기간을 단축할 수 있다는 점에서 경구 valganciclovir의 장점이 분명하여, 현재 국내외 상당수 이식센터에서 D+/R- 간이식환자에게는 경구 valganciclovir를 사용한다[28]. 표준 용량은 valganciclovir 900 mg 경구 하루 1회 복용이지만, valganciclovir 450 mg 경구 하루 1회 복용과 같은 저용량이 CMV 예방효과는 떨어지지 않으면서 호중구 감소증과 같은 부작용은 줄일 수 있다는 연구 결과도 있다[29].
선제요법을 하는 경우, CMV 항원혈증검사 또는 PCR 검사를 주기적으로 시행하며, 센터에서 정한 기준치 이상으로 양성이 나올 경우 valganciclovir 또는 ganciclovir를 치료용량으로 투여하며, 추적 검사에서 음성이 확인되면 종료한다[26].
Herpes simplex virus (HSV)
HSV-혈청양성 조혈모세포 이식 수혜자에게는 acyclovir 예방요법을 권고한다[2]. 일반적으로 전처치 치료(conditioning therapy) 시작 시점부터 생착이 이루어질 때까지 또는 점막염이 호전될 때까지 또는 이식 후 30일째까지 acyclovir를 투여하며 경구 acyclovir 400-800 mg 하루 2회 투여하거나 주사제 acyclovir를 5 mg/kg 하루 2회 정주투여한다. Valacyclovir는 acyclovir의 경구약제로서 조혈모세포 이식환자의 HSV예방요법으로는 아직 승인되지 않았지만, 자가조혈모세포 이식 환자들에서 acyclovir와 동등한 예방 효과를 보여주었다[30,31]. HSV 예방요법으로 쓰이는 valacyclovir 용량은 500 mg 경구 하루 1회 복용하며, T 세포 제거한 이식편, T세포 항체 사용 또는 고용량 스테로이드 사용 시 하루 2회 복용한다[2]. HSV-혈청음성 수혜자에게는 acyclovir 예방요법이 권고되지 않는다.
주폐포자충 폐렴(Pneumocystits jirovecii pneumonia, PCP)
PCP는 체내에 잠복해 있던 Pneumocystis jirovecii가 재활성화되면서 발병하거나 또는 공기 전파를 통해 사람 간에 감염이 전파될 수 있어서 최근 여러 보고에서 병원내 유행이 확인되어 왔다[32-36]. 과거 PCP 예방요법을 시행하기 이전에 조혈모세포 및 고형장기 이식환자에서 PCP 발생률은 약 5-15%였으며[36,37], 폐이식 및 심-폐이식 환자들이 가장 고위험군으로서 10-40%에 달했고, 간 및 신이식 환자는 2-15%의 발생률이 보고되었다[38].
PCP 예방요법을 시행하고 있는 현재, 조혈모세포 이식환자의 PCP 발생률은 5% 미만이다[37]. PCP 예방은 trimethoprim/sulfamethoxazole (TMP-SMX) 경구 복용으로 시행하며, TMP-SMX가 골수 억제를 일으킬 수 있어 일반적으로 조혈모세포가 골수에 생착된 후부터 투여한다[9,39]. 만약 생착이 늦어진다면 생착 전에 PCP 예방요법을 시작할 수도 있다. 예방요법은 최소한 이식 후 6개월까지는 받아야 하며, 6개월이 경과한 뒤에도 지연성 PCP가 발생하는 경우가 있어[40,41], 환자가 지속적으로 면역억제제를 투여받고 있거나 만성 이식편대 숙주반응(chronic graft-versus-host disease, GVHD)이 있는 경우, 기저 혈액암의 재발 또는 CD4 T 세포 수치가 200/μL 이하인 경우에는 이식 후 6개월이 경과하여도 PCP 예방요법을 지속하도록 한다[37].
최우선으로 권고되는 약제인 TMP-SMX는 80 mg/400 mg 제제 하루 1회 복용 또는 160 mg/800 mg 주 3회 복용한다. 만약 TMP-SMX를 복용할 수 없는 경우라면 dapsone, atovaquone, pentamidine 또는 clindamycin과 pyrimethamine 병합요법 등이 이차약제로 권고되는데 이들 약제의 선택 및 예방요법 여부는 감염내과 전문의와 상의하도록 한다. PCP 이외의 다른 균 감염도 예방한다는 측면에서 TMP-SMX가 장점이 있다.
고형장기 이식환자의 경우, 이식 후 PCP 발생률이 3-5%를 넘는 센터에서는 PCP 예방요법을 권고하나[42,43], 현실적으로 대부분 센터에서 예방요법을 시행하고 있어서 예방요법을 시행하지 않는 환자에서 센터별 이식 후 PCP 발생률에 관한 정확한 자료가 거의 없다. TMP-SMX 복용이 PCP뿐 아니라 톡소플라즈마(Toxoplasma), 리스테리아(Listeria species), 흔한 호흡기 감염, 요로 감염 및 위장관 감염을 유발하는 균에도 예방효과가 있다는 장점을 고려했을 때, PCP 예방요법을 적극 고려하는 것이 좋겠다. 이식편 거부반응, 이전에 PCP 감염이 있었던 환자, 반복적인 CMV 감염 환자, 장기간 고용량 스테로이드 복용자(최소 2주 이상 하루 20 mg을 초과하는 용량을 복용), 지속적인 호중구 감소증 또는 기저 자가면역질환이 재발한 환자는 PCP의 고위험군이며, 폐 이식환자는 항상 고위험군으로 평가되므로 예방요법의 대상이 된다[42]. 이식 후 첫 6개월 동안 PCP 발생위험이 가장 높으며, 기저 자가면역질환으로 인하여 이식 전에 이미 면역억제제 또는 스테로이드 복용 중이었던 환자의 경우 이식 후 1개월 이내에 조기에 PCP가 발생할 수 있다.
일반적으로 고형장기 이식환자는 이식 후 6-12개월 동안 PCP 예방요법을 받도록 권고한다. 면역억제제 용량을 감량하지 못하는 환자는 장기간의 예방요법이 필요하다[42]. 예방요법 약제의 용법 및 용량은 조혈모세포 이식환자와 같다.
침습성 진균 감염증
조혈모세포 이식환자에서 발생하는 침습성 진균 감염증은 TRANSNET 자료에 따르면, 침습성 아스페르길루스증이 43%로 가장 흔하였고 그 뒤를 이어 침습성 칸디다증(28%), mucormycosis(8%)의 순으로 발생하였다[44]. 침습성 칸디다증이 발생하는 시기는 이식 후 정중값 61일째였고, 침습성 아스페르길루스증은 이식 후 정중값 99일째에 발병하였다. 동종 조혈모세포 이식환자는 이식편이 생착되기 전까지 호중구 감소증, 점막염 및 중심정맥관 등으로 인해 침습성 칸디다증이 호발한다. 생착 후에는 중심정맥관, 위장관 GVHD 등이 침습성 칸디다증의 위험인자이다. 자가조혈모세포 이식환자의 경우 일단 호중구가 회복되고 점막염이 호전되면 칸디다 감염의 위험은 매우 적다[45]. Fluconazole이 일차적으로 선택되는 예방약제이며, 전처치요법 약제 투여시점부터 이식편생착이 일어날 때까지 투여한다. 저용량 fluconazole은 그 효능의 범위가 상이하여, 하루 200 mg 이상의 용량을 추천한다[9].
Fluconazole은 Candida krusei에는 항균력이 없으며 Candida glabrata에 대해서도 항균력이 일정하지 않아 내성이 발현될 수 있다[46]. 이러한 fluconazole 내성 칸디다균을 상재균으로 보유한 이식환자라면 fluconazole은 권고되지 않는다. 일부 칸디다균의 경우 아졸계의 항진균제에 교차내성을 보이는 경우도 있어, 아졸계로 예방요법을 받는 환자에서는 내성균에 의한 돌발감염의 가능성을 항상 염두에 두어야 한다[47]. Fluconazole은 사상균에 대한 항균력이 없다.
Micafungin은 fluconazole을 대체할 수 있는 예방약제로서 침습성 진균감염을 예방하는 효과가 fluconazole에 비해 비열등함이 확인되었지만[48], 정주로 투여하여야 하고 비용이 비싸다는 단점이 있으며, echinocandin 계열 약제에 내성이 있는 진균(특히 Trichosporon species)의 돌발감염이 보고되고 있어[49] 주의를 요한다. Micafungin의 사상균 감염증에 대한 예방 효과는 아직 정립되지 않았다. 조혈모세포 이식환자에서 진균감염 예방을 위해 micafungin을 투여했던 한 연구에서는 침습성 사상균 감염증 자체 발생률이 매우 낮아서 micafungin의 예방효과를 제대로 증명하기 어려웠다[48]. 다른 echinocandins 제제들도 침습성 진균 감염 예방약제로 시도된 바 있으나, 돌발 사상균 감염에 주의해야 한다[50]. Micafungin을 예방요법으로 투여 시 50 mg 하루 1회 정주한다. Itraconazole 경구 액상제제는 침습성 진균감염 예방에 효과가 있으며[51,52], 침습성 사상균 감염에 대한 효과가 fluconazole 보다 우수하지만[53], 내약성이 낮고 독성 문제 및 약물 간 상호작용으로 인해 예방약제로서의 사용이 제한적이라고 평가된다[9,53]. Itraconazole 용량은 경구 액상제제로 200 mg 하루 2회 공복에 복용한다.
Posaconazole은 최근에 개발된 광범위 트리아졸계 항진균제로 칸디다, 아스페르길루스, Fusarium species 및 zygomycetes에 대해 항진균력이 있다[54,55]. GVHD로 면역억제제 치료를 받는 환자에서 침습성 진균 감염증의 예방에 fluconazole과 동등한 효과가 보고되었고, 특히 침습성 사상균 감염증 예방에 fluconazole보다 우월하였다[56]. 또한 조혈모세포 이식 후 발생한 GVHD를 앓는 환자에서 침습성 진균감염 예방에 fluconazole보다 posaconazole이 더 비용효과적이라는 자료도 나오고 있다[57,58]. 하지만 posaconazole은 아직 이식편이 생착되기 전의 기간 동안 침습성 진균감염 예방 효과에 관한 연구가 부족하고, 약물 농도를 측정하여야 한다는 단점이 있다[59]. Posaconazole 예방요법 시 용량은 200 mg 하루 3회 음식과 함께 복용한다[2].
Voriconazole은 현재까지 침습성 진균감염의 예방에 일반적으로 권고되지는 않으나, 조혈모세포 이식 전에 침습성 사상균 감염증을 경험했던 환자라면, 이식기간 동안 이차 예방을 위해 voriconazole을 투여하는 것이 추천된다[60,61]. 용량은 200 mg 하루 2회 복용한다.
고형장기 이식환자에서는 침습성 칸디다증이 가장 흔하고(53%), 그 뒤를 이어 침습성 아스페르길루스증(19%), 크립토코쿠스증(8%) 순이었는데[62], 각각의 발생시기는 이식 후 103일, 184일 및 575일째였다. 이외에도 비-아스페르길루스 진균(8%), 풍토성 진균(5%) 및 mucormycosis (2%)가 있었다.
여러 연구에서 fluconazole은 간이식 환자에서 안전하면서도 대조군에 비해 유의하게 침습성 진균감염을 낮추었다는 결과가 보고되었다[63-67]. 이보다 자료는 부족하지만 itraconazole과 liposomal amphotericin B 역시 비슷한 효과를 보임을 시사하였다[68]. 폐이식환자의 경우 침습성 아스페르길루스증이 흔하며 사망률도 높아, 사상균에 대한 항균력이 있는 항진균제를 예방약제로 선택하여야 한다. Itraconazole 또는 aerosolized amphotericin B가 가장 흔히 사용되는 예방약제이다[69]. 심장이식환자는 침습성 진균감염의 빈도가 상대적으로 낮고 예방요법에 대한 임상연구가 적어 아직까지 뚜렷한 권고 사항이 정립되지 않았다. 한 연구에 따르면, 침습성 아스페르길루스증의 고위험요인으로 재이식 수술, CMV 질환, 심장이식 후 혈액 투석, 심장이식전후 2개월 이내에 침습성 아스페르길루스증의 병력 등이 확인되었고, 이런 경우 itraconazole 예방요법을 권고하기도 한다[70]. 신이식 환자의 경우 침습성 진균감염의 빈도도 낮고 연구된 바가 거의 없어 현재까지 진균감염 예방은 권고되지 않는다[69]. 각 항진균제의 예방적 투여 용량은 fluconazole 400 mg 하루 1회 투여[67,68,71], itraconazole 경구 액상제제로 200 mg 하루 2회 공복에 투여[71-73], liposomal amphotericin B 1-2 mg/kg 하루 1회 정주투여[67,71], inhaled amphotericin B 25 mg 또는 inhaled amphotericin B lipid complex 50 mg을 하루 1회 투여한다[74,75].
결핵
조혈모세포 이식환자와 고형장기 이식환자를 비교했을 때, 결핵의 발병률은 조혈모세포 이식환자에서 10배 정도 낮은 것으로 알려져 있는데, 이들은 면역억제치료를 평생 받지 않으므로 면역억제치료가 종결되면 서서히 T 세포 기능이 회복되면서 결핵의 위험은 낮아진다. 하지만 만성 GVHD로 인해 지속적으로 면역억제제를 복용하여야 하는 경우는 결핵의 위험군이다. 조혈모세포이식 후에 결핵이 발생한 환자들의 대부분은 분명한 위험인자를 가지고 있지 않았지만 주요 임상적 특징은 기저질환으로 백혈병, 이식 당시 전처치로 전신 방사선 조사를 받았으며 동종이식 수혜자이었고, GVHD로 치료를 받고 있었다[76,77].
조혈모세포 이식 전 잠복결핵 또는 활동성결핵에 대한 평가를 철저히 하여야 하며, 활동성결핵이 발견되면 즉시 치료를 시작하고, 조혈모세포 이식은 임상적으로 결핵이 어느 정도 치료되었다고 판단될 때까지 보류하여야 한다. 잠복결핵이 진단되면 잠복결핵에 대한 치료를 시작하고, 조혈모세포 이식은 동시에 진행할 수 있다.
면역저하자에서 잠복결핵 진단은 결핵피부반응검사(tuberculin skin test, TST)나 IGRA 단독 혹은 두 검사를 병합하여 시행하며 두 검사 중 어느 한 검사에서라도 양성인이면서 활동성결핵이 배제되면 잠복결핵으로 진단한다. TST 양성 기준은 국가마다 다르고 면역저하자의 경우 5-10 mm에서 정하지만 국내에서는 잠정적으로 10 mm 이상을 TST 양성의 기준으로 한다. 국내 결핵진료지침에서는 잠복결핵으로 진단되고 장기이식으로 면역억제제를 복용 중이거나 복용 예정자는 잠복결핵치료를 하도록 권고하고 있다. 그러나 다른 위험인자 없이 잠복결핵 진단검사 양성인 환자 치료 시 결핵 발병 예방 효과에 대한 자료는 아직 없으므로 위험-유익성을 잘 평가하여 결정하도록 한다. 표준치료는 이소니아지드(5 mg/kg/일, 최대 300 mg/일) 9개월 요법을 권고하나, 리팜핀 4개월 요법 및 이소니아지드와 리팜핀 병합 3개월 요법도 선택적으로 고려할 수 있다[78]. 리팜핀 투여 시 약물 상호작용에 의해 면역억제제의 농도를 낮출 수 있으므로 주의한다.
고형장기 이식환자는 일반 인구집단에 비해 결핵 고위험군으로, 약 4-20배 높은 발병률을 보인다[79,80]. 고형장기 이식환자도 조혈모세포 이식환자와 마찬가지로 이식 전에 잠복결핵여부를 검사하고 잠복결핵이 확인되면 이에 대한 치료를 한다. 잠복결핵의 진단과 치료는 조혈모세포 이식환자에서 기술한 바와 같이 국내 결핵진료지침을 따른다[78]. 잠복결핵 검사 양성인 환자 중, 최근 1-2년 내에 활동성결핵환자와 접촉한 병력이 있거나, 결핵의 치료력 없이 흉부 방사선 검사에서 비활동성 결핵병변이 확인되는 경우에는 결핵발병의 고위험군이므로 반드시 치료를 하도록 한다[81].
이식 전 예방접종
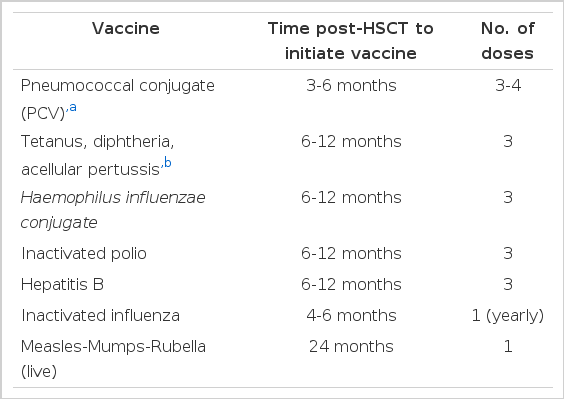
조혈모세포 이식 환자는 이식 후 시간이 지날수록 백신으로 예방 가능한 질환에 대한 체내 항체 역가가 낮아지므로[82-84], 반드시 이식 후에 재접종을 받아야 한다[2]. 이식 후 어느 시점에 접종해야 가장 면역원성이 높은가에 대한 자료는 많지 않은데, 면역원성이 충분하려면 T 세포 및 B 세포 면역이 어느 정도는 회복되어야 한다. B 세포 수는 이식 후 3-12개월이 경과하면 회복되지만[85,86], 새로 생성된 B 세포는 미감작 B 세포로서, 항원에 대하여 체세포 변이(somtatic mutation) 및 동형전환(isotype switching)을 거치기까지 이식 후 1년 정도 소요된다. T 세포 역시 미감작 T 세포가 새 항원에 대한 면역반응을 나타내려면 이식 후 6-12개월이 필요하다. 고령, GVHD가 동반되어 있으면 T 세포 숫자 및 기능 회복시간이 더디며, 만성 GVHD가 있는 성인의 경우 2년 이상 소요되기도 한다[2]. 일부 연구에서 파상풍 톡소이드 백신, 7가 폐알균 단백접합 백신 및 b형 Haemophilus influenzae 단백접합백신을 공여자에게 투여하면 이들 질환에 대해 수혜자의 이식 후 면역이 개선된다는 보고가 있지만[87,88] 현실적으로 공여자에게 백신 투여는 윤리적 문제 또는 실용적 어려움이 있다. 조혈모세포 이식 후 수혜자에게 기본적으로 추천되는 백신()은 폐알균, 파상풍-디프테리아, b형 Haemophilus influenzae, 비활성화 폴리오, B형 간염, 비활성화 인플루엔자, MMR 백신 등이며, 이 중 폐알균 백신의 경우 다당류 백신은 면역원성이 낮아 단백접합백신이 더 선호된다[89-92].
Vaccinations recommended for autologous and allogeneic hematopoietic stem cell transplant recipients [2]
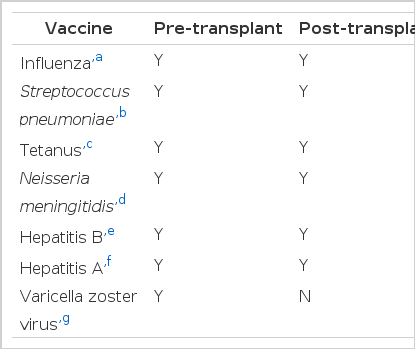
고형장기 이식환자는 이식 후 면역력 저하로 인해 감염에 취약하므로 가급적 이식 수술 전에 필요한 모든 예방접종이 완료되도록 한다() [93]. 이를 위해 이식 준비단계 때 환자의 예방접종력을 확인하고, 만약 완전한 예방접종이 이루어지지 않은 상태라면, 감염내과 전문의와 협진하도록 한다. 가급적 모든 예방접종은 이식 전에 이루어지면 가장 좋으나, 불활성화 사백신은 이식 후에 투여하여도 비교적 안전하며 생백신은 이식 후에는 투여할 수 없으므로 홍역, 볼거리, 풍진, 수두 백신 등은 이식 전에 완료되어야 한다. 이식 후에 백신을 투여해야 하는 경우, 그 시기는 일반적으로 면역억제제가 어느 정도 기저상태에 도달한 시점인 이식 후 3-6개월 째에 재시작하는 것이 추천된다. 하지만 인플루엔자의 경우 발병률이 높으면서 이식환자에서 이환율 및 사망률이 높아 임상적으로 중요한 질환이고, 여러 연구에서 이식 후 조기에 예방접종을 시행하여도 비교적 안전하고 예방효과도 열등하지 않다는 자료가 있어서 유행시기에 필요하다면 이식 후 조기(이식 후 1개월째 이후)에 투여할 수 있다[94].
Vaccinations recommended for solid organ transplant recipients
간이식 환자의 경우, 종종 비장절제술이 이루어지기도 하는데, 이 경우 사전에 비장절제술을 계획한다면, 고형장기이식환자에게 필요한 예방접종 이외에 추가로 비장절제환자에게 필요한 예방접종도 시행하도록 한다. 현재 국내에서는 뇌수막균 백신으로 멘비오(Menveo®) 주사제가 사용 가능하다. 이식 전에 시행하는 모든 예방접종은 늦어도 이식 2주 전에 완료되도록 한다.
환자 본인 이외에도 환자의 가족 및 의료인 역시 예방접종이 필요한 경우가 있는데, 특히 인플루엔자 백신은 반드시 가족도 함께 접종하도록 한다.
References
1. Fishman JA. Infection in solid-organ transplant recipients. N Engl J Med 2007;357:2601–2614.
2. Tomblyn M, Chiller T, Einsele H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol Blood Marrow Transplant 2009;15:1143–1238.
3. Lee DG, Kim SH, Kim SY, et al. Evidence-based guidelines for empirical therapy of neutropenic fever in Korea. Infect Chemother 2011;43:258–321.
4. Goodrich JM, Bowden RA, Fisher L, Keller C, Schoch G, Meyers JD. Ganciclovir prophylaxis to prevent cytomegalovirus disease after allogeneic marrow transplant. Ann Intern Med 1993;118:173–178.
5. Prentice HG, Gluckman E, Powles RL, et al. Impact of long-term acyclovir on cytomegalovirus infection and survival after allogeneic bone marrow transplantation: European Acyclovir for CMV Prophylaxis Study Group. Lancet 1994;343:749–753.
6. Ljungman P, de La Camara R, Milpied N, et al. Randomized study of valacyclovir as prophylaxis against cytomegalovirus reactivation in recipients of allogeneic bone marrow transplants. Blood 2002;99:3050–3056.
7. Boeckh M, Nichols WG, Papanicolaou G, Rubin R, Wingard JR, Zaia J. Cytomegalovirus in hematopoietic stem cell transplant recipients: current status, known challenges, and future strategies. Biol Blood Marrow Transplant 2003;9:543–558.
8. Drew WL. Laboratory diagnosis of cytomegalovirus infection and disease in immunocompromised patients. Curr Opin Infect Dis 2007;20:408–411.
9. Tomblyn M, Chiller T, Einsele H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective: preface. Bone Marrow Transplant 2009;44:453–455.
10. Freeman RB. Valganciclovir: oral prevention and treatment of cytomegalovirus in the immunocompromised host. Expert Opin Pharmacother 2004;5:2007–2016.
11. Ayala E, Greene J, Sandin R, et al. Valganciclovir is safe and effective as pre-emptive therapy for CMV infection in allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant 2006;37:851–856.
12. Einsele H, Reusser P, Bornhäuser M, et al. Oral valganciclovir leads to higher exposure to ganciclovir than intravenous ganciclovir in patients following allogeneic stem cell transplantation. Blood 2006;107:3002–3008.
13. Van der Heiden PL, Kalpoe JS, Barge RM, Willemze R, Kroes AC, Schippers EF. Oral valganciclovir as pre-emptive therapy has similar efficacy on cytomegalovirus DNA load reduction as intravenous ganciclovir in allogeneic stem cell transplantation recipients. Bone Marrow Transplant 2006;37:693–698.
14. Busca A, de Fabritiis P, Ghisetti V, et al. Oral valganciclovir as preemptive therapy for cytomegalovirus infection post allogeneic stem cell transplantation. Transpl Infect Dis 2007;9:102–107.
15. Allice T, Busca A, Locatelli F, Falda M, Pittaluga F, Ghisetti V. Valganciclovir as pre-emptive therapy for cytomegalovirus infection post-allogenic stem cell transplantation: implications for the emergence of drug-resistant cytomegalovirus. J Antimicrob Chemother 2009;63:600–608.
16. Takenaka K, Nagafuji K, Takase K, et al. Initial low-dose valganciclovir as a preemptive therapy is effective for cytomegalovirus infection in allogeneic hematopoietic stem cell transplant recipients. Int J Hematol 2012;96:94–100.
17. Nichols WG, Price TH, Gooley T, Corey L, Boeckh M. Transfusion-transmitted cytomegalovirus infection after receipt of leukoreduced blood products. Blood 2003;101:4195–4200.
18. Ljungman P, Larsson K, Kumlien G, et al. Leukocyte depleted, unscreened blood products give a low risk for CMV infection and disease in CMV seronegative allogeneic stem cell transplant recipients with seronegative stem cell donors. Scand J Infect Dis 2002;34:347–350.
19. Bowden RA, Slichter SJ, Sayers M, et al. A comparison of filtered leukocyte-reduced and cytomegalovirus (CMV) seronegative blood products for the prevention of transfusion-associated CMV infection after marrow transplant. Blood 1995;86:3598–3603.
20. Ratko TA, Cummings JP, Oberman HA, et al. Evidencebased recommendations for the use of WBC-reduced cellular blood components. Transfusion 2001;41:1310–1319.
21. Bowden RA, Slichter SJ, Sayers MH, Mori M, Cays MJ, Meyers JD. Use of leukocyte-depleted platelets and cytomegalovirus-seronegative red blood cells for prevention of primary cytomegalovirus infection after marrow transplant. Blood 1991;78:246–250.
22. Van Prooijen HC, Visser JJ, van Oostendorp WR, de Gast GC, Verdonck LF. Prevention of primary transfusionassociated cytomegalovirus infection in bone marrow transplant recipients by the removal of white cells from blood components with high-affinity filters. Br J Haematol 1994;87:144–147.
23. Small LN, Lau J, Snydman DR. Preventing post-organ transplantation cytomegalovirus disease with ganciclovir: a meta-analysis comparing prophylactic and preemptive therapies. Clin Infect Dis 2006;43:869–880.
24. Potena L, Grigioni F, Magnani G, et al. Prophylaxis versus preemptive anti-cytomegalovirus approach for prevention of allograft vasculopathy in heart transplant recipients. J Heart Lung Transplant 2009;28:461–467.
25. Potena L, Valantine HA. Cytomegalovirus-associated allograft rejection in heart transplant patients. Curr Opin Infect Dis 2007;20:425–431.
26. Kotton CN, Kumar D, Caliendo AM, et al. International consensus guidelines on the management of cytomegalovirus in solid organ transplantation. Transplantation 2010;89:779–795.
27. Kalil AC, Freifeld AG, Lyden ER, Stoner JA. Valganciclovir for cytomegalovirus prevention in solid organ transplant patients: an evidence-based reassessment of safety and efficacy. PLoS One 2009;4:e5512.
28. Andrews PA, Emery VC, Newstead C. Summary of the British transplantation society guidelines for the prevention and management of CMV disease after solid organ transplantation. Transplantation 2011;92:1181–1187.
29. Kalil AC, Mindru C, Florescu DF. Effectiveness of valganciclovir 900 mg versus 450 mg for cytomegalovirus prophylaxis in transplantation: direct and indirect treatment comparison meta-analysis. Clin Infect Dis 2011;52:313–321.
30. Dignani MC, Mykietiuk A, Michelet M, et al. Valacyclovir prophylaxis for the prevention of Herpes simplex virus reactivation in recipients of progenitor cells transplantation. Bone Marrow Transplant 2002;29:263–267.
31. Eisen D, Essell J, Broun ER, Sigmund D, DeVoe M. Clinical utility of oral valacyclovir compared with oral acyclovir for the prevention of herpes simplex virus mucositis following autologous bone marrow transplantation or stem cell rescue therapy. Bone Marrow Transplant 2003;31:51–55.
32. De Boer MG, Bruijnesteijn van Coppenraet LF, Gaasbeek A, et al. An outbreak of Pneumocystis jiroveci pneumonia with 1 predominant genotype among renal transplant recipients: interhuman transmission or a common environmental source? Clin Infect Dis 2007;44:1143–1149.
33. Schmoldt S, Schuhegger R, Wendler T, et al. Molecular evidence of nosocomial Pneumocystis jirovecii transmission among 16 patients after kidney transplantation. J Clin Microbiol 2008;46:966–971.
34. Sassi M, Ripamonti C, Mueller NJ, et al. Outbreaks of Pneumocystis pneumonia in 2 renal transplant centers linked to a single strain of Pneumocystis: implications for transmission and virulence. Clin Infect Dis 2012;54:1437–1444.
35. Phipps LM, Chen SC, Kable K, et al. Nosocomial Pneumocystis jirovecii pneumonia: lessons from a cluster in kidney transplant recipients. Transplantation 2011;92:1327–1334.
36. Fishman JA. Prevention of infection due to Pneumocystis carinii. Antimicrob Agents Chemother 1998;42:995–1004.
37. De Castro N, Neuville S, Sarfati C, et al. Occurrence of Pneumocystis jiroveci pneumonia after allogeneic stem cell transplantation: a 6-year retrospective study. Bone Marrow Transplant 2005;36:879–883.
38. Rodriguez M, Fishman JA. Prevention of infection due to Pneumocystis spp. in human immunodeficiency virusnegative immunocompromised patients. Clin Microbiol Rev 2004;17:770–782.
39. Centers for Disease Control and Prevention, ; Infectious Disease Society of America, ; American Society of Blood and Marrow Transplantation. Guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. MMWR Recomm Rep 2000;49(RR-10)1-125, CE1-7.
40. Lyytikäinen O, Ruutu T, Volin L, et al. Late onset Pneumocystis carinii pneumonia following allogeneic bone marrow transplantation. Bone Marrow Transplant 1996;17:1057–1059.
41. Tuan IZ, Dennison D, Weisdorf DJ. Pneumocystis carinii pneumonitis following bone marrow transplantation. Bone Marrow Transplant 1992;10:267–272.
42. Martin SI, Fishman JA, ; AST Infectious Diseases Community of Practice. Pneumocystis pneumonia in solid organ transplant recipients. Am J Transplant 2009;9(Suppl 4):S227–S233.
43. Fishman JA. Prevention of infection caused by Pneumocystis carinii in transplant recipients. Clin Infect Dis 2001;33:1397–1405.
44. Kontoyiannis DP, Marr KA, Park BJ, et al. Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients, 2001-2006: overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database. Clin Infect Dis 2010;50:1091–1100.
45. Marr KA, Bow E, Chiller T, et al. Fungal infection prevention after hematopoietic cell transplantation. Bone Marrow Transplant 2009;44:483–487.
46. Pfaller MA, Diekema DJ, Gibbs DL, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance study, 1997 to 2005: an 8.5-year analysis of susceptibilities of Candida species and other yeast species to fluconazole and voriconazole determined by CLSI standardized disk diffusion testing. J Clin Microbiol 2007;45:1735–1745.
47. Pfaller MA, Messer SA, Boyken L, Tendolkar S, Hollis RJ, Diekema DJ. Geographic variation in the susceptibilities of invasive isolates of Candida glabrata to seven systemically active antifungal agents: a global assessment from the ARTEMIS Antifungal Surveillance Program conducted in 2001 and 2002. J Clin Microbiol 2004;42:3142–3146.
48. Van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis 2004;39:1407–1416.
49. Matsue K, Uryu H, Koseki M, Asada N, Takeuchi M. Breakthrough trichosporonosis in patients with hematologic malignancies receiving micafungin. Clin Infect Dis 2006;42:753–757.
50. Madureira A, Bergeron A, Lacroix C, et al. Breakthrough invasive aspergillosis in allogeneic haematopoietic stem cell transplant recipients treated with caspofungin. Int J Antimicrob Agents 2007;30:551–554.
51. Oren I, Rowe JM, Sprecher H, et al. A prospective randomized trial of itraconazole vs fluconazole for the prevention of fungal infections in patients with acute leukemia and hematopoietic stem cell transplant recipients. Bone Marrow Transplant 2006;38:127–134.
52. Winston DJ, Maziarz RT, Chandrasekar PH, et al. Intravenous and oral itraconazole versus intravenous and oral fluconazole for long-term antifungal prophylaxis in allogeneic hematopoietic stem-cell transplant recipients: a multicenter, randomized trial. Ann Intern Med 2003;138:705–713.
53. Marr KA, Crippa F, Leisenring W, et al. Itraconazole versus fluconazole for prevention of fungal infections in patients receiving allogeneic stem cell transplants. Blood 2004;103:1527–1533.
54. Hof H. A new, broad-spectrum azole antifungal: posaconazole: mechanisms of action and resistance, spectrum of activity. Mycoses 2006;49(Suppl 1):S2–S6.
55. Boucher HW, Groll AH, Chiou CC, Walsh TJ. Newer systemic antifungal agents: pharmacokinetics, safety and efficacy. Drugs 2004;64:1997–2020.
56. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med 2007;356:335–347.
57. De la Cámara R, Jarque I, Sanz MA, et al. Economic evaluation of posaconazole vs fluconazole in the prevention of invasive fungal infections in patients with GVHD following haematopoietic SCT. Bone Marrow Transplant 2010;45:925–932.
58. O'Sullivan AK, Weinstein MC, Pandya A, et al. Costeffectiveness of posaconazole versus fluconazole for prevention of invasive fungal infections in U.S. patients with graft-versus-host disease. Am J Health Syst Pharm 2012;69:149–156.
59. Ananda-Rajah MR, Grigg A, Slavin MA. Making sense of posaconazole therapeutic drug monitoring: a practical approach. Curr Opin Infect Dis 2012;25:605–611.
60. Cordonnier C, Rovira M, Maertens J, Cornely OA, Ljungman P, Einsele H. Voriconazole as secondary antifungal prophylaxis in stem cell transplant recipients. Haematologica 2011;96:e9–e10.
61. Cordonnier C, Rovira M, Maertens J, et al. Voriconazole for secondary prophylaxis of invasive fungal infections in allogeneic stem cell transplant recipients: results of the VOSIFI Study. Haematologica 2010;95:1762–1768.
62. Pappas PG, Alexander BD, Andes DR, et al. Invasive fungal infections among organ transplant recipients: results of the Transplant-Associated Infection Surveillance Network (TRANSNET). Clin Infect Dis 2010;50:1101–1111.
63. Winston DJ, Pakrasi A, Busuttil RW. Prophylactic fluconazole in liver transplant recipients: a randomized, doubleblind, placebo-controlled trial. Ann Intern Med 1999;131:729–737.
64. Lumbreras C, Cuervas-Mons V, Jara P, et al. Randomized trial of fluconazole versus nystatin for the prophylaxis of Candida infection following liver transplantation. J Infect Dis 1996;174:583–588.
65. Cruciani M, Mengoli C, Malena M, Bosco O, Serpelloni G, Grossi P. Antifungal prophylaxis in liver transplant patients: a systematic review and meta-analysis. Liver Transpl 2006;12:850–858.
66. Playford EG, Webster AC, Sorell TC, Craig JC. Antifungal agents for preventing fungal infections in solid organ transplant recipients. Cochrane Database Syst Rev 2004;:CD004291.
67. Hadley S, Huckabee C, Pappas PG, et al. Outcomes of antifungal prophylaxis in high-risk liver transplant recipients. Transpl Infect Dis 2009;11:40–48.
68. Playford EG, Webster AC, Sorrell TC, Craig JC. Systematic review and meta-analysis of antifungal agents for preventing fungal infections in liver transplant recipients. Eur J Clin Microbiol Infect Dis 2006;25:549–561.
69. Brizendine KD, Vishin S, Baddley JW. Antifungal prophylaxis in solid organ transplant recipients. Expert Rev Anti Infect Ther 2011;9:571–581.
70. Muñoz P, Rodríguez C, Bouza E, et al. Risk factors of invasive aspergillosis after heart transplantation: protective role of oral itraconazole prophylaxis. Am J Transplant 2004;4:636–643.
71. Biancofiore G, Bindi ML, Baldassarri R, et al. Antifungal prophylaxis in liver transplant recipients: a randomized placebo-controlled study. Transpl Int 2002;15:341–347.
72. Winston DJ, Busuttil RW. Randomized controlled trial of oral itraconazole solution versus intravenous/oral fluconazole for prevention of fungal infections in liver transplant recipients. Transplantation 2002;74:688–695.
73. Sharpe MD, Ghent C, Grant D, Horbay GL, McDougal J, David Colby W. Efficacy and safety of itraconazole prophylaxis for fungal infections after orthotopic liver transplantation: a prospective, randomized, double-blind study. Transplantation 2003;76:977–983.
74. Drew RH, Dodds Ashley E, Benjamin DK Jr, Duane Davis R, Palmer SM, Perfect JR. Comparative safety of amphotericin B lipid complex and amphotericin B deoxycholate as aerosolized antifungal prophylaxis in lung-transplant recipients. Transplantation 2004;77:232–237.
75. Drew R. Potential role of aerosolized amphotericin B formulations in the prevention and adjunctive treatment of invasive fungal infections. Int J Antimicrob Agents 2006;27(Suppl 1):36–44.
76. Akan H, Arslan O, Akan OA. Tuberculosis in stem cell transplant patients. J Hosp Infect 2006;62:421–426.
77. Yuen KY, Woo PC. Tuberculosis in blood and marrow transplant recipients. Hematol Oncol 2002;20:51–62.
78. Joint Committee for the Development of Korean Guidelines for Tuberculosis, ; Korea Centers for Disease Control and Prevention. Korean Guidelines for Tuberculosis 2011. p. 1–218.
79. Torre-Cisneros J, Doblas A, Aguado JM, et al. Tuberculosis after solid-organ transplant: incidence, risk factors, and clinical characteristics in the RESITRA (Spanish Network of Infection in Transplantation) Cohort. Clin Infect Dis 2009;48:1657–1665.
80. Ha YE, Joo EJ, Park SY, et al. Tacrolimus as a risk factor for tuberculosis and outcome of treatment with rifampicin in solid organ transplant recipients. Transpl Infect Dis 2012;14:626–634.
81. Muñoz P, Rodríguez C, Bouza E. Mycobacterium tuberculosis infection in recipients of solid organ transplants. Clin Infect Dis 2005;40:581–587.
82. Ljungman P, Fridell E, Lönnqvist B, et al. Efficacy and safety of vaccination of marrow transplant recipients with a live attenuated measles, mumps, and rubella vaccine. J Infect Dis 1989;159:610–615.
83. Ljungman P, Wiklund-Hammarsten M, Duraj V, et al. Response to tetanus toxoid immunization after allogeneic bone marrow transplantation. J Infect Dis 1990;162:496–500.
84. Pauksen K, Duraj V, Ljungman P, et al. Immunity to and immunization against measles, rubella and mumps in patients after autologous bone marrow transplantation. Bone Marrow Transplant 1992;9:427–432.
85. Parkman R, Weinberg K. Immunological reconstitution following hematopoietic stem cell transplantation. In : Blume K, Forman S, Appelbaum F, eds. Thomas’s Hematopoietic Cell Transplantation 3rd editionth ed. Malden: Blackwell Science; 2003. p. 853–861.
86. Storek J, Witherspoon RP. Immunological reconstitution after hematopoietic stem cell transplantation. In : Atkinson K, Champlin R, Ritz J, Fibbe WE, Ljungman P, Brenner MK, eds. Clinical Bone Marrow and Blood Stem Cell Transplantation 3rd editionth ed. Cambridge: Cambridge University Press; 2004. p. 194–226.
87. Molrine DC, Antin JH, Guinan EC, et al. Donor immunization with pneumococcal conjugate vaccine and early protective antibody responses following allogeneic hematopoietic cell transplantation. Blood 2003;101:831–836.
88. Molrine DC, Guinan EC, Antin JH, et al. Donor immunization with Haemophilus influenzae type b (HIB)-conjugate vaccine in allogeneic bone marrow transplantation. Blood 1996;87:3012–3018.
89. Guinan EC, Molrine DC, Antin JH, et al. Polysaccharide conjugate vaccine responses in bone marrow transplant patients. Transplantation 1994;57:677–684.
90. Kumar D, Chen MH, Welsh B, et al. A randomized, double-blind trial of pneumococcal vaccination in adult allogeneic stem cell transplant donors and recipients. Clin Infect Dis 2007;45:1576–1582.
91. Cordonnier C, Labopin M, Chesnel V, et al. Randomized study of early versus late immunization with pneumococcal conjugate vaccine after allogeneic stem cell transplantation. Clin Infect Dis 2009;48:1392–1401.
92. Cordonnier C, Labopin M, Chesnel V, et al. Immune response to the 23-valent polysaccharide pneumococcal vaccine after the 7-valent conjugate vaccine in allogeneic stem cell transplant recipients: results from the EBMT IDWP01 trial. Vaccine 2010;28:2730–2734.
93. Danzinger-Isakov L, Kumar D, ; AST Infectious Diseases Community of Practice. Guidelines for vaccination of solid organ transplant candidates and recipients. Am J Transplant 2009;9(Suppl 4):S258–S262.
94. Cordero E, Manuel O. Influenza vaccination in solid-organ transplant recipients. Curr Opin Organ Transplant 2012;17:601–608.