žĄú Ž°†
Í≥†žĚłžāįŪėąž¶ĚžĚÄ žč†žě•žóźžĄú žĚł ŽįįžĄ§žóź žě•žē†ÍįÄ žěąÍĪįŽāė žĄłŪŹ¨žôłžē°žóź Í≥ľŽŹĄŪēėÍ≤Ć žĚłžĚī Ūą¨žó¨Žź† ŽēĆ ŽįúžÉĚŪē† žąė žěąŽč§. žėąŽ•ľ Žď§žĖī žč†Ž∂Äž†Ą, Ž∂ÄÍįĎžÉĀžĄ†ÍłįŽä•ž†ÄŪēėž¶Ě, Í≥ľŽŹĄŪēú žĚł žĄ≠ž∑® ŽėźŽäĒ ÍīĎŽ≤ĒžúĄŪēú žĄłŪŹ¨ žÜźžÉĀžĚī žěąžĚĄ ŽēĆ Í≥†žĚłžāįŪėąž¶ĚžĚī žÉĚÍłł žąė žěąŽč§. Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú ÍīÄžįįŽźėŽäĒ žč†ÍłįŽä•žě•žē†ŽäĒ Í≥†žĻľžäėŪėąž¶Ě, Í≤Şᥠžč†žĄłŽá®ÍīÄŽ≥Ďž¶Ě, žöĒžāį žč†Ž≥Ďž¶Ě, Íįźžóľ ŽďĪžóź žĚėŪēėŽ©į Í≥†žĚłžāįŪėąž¶ĚžĚÄ ŽĆÄÍįú žč†Ž∂Äž†ĄžĚī žõźžĚłžĚīŽč§[1]. ž†ÄžěźŽď§žĚÄ žĚėŽĮł žěąŽäĒ žč†Ž∂Äž†ĄžĚī žóÜžĚƞ󟎏Ą ŽÜížĚÄ Ūėąž≤≠ žĚł žąėžĻėŽ•ľ Ž≥īžĚł Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź Ž¨łŪóĆÍ≥†žįįÍ≥ľ Ūē®ÍĽė Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
ž¶Ě Ž°Ä
Ūôė žěź: žĚī„Äá„Äá, 86žĄł, žó¨žěź
ž£ľ žÜĆ: 2žĚľÍįĄžĚė Žįúžóī
ŪėĄŽ≥ĎŽ†•: Žāīžõź 1ÍįúžõĒ ž†ĄŽ∂ÄŪĄį ŽßąŽ•ł ÍłįžĻ®žĚī žěąžóąžúľŽāė Í≤ĹÍ≥ľÍīÄžįį Ūēīžė§Žćė ž§Ď Žāīžõź 2žĚľ ž†ĄŽ∂ÄŪĄį Žįúžóī, žė§ŪēúžĚī ŽįúžÉĚŪēėžėÄÍ≥† ÍłįžĻ®žĚī žč¨ŪēīžßÄÍ≥† ŽÜ枥Ī ÍįÄŽěėÍįÄ ŽŹôŽįėŽźėžĖī ŽāīžõźŪēėžėÄŽč§. ŪôėžěźŽäĒ žąėÍįúžõĒ ž†ĄŽ∂ÄŪĄį žöĒŪÜĶžĚĄ ŪėłžÜĆŪēėžėÄŽč§.
Í≥ľÍĪįŽ†•: Í≥†Ūėąžēē žôł ŪäĻžĚīžā¨Ūē≠žĚÄ žóÜžóąŽč§.
žč†ž≤īÍ≤Äžā¨ žÜĆÍ≤¨: Žāīžõź ŽčĻžčú Ūėąžēē 120/80 mmHg, Žß•Žįēžąė 80ŪöĆ/Ž∂Ą, ž≤īžė® 38‚ĄÉ, ŪėłŪĚ°žąė 20ŪöĆ/Ž∂ĄžĚīžóąŽč§. ŪôėžěźŽäĒ ŽßĆžĄĪ Ž≥ĎžÉȞ̥ Ž≥īžėÄžúľŽ©į Í≤įŽßČžĚÄ žįĹŽįĪŪēėžėÄŽč§. žč¨žĚĆžĚÄ ž†ēžÉĀžĚīžóąÍ≥† žöįžł° ŪēėŽ∂Ä ŪŹźžēľžóźžĄú žąėŪŹ¨žĚĆžĚī ž≤≠žßĄŽźėžóąŽč§. žöįžł° žÉĀŪĚČŽ∂Äžóź Í≤ĹŪēú žēēŪÜĶžĚī žěąžóąžúľŽāė žĘÖÍīīŽäĒ žīČžßÄŽźėžßÄ žēäžēėŽč§. Ž≥ĶŽ∂ÄŽäĒ ž†ēžÉĀ žě•žĚĆžĚīžóąÍ≥† ÍįĄŽĻĄžĘÖŽĆÄŽäĒ žóÜžóąžúľŽ©į žēēŪÜĶžĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§. ŪēėŽ∂Ä žöĒž∂ĒžóźžĄú žēēŪÜĶžĚī ÍīÄžįįŽźėžóąžúľŽāė ŽŹĆž∂úŽźú žĘÖÍīīŽäĒ žóÜžóąŽč§. žĖĎŪēėžßÄžóź Ž∂ÄžĘÖžĚÄ žóÜžóąŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: ŽßźžīąŪėąžē° Í≤Äžā¨žóźžĄú ŽįĪŪėąÍĶ¨ 8,970/őľL, Ūėłž§ĎÍĶ¨ 81.6%, ŪėąžÉČžÜĆ 8.1 g/dL, ž†ĀŪėąÍĶ¨žö©ž†ĀŽ•† 23.5%, ŪėąžÜĆŪĆź 234,000/őľL žėÄŽč§. Ūėąž≤≠ žÉĚŪôĒŪēô Í≤Äžā¨žóźžĄú žīĚ Žč®ŽįĪ 9.1 g/dL, žēĆŽ∂ÄŽĮľ 2.7 g/dL, AST 29 IU/L, ALT 10 IU/L, LDH 301 IU/L, BUN 19.8 mg/dL, creatinine 1.0 mg/dL, žĻľžäė 8.4 mg/dL, žĚł 11.6 mg/dL, žöĒžāį 5.2 mg/dLžėÄŽč§. PTH intact 57.1 pg/mL, 1,25-(OH)2 VitD3 21.8 pg/mLžėÄÍ≥† IgG 4,002 mg/dL, IgA 34 mg/dL, IgM 33 mg/dLžúľŽ°ú IgGÍįÄ ž¶ĚÍįÄŽźėžĖī žěąžóąŽč§(Table 1). Ūėąž≤≠ Žč®ŽįĪžßą ž†ĄÍłįžėĀŽŹô Í≤Äžā¨žóźžĄú MŽč®ŽįĪžĚī 3.35 g/dLŽ°ú žł°ž†ēŽźėžóąŽč§. Ūėąž≤≠ Ž©īžó≠Í≥†ž†ē ž†ĄÍłįžėĀŽŹôÍ≤Äžā¨žóźžĄú IgG kappa lanežóź ŽĻĄž†ēžÉĀ ŽįīŽďúÍįÄ ÍīÄžįįŽźėžóąÍ≥† Í≥®žąėŪĚ°žĚłÍ≤Äžā¨žóźžĄú ŪėēžßąžĄłŪŹ¨ÍįÄ 26%Ž°ú ž¶ĚÍįÄŽźėžĖī žěąžóąŽč§.
Žį©žā¨žĄ† žÜĆÍ≤¨: ŪĚČŽ∂Ä Žį©žā¨žĄ†žī¨žėĀ ŽįŹ ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžóźžĄú žöįŪēėžóĹžóź Í≤ĹŪôĒ žÜĆÍ≤¨žĚĄ Ž≥īžėÄžúľŽ©į žöįžł° 3Ž≤ą ŽäĎÍ≥®žóź Í≥®ž†ą ŽįŹ žĚłž†ĎŪēú ŪĚČŽßČžóź žóįž°įžßĀ žĘÖÍīīÍįÄ ÍīÄžįįŽźėžóąŽč§. Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžóźžĄúŽäĒ 4Ž≤ą žöĒž∂Ē Í∑ĻŽŹĆÍłįžóź 2.4 cmžĚė žĘÖÍīīÍįÄ ÍīÄžįįŽźėžóąŽč§.
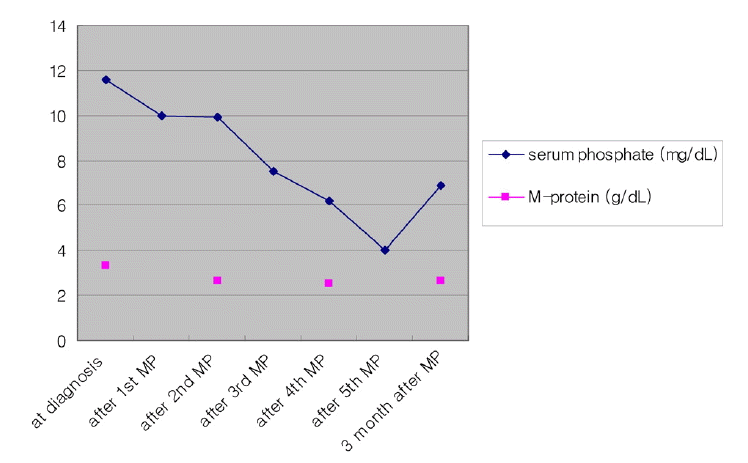
žĻėŽ£Ć ŽįŹ Í≤ĹÍ≥ľ: ŪôėžěźŽäĒ IgG kappa žēĄŪėēžĚė Žč§ŽįúÍ≥®žąėžĘÖ, Durie-Salmon Ž≥ĎÍłį IIIAŽ°ú žßĄŽč®ŽźėžóąÍ≥† melphalan/prednisolone (MP)žúľŽ°ú Ūē≠žēĒžĻėŽ£ĆŽ•ľ žčúžěĎŪēėžėÄŽč§. 4ŪöĆžĚė Ūē≠žēĒžĻėŽ£ĆŽ•ľ ŽßąžĻú ŪõĄ Ūėąž≤≠ M Žč®ŽįĪžĚÄ 2.54 g/dLŽ°ú žēĹÍįĄ ÍįźžÜĆŪēėžėÄÍ≥† žīĚ Žč®ŽįĪ 7.3 g/dL, žēĆŽ∂ÄŽĮľ 3.1 g/dL, žĻľžäė 8.3 mg/dL, žĚł 6.2 mg/dLŽ°ú M Žč®ŽįĪžĖĎžĚī ÍįźžÜĆŪēėŽ©īžĄú žĚł žąėžĻėŽŹĄ ÍįźžÜĆŪēėžėÄŽč§(Fig. 1). ŪôėžěźŽäĒ žīĚ 6ŪöĆžĚė MP Ūē≠žēĒžĻėŽ£ĆŽ•ľ žčúŪĖČ ŪõĄ žôłŽěėžóźžĄú Í≤ĹÍ≥ľÍīÄžįįŪēėŽćė ž§Ď ŪŹźŽ†īžúľŽ°ú žā¨ŽßĚŪēėžėÄŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨žĚė ŪŹČÍįÄ: žßĄŽč® ŽčĻžčú Ūėąž≤≠ žĚłžĚī 11.6 mg/dLŽ°ú ž¶ĚÍįÄŽźėžĖī žěąžóąžúľŽāė ŪĀ¨Ž†ąžēĄŪčįŽčĆ ž≤≠žÜĆžú®žĚÄ 55.8 mL/minžúľŽ°ú žč†ÍłįŽä•žě•žē†ÍįÄ žč¨ŪēėžßÄ žēäžēėÍ≥† Ž∂ÄÍįĎžÉĀžĄ†ÍłįŽä•ŽŹĄ ž†ēžÉĀžĚīžóąžúľŽĮÄŽ°ú ž¶ĚÍįÄŽźú žĚł žąėžĻėžĚė žõźžĚłžúľŽ°ú žč§Ūóėžč§ žė§Ž•ėŽ•ľ žÉĚÍįĀŪēėžėÄŽč§. žĚīžÉĀŽč®ŽįĪžĚė ž°īžě¨ÍįÄ Ūėąž≤≠ žĚłžĚė žł°ž†ēžóź žėĀŪĖ•žĚĄ ž§Ą žąė žěąŽč§ŽäĒ Ž≥īÍ≥†Ž•ľ žįłÍ≥†Ūēėžó¨, sulfosalicylic acidŽ•ľ žĚīžö©Ūēėžó¨ ŪôėžěźžĚė Ūėąž≤≠žóźžĄú Žč®ŽįĪžßąžĚĄ ž†úÍĪį ŪõĄ Žč§žčú žĚłžĚĄ žł°ž†ēŪēėžėÄŽč§. ŽėźŪēú Žč§ŽįúÍ≥®žąėžĘÖžúľŽ°ú žßĄŽč®Žźú ž†ĀžĚī žóÜŽäĒ žěÖžõź Ūôėžěź 4Ž™ÖžĚĄ Ž¨īžěĎžúĄŽ°ú Í≥®ŽĚľ ŽŹôžĚėŽ•ľ ÍĶ¨Ūēú ŪõĄ Žč®ŽįĪžßą ž†úÍĪį ŪõĄžĚė žĚł žąėžĻėŽ•ľ žł°ž†ēŪēėžėÄŽč§. Ž≥ł ŪôėžěźžĚė Ūėąž≤≠ žĚłžĚÄ Žč®ŽįĪžßą ž†úÍĪį ž†Ą 11.4 mg/dLžėÄžúľŽāė Žč®ŽįĪžßą ž†úÍĪį ŪõĄ 3.1 mg/dLŽ°ú ž†ēžÉĀžĻėŽ•ľ Ž≥īžó¨ž£ľžóąŽč§. Žč§ŽįúÍ≥®žąėžĘÖžĚī žóÜŽäĒ 4Ž™ÖžĚė ŽĆÄž°įÍĶįžóźžĄúŽäĒ Žč®ŽįĪžßą ž†úÍĪį ŪõĄ Ūėąž≤≠ žĚł žąėžĻėÍįÄ žė§Ū칎†§ žēĹÍįĄ ž¶ĚÍįÄŪēėžėÄŽč§(Table 2). Ž≥łžõźžóźžĄúŽäĒ žÉĀžóÖŪôĒŽźú kit (Roche Diagnostics GmbH, Mannheim, Germany)žĚĄ žĚīžö©Ūēėžó¨ žěźŽŹôŪôĒŽźú žěĄžÉĀŪôĒŪēô Ž∂ĄžĄĚÍłį(Roche MODULAR P analyzer; Roche Diagnostics GmbH, Mannheim, Germany)Ž°ú phosphomolybdate žěźžôłžĄ†Ž≤ēžĚĄ ŪÜĶŪēī Ūėąž≤≠ žĚłžĚĄ žł°ž†ēŪēėžėÄŽč§. Žč®ŽįĪžßą ž†úÍĪį(deproteinization)ŽäĒ 2 mL Ūėąž≤≠žóź 200 ¬ĶL 1.57 M sulfosalicylic acid (SSA)Ž•ľ ž≤®ÍįÄŪēėžó¨ žčúŪĖČŽźėžóąŽč§[2].
Í≥† žįį
Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú ÍīÄžįįŽźėŽäĒ Í≥†žĚłžāįŪėąž¶ĚžĚÄ ŽĆÄŽ∂ÄŽ∂Ą Í≥®žąėžĘ֞膞úľŽ°ú žĚłŪēī ŽßĆžĄĪ žč†Ž∂Äž†ĄžĚī ŽįúžÉĚŪēėŽ©ī ŽāėŪÉÄŽā† žąė žěąŽč§. Í∑łŽü¨Žāė žĚėŽĮł žěąŽäĒ žč†Ž∂Äž†ĄžĚī žóÜžúľŽ©īžĄú Í≥†žĚłžāįŪėąž¶ĚžĚĄ Ž≥īžĚīÍłįŽäĒ ŪēėŽāė Í≥†žĚłžāįŪėąž¶ĚÍ≥ľ ÍīÄŽ†®Žźú ž¶ĚžÉĀžĚÄ ÍīÄžįįŪē† žąė žóÜŽäĒ Í≥®žąėžĘÖ ŪôėžěźŽ•ľ ŽďúŽ¨ľÍ≤Ć ž†ĎŪēėÍ≤Ć ŽźėŽäĒŽćį žĚīŽü¨Ūēú ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚÄ Ūėąž≤≠Žāī žĚīžÉĀŽč®ŽįĪ(paraprotein)žĚė žėĀŪĖ•žúľŽ°ú ŽāėŪÉÄŽāėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[3]. ž¶Č, Ūėąž≤≠ žĚłžĚī ŽÜíÍ≤Ć žł°ž†ēŽźėžóąžúľŽāė Í∑ľžú°Í≤ĹŽ†®žĚīŽāė žóįž°įžßĀ žĄĚŪöĆŪôĒ ÍįôžĚÄ Í≥†žĚłžāįŪėąž¶ĚžĚė ž¶ĚžÉĀžĚī žóÜÍ≥† ž†ēžÉĀžĻėžóź ÍįÄÍĻĆžöī Ūėąž≤≠ žĻľžäė žąėžĻėŽ•ľ Ž≥īžĚīŽ©į žĚł žąėžĻėŽ•ľ Žāģž∂ĒÍłį žúĄŪēú žĻėŽ£Ćžóź ŽįėžĚĎŪēėžßÄ žēäžĚĄ ŽēĆ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ žĚėžč¨Ūē† žąė žěąŽč§.
Ūėąž≤≠ Ž¨īÍłįžĚłžĚė žł°ž†ēžĚÄ žĚľŽįėž†ĀžúľŽ°ú phosphomolybdate žěźžôłžĄ†Ž≤ē ŽėźŽäĒ ŪôėžõźŽ≤ēžúľŽ°ú ŪēėÍ≥† žěąŽäĒŽćį phosphomolybdate žěźžôłžĄ†Ž≤ēžĚÄ Í≤Äž≤ī žÜćžĚė Ž¨īÍłįžĚłžĚī sulfuric acidžĚė ž°īžě¨Ūēėžóź ammonium molybdatežôÄ ŽįėžĚĎŪēėžó¨ žÉĚžĄĪŽźú ammonium phosphomolybdate complexÍįÄ 340 nmžóźžĄú ŪĚ°ÍīĎŽŹĄ(absorbance ŽėźŽäĒ optical density)Ž•ľ žßĎ蹎äĒ žĄĪžßąžĚĄ žĚīžö©ŪēėÍ≥† žěąŽč§. ž¶Č, Ž¨īÍłįžĚłžĚė ŽÜ掏ĄžôÄ ŪĚ°ÍīĎŽŹĄžĚė ŽĻĄŽ°ÄÍīÄÍ≥ĄŽ°úžĄú ž†ēŽüČŪēėŽäĒ ŽĻĄžÉČŽ∂ĄžĄĚŽ≤ē(colorimetric method)žĚĄ žĚīžö©ŪēúŽč§[4]. ŪôėžõźŽ≤ēžĚÄ ž∂ĒÍįÄŽ°ú Ūôėžõźž†úŽ•ľ ž≤ėŽ¶¨Ūēėžó¨ molybdenum bluežĚė ŪĚ°ÍīĎŽŹĄŽ•ľ žł°ž†ēŪēėÍ≤Ć ŽźėŽ©į žĚī Í≤Ĺžöį žčúžēĹžĚė žēąž†ēžĄĪžĚī Ž¨łž†úÍįÄ Žź† žąė žěąŽč§.
ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚÄ žč§Ūóėžč§ž†Ā Ž∂ĄžĄĚžĚĄ Žį©ŪēīŪēėŽäĒ žöĒžĚł ŽėźŽäĒ Ž¨ľžßąžóź žĚėŪēī Ūėąž≤≠ žĚłžĚė žúĄž¶ĚÍįÄ(spurious elevation)Ž•ľ Ž≥īžĚīŽäĒ Í≤ɞ̳Žćį, Í∑ł žõźžĚł ž§ĎžĚė ŪēėŽāėÍįÄ Žč§ŽįúÍ≥®žąėžĘÖÍ≥ľ ÍįôžĚÄ Žč®ŪĀīŽ°†žĄĪÍįźŽßąÍłÄŽ°úŽ∂ąŽ¶įŪėąž¶ĚžóźžĄú ŽāėŪÉÄŽāėŽäĒ žĚīžÉĀŽč®ŽįĪžĚīŽč§. žĚīžÉĀŽč®ŽįĪŪėąž¶ĚžĚĄ ÍįĞߥ ŪôėžěźÍįÄ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ Ž≥īžĚīŽäĒ Íłįž†ĄžĚÄ ŪĀ¨Í≤Ć ŽĎź ÍįÄžßÄŽ°ú žĄ§Ž™ÖŽźėÍ≥† žěąŽč§[1,2,5]. ž≤ęžßłŽäĒ molybdate žčúžēĹÍ≥ľ žĚīžÉĀŽč®ŽįĪ žā¨žĚīžĚė ÍįĄžĄ≠(interference) ŽēĆŽ¨łžóź ŪĚ°ÍīĎŽŹĄÍįÄ ž¶ĚÍįÄŪēėžó¨ Ūėąž≤≠žĚłžĚī žč§ž†úŽ≥īŽč§ ŽÜíÍ≤Ć žł°ž†ēŽźúŽč§ŽäĒ Í≤ÉžĚīŽč§. McClure ŽďĪ[6]žĚÄ phosphomolybdate žěźžôłžĄ†Ž≤ēžúľŽ°ú Ūėąž≤≠ žĚłžĚĄ žł°ž†ēŪēėŽäĒ Í≥ľž†ēžóźžĄú žĚīžÉĀŽč®ŽįĪžĚė žĻ®ž†Ą(precipitation)žĚī žĚľžĖīŽāėŽ©īžĄú ŽįėžĚĎ ŪėľŪē©Ž¨ľžóź ŪėľŪÉĀ(turbidity)žĚĄ žīąŽěėŪēėžó¨ ŪĚ°ÍīĎŽŹĄÍįÄ ž¶ĚÍįÄŪēúŽč§Í≥† ž∂Ēž†ēŪēėžėÄŽč§. Í≥†Žč®ŽįĪŪėąž¶ĚžĚĄ Ž≥īžĚīŽāė žĚīžÉĀŽč®ŽįĪžĚī ž°īžě¨ŪēėžßÄ žēäŽäĒ Ūėąžē°žóźžĄúŽäĒ ŪėľŪÉĀžĚī ÍīÄžįįŽźėžßÄ žēäžēėžúľŽĮÄŽ°ú ž†ēžÉĀž†ĀžĚł Žč®ŽįĪÍ≥ľŽäĒ Žč§Ž•ł žĚīžÉĀŽč®ŽįĪžĚė Ž¨ľŽ¶¨ž†Ā žĄĪžßąŽēĆŽ¨łžóź ŪėľŪÉĀžĚī žīąŽěėŽźúŽč§Í≥† ŪēėžėÄŽč§[6]. Í≤Äž≤īžóźžĄú Žč®ŽįĪžßąžĚĄ ž†úÍĪįŪēú Ží§ žł°ž†ēŪēú Ūėąž≤≠ Ž¨īÍłįžĚłžĚė žąėžĻėŽäĒ ž†ēžÉĀŽ≤ĒžúĄžėÄŽč§[3-6]. ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžúľŽ°ú ŪĆźŽč®ŽźėŽäĒ Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú Ūą¨žĄĚ(dialysis)žĚĄ ŪÜĶŪēī Žč®ŽįĪžßąÍ≥ľ Žč§Ž•ł ÍĪįŽĆÄŽ∂ĄžěźŽď§žĚĄ ž†úÍĪįŪēú Ží§ žĚłžĚĄ žł°ž†ēŪēėŽäĒ vanadateŽ≤ēžĚĄ žčúŪĖČŪēú Í≤įÍ≥ľ ž†ēžÉĀŽ≤ĒžúĄžĚė žĚł žąėžĻėŽ•ľ Ž≥īžėÄžúľŽ©į, Ūėąž≤≠ ŽāīžĚė Ž¨īÍłįžĚł ŽŅźŽßĆ žēĄŽčąŽĚľ žĚłžßÄžßą ŽįŹ Žč®ŽįĪžßąžóź Í≤įŪē©ŽźėžĖī žěąŽäĒ žĚłÍĻĆžßÄ žł°ž†ēŪē† žąė žěąŽäĒ atomic emission spectroscopyŽ≤ēžĚĄ žā¨žö©ŪĖąžĚĄ ŽēĆŽŹĄ ž†ēžÉĀŽ≤ĒžúĄžĚė žąėžĻėŽ°ú ŽāėŪÉÄŽā¨Žč§[3]. Stratta ŽďĪ[4]žĚÄ Í≥®žąėžĘÖ ŪôėžěźžóźžĄú perchloric acidŽ•ľ žĚīžö©Ūēėžó¨ Žč®ŽįĪžßąžĚĄ ž†úÍĪįŪēėÍłį ž†ĄŪõĄŽ°ú Ūėąž≤≠žĚĄ ž§ÄŽĻĄŪēėžó¨ žěźžôłžĄ†Ž≤ēžĚĄ žĚīžö©Ūēī ŽįėžĚĎ Í≥°žĄ†žĚĄ žĖĽžóąŽäĒŽćį ŽĎź Í≤Äž≤īžĚė ŽįėžĚĎ Í≥°žĄ†žĚÄ žÉĀžĚīŪēėžėÄžúľŽ©į ž†úŽč®ŽįĪ ž†ĄžóźŽäĒ ŪĚ°ÍīĎŽŹĄÍįÄ Žß§žöį ŽÜíÍ≤Ć ŽāėŪÉÄŽā¨žúľŽāė ž†úŽč®ŽįĪ ŪõĄžóźŽäĒ žôĄž†ĄŪěą ž†ēžÉĀžúľŽ°ú ŽāėŪÉÄŽā¨Žč§. ŽįėŽ©ī žßĄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ ŽŹôŽįėŪēú žč¨Ūēú žč†Ž∂Äž†ĄžĚĄ ÍįĞߥ ŪôėžěźžĚė Í≤Ĺžöį ž†úŽč®ŽįĪ ž†ĄŪõĄžĚė ŽįėžĚĎ Í≥°žĄ†žĚė Ž™®žĖĎžĚī ŽŹôžĚľŪēėžėÄžúľŽĮÄŽ°ú Í≥®žąėžĘÖ ŪôėžěźžóźÍ≤Ć ž°īžě¨ŪēėŽäĒ žĚīžÉĀŽč®ŽįĪžĚī ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ žĚľžúľŪā®Žč§Í≥† žÉĚÍįĀŪēėžėÄŽč§[4]. Sulfosalicylic acidŽ°ú Žč®ŽįĪžßąžĚĄ žĻ®ž†ĄžčúŪā® ŪõĄ žõźžč¨Ž∂ĄŽ¶¨Ž•ľ žčúŪĖČŪēėžó¨ žĖĽžĚÄ ž†úŽč®ŽįĪ Ūėąž≤≠žúľŽ°ú žł°ž†ēŪēėžėĞ̥ ŽēĆŽŹĄ ž†ēžÉĀ Ž≤ĒžúĄžĚė žĚł žąėžĻėŽ•ľ Ž≥īžó¨ž£ľžóąŽč§[2,5].
Žč§Ž•ł Íłįž†ĄžúľŽ°úŽäĒ žĚīžÉĀŽč®ŽįĪžóź Žč§ŽüČžĚė žĚłžĚī Í≤įŪē©ŪēėÍ≥† žěąžĚĄ ÍįÄŽä•žĄĪžĚīŽč§. Mandry ŽďĪžĚÄ IgG Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú ŪôėžěźžĚė IgGÍįÄ Ž¨īÍłįžĚłžĚĄ Í≤įŪē©ŪēėÍ≥† žěąžĚƞ̥ ž¶ĚŽ™ÖŪēėžėÄÍ≥† 32PŽ•ľ žĚīžö©Ūēú atomic emission spectroscopy žóįÍĶ¨ŽäĒ žĚīžÉĀŽč®ŽįĪžóź Í≤įŪē©Žźú žĚłžĚė žĖĎžĚī ž†ēžÉĀ ͳĎ°úŽ∂ąŽ¶įžóź Í≤įŪē©Žźú žĚłžĚė žĖĎÍ≥ľ ŽĻĄÍĶźŪēėžó¨ 10Žįį ž¶ĚÍįÄŽźėžĖī žěąžĚƞ̥ Ž≥īžó¨ž£ľžóąŽč§[7].
Ž≥ł ž¶ĚŽ°ÄŽäĒ sulfosalicylic acidŽ•ľ žĚīžö©Ūēī Žč®ŽįĪžßąžĚĄ ž†úÍĪįŪēú ŪõĄ žł°ž†ēŪēú žĚł žąėžĻėŽäĒ ž†ēžÉĀžúľŽ°ú ŪöĆŽ≥ĶŽźėžóąžúľŽ©į Žč§ŽįúÍ≥®žąėžĘÖžĚī žóÜŽäĒ žěÖžõź Ūôėžěź 4Ž™ÖžĚÄ Žč®ŽįĪžßąžĚĄ ž†úÍĪįŪēėžó¨ŽŹĄ žĚł žąėžĻėÍįÄ ÍįźžÜĆŪēėžßÄ žēäžēėÍ≥† žė§Ū칎†§ žēĹÍįĄ ž¶ĚÍįÄŽźėŽäĒ Í≤ĹŪĖ•žĚĄ Ž≥īžėÄŽč§. žĚīŽ°ú Ž≥īžēĄ Ž≥ł ž¶ĚŽ°ÄžĚė Í≤Ĺžöį žĚīžÉĀŽč®ŽįĪžúľŽ°ú žĚłŪēī ŪĚ°ÍīĎŽŹĄÍįÄ ž¶ĚÍįÄŪēėžó¨ ŽÜížĚÄ žĚł žąėžĻėŽ•ľ Ž≥īžĚł Í≤ÉžúľŽ°ú žÉĚÍįĀŽźėŽāė Žč®ŽįĪžĚĄ ž†úÍĪįŪēėŽäĒ Žč§Ž•ł Žį©Ž≤ēžĚīŽāė atomic emission spectroscopyŽ≤ēžúľŽ°úŽŹĄ Ūėąž≤≠ žĚłžĚė ŽÜ掏ĄŽ•ľ žł°ž†ēŪēī Ž≥īžēėŽč§Ž©ī ŽćĒžöĪ Ūôēžč§ŪēėžėĞ̥ Í≤ÉžĚīŽč§. ŽĆÄž°įÍĶį 1Í≥ľ 2žĚė Í≤Ĺžöį Ūėąž≤≠ žĚłžĚī 9.3 mg/dL, 8.3 mg/dLŽ°ú ž¶ĚÍįÄŽźėžĖī žěąžóąŽäĒŽćį žĚīŽď§žĚÄ ŽßĆžĄĪžč†žě• žßąŪôėžúľŽ°ú ž∂Ēž†Ā ž§ĎžĚīžóąŽč§. ŽĆÄž°įÍĶį 4Ž™Ö Ž™®ŽĎźžóźžĄú Žč®ŽįĪžßąžĚĄ ž†úÍĪį ŪõĄ žł°ž†ēŪēú žĚł žąėžĻėÍįÄ ž†úÍĪį ž†ĄŽ≥īŽč§ žēĹÍįĄ ž¶ĚÍįÄŽźėžóąŽč§. žĚīŽäĒ ž†úŽč®ŽįĪ ŪõĄžĚė žĚł žł°ž†ēžóź ŽĆÄŪēú žĄ§Ž™ÖžĚĄ ŪēėÍ≥† ŽŹôžĚėŽ•ľ žĖĽŽäĒ Žćį žčúÍįĄžĚī ÍĪłŽ†łžúľŽ©į Í∑łŽŹôžēą ŪÜĶžÉĀž†ĀžĚł Í≤ĹžöįŽ≥īŽč§ Í≤Äž≤īÍįÄ žė§Žěė Ž≥īÍīÄžĚī ŽźėžóąÍ≥† žö©ŪėąŽŹĄ ŽįúžÉĚŪēėžó¨ žĚł žąėžĻėÍįÄ ž¶ĚÍįÄŽźėžóąžĚĄ Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§.
žĚīžÉĀŽč®ŽįĪžĚė ÍįĄžĄ≠žĚĄ Í∑ĻŽ≥ĶŪēėÍłį žúĄŪēī Í≤Äž≤īŽ•ľ žīąžó¨Í≥ľ(ultrafiltration) ŽėźŽäĒ Ūą¨žĄĚ(dialysis)žĚĄ žčúŪā§ŽäĒ Žį©Ž≤ē, vanadateŽ≤ē, Ūö®žÜĆŽ∂ĄžĄĚŽ≤ē ŽėźŽäĒ atomic emission spectroscopyŽ≤ē ŽďĪžĚĄ žā¨žö©Ūē† žąė žěąŽč§[2]. Žč§žąėžĚė Í≤Äžā¨žč§žóźžĄú žÉĀŪíąŪôĒŽźú kitžĚĄ žĚīžö©Ūēú žěźŽŹôŪôĒŽźú ŪôĒŪēô Ž∂ĄžĄĚÍłįŽ•ľ žā¨žö©ŪēėÍ≥† žěąÍ≥† žł°ž†ēžóź žėĀŪĖ•žĚĄ ž§Ą žąė žěąŽäĒ žó¨Žü¨ žöĒžĚłŽď§žóź žĚėŪēī Í≤įÍ≥ľŽ•ľ žč†ŽĘįŪē† žąė žóÜŽäĒ Í≤ĹžöįŽŹĄ ŽįúžÉĚŪē† žąė žěąŽč§. Žč®ŪĀīŽ°†žĄĪ ÍįźŽßąÍłÄŽ°úŽ∂ąŽ¶įŪėąž¶ĚžĚĄ ÍįĞߥ ŪôėžěźžóźžĄú ŽöúŽ†∑Ūēú žõźžĚłžóÜžĚī Ūėąž≤≠ Ž¨īÍłįžĚłžĚī ŽÜíÍ≤Ć žł°ž†ēŽźúŽč§Ž©ī ž†úŽč®ŽįĪ Ūėąž≤≠žúľŽ°ú Žč§žčú Í≤Äžā¨Ž•ľ ŪēīŽ≥īžēĄžēľ ŪēėŽ©į žÉĀÍłįŪēú Žč§Ž•ł Í≤Äžā¨Ž≤ēžúľŽ°ú ŪôēžĚłžĚĄ ŪēėŽäĒ Í≤ÉžĚī ŪēĄžöĒŪēėŽč§.
žó¨Žü¨ ž†ÄžěźŽď§žĚÄ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ Ž≥īžĚīŽäĒ ŪôėžěźžóźžĄú žł°ž†ēŽźú Ūėąž≤≠ žĚł žąėžĻėžôÄ M Žč®ŽįĪžĚė žĖĎžĚī ŽĻĄŽ°ÄÍīÄÍ≥ĄžěĄžĚĄ Ž≥īÍ≥†ŪēėžėÄŽč§[1-3]. Barutcuoglu ŽďĪ[2]žĚÄ Ūėąž≤≠ Ž¨īÍłįžĚł žąėžĻėÍįÄ Ūėąž≤≠ Žč®ŽįĪ žąėžĻė(p= 0.001, r = 0.89) ŽįŹ Ūėąž≤≠ ͳĎ°úŽ∂ąŽ¶į žąėžĻė(p= 0.001, r = 0.88)žôÄ žĖĎžĚė žÉĀÍīÄÍīÄÍ≥ĄŽ•ľ Ž≥īžĚłŽč§Í≥† ŪēėžėÄÍ≥†, Han ŽďĪ[1]žĚÄ Ūėąžě•Žįėž∂úžą†žĚīŽāė Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžóź ŽįėžĚĎŪēėžó¨ Ūėąž≤≠ ͳĎ°úŽ∂ąŽ¶įžĖĎžĚī ÍįźžÜĆŪē®žóź ŽĒįŽĚľ žĚłžĚĄ Žāģž∂ĒÍłį žúĄŪēú ž≤ėžĻėžóÜžĚī Ūėąž≤≠ žĚłžĚė ŽÜ掏ĄŽŹĄ Ūē®ÍĽė ÍįźžÜĆŪēėŽäĒ žÜĆÍ≤¨žĚĄ ÍīÄžįįŪēėžėÄŽč§. Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽŹĄ MP Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪēėŽ©īžĄú M Žč®ŽįĪÍ≥ľ Ūėąž≤≠ žĚłžĚī Ūē®ÍĽė ÍįźžÜĆŪē®žĚĄ ÍīÄžįįŪē† žąė žěąžóąŽč§. Ūėąž≤≠ žĚłÍ≥ľ M Žč®ŽįĪžĚī žĖĎžĚė žÉĀÍīÄÍīÄÍ≥ĄŽ•ľ Ž≥īžĚīŽäĒ Í≤ɞ̥ Í≥†Ž†§ŪēėŽ©ī M Žč®ŽįĪžĚė žĖĎžĚī ŽßéžĚĄžąėŽ°Ě ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ ŽāėŪÉÄŽāľ ÍįÄŽä•žĄĪžĚī ž¶ĚÍįÄŪēúŽč§Í≥†ŽŹĄ Ž≥ľ žąė žěąÍ≤†Žč§. Ž≥īÍ≥†Žźú ž¶ĚŽ°ÄžĚė ŽĆĎ觞ąėÍįÄ IgG žēĄŪėēžĚīÍ≥† Durie-Salmon Ž≥ĎÍłį IIIAžėÄžúľŽ©į[1-5,7] Í≥®žąėžĘÖ žßĄŽč® žčúžóźŽäĒ Ūėąž≤≠ žĚłžĚī ž†ēžÉĀžĚīžóąžúľŽāė žąėŽÖĄÍįĄ Í≤ĹÍ≥ľÍīÄžįįŪēėŽ©īžĄú ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚī ŽāėŪÉÄŽāú ž¶ĚŽ°Ä[4]ŽŹĄ žěąžĖī žĚīŽ°ú Ž≥īžēĄ M Žč®ŽįĪžĚė žĖĎžĚī ŽßéÍ≥† ž¶Č, žĘÖžĖĎ Ž∂ÄŪēė(tumor burden)ÍįÄ ŽßéÍ≥† Í≥®žąėžĘÖžĚī žßĄŪĖČŽźú Ž≥ĎÍłįŽ°ú ÍįÄŽ©īžĄú ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚī ŽāėŪÉÄŽāėŽäĒ Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§.
Žč®ŪĀīŽ°†žĄĪ Ž©īžó≠ͳĎ°úŽ∂ąŽ¶įŪėąž¶ĚžĚĄ Ž≥īžĚīŽäĒ ŪôėžěźžóźžĄú ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚī Ž≥īÍ≥†ŽźėÍ≥† žěąžúľŽāė žĚīŽü¨Ūēú žĚīžÉĀŽč®ŽįĪŪėąž¶Ě Ūôėžěź Ž™®ŽĎźÍįÄ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ ŽāėŪÉÄŽāīžßÄŽäĒ žēäŽäĒŽč§. Acid/molybdateŽ≤ēžóźžĄúžĚė ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚė Íłįž†ĄžúľŽ°ú žĄ§Ž™ÖŽźėÍ≥† žěąŽäĒ ŽįėžĚĎŪėľŪē©Ž¨ľžóźžĄúžĚė ŪėľŪÉĀžĚė ŽįúžÉĚžĚī žĚīžÉĀŽč®ŽįĪžĚė žēĄŪėēÍ≥ľ ÍīÄÍ≥ĄÍįÄ žóÜžóąŽč§ŽäĒ Ž≥īÍ≥†ÍįÄ žěąÍłī ŪēėŽāė[6] ŪĚ•ŽĮłŽ°≠Í≤ĆŽŹĄ ž¶ĚŽ°ÄžĚė ŽĆÄŽ∂ÄŽ∂ĄžĚī IgG žēĄŪėēžĚīžóąŽč§. Adler ŽďĪžĚÄ ž†ēžÉĀ Ūėąž≤≠žóź ͳĎ°úŽ∂ąŽ¶įžĚĄ ž≤®ÍįÄŪēėŽ©ī Ūėąž≤≠ Ž¨īÍłį žĚłžĚė ŽÜ掏ĄÍįÄ ž¶ĚÍįÄŪēėÍ≥† Í≥†ÍłÄŽ°úŽ∂ąŽ¶įŪėąž¶ĚžĚĄ ÍįĞߥ ŪôėžěźžóźžĄúŽäĒ žĚīŽü¨Ūēú žĚłžĚė ŽÜ掏Ą ž¶ĚÍįÄÍįÄ ŽćĒžöĪ ŪĀľžĚĄ ŪôēžĚłŪēėžó¨ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚī ͳĎ°úŽ∂ąŽ¶į(žĚīžÉĀŽč®ŽįĪ)žĚė ŽÜ掏ĄžôÄ ÍłÄŽ°úŽ∂ąŽ¶į Í≥†žú†žĚė Ž¨ľŽ¶¨ŪôĒŪēôž†Ā žĄĪžßąžóź žĚėŪēī žėĀŪĖ•žĚĄ ŽįõŽäĒŽč§Í≥† ŪēėžėÄŽč§[8].
Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú Ūėąž≤≠ žĚłžĚī žėąŪõĄ žł°Ž©īžóźžĄú ÍįĖŽäĒ ž§ĎžöĒžĄĪžĚĄ ŪŹČÍįÄŪēú žóįÍĶ¨žóź ŽĒįŽ•īŽ©ī, Ūö®žÜĆŽ∂ĄžĄĚŽ≤ēžúľŽ°ú žł°ž†ēŪēú Ūėąž≤≠ žĚł žąėžĻėŽäĒ Ūėąž≤≠ creatinine, ő≤2 microglobulin, Ūėąž≤≠ žöĒžāį, Ūėąž≤≠ žĻľžäė žąėžĻėžôÄ ÍįôžĚÄ žč†ÍłįŽä• žě•žē†žôÄ ÍīÄŽ†®Žźú žėąŪõĄžĚłžěźžôÄ žĚėŽĮł žěąŽäĒ žÉĀÍīÄÍīÄÍ≥ĄŽ•ľ Ž≥īžėÄÍ≥† Í≥®žąėŽāī ŪėēžßąžĄłŪŹ¨žĚė ŽĻĄžú®, ŪėąžÉČžÜĆ žąėžĻė, ŽįĪŪėąÍĶ¨žąėžôÄ ÍįôžĚÄ žĘÖžĖĎ Ž∂ÄŪēėžôÄ ÍīÄŽ†®Žźú žėąŪõĄžĚłžěźžôÄŽŹĄ žĚėŽĮł žěąŽäĒ žÉĀÍīÄÍīÄÍ≥ĄŽ•ľ Ž≥īžėÄžúľŽ©į Í≥†žĚłžāįŪėąž¶ĚžĚī žěąŽäĒ ŪôėžěźžóźžĄú žÉĚž°īÍłįÍįĄžĚī žĚėŽĮł žěąÍ≤Ć žßßÍ≤Ć ŽāėŪÉÄŽāė Ūėąž≤≠ žĚł žąėžĻėÍįÄ Ž∂ąŽüČŪēú žėąŪõĄžĚłžěźžěĄžĚĄ Ž≥īÍ≥†ŪēėžėÄŽč§[9]. Í≥®žąėžĘÖ ŪôėžěźžóźžĄú ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶Ě žú†Ž¨īÍįÄ žėąŪõĄžóź žĖīŽĖ†Ūēú žĚėŽĮłŽ•ľ ÍįÄžßÄŽäĒÍįÄžóź ŽĆÄŪēīžĄúŽäĒ Ž≥īÍ≥†Žźú ž¶ĚŽ°ÄžąėÍįÄ ŽßéžßÄ žēäžēĄ žú†ž∂ĒŪēėÍłį žĖīŽ†ĶžßÄŽßĆ žĘÖžĖĎ Ž∂ÄŪēėŽāė Ž≥ĎžĚė žßĄŪĖČžĚī ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚÍ≥ľ ÍīÄŽ†®žěąžĖī Ž≥īžĚīŽĮÄŽ°ú ŽćĒžöĪ ŽßéžĚÄ ž¶ĚŽ°ÄŽ•ľ ŪÜĶŪēī ŪôēžĚłŪēī Ž≥ľ ŪēĄžöĒÍįÄ žěąŽč§.
Ž≥ł ž¶ĚŽ°ÄŽäĒ IgG, kappa žēĄŪėēžĚė Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú žěźŽŹôŪôĒŽźú Ž∂ĄžĄĚÍłįŽ•ľ ŪÜĶŪēī phosphomolybdate žěźžôłžĄ†Ž≤ēžúľŽ°ú Ūėąž≤≠ Ž¨īÍłįžĚłžĚĄ žł°ž†ēŪēėžó¨ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶ĚžĚĄ Ž≥īžĚł Í≤ĹžöįŽ°ú, žĚėŽĮł žěąŽäĒ žč†ÍłįŽä• žě•žē†ÍįÄ žóÜÍ≥† Í≥†žĚłžāįŪėąž¶ĚžĚĄ žú†ŽįúŪē† Žč§Ž•ł žöĒžĚłžĚī žóÜžĚī Ūėąž≤≠ žĚłžĚī ŽÜíÍ≤Ć žł°ž†ēŽźėŽäĒ Í≤ĹžöįžóźŽäĒ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶Ě ÍįÄŽä•žĄĪžĚĄ Í≥†Ž†§ŪēėÍ≥† Í≥®žąėžĘÖÍ≥ľ ÍįôžĚÄ žĚīžÉĀŽč®ŽįĪŪėąž¶ĚžĚī žěąžßÄ žēäžĚÄžßÄ ŪôēžĚłŪēī Ž≥īžēĄžēľ ŪēúŽč§. ŽėźŪēú Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźŽ•ľ žßĄŽč® ŽėźŽäĒ žĻėŽ£ĆŪēėŽ©īžĄú Ūėąž≤≠ žĚł žąėžĻėÍįÄ žÉĀŪô©žóź ŽßěžßÄ žēäÍ≤Ć ŽÜíÍ≤Ć Žāėžė§ŽćĒŽĚľŽŹĄ žĚīŽ•ľ ÍįĄÍ≥ľŪēėÍłį žČ¨žöįŽĮÄŽ°ú Í≤Äžā¨Žį©Ž≤ēžĚė ž†úŪēúž†źÍ≥ľ ÍįÄžĄĪÍ≥†žĚłžāįŪėąž¶Ěžóź ŽĆÄŪēī žĚłžßÄŪēėÍ≥† žěąŽäĒ Í≤ÉžĚī ŽŹĄžõÄžĚī Žź† Í≤ÉžĚīŽ©į ž†úŽč®ŽįĪ Ūėąž≤≠žúľŽ°ú žĚłžĚė ŽÜ掏ĄŽ•ľ žł°ž†ēŪē®žúľŽ°úžć® žĚłžĚĄ Žāģž∂ĒÍłį žúĄŪēú Ž∂ąŪēĄžöĒŪēú žĻėŽ£ĆŽ•ľ ŪĒľŪē† žąė žěąžĚĄ Í≤ÉžĚīŽč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






