žĄú Ž°†
žč†ŽŹôŽß• ŽįēŽ¶¨ŽäĒ ŽĆÄŽ∂ÄŽ∂Ą ŽĆÄŽŹôŽß• ŽįēŽ¶¨žôÄ žóįÍīÄŽźėžĖī ŽįúžÉĚŪēėŽ©į, žôłžÉĀžĚīŽāė Íłįž†ÄžßąŪôė žóÜžĚī žč†ŽŹôŽß•žóź ÍĶ≠ŪēúŽźėžĖī ž†Äž†ąŽ°ú ŽįúžÉĚŪēėŽäĒ žěźŽįúžĄĪ ŽįēŽ¶¨ŽäĒ Žß§žöį ŽďúŽ¨ľŽč§. žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨ŽäĒ žēÖžĄĪ Í≥†Ūėąžēē, žč¨Ūēú ŽŹôŽß• Í≤ĹŪôĒž¶Ě, žĄ¨žú†Í∑ľžĄĪ žĚīŪėēžĄĪž¶Ě ŽįŹ Marfan ž¶ĚŪõĄÍĶį ŽďĪžĚī žõźžĚłžúľŽ°ú žēĆŽ†§ž†ł žěąžúľŽ©į, ÍįÄžĄĪ ŽāīÍįēžĚī žßĄžĄĪ ŽāīÍįēžĚĄ ŽąĆŽü¨ žč†Í≤ĹžÉȞ̥ žú†ŽįúŪē† žąė žěąŽč§[1].
ŪôúžĄĪ Žč®ŽįĪžßą C ŽėźŽäĒ Í∑łÍ≤ÉžĚė Ž≥īž°į žĚłžěźžĚł Žč®ŽįĪžßą SŽäĒ factor V, VIIIžĚė ŪôúžĄĪžĚĄ Žį©ŪēīŪēėžó¨ Ūėąž†ĄŪėēžĄĪžĚĄ žĖĶž†úŪēėŽäĒ Ūē≠žĚĎÍ≥† žĚłžěźŽ°ú, žĚīŽď§žĚė Ž∂Äž°Īžóź žĚėŪēú žč†Í≤ĹžÉČžĚÄ ÍįĄŪėĻ Ž≥īÍ≥†ŽźėÍ≥† žěąžúľŽāė žč†ŽŹôŽß• ŽįēŽ¶¨žôÄ ÍīÄŽ†®ŪēīžĄúŽäĒ žēĄžßĀÍĻĆžßÄ ÍĶ≠ŽāīžóźžĄú Ž≥īÍ≥†Žźú žėąÍįÄ žóÜŽč§. žĚīžóź ž†ÄžěźŽď§žĚÄ ÍįĎžěźÍłį ŽįúžÉĚŪēú žė§Ž•łž™Ĺ žėÜÍĶ¨Ž¶¨ ŪÜĶž¶ĚžúľŽ°ú ŽāīžõźŪēėžó¨ žöįžł° žč†ŽŹôŽß• ŽįēŽ¶¨žôÄ ŽŹôŽįėŽźú žč†Í≤ĹžÉȞ̥ žßĄŽč® ŽįõÍ≥† Í∑łÍ≤ÉžĚė žõźžĚłžĚĄ Í∑úŽ™ÖŪēėŽäĒ Í≥ľž†ēžóźžĄú Žč®ŽįĪžßą C ŽįŹ Žč®ŽįĪžßą S Í≤įŪē架̞Ěī Í∑úŽ™ÖŽźėžĖī Ūē≠žĚĎÍ≥† žöĒŽ≤ē ŪõĄ Ūėłž†ĄŽźú žėąŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź žĚīŽ•ľ Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
ž¶Ě Ž°Ä
Ūôė žěź: Ūēú„Äá„Äá, žó¨žěź 56žĄł
Í≥ľÍĪįŽ†• ŽįŹ ŪėĄŽ≥ĎŽ†•: žÉĀÍłį ŪôėžěźŽäĒ 4žĚľ ž†ĄŽ∂ÄŪĄį žßÄžÜ掟ú žöįžł° žėÜÍĶ¨Ž¶¨ ŪÜĶž¶ĚžĚĄ ž£ľžÜĆŽ°ú žÜĆŪôĒÍłį ŽāīÍ≥ľ Žį©Ž¨łŪēėžėÄŽč§. Í≥†ŪėąžēēžĚīŽāė ŽčĻŽá®Ž≥ĎžĚė Í≥ľÍĪįŽ†•žĚÄ žóÜžóąžúľŽāė 4ŽÖĄ ž†ĄŽ∂ÄŪĄį ÍįĄŽ¨łŽß• ÍłįŪėēÍ≥ľ ŪóąŪėąžĄĪ ŽáĆž°łž§ĎžúľŽ°ú ŪÉÄ Ž≥ĎžõźžóźžĄú clopidogrel 75 mg Ž≥Ķžö©ŪēėÍ≥† žěąžóąÍ≥† Í∑ł žôł ŪäĻžĚī žēĹŽ¨ľ Ž≥Ķžö©žĚīŽāė žôłžÉĀžĚė Ž≥ĎŽ†•žĚÄ žóÜžóąŽč§. žôłŽěėžóźžĄú žčúŪĖČŪēú Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒ Žč®žłĶ žī¨žėĀžóźžĄú žč†Í≤ĹžÉČžĚī žĚėžč¨ŽźėžĖī žč†žě•ŽāīÍ≥ľŽ°ú žĚėŽĘįŽźėžóąŽč§.
žĚīŪēôž†Ā žÜĆÍ≤¨: žÉĚž≤īžßēŪõĄŽäĒ Ūėąžēē 120/80 mmHg, Žß•Žįē 80ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąė 20ŪöĆ/Ž∂Ą, ž≤īžė®žĚÄ 36.5‚ĄÉžėÄžúľŽ©į, žßĄžįįžÜĆÍ≤¨žóźžĄú ŪėłŪĚ°žĚĆÍ≥ľ žč¨žĚĆžĚÄ ž†ēžÉĀžĚīžóąÍ≥† Ž≥ĶŽ∂ÄŽäĒ Ž∂ÄŽďúŽüĹÍ≥† žě•žĚĆžĚÄ ž†ēžÉĀžĚīžóąžúľŽāė ÍįĄÍ≥ľ ŽĻĄžě•žĚė ŽĻĄŽĆÄžôÄ Ūē®ÍĽė žöįžł° ŽäĎÍ≥® ž≤ôž∂ĒÍįĀžĚė ŪÜĶž¶ĚžĚī ÍīÄžįįŽźėžóąŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: Žāīžõź ŽčĻžčú Žßźžīą Ūėąžē°žÜĆÍ≤¨žóźžĄú ŪėąžÉČžÜĆ 15.7 g/dL, ŽįĪŪėąÍĶ¨ žąė 11,000/uL, ŪėąžÜĆŪĆź žąė 378,000/uL, žÉĚŪôĒŪēô Í≤Äžā¨žóźžĄú BUN/Cr 15/1.1 mg/dLžĚīžóąÍ≥†, AST/ALT 46/37 IU/LžĚīžóąŽč§. žīĚ Žč®ŽįĪ 7.5 mg/dL, žēĆŽ∂ÄŽĮľ 4.8 mg/dL, žīĚ žĹúŽ†ąžä§ŪÖĆŽ°§ 199 mg/dL, C-ŽįėžĚĎžĄĪ Žč®ŽįĪ 6.31 mg/L, CPK 96 IU/LžėÄžúľŽ©į LDHŽäĒ 294 IU/L (ž†ēžÉĀ: 100-190 IU/L)žėÄŽč§. Ūėąž≤≠ Ž≥īž≤ī C3/C4 149/67 mg/dLŽ°ú C4ÍįÄ žÉĀžäĻ(ž†ēžÉĀ 10-40 mg/dL)ŽźėžĖī žěąžóąÍ≥†, Ž©īžó≠ Ūėąž≤≠Ūēôž†Ā Í≤Äžā¨žÉĀ HbsAg/Ab (-/+), Anti-HCV Ab (-), Anti HIV Ab (-), VDRL (-)žėÄžúľŽ©į, Ūē≠ŪēĶŪē≠ž≤ī, Ūē≠ds-DNAŪē≠ž≤ī, Ž£®ŪĎłžä§ Ūē≠žĚĎÍ≥† žĚłžěź ŽįŹ Ūē≠žĚłžßÄžßą Ūē≠ž≤īŽäĒ Ž™®ŽĎź žĚĆžĄĪžĚīžóąŽč§. žÜĆŽ≥Ä Í≤Äžā¨žóźžĄú ŪėąŽá®žôÄ Žč®ŽįĪŽá®ŽäĒ ÍīÄžįįŽźėžßÄ žēäžēėŽč§. ŽĻĄÍĶźž†Ā ž†äžĚÄ ŽāėžĚīžĚė ŪóąŪėąžĄĪ ŽáĆž°łž§ĎÍ≥ľ žč†Í≤ĹžÉČžĚī ŽįúŽ≥ĎŪēėžėÄÍłįžóź Í≥ľžĚĎÍ≥†Ūėąž¶ĚžĚė ÍįÄŽä•žĄĪžĚĄ žóľŽĎźžóź ŽĎźÍ≥† žčúŪĖČŪēú Ūėąžē°žĚĎÍ≥† Í≤Äžā¨žÉĀ ŪĒĄŽ°úŪ䳎°¨ŽĻą žčúÍįĄ(PT) 14.4žīą, ŪôúžĄĪŪôĒ Ž∂ÄŽ∂Ą Ū䳎°¨Ž≥īŪĒĆŽĚľžä§Ūčī žčúÍįĄ(aPTT) 39.4žīą, Ūē≠ Ū䳎°¨ŽĻą IIIŽäĒ 84% (ž†ēžÉĀ 70-120%)Ž°ú ž†ēžÉĀ žąėž§ÄžĚīžóąžúľŽāė Ūėąžě• Žč®ŽįĪžßą C Ūē≠žõź 49% (ž†ēžÉĀ 72-150%), ŪôúžĄĪŽŹĄ 73% (ž†ēžÉĀ 73-142%)žĚīžóąÍ≥† Žč®ŽįĪžßą S Ūē≠žõź 56% (ž†ēžÉĀ 60-140%), ŪôúžĄĪŽŹĄ 41% (ž†ēžÉĀ 60-140%)Ž°ú ÍįźžÜĆŽźú žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąŽč§.
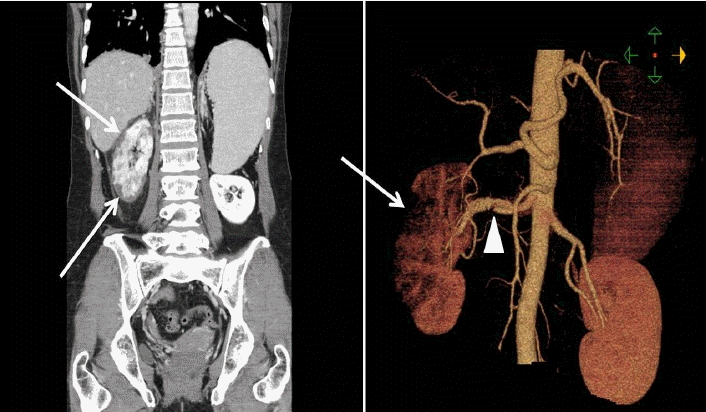
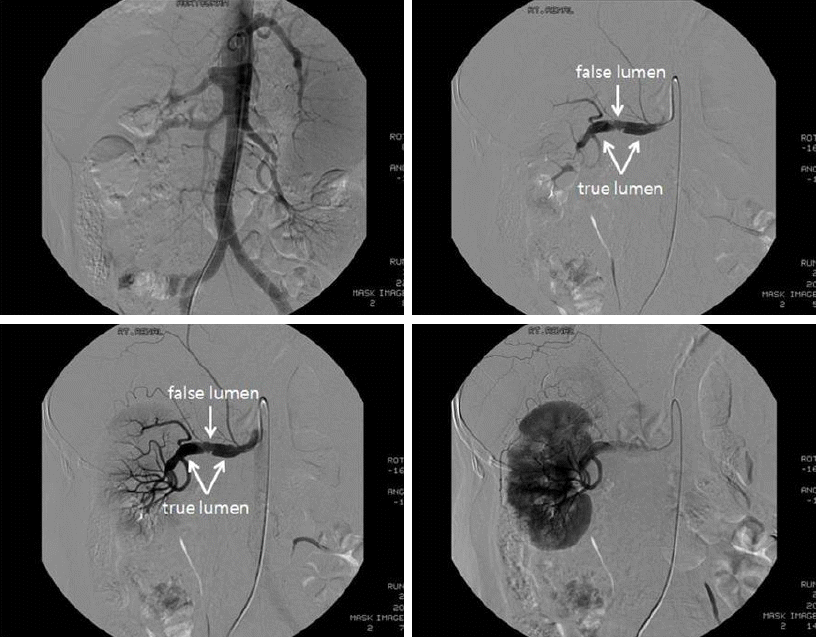
Žį©žā¨žĄ† žÜĆÍ≤¨: Žāīžõź ŽčĻžčú Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒ Žč®žłĶ žī¨žėĀžóźžĄú žöįžł°žč†žě•žĚė Ž∂ÄŽ∂Ąž†Ā žč†Í≤ĹžÉČÍ≥ľ Ūē®ÍĽė žöįžł° žč†ŽŹôŽß• ŽįēŽ¶¨ÍįÄ žĚėžč¨ŽźėžóąžúľŽ©į ÍįĄŽ¨łŽß• ÍłįŪėē, žúĄž†ēŽß•Ž•ė ŽįŹ ÍįĄÍ≥ľ ŽĻĄžě•žĚė ŽĻĄŽĆÄÍįÄ ÍīÄžįįŽźėžóąŽč§(Fig. 1). Žāīžõź 7žĚľžßł ŪėąÍīÄ ž°įžėĀžą†žĚĄ žčúŪĖČŪēėžėÄŽč§(Fig. 2). ŽĆÄŽŹôŽß•Í≥ľ žĘĆžł° žč†ŽŹôŽß•žĚÄ ž†ēžÉĀžĚīžóąžúľŽāė žöįžł° žč†ŽŹôŽß•žĚė žčúžěĎ Ž∂ÄžúĄžôÄ ŽßźŽč® Ž∂ÄžúĄžĚė žč†ŽŹôŽß• ŽįēŽ¶¨ÍįÄ ÍīÄžįįŽźėžóąŽč§. žč†ŽŹôŽß•žĚė ž§ĎÍįĄŽ∂ÄžúĄŽäĒ ÍįÄžĄĪŽāīÍįēžĚī žßĄžĄĪŽāīÍįēžĚĄ ŽąĆŽü¨ žĘĀžēĄž†ł žěąžóąÍ≥† žč†žě•žóźŽäĒ ŽßźŽč®Ž∂ÄžúĄžĚė Žč§ŽįúžĄĪ žĚĆžėĀÍ≤įžÜźžĚī ÍīÄžįįŽźėžóąŽč§.
žč¨žě•žīąžĚĆŪĆĆ žÜĆÍ≤¨: žÉČž†Ąž¶ĚžĚĄ Žįįž†úŪēėÍłį žúĄŪēī žčúŪĖČŪēú žč¨ž†ĄŽŹĄžôÄ žč¨žě• žīąžĚĆŪĆƞ󟞥úŽŹĄ ŪäĻžĚīžÜĆÍ≤¨žĚī žóÜžóąŽč§.
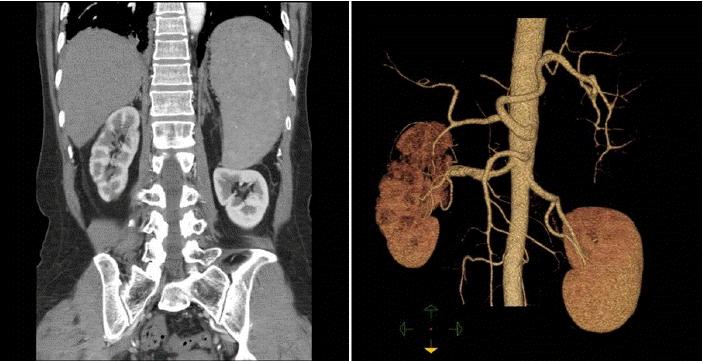
žĻėŽ£Ć ŽįŹ žěĄžÉĀÍ≤ĹÍ≥ľ: Žāīžõź ŽčĻžĚľ žßĄŪÜĶž†úžôÄ Ūē≠žĚĎÍ≥†ž†ú Ūą¨žó¨ ŪõĄ ŪÜĶž¶ĚžĚÄ Žč§žĚĆŽā†Ž∂ÄŪĄį žÜƞ觎źėÍłį žčúžěĎŪēėžó¨ žěÖžõź 10žĚľžßł žöįžł° žėÜÍĶ¨Ž¶¨ ŪÜĶž¶ĚžĚÄ žôĄž†ĄŪěą žÜƞ觎źėžĖī ŪáīžõźŪēėžėÄŽč§. žĚīŪõĄ 1ÍįúžõĒ ŽŹôžēą ŪÜĶž¶ĚžĚÄ žóÜžóąžúľŽ©į Žč®ŽįĪžßą CžôÄ Žč®ŽįĪžßą SžĚė žĚľžčúž†Ā ÍįźžÜĆŽ•ľ ÍįźŽ≥ĄŪēėÍłį žúĄŪēī Ūē≠žĚĎÍ≥† žöĒŽ≤ē žóÜžĚī 1ÍįúžõĒžßł ž∂Ēž†ĀÍīÄžįįŪēú Ūē≠ Ū䳎°¨ŽĻą IIIŽäĒ 103% (ž†ēžÉĀ 70-120%)Ž°ú ž†ēžÉĀ žąėž§ÄžĚīžóąžúľŽāė Ūėąžě• Žč®ŽįĪžßą C Ūē≠žõź 67% (ž†ēžÉĀ 72-150%), ŪôúžĄĪŽŹĄ 50% (ž†ēžÉĀ 73-142%)žĚīžóąÍ≥† Žč®ŽįĪžßą S Ūē≠žõź 44% (ž†ēžÉĀ 60-140%), ŪôúžĄĪŽŹĄ 25% (ž†ēžÉĀ 60-140%)Ž°ú žßÄžÜ枆ĀžúľŽ°ú ÍįźžÜĆŽźú žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąŽč§. žĄ†ž≤úžĄĪ žĚĎÍ≥† žě•žē†žĚė žõźžĚłžĚł Factor V Leiden MutationžĚÄ ž†ēžÉĀŪėēžĚīžóąŽč§. 2ÍįúžõĒ ŪõĄžôÄ 1ŽÖĄ ŪõĄ žčúŪĖČŪēú žč†ŽŹôŽß• ž†ĄžāįŪôĒŽč®žłĶ žī¨žėĀžóźžĄú žč†ŽŹôŽß• ŽįēŽ¶¨Žāė žč†Í≤ĹžÉČžĚī ŽćĒ žĚīžÉĀ žßĄŪĖČŪēėžßÄ žēäžĚÄ žÜĆÍ≤¨žĚĄ Ž≥īžó¨(Fig. 3) Í≤ĹÍĶ¨ Ūē≠žĚĎÍ≥†ž†úŽ•ľ žú†žßÄŪēėŽ©į žôłŽěė ž∂Ēž†ĀÍīÄžįį ž§ĎžĚīŽč§.
Í≥† žįį
žč†ŽŹôŽß• ŽįēŽ¶¨ŽäĒ ŽĆÄŽ∂ÄŽ∂Ą ŽĆÄŽŹôŽß• ŽįēŽ¶¨žôÄ žóįÍīÄŽźėžĖī ŽįúžÉĚŪēėŽ©į, žēÖžĄĪÍ≥†Ūėąžēē, žč¨Ūēú ŽŹôŽß•Í≤ĹŪôĒž¶Ě, žĄ¨žú†Í∑ľžĄĪ žĚīŪėēžĄĪž¶Ě ŽįŹ Marfan ž¶ĚŪõĄÍĶį, Ehlers-Danlos ž¶ĚŪõĄÍĶį, Í≤įŪēĶ, Žč§ŽįúžĄĪ ŪėąÍīÄžóľ ŽďĪžĚė žõźžĚłžĚī žóÜŽäĒ žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨ŽäĒ Žß§žöį ŽďúŽ¨ł žßąŪôėžĚīŽč§[1]. žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨žĚė žõźžĚłžĚÄ žěė žēĆŽ†§ž†ł žěąžßÄ žēäžúľŽāė Í≥†Ž¶ĹžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨žĚė ŽĆĎ觞ąėžóźžĄú žč†ŽŹôŽß• žĚīŪėēžĄĪž¶ĚžĚĄ ŽŹôŽįėŪēúŽč§ŽäĒ ž†źžóźžĄú žĄ¨žú†Í∑ľžĄĪ žĚīŪėēžĄĪž¶ĚžĚė žóįÍīÄžĄĪžĚī Íįēž°įŽźėÍ≥† žěąŽč§[2]. Ž≥ł ŪôėžěźŽäĒ Í≥†Ūėąžēē ŽďĪžĚė Í≥ľÍĪį Ž≥ĎŽ†•žĚī žóÜŽäĒ ŪôėžěźÍįÄ ŽĆÄŽŹôŽß•Í≥ľ žč†ŽŹôŽß•žĚė žĚīžÉĀžÜĆÍ≤¨žĚī žóÜžĚī žöįžł° žč†ŽŹôŽß•žóź ÍĶ≠ŪēúŽźėžĖī ŽįēŽ¶¨ÍįÄ ŽįúžÉĚŪēėžėÄžúľŽĮÄŽ°ú žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨Ž°ú žßĄŽč®ŪēėžėÄŽč§.
Ž≥ł ŪôėžěźžĚė Í≤Ĺžöį žč¨žě• žßąŪôėžĚė ž¶ĚÍĪįÍįÄ žóÜžóąÍ≥† ŽĻĄÍĶźž†Ā ž†äžĚÄ ŽāėžĚīžĚė ŪóąŪėąžĄĪ ŽáĆž°łž§ĎÍ≥ľ žč†Í≤ĹžÉČžĚī ŽįúŽ≥ĎŪēėžėÄÍłįžóź Ūėąžē°Ūēôž†Ā žĚīžÉĀžĚĄ žóľŽĎźžóź ŽĎźÍ≥† žčúŪĖČŪēú Ūėąžē°žĚĎÍ≥† Í≤Äžā¨žóźžĄú Žč®ŽįĪžßą CžôÄ SÍįÄ ÍįźžÜĆŽźėžĖī žěąžĚƞ̥ ŪôēžĚłŪēėžėÄŽč§. Žč®ŽįĪžßą CžôÄ Í∑łÍ≤ÉžĚė Ž≥īž°įžĚłžěźžĚł Žč®ŽįĪžßą SŽäĒ ŽĻĄŪÉÄŽĮľ K žĚėž°īžĄĪ Ūē≠žĚĎÍ≥† Žč®ŽįĪžßąŽ°ú factor V, VIIIžĚė ŪôúžĄĪžĚĄ Žį©ŪēīŪēėŽ©īžĄú Ūē≠žĚĎÍ≥† žó≠Ūē†žĚĄ ŽčīŽčĻŪēėŽäĒ ž§ĎžöĒŪēú žĚłžěźžĚīŽč§. Žč®ŽįĪžßą CŽäĒ Ū䳎°¨ŽĻąžóź žĚėŪēī ŪôúžĄĪŪôĒŽźėžĖī žĚĎÍ≥†žĚłžěź V, VIIIžĚė ŪôúžĄĪžĚĄ Žį©ŪēīŪēėŽ©į žīĚ Žč®ŽįĪŽüČžĚī 67% žĚīŪēėŽ°ú ÍįźžÜĆŪēėŽ©ī Ūėąž†Ąž¶ĚžĚī žēĹ 3Žįį ž¶ĚÍįÄŪēėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[3]. Žč®ŽįĪžßą SŽäĒ žĚłžßÄžßąžóź ŽĆÄŪēú Žč®ŽįĪžßą CžĚė žĻúŪôĒŽ†•žĚĄ ž¶ĚÍįÄžčúžľú žĚĎÍ≥†žĚłžěźŽ•ľ Ž∂ąŪôúžĄĪŪôĒžčúŪā§ŽäĒ Žćį Ž≥īž°įžĚłžěźŽ°ú žěĎžö©ŪēėŽäĒ Žč®ŽįĪžßąžĚīŽč§. žĄ†ž≤úž†ĀžúľŽ°ú ŽįúžÉĚŪēėŽäĒ Žč®ŽįĪžßą C, SžĚė Í≤įŪēćžĚÄ žÉĀžóľžÉČž≤ī žöįžĄĪžúľŽ°ú žú†ž†ĄŽźėŽ©į Žč®ŽįĪžßą CžôÄ SžĚė žú†ž†ĄžěźŽäĒ ÍįĀÍįĀ žóľžÉČž≤ī 2Ž≤ą, 3Ž≤ąžóź žúĄžĻėŪēī ŽŹÖŽ¶Ĺž†ĀžúľŽ°ú žú†ž†ĄŽźėžßÄŽßĆ Žč®ŽįĪžßą CžôÄ SžĚė Í≤įŪēćžĚī ŽŹôžčúžóź ŽāėŪÉÄŽāėŽäĒ Í≤ĹžöįÍįÄ ŽßéžēĄ ŽĎź žú†ž†ĄžěźÍįÄ žóįÍīÄŽźėžĖī žěąžĚƞ̥ žčúžā¨ŪēúŽč§[4]. ŪõĄž≤úž†ĀžĚł žõźžĚłžĚÄ ž§Ďž¶Ě ÍįĄžßąŪôė, žč†ž¶ĚŪõĄÍĶį, ŪõĄž≤úžĄĪ Ž©īžó≠ Í≤įŪē架̞̥ ŪŹ¨Ūē®Ūēú žč¨ÍįĀŪēú Íįźžóľ, ŪĆ®Ūėąž¶Ě žáľŪĀ¨, ŪĆĆžĘÖ ŪėąÍīÄ Žāī žĚĎÍ≥†, žĘÖžĖĎ, žěĄžč† ŽįŹ Ūē≠žĚĎÍ≥† žöĒŽ≤ē ŽďĪžĚī žěąŽč§[5]. Žč®ŽįĪžßą CžĚė Í≤įŪēćžĚī ŪėąÍīÄŽāīŪĒľ žĄłŪŹ¨žĚė žÜźžÉĀÍ≥ľ ÍįĄž†ēŽß• ŽėźŽäĒ ÍįĄŽ¨łŽß• Ūėąž†Ąž¶ĚžĚĄ žú†ŽįúŪēėžó¨ žĚīžį®ž†ĀžúľŽ°ú ÍįĄŽ¨łŽß• Ūē≠žßĄž¶ĚžĚĄ žĚľžúľŪā¨ žąė žěąžĚĆžĚÄ žēĆŽ†§ž†ł žěąŽč§[6]. Ž≥ł ŪôėžěźžĚė Í≤ĹžöįŽäĒ ÍįĄÍ≥ľ ŽĻĄžě•žĚė ŽĻĄŽĆÄ ŽįŹ Ž¨łŽß•ÍłįŪėēžĚī žěąžßÄŽßĆ Ūē≠žĚĎÍ≥† žĚłžěźžĚė Ūē©žĄĪžĚĄ ÍįźžÜĆžčúŪā¨ ŽßĆŪĀľžĚė ž§Ďž¶Ě ÍįĄžßąŪôėžĚė ž¶ĚÍĪįÍįÄ Ūėąžē°Ūēôž†Ā Í≤Äžā¨žÉĀžóźžĄú ŽįúÍ≤¨ŽźėžßÄ žēäžúľŽĮÄŽ°ú, ÍįĄÍłįŽä• žĚīžÉĀžóź žĚėŪēī žĚīžį®ž†ĀžúľŽ°ú ŽįúžÉĚŪēú žĚĎÍ≥†žĚłžěź Í≤įŪēćŽ≥īŽč§ŽäĒ žĚľžį®ž†ĀžúľŽ°ú ŽįúžÉĚŪēú Žč®ŽįĪžßą CžôÄ SžĚė Í≤įŪēćžóź žĚėŪēú žĚīžį®ž†ĀžĚł Ž¨łŽß•žēē Ūē≠žßĄž¶ĚžĚĄ žöįžĄ†ž†ĀžúľŽ°ú Í≥†Ž†§Ūēīžēľ Ūē† Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§.
Žč®ŽįĪžßą C ŽįŹ Žč®ŽįĪžßą SžĚė Í≤įŪēćÍ≥ľ žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨žĚė žĚłÍ≥ľÍīÄÍ≥ĄŽäĒ Ž™ÖŪôēŪēėžßÄ žēäŽč§. ŪôúžĄĪ Žč®ŽįĪžßą CŽäĒ ŪėąÍīÄ ŽāīŪĒľžĄłŪŹ¨žóźžĄú ž†úÍ≥ĶŽźú Žč®ŽįĪžßą C žąėžö©ž≤īžóź Í≤įŪē©Ūēėžó¨ Ūėąžē°žĚĎÍ≥†Ž•ľ Žį©žßÄŪēėŽ©į, žóľž¶ĚžĚĄ žĖĶž†úŪēėŽäĒ žó≠Ūē†žĚĄ Ūē† ŽŅźŽßĆ žēĄŽčąŽĚľ žÜźžÉĀŽźú ŪėąÍīÄ ŽāīŪĒľžĄłŪŹ¨žĚė žě¨žÉ̞̥ ŽŹēŽäĒŽč§[7]. Ūē≠žĚłžßÄžßą Ūē≠ž≤ī žĖĎžĄĪ ŪôėžěźžóźžĄú ŽįúžÉĚŪēú žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨žĚė žėąžóźžĄú Ūē≠žĚłžßÄžßą Ūē≠ž≤īžóź ÍłįžĚłŪēú ŪėąÍīÄŽāīŪĒľ žĄłŪŹ¨žĚė ŪôúžĄĪŪôĒÍįÄ žóľž¶Ě Žß§ÍįúŽ¨ľžßąžĚė Ž∂ĄŽĻĄžôÄ žĚĎÍ≥† Íłįž†ĄžĚĄ ŪôúžĄĪŪôĒžčúžľú ŪėąÍīÄ žąėž∂ēÍ≥ľ žĚīžôĄžĚė Í∑†Ūėē žě•žē†Ž•ľ žĚľžúľŪā§Í≥† Í≤įÍĶ≠ žč†ŽŹôŽß• ŽįēŽ¶¨Ž•ľ žĚľžúľžľįžĚĄ Í≤ÉžĚīŽĚľÍ≥† ž£ľžě•Ūēú Ž≥īÍ≥†ž≤ėŽüľ[8], Žč®ŽįĪžßą CžĚė Í≤įŪēćžĚÄ žóľž¶ĚŽįėžĚϞ̥ žēÖŪôĒžčúžľú ÍĶ≠žÜĆ ŽŹôŽß•žĚė žÜźžÉĀžĚĄ žĚľžúľŪā¨ žąė žěąÍ≥† žĚīŽ°ú žĚłŪēī žč†žě•ŽŹôŽß•žĚė ŽįēŽ¶¨ÍįÄ ŽįúžÉĚŪĖąžĚĄ ÍįÄŽä•žĄĪžĚī žěąŽč§.
žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨žĚė ž†ēŽ¶ĹŽźú žĻėŽ£Ć Žį©Ž≤ēžĚÄ žóÜžßÄŽßĆ žč¨ÍįĀŪēú žč†ŽŹôŽß• ŪėĎžį©žĚīŽāė žēÖžĄĪ Í≥†ŪėąžēēžĚĄ ŽŹôŽįėŪēėžßÄ žēäžĚÄ ž†úŪēúŽźú Ž≤ĒžúĄžĚė žěźŽįúžĄĪ žč†ŽŹôŽß• ŽįēŽ¶¨ ŪôėžěźžóźžĄúŽäĒ 6-12ÍįúžõĒÍįĄ Ūē≠Í≥†Ūėąžēēž†úžôÄ Ūē≠žĚĎÍ≥†ž†úŽ•ľ Í∑ľÍįĄžúľŽ°ú ŪēėŽäĒ ŽāīÍ≥ľž†Ā žĻėŽ£ĆÍįÄ žöįžĄ†žĚīŽč§[9]. Í∑łŽü¨Žāė Ž≥īž°īž†Ā žĻėŽ£ĆŽßĆžúľŽ°ú Í≥†ŪėąžēēžĚī ž°įž†ąŽźėžßÄ žēäÍ≥† žč†ÍłįŽä•žĚī žēÖŪôĒŽźėŽäĒ Í≤Ĺžöį ŪėąÍīĞ쨞ÉĚ žąėžą†, žč† ž†ąž†úžą†žĚĄ Í≥†Ž†§Ūē† žąė žěąžúľŽ©į, žĶúÍ∑ľžóźŽäĒ Í≤ĹŪĒľž†Ā ŪėąÍīÄžĄĪŪėēžą† ŽįŹ žč†ŽŹôŽß• žä§ŪÖźŪäł žāĹžěÖžą†žĚĄ žĚīžö©Ūēėžó¨ žĻėŽ£ĆŪēėÍłįŽŹĄ ŪēúŽč§[10]. ŪôėžěźžĚė Í≤Ĺžöį Ūó§ŪĆĆŽ¶įžúľŽ°ú žĻėŽ£ĆŽ•ľ žčúžěĎŪēú Ží§ Ž≥ĶŽ∂Ä ŪÜĶž¶ĚžĚī Ūėłž†ĄŽźėžóąÍ≥† ŪôúŽ†•žßēŪõĄÍįÄ žēąž†ēž†ĀžĚīžóąžúľŽ©į žč†ÍłįŽä•žĚī ž†ēžÉĀžúľŽ°ú žú†žßÄŽźėžĖī ŪėąÍīÄ žąėžą†žĚīŽāė ž§Ďžě¨žą†žĚÄ ŪēėžßÄ žēäžēėŽč§. ŪôėžěźŽäĒ Í≤ĹÍĶ¨ Ūē≠žĚĎÍ≥†ž†úŽ•ľ Ž≥Ķžö©ŪēėŽ©īžĄú 1ŽÖĄ ŽŹôžēąžĚė žôłŽěė ž∂Ēž†ĀÍīÄžįį Í≤įÍ≥ľ žě¨Žįú žóÜžĚī žēąž†ēž†ĀžĚł žÉĀŪÉúŽ•ľ žú†žßÄŪēėÍ≥† žěąŽč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






