일차성 사구체신염의 국내발병 현황
Current Status of Primary Glomerulonephritis
Article information
Trans Abstract
Recent change in major indication for renal biopsy from nephrotic syndrome to asymptomatic urinary abnormality (AU) in Korea makes IgA nephropathy the most common biopsy- confirmed glomerulonephritis (GN). Beside from the most common manifestation of AU, a significant portion (22%) of IgA nephropathy (IgAN) patient revealed the nephrotic-range proteinuria. About 1/3 of patients with minimal change disease (MCD), membranous nephropathy (MN) and focal segmental glomerulosclerosis (FSGS) presented with AU. In elderly patient (> 60 years), the proportion of cresentic glomerulonephritis, MN, and FSGS increased, while the prevalence of IgAN decreased compared to younger patients. MCD showed no change based on old age. GN was the third most common cause of ESRD constituting 11-15% of cases. ESRD patients from GN start dialysis younger and live longer on dialysis compared to diabetic and hypertensive patients in Korea. (Korean J Med 2013;84:1-5)
서 론
사구체신염은 다양한 면역기전이나 사구체를 구성하는 단백질 생성의 유전적 결함에 의하여 발생하며 임상적으로 무증상 요이상, 급성신염, 급속진행성 사구체신염, 신증후군 그리고 만성사구체신염의 증후군으로 발현하며 최종 진단은 콩팥생검에 의한 형태학적 진단에 의거한다. 본 종설에서는 우리나라에서 발생하는 일차성 사구체신염(primary glomerulonephritis, PGN)의 발병 현황에 대하여 간단히 기술하고자 한다.
콩팥생검에 의하여 확진된 일차성 사구체 신염의 발병률
발병률은 관찰 시작 시점에서 질병이 없는 인구집단의 종단 관찰에서 질병이 발병하는 비율이므로 우리나라 전체 인구를 대상으로 하는 콩팥 생검 등록체계가 필요하나 불행히 아직 존재하지 않는다. 미국 및 유럽의 여러 선진국뿐 아니라 싱가포르, 일본 등 아시아 국가에서도 훌륭한 등록체계를 지니고 있다.
최근 1980-2010에 걸쳐 유럽, 북미, 남미 중동에서 시행된 40개의 연구를 메타분석한 결과에 의하면 IgA콩팥병의 발병률이 25 ppm (person per million)으로 가장 높고 막성콩팥병이 12 ppm, 국소분절 사구체경화증 8 ppm, 미소성변화 6 ppm, 그리고 막성증식성 사구체신염이 2 ppm이었다[1].
우리나라에서 일차성 사구체신염의 분포
PGN은 콩팥 생검에 의하여 진단되므로 콩팥 생검의 적응증이 PGN의 분포에 큰 영향을 미친다. 특히 무증상 요이상을 지닌 환자에게 보다 적극적으로 신생검을 시행할수록 무증상 요이상으로 발현하는 경우가 많은 IgA콩팥병의 진단빈도가 증가한다[2].
우리나라에서 1990년대 중반 이전에 시행된 1,500예 이상의 성인 PGN을 대상으로 시행된 연구들[3,4]에 의하면 미소성변화가 성인 PGN의 26.6% 및 26.3%를 차지하여 가장 흔한 PGN이었으나 이는 신증후군이 콩팥생검의 주된 적응증이었던 당시 상황을 반영하며 최근 학교, 직장, 군대 등에서 다양한 기회를 통하여 실시되는 요검사로 많은 수의 무증상 요이상이 발견되고 적극적으로 콩팥생검이 이루어지는 현재의 상황을 반영하지 못한다. 물론 위생상황의 개선, 식생활 변화 등의 환경적 요인의 차이도 작용하였으리라 판단된다[5].
PREMIER (Progressive Renal disease and Medical Informatics and gEnomic Research) study는 2003-2008년에 걸쳐 대한신장학회 후원하에 저자가 책임 연구자로 시행한 연구로 우리나라 25개 병원에서 콩팥 생검으로 확진된 4,918명의 자료를 수집하였다. PREMIER 연구에서 콩팥생검의 적응증은 무증상 요이상이 가장 많았고 이어 신증후군 순이었다(Table 1).
PREMIER 연구에서 가장 흔한 병리학적 진단은 IgA콩팥병이었고 이어 막성콩팥병 그리고 국소분절사구체경화증 순이었다(Table 2). 1990-2010년에 걸쳐 국내 단일대학에서 시행한 연구결과는 IgA콩팥병, 미세변화, 국소분절 사구체경화증 그리고 막성콩팥병의 순으로 PRIMIER와 약간 상이한 결과를 보였다[6].
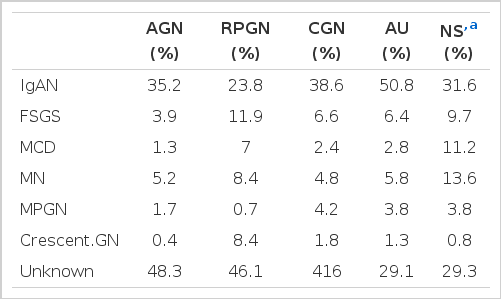
무증상 요이상으로 발현한 환자의 50.8%가 IgA콩팥병이었고, 신증후군 영역의 다량의 단백뇨를 나타낸 환자의 31,6%가 IgA콩팥병이었으며 막성콩팥병(13.6%), 미소성변화(11.2%), 그리고 국소분절성 사구체경화증(9.7%) 순이었다. 만성사구체신염의 가장 흔한 원인도 IgA콩팥병이었고 이어 국소분절성 사구체경화증이었다(Table 3).
IgA콩팥병의 환자의 49.5%는 무증상 요이상으로 발현하였고 상당수 환자에서 하루 3.5g 이상의 단백뇨가 관찰되었다. 막성콩팥병, 국소분절성 사구체경화증, 그리고 미소성변화에서 신증후군이 가장 흔한 임상상이었으나 30% 전후의 환자에서 무증상 요이상으로 발현하였다(Table 4).
고령 환자에서 사구체신염
우리나라는 세계에서 가장 빠른 속도로 고령화되고 있으며 훌륭한 의료전달체계 때문에 다양한 진단적 및 치료적 처치가 연령에 제한 없이 행해지고 있으며 신생검도 이러한 처치 중의 하나이다.
고령으로 인한 다양한 생물학적인 변화는 연령에 특이한 사구체손상을 유발하여 고령 환자에 독특한 사구체신염의 발병 양상을 나타낸다. PREMIER 연구에 의하면 60세 이상의 고령에서 15-60세 사이의 환자에 비하여 전체 사구체신염 중 막성콩팥병의 비율은 2.6배 높고, 국소분절 사구체경화증은 1.8배, 막성증식성 사구체신염은 1.4배 높은 반면, 미소성변화의 비율은 동일하였고 IgA콩팥병의 비율은 0.4배에 불과하였다. 특징적으로 초승달 사구체신염의 비율이 젊은 연령에 비하여 고령에서 5.5배 높았다(Table 5).
일본 콩팥생검 등록체계에 의하면 65세 이상의 환자에서 20-64세 환자에 비하여 우리나라와 유사하게 막성콩팥병과 막성증식성 사구체신염의 비율이 높고 IgA콩팥병의 비율은 낮았다. 그러나 우리나라와 상이하게 국소분절 사구체경화증의 비율은 고령에 따른 차이가 없었고 미소성변화의 비율은 고령에서 낮았다. 80세 이상의 극고령층에서 항중성구세포질항체에 의한 초승달 사구체신염이 모든 사구체신염 중 15.2%를 차지하여 가장 높았고 이어 아밀로이드증이 9.0%를 차지하였고 IgA콩팥병은 8.5%로 20-64세 사이의 IgA콩팥병 발병률의 1/5에 불과하였다[7].
미국 콜롬비아대학의 보고에서도 80세 이상의 극고령층 사구체신염에서 항중성구세포질항체에 의한 초승달 사구체신염의 비율이 19%로 가장 높았고 IgA콩팥병의 발병률은 7.1%에 불과하였다[8].
고령에서 흔히 존재하는 심혈관계 질환을 비롯한 동반 질환으로 사구체신염에 의한 임상 소견이 다르게 발현할 수 있다. PREMIER 연구에서 60세가 넘는 고령에서 사구체신염이 발생한 경우 60세 미만인 환자에 비하여 고혈압의 빈도가 더 높고(40.1 vs. 60.1%, p< 0.05) 혈중 크레아티닌 수치는 높고 사구체여과율은 낮았다. 혈중 콜레스테롤 수치가 더 높았고 하루 요단백뇨량이 더 많았으며 헤모글로빈은 더 낮았다. 임상발현 양상은 무증상 요이상의 빈도는 낮고 신증후군과 만성사구체신염의 빈도는 더 높았다. 추적 도중 혈중 크레아티닌 수치가 2배 이상 증가하는 비율이 높았다(6.7% vs. 9.8%, p= 0.011).
사구체신염과 말기신부전
대한신장학회 등록위원회의 자료에 의하면 원발성 사구체신염은 1980년대 중반까지 우리나라에서 말기신부전으로 진행하는 가장 흔한 질환으로 말기신부전 환자의 약 40%를 차지하였으나 1980년대 후반부터 약 20-25%로 감소하였고 2000년대 이후에는 10% 중반에서 서서히 감소하여 2011년 사구체신염은 말기신부전의 원인 질환 중 10.4%로 당뇨콩팥병(47.1%), 고혈압신경화증(19.6%)에 이어 3번째로 흔한 질환이다. 그외 말기신부전을 유발하는 주요한 사구체신염으로 루푸스신장염(0.5%) 및 알포트증후군 등의 유전성신병증(0.2%)이 있다[9].
United States Renal Data System (USRDS)에 의하면 미국에서 2006년에서 2010년까지 발생한 말기신부전의 원인 질환 중 당뇨콩팥병이 44.2%로 가장 흔하고 고혈압신경화증이 28.8%를 차지하였고 원발성 사구체신염이 6.6%, 루푸스신장염을 포함한 이차성 사구체신염이 2.1%으로 우리나라에 비하여 고혈압신경화증의 빈도가 높고 사구체신염의 빈도가 낮았다. 그러나 미국에 거주하는 아시아인의 말기신부전의 원인은 당뇨콩팥병이 48.7%, 고혈압신경화증이 23.5%, 그리고 원발성 사구체신염이 10.7%로 원발성 사구체신염이 차지하는 비율이 우리나라와 거의 동일하였고 이는 아시안이 다른 인종에 비하여 사구체신염의 발병 위험성이 높음을 시사한다[10].
일본과 대만의 경우 우리나라와 비슷하게 각각 1997년[11] 및 2001년[12] 이후 당뇨콩팥병이 말기신부전의 가장 흔한 질환으로 부상하였으나 사구체신염이 아직 25-30%를 차지하는 반면 고혈압신경화증은 8-10%로 우리나라에 비하여 현저히 낮았다[13]. 이러한 차이의 이유 중의 하나로 우리나라에서 고혈압성신경화증의 진단은 신생검 및 고혈압이 신손상에 명확히 선행하는 병력의 확인없이 대부분 진료의사의 의견에 기초하여 이루어짐을 반드시 고려하여야 한다. 사구체신염을 비롯한 다양한 원인에 의한 신손상은 고혈압을 유발하며 고혈압은 모든 종류의 신질환에서 말기신부전으로 진행을 촉진시키므로 실제 다른 원인에 의한 말기신부전이 고혈성신경화증으로 오진될 가능성이 크다[14].
각 나라의 말기신부전 registry에 기록된 원인 질환은 모두 담당의사의 진단으로 작성되므로 정확성에 항상 문제가 있음을 고려하여야 하며 실제 USRDS 자료와 신장조직검사 결과를 비교한 연구에서 USRDS에서 사구체신염의 진단된 증례의 민감도는 37%에 불과하여 실제 많은 사구체신염 환자가 다른 질병으로 분류됨을 보고하였다[15].
말기신부전에 도달한 우리나라 사구체신염 환자의 약 30%에서만 신장조직검사 시행되어 말기신부전 환자에서 사구체신염의 분포를 파악하기 어렵다. 아시안계 미국인에서 IgA콩팥병은 말기신부전의 3.2%를 차지하며 국소분절사구체경화증(2.0%), 루푸스콩팥병(1.5%), 그리고 막성콩팥병(0.3%)의 순이다.
우리나라의 사구체신염에 의한 말기신부전 투석 환자의 평균연령은 52.7 ± 14.4세로 당뇨병콩팥병 환자의 61.3 ± 11.7세, 고혈압신경화증 환자의 59.6 ± 13.6세보다 젊어 사회경제적 활동이 왕성한 시기에 말기신부전으로 인한 개인적 손실이 사구체신염 환자에서 보다 심각함을 알 수 있다. 또한 우리나라 사구체신염 투석 환자의 10년 생존율은 66.4%로 당뇨병콩팥병 투석 환자의 29.5%, 고혈압신경화증 투석 환자의 57.1%보다 양호하여 발병률에 비하여 말기신부전의 유병률과 이에 동반하는 의료비용 지출 증가에 기여하고 있다.
일본의 경우 사구체신염, 당뇨병콩팥병, 그리고 고혈압신경화증에 의한 투석 환자의 10년 생존율은 각각 52.7%, 28.0%, 그리고 27.0% [13]로 고혈압신병증 환자의 생존율에 큰 차이를 보이고 있으며 이는 앞에서 지적한 고혈압신경화증의 진단적 문제와 관련된 것으로 판단된다.
결 론
우리나라에서 콩팥생검으로 확진된 사구체신염 중 미소성변화가 가장 흔하였으나 2000년대 이후 IgA콩팥병이 가장 흔하며 이는 위생상태개선 등 환경적 요인과 함께 콩팥생검의 주된 적응증이 신증후군에서 무증상 요이상으로 변화하였기 때문이다.
우리나라 IgA콩팥병의 절반은 무증상 요이상으로 발현하나 20% 이상의 환자에서 신증후군 영역의 단백뇨를 나타낸다. 또한 막성콩팥병, 국소분절성 사구체경화증, 그리고 미소성변화에서 신증후군이 가장 흔한 임상상이었으나 30% 전후의 환자에서 무증상 요이상으로 발현하였다.
고령의 환자에서는 젊은 연령군에 비하여 막성콩팥병, 국소분절성 사구체경화증의 빈도가 높았고 IgA콩팥병의 빈도는 훨씬 낮았다. 또한 반월성 사구체신염의 빈도가 고령에서 매우 높았다.
사구체신염은 우리나라 말기신부전의 원인 질환 중 10%를 차지하며 다른 질병군에 비하여 투석개시연령이 낮고 장기생존율이 높아 개인적, 국가적으로 초래하는 사회경제적 부담이 높다.