칼시토닌 분비 췌장 내분비 종양을 동반한 다발내분비샘종양 1형 1예
A Case of a Calcitonin-Secreting Pancreatic Endocrine Tumor in a Pateint with Multiple Endocrine Neoplasia Type 1
Article information
Abstract
다발내분비샘종양 1형과 동반된 칼시토닌 분비 췌장 내분비 종양은 이전에 보고된 적이 없다. 칼시토닌 분비 췌장 내분비 종양은 악성이 많고 불량한 예후를 보이므로 조기진단과 치료가 필요하다. 갑상선 수질암이 없으나 칼시토닌이 증가되어 있을 경우 칼시토닌 분비 췌장 내분비 종양의 가능성을 고려해 볼 필요가 있다. 저자들은 유방암 수술을 위해 입원한 환자에서 시행한 호르몬 검사, 방사선 검사에서 뇌하수체선종, 갑상선 유두암, 부갑상선 기능항진증, 흉선 유암종, 칼시토닌 분비 췌장 내분비 종양, 부신수질선종, 우측 침습성 유관암, 자궁근종, 자궁선근종을 진단하였다. 이후 수술을 시행하여 다발내분비샘종양 1형을 동반한 칼시토닌 분비 췌장 내분비 종양 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Multiple endocrine neoplasia type 1 (MEN1) is an autosomal dominant hereditary disorder characterized by the combined occurrence of tumors of the parathyroid gland, exocrine pancreas, and anterior pituitary gland. Calcitonin-secreting pancreatic endocrine tumors are rare, and calcitonin-secreting pancreatic endocrine tumors with MEN1 have not been reported in Korea. A 46-year-old woman was admitted for a right breast cancer operation. Abnormal blood chemistry findings were hypercalcemia and elevated calcitonin. The patient was diagnosed with a calcitonin-secreting pancreatic endocrine tumor, left thyroid papillary carcinoma, right breast invasive ductal carcinoma, a thymic carcinoid tumor, left adrenal adenoma, uterine myoma, and adenomyosis by computed tomography scan, and with pituitary macroadenoma by brain magnetic resonance imaging. We present this case with a review of the literature, because it is the first reported calcitonin-secreting pancreatic endocrine tumor with MEN 1 in Korea. (Korean J Med 2012;83:817-822)
서 론
다발내분비샘종양은 임상양상에 따라 1형, 2A형, 2B형으로 구분되며 그 중 다발내분비샘종양 1형은 부갑상선, 뇌하수체, 췌장소도 중 두 곳 이상의 내분비 종양이 동반되어 발생하는 질환이다[1,2]. 국내에는 1986년 이후 다발내분비샘 종양과 관련된 25예가 보고되었다. 1형의 경우 세 부위 이외에도 부신, 흉선, 기관지, 위장관, 자궁 등 여러 부위에 내분비 종양이 동반될 수 있으나[3] 칼시토닌 분비 췌장 내분비 종양을 동반한 다발내분비샘종양 1형 환자는 아직 보고된예가 없다. 저자들은 유방동통을 주소로 내원하여 유방암을 진단받고 수술 전 검사에서 우연히 발견된 칼시토닌 분비췌장 내분비 종양을 동반한 다발내분비샘종양 1형 1예를 경험하여 이에 문헌고찰과 함께 보고하는 바이다.
증 례
환자는 46세 여자로 내원 1달 전부터 우측 유방에 동통이 있었고, 자가 촉진상 우측 유방에 종물이 만져져 본원 외과를 방문하여 유방 초음파를 시행하였다. 유방 초음파에서 우측 유방에 2.1 × 1.33 cm, 1.0 × 0.64 cm 크기의 종물이 보여, 유방 세침흡인조직 검사를 시행하여 침습성 유관암으로 진단받고 수술을 위해 입원하였다. 과거력상 3년 전 자궁근종을 진단받고 경과관찰 중이며, 가족력상 특이 소견은 없었다. 내원 당시 활력 징후는 혈압 137/72 mmHg, 맥박 80회/분, 체온 36.7℃, 신장은 155 cm, 몸무게 57 kg이었다. 유방 촉진상 우측에 다발성 종괴들이 만져졌으며, 가장 큰 것은 2 cm 정도였다. 좌측 갑상선에 1 cm 크기의 종물이 촉진되었다. 복부 및 사지 진찰상 특이 소견은 없었다. 내원하여 시행한 말초 혈액 검사에서 백혈구 8,400/uL, 혈색소 9.7 g/dL, 적혈구 용적 35.5%, 혈소판 303,000/uL였고, 혈청 생화학 검사에서 AST/ALT 18/17 IU/L, Ca 12.1 mg/dL, P 2.3 mg/ dL, Na/K/Cl 135/3.6/106 mEq/L였으며, 소변 검사에서 특이소견은 없었다. 수술 전 시행한 전신 양전자방출단층촬영에서 우측 유방, 좌측 갑상선, 흉선, 췌장, 좌측 부신, 자궁에 FDG섭취 증가가보여 추가적인 내분비 기능 검사를 시행하였다(Fig. 1). 갑상선 기능 검사상 TSH 1.44 uIU/mL (정상치 0.4-4.0 uIU/mL), T31.46 ng/mL (정상치 0.6-1.7 ng/mL), fT4 1.17 ng/dL (정상치 0.8-1.9 ng/dL)로 정상소견을 보였다. 부갑상선호르몬(iPTH)은 340 pg/mL (정상치 0-9.9 pg/mL), 칼시토닌은 286 pg/mL (정상치 0-9.9 pg/mL)로 모두 증가되어 있었다. 24시간 소변 검사에서 epinephrine 8.3 μg/24 hr (정상치 0-10 μg/24 hr), nore-pinephrine 72.5 mg/24 hr (정상치 15-80 mg/24 hr), metanephrine 0.669 mg/24 hr (정상치 0-1.29 mg/24 hr), VMA 4.41 mg/24 hr (정상치 0-7.9 mg/24 hr)로 정상, free cortisol은 563.3 μg/24 hr (정상치 55.5-286 μg/24 hr)로 증가 소견을 보였다. Overnight dexamethasone 억제 검사에서는 코티솔이 7.89 μg/dL에서 5.69 μg/dL로 억제되어 쿠싱병은 배제할 수 있었다. 복합 뇌하수체 기능 검사에서 프로락틴이 43.9 ng/mL로 정상범위(0-35 ng/mL)보다 증가되어 있었으나 다른 뇌하수체 호르몬의 이상 소견은 보이지 않았다(Table 1).
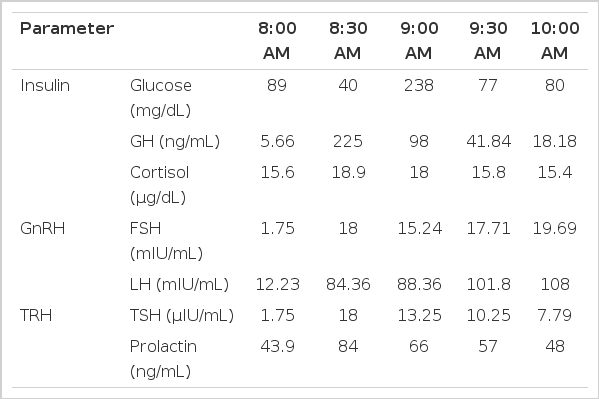
Fluorodeoxyglucose positron emission tomography/computed tomography (FDG-PET/CT) shows intense FDG uptake in the thyroid gland, thymus, pancreatic neck and tail, left adrenal gland, and endometrium. Total pancreatectomy (A), left adrenalectomy (B), and total hysterectomy (C) were performed.
복부컴퓨터단층촬영에서 4.1 × 2.8 cm 크기의 췌장 경부종양, 6.5 × 6.1 cm 크기의 췌장 꼬리 종양, 골반강과 작은 그물막 주위에 다발성 종괴가 산재해 있었고, 좌측 부신선종이 관찰되었다. 다발내분비샘종양 확인을 위해 시행한 뇌 자기공명촬영에서 뇌하수체에 14 × 9 mm 크기의 종괴가 확인되었다. 흉부컴퓨터단층촬영과 갑상선 초음파를 시행하여, 좌측 1.14 × 0.8 cm, 우측 0.62 × 0.42 cm, 1.09 × 1.16 cm 크기의 종괴가 확인되어, 세침흡인조직 검사 시행상 갑상선 유두암을 확진하였다.
분자 유전학 검사: 다발내분비샘종양 1형 유전자의 모든 엑손에 대한 돌연변이 분석을 시행한 결과 엑손 3번에서 5개의 염기 AGCCC (196-200번째)가 중복되는 틀 이동 돌연변이가 확인되었다. 다발내분비샘종양 2형 유전자 돌변변이를 확인하기 위해 시행한 RET 유전자 돌연변이 분석에서는 정상, 유방암 유전자 BRCA 1, 2 돌연변이 분석에서도 정상으로 확인되었다
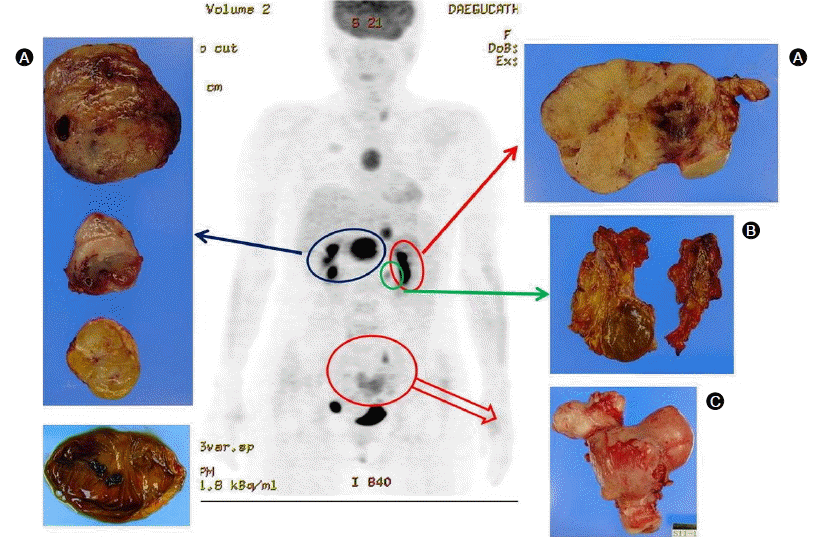
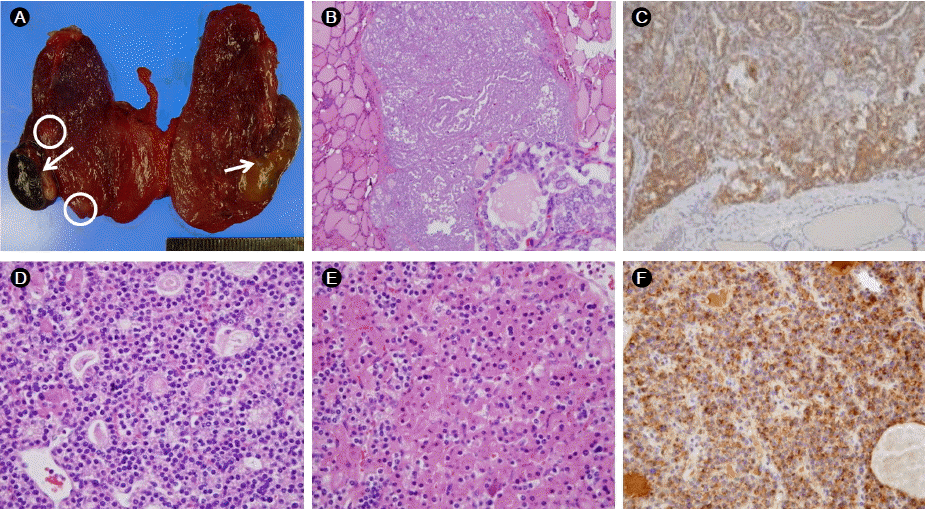
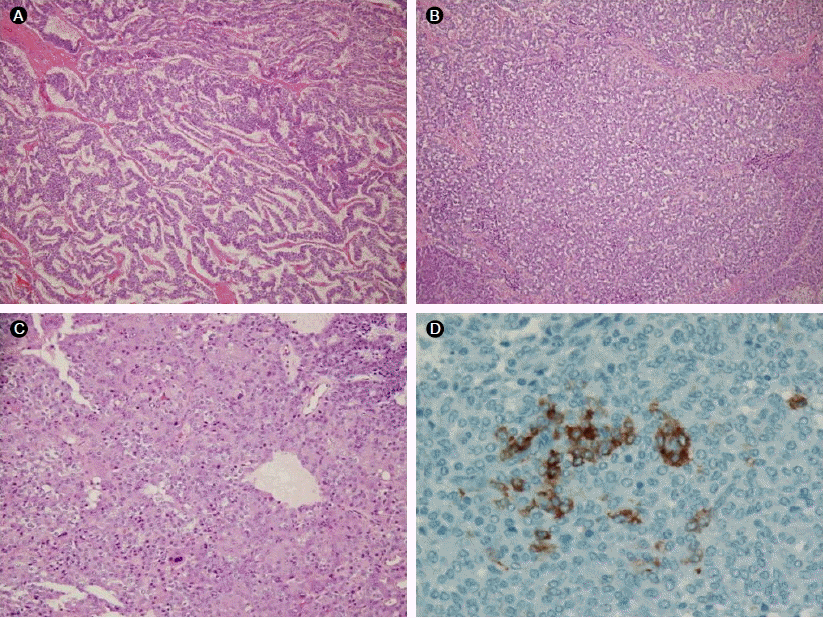
치료 경과: 칼시토닌 증가와 부갑상선호르몬 증가로 갑상선 전 절제술 및 우측 부갑상선 절제술을 시행하였다. 절제된 갑상선에서는 좌측 0.5 cm, 0.2 cm, 우측 0.5 cm 크기의 갑상선 유두암, 양쪽 부갑상선에서는 선종이 진단되었다(Fig. 2). 갑상선 및 부갑상선 종양에서 시행한 칼시토닌 면역염색에서 칼시토닌 분비는 관찰되지 않았다. 췌장 내분비 종양과 좌측부신 선종의 절제를 위해 췌장 두부 및 미부 부분 절제술과 좌측 부신 절제술 시행하였다. 절제된 췌장에는 육안적으로 식별가능한 4개의 종괴 이외에 0.5-1.0 cm 크기의 작은 결절들이 전체 췌장에 흩어져 있었다. 종괴와 결절들은 조직 검사에서 혈관침윤과 피막침범을 동반하는 악성내분비 종양으로 확인되었다. 췌장의 종양에서 시행한 칼시토닌 면역염색결과 췌장의 내분비 종양에서 이소성의 칼시토닌 분비를 확인하였다(Fig. 3). 부신 조직 검사에서는 부신선종이 확인되었다. 전 자궁적출술 후 시행한 자궁 조직 검사에서는 자궁근종 및 자궁선근증이 확인되었다. 뇌하수체선종은 특이 증상 없어 경과관찰 중이다. 우측 유방암과 흉선 종괴는 우측 유방 보존술과 흉선 절제술을 시행하였다. 절제된 유방종괴는 조직 검사에서 신경내분비 분화를 보이는 침윤성 관암종으로 진단되었으며, 흉선 종괴는 유암종으로 진단되었다.
(A) Total thyroidectomy specimen shows two small intrathyroidal nodules (white circles) in the left lobe and two extrathyroidal nodular masses (black arrows) in bilateral lobes. (B) Photomicrograph of the two intrathyroidal nodules shows a papillary tumor with anaplastic cells [hematoxylin and eosin (H&E), × 40] and an intranuclear inclusion (inset, H&E, × 400). (C) The papillary tumor cells expressed anti-galectin-3 antibody (× 200). (D) and (E) Photomicrograph of the bilateral parathyroid microfollicular masses with clear cell proliferation (D, H&E, × 100) and large eosinophilic cells (E, H&E, × 100). (F) The parathyroid tumor expressed anti-chromogranin A antibody (× 100).
The resected pancreatic masses show various growth patterns. (A) Gyriform and trabecular [hematoxylin and eosin (H&E), ×; 100], (B) microfollicular (H&E, × 40), and (C) solid with enlarged nuclei (H&E, × 100). (D) Calcitonin secretion by pancreatic tumor cells (× 200).
췌장 부분 절제술 후 칼시토닌은 286 pg/mL에서 2.6 pg/mL로 회복된 후 8개월간 정상으로 유지되고 있다. 갑상선 전 절제술 및 우측 부갑상선 절제술 후 칼슘제제 및 synthyroxine 150 mg 복용 중이다. 수술 후 7개월째 시행한 혈청생화학 검사상 혈청 칼슘 8.0 mg/dL, 인 4.6 mg/dL, 부갑상선 호르몬 21.4 pg/mL로 유지되고 있다. 유방 보존술 후 유방 전이 및 재발 예방을 위해 4개월에 걸쳐 4회의 수술 후 보조적 항암치료 시행하였으며, 현재는 수술 후 보조적 방사선 치료를 시행하고 있다. 수술 후 8개월째 암의 재발을 확인하기 위해 전신 양전자방출단층촬영, 흉부컴퓨터단층촬영, 복부컴퓨터단층촬영, 유방초음파를 시행하였다. 암의 재발소견은 보이지 않았으며, 특이 증상 없이 경과관찰 중이다.
고 찰
다발내분비샘종양 1형은 상염색체 우성으로 유전되는 질환으로 부갑상선, 뇌하수체, 췌장소도 중 두 곳 이상의 내분비 종양이 동시에 발생할 때 진단 가능하다[1]. 염색체 11q13에 위치한 MEN1 gene의 종양 억제 유전자에 돌연변이가 발생하면 이로 인해 다발내분비샘종양 1형이 발생한다. 유병률은 3만 명당 한 명 정도로 비교적 드문 질환이다[2,4].
다발내분비샘종양 1형 중 부갑상선기능항진증이 가장 흔하며 환자의 약 95% 정도에서 동반되며, 흔히 최초로 발견되는 임상 증상으로 알려져 있다. 뇌하수체 종양의 경우 발생 빈도는 20-50%로 알려져 있다[3-5]. 췌장 내분비 종양은 매년 100,000명당 1-5명 이하로 발생하는 매우 드문 질환이다[2,7,8]. 췌장 내분비 종양의 경우 분비되는 호르몬의 종류에 따라 임상양상이 구별된다. 가스트린과 인슐린을 분비하는 경우가 가장 흔하나 점진적인 발병과 진행, 1/3 정도는 증상이 없어 진단이 어렵다. 췌장 내분비 종양은 다심성이며 1/3 정도가 악성이다. 다양한 종류의 호르몬 분비 종양은 내과적 치료가 비효율적이므로 절제가 필요하다. 가장 흔하게 발생하는 가스트린종의 치료는 히스타민 2 수용체 억제제와 프로톤 펌프 억제제의 사용, 수술적 치료가 시행되고있다. 악성 종양을 치료하기 위해서는 전 췌장 절제술이 필요하나 부작용으로 당뇨와 신경증, 막망증, 신증 등의 부작용도 고려해야 한다. 종양의 완전 절제가 예후를 호전시킨다고 보고되고 있으나 아직까지 치료에 대한 논란이 많은 상태이다[6].
본 증례의 경우 좌측 갑상선 종양이 전신 양전자방출단층 촬영과 흉부컴퓨터단층촬영에서 확인되어 다발내분비샘 종양 2형에서 흔히 볼 수 있는 갑상선 부신 수질암종에 인한칼시토닌의 증가가 생각되었다. 수술 후 시행한 조직검사에서는 갑상선 유두암이 진단되어 다발내분비샘종양 2형은 배제할 수 있었고, 칼시토닌을 분비하는 조직을 췌장에서 확인하여 칼시토닌 분비 췌장 내분비 종양을 확인할 수 있었다(Fig. 3).
칼시토닌 분비 췌장 내분비 종양은 외국의 경우에도 37예만 보고되었고[7], 국내에서는 아직 보도된 예가 없는 매우 드문 질환이다. 37예의 환자들을 분석한 결과, 환자의 주증상은 수양성 설사와 복통이었으며, 진단은 복부컴퓨터단층촬영, 복부초음파, 내시경 초음파 등의 다양한 방법으로 우연하게 이루어졌다. 칼시토닌은 보통 갑상선 C세포에서 분비되는 폴리펩티드 호르몬으로 이차적인 부갑상선항진증을 동반한 만성신장 질환과 다른 종양에서도 분비될 수 있다. 칼시토닌이 증가되어 있을 경우 가장 먼저 갑상선 수질암종에 의한 분비를 생각할 수 있다. 이소성 칼시토닌 분비의 명확한 기전에 대해서는 알려지지 않았으나, 신경내분비 종양의 50-70%에서 칼시토닌 분비 세포가 발견되고 있다. 갑상선 수질암종이 없이 칼시토닌이 증가되어 있을 경우에는 칼시토닌 분비 췌장 내분비 종양의 가능성을 고려해 보아야한다. 지금까지 보고된 칼시토닌 분비 췌장 내분비 종양은 흔히 악성이며, 불량한 예후를 보인다. 종양은 대부분 췌장의 두부와 미부에 발생하며, 진단 당시의 전이 유무와 종양의 크기에 관계없는 적극적 수술적 치료가 생존율과 질환의 증상을 감소시킬 수 있다고 보고되고 있다[2,5-8].
본 증례에서도 저자 등은 칼시토닌을 분비하는 췌장 내분비 종양을 동반한 다발내분비샘종양 1형을 진단하여, 생존율 향상을 위해 췌장 부분 절제술을 시행하였다. 37예의 칼시토닌 분비 췌장 내분비 종양만으로 이소성 칼시토닌 분비 췌장 내분비 종양의 발병원인, 기전, 전형적인 증상, 병의 진행 및 예후를 판단하기에는 어려움이 많아, 지속적인 연구가 필요하다.
다발내분비샘종양 1형에서 기관지, 흉선, 위 등에 유암종을 동반할 수 있다고 알려져 있으며[3,5], 국내에서는 Cho 등[2]이 흉선 유암종을 동반한 다발내분비샘종양 1예를 보고했다[9].
평활근종의 경우도 다발내분비샘종양 1형 환자에서 폐, 자궁, 식도에서 발생이 보고되나, 국내에서는 Sim 등[2]이 보고한 1예에서 대장 평활근종의 발생을 확인할 수 있었다[3,10]. 이후 Roh 등[2]이 유방암을 동반한 다발내분비샘종양 2형 환자를 보고한 1예가 있으나, 다발내분비샘종양 1형을 동반한 유방암은 국내에서 보고된 적이 없다. 흉선 유암종, 유방암, 자궁근종처럼 다발내분비샘종양 1형에서 드물게 동반되는 질환들이 함께 발생한 경우도 보고된적이 없다. 본 증례에서처럼 칼시토닌 분비 췌장 내분비 종양, 흉선 유암종, 유방암, 자궁근종이 동반된 다발내분비샘종양 1형은 매우 드문 경우로 지금까지 보고된 적이 없어 향후 근접 경과 관찰과 연구를 통해 이소성 칼시토닌 분비 췌장 내분비 종양의 발병원인, 다발내분비샘종양과의 관계 등 많은 조사가 필요할 것으로 보인다.