서 론
원발성 위 림프종(Primay gastric lymphoma)은 가장 흔한 extranodal 림프종이며 일반적으로 non-Hodgkin’s 림프종이다. 이는 전체 위 악성종양의 ~5%를 차지하는 드문 질환이지만 최근 그 발생 빈도가 증가하고 있다. 주된 조직학적 분류로는 DLBCL (diffuse large B-cell lymphoma)과 MALT (marginal zone B-cell lymphoma of the mucosa-associated lymphoid tissue) 림프종이 있고 이 중 MALT 림프종이 40% 이상을 차지한다[1,2]. MALT 림프종은 1983년 Isaacson과 Wright가 처음으로 B 세포 림프종의 한 형태로 기술하였고, 1994년 Revised European American Lymphoma (REAL) 분류에서 B-marginal zone lymphoma, extranodal (MALT) type으로 명명된 이후 2008년 WHO 분류에서 림프절 외 변연부 림프종(extranodal marginal zone B-cell lymphoma of MALT)으로 분류되었다[3].
가장 잘 알려진 병인은 H. pyloriylori으로 위 MALT 림프종 환자의 90%에서 H. pylori 감염이 보고되었다[4]. 림프 여포(MALT)는 위 점막에서 H. pylori 감염에 대한 면역 반응으로 형성되어 저등급 위 MALT 림프종으로 진행한다. 또한 위 MALT 림프종의 60-90%는 H. pylori 제균 치료로 완전 관해에 도달한다[5-8].
하지만 위 MALT 림프종은 드물고 비특이적인 위장관 증상을 보이므로 임상적으로 진단이 어렵다. 또한 내시경 소견도 특징적 소견 없이 다양하게 관찰되어 내시경 검사 및 조직 검사에서 주의를 요한다. 병기 설정에 있어서도 초음파내시경(EUS)의 발달과 함께 여러 분류체계가 제안되고 있으며, 치료 후 경과관찰법도 위선암과는 다르다. 저자는 위 MALT 림프종의 내시경 소견 및 진단방법, 추적관찰에 대해 중점적으로 정리하고자 한다.
본 론
위 내시경 검사
위 MALT 림프종은 주로 55세에서 60세 사이에 가장 흔하다. 진단 시 무증상인 경우도 있지만 증상이 있는 경우 비특이적으로 상복부 통증이나 오심, 구토 등을 호소할 수 있다[2]. 위 MALT 림프종의 진단은 기본적으로 내시경과 조직 검사를 통해 이루어진다. 위 MALT 림프종은 위의 모든 위치에서 나타날 수 있는데 대부분 H. pylori가 서식하는 위의 전정부와 하부 체부에서 주로 발견된다[9]. 내시경 소견으로는 발적, 미란, 궤양, 비후된 주름 또는 위암과 유사한 종괴등 다양한 형태로 관찰될 수 있다. 그 중 흔한 소견으로는 궤양이나 다수의 미란을 동반한 궤양형(ulcerative type), 용종과 같은 종괴형태(exophytic type) 큰, 결절성 또는 비후된 주름 형태(hypertrophic type)가 있다. 하지만 이러한 소견들은 MATL 림프종만 발견되는 특징적인 것들이 아니어서 진단을 위한 조직 생검이 필수적이다[2].
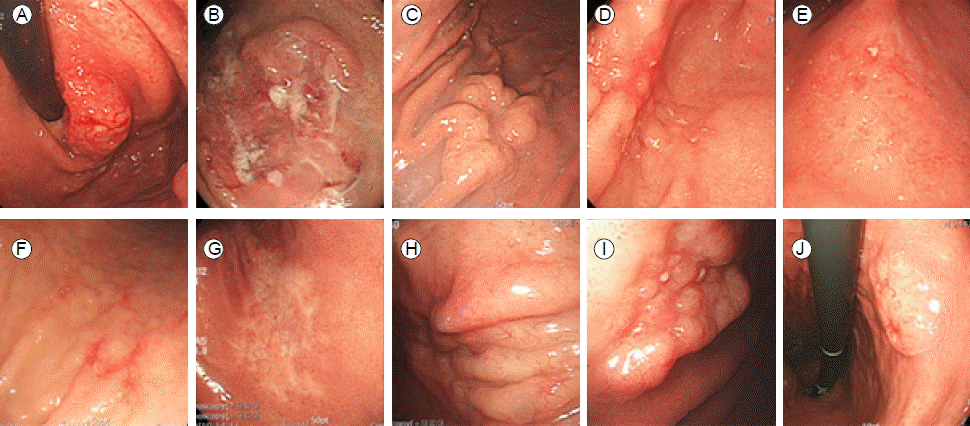
위 림프종(gastric lymphoma)은 체계적으로 표준화된 내시경분류법은 없지만 일반적으로 종괴를 형성하거나 용종 같은 모습은 보이는 돌출형(exophytic type), 궤양침윤형(ulceroinfiltrative type), 표재성병변형(superficial type) 및 기타 형으로 나눌 수 있다. 위 MALT 림프종은 위 점막에서 발생하여 서서히 진행하므로 표재성 병변의 형태가 주로 관찰되며 여러가지 병변들이 혼재되어 발견되기도 한다. 국내의 연구에서도 위 MALT 림프종을 표재성(superficial) 병변, 점막주름의 비후성(hypertrophic fold) 병변, 궤양 침윤형(ulceroinfilltrative) 병변, 종괴형성(ulcerofungating) 병변으로 분류하였을 때 표재성 병변이 54%로 가장 흔하였다. 표재성 병변은 만성 위염과 내시경 소견이 비슷하여 다양한 소견을 보이며 많은 연구에서 다양한 분류들을 사용하고 있다. Yokoi 등은 표재성 병변을 표면함몰형(IIc-like type), 점막하종양형(submucosal tumor type), 다발성 미란형(multiple erosion type), 조약돌 점막형(cobblestone-mucosa type), 부분적 점막주름 비후형(partialfold swelling type), 퇴색형(discoloration type)의 여섯 가지로 세분화하였다(Fig. 1) [9]. 표재성 병변의 양상은 조기위선암과 유사하여 감별을 요하며 위 MALT 림프종은 내시경에서 다발성이고 경계가 불분명하며 비교적 주름 말단부가 궤양에 부드럽게 연접하며 궤양경계가 예리하다. 아울러 위 내공기를 주입하면 신전이 잘 되며, 주변점막에 점막하 종괴와 같은 양상을 보이거나 조약돌상 병변이 관찰되는 경우 위 MALT 림프종을 의심하여야 한다.
위 MALT 림프종의 진단은 기본적으로 내시경과 조직검사를 통해 이루어지지만, 내시경적으로 비특이적이고 위염으로 오인하고 진단되는 경우가 있다. 반면 병변이 의심되는 부위에서 조직검사로 위음성을 보이는 경우가 있다. Taal 등의 조사에 의하면 첫 내시경에서 조직학적 진단과의 일치도가 저등급 림프종은 75%, 고등급 림프종의 경우는 79%로서[10,11] 조직학적 진단이 어려워 정확한 MALT 림프종 진단을 위해 반복적인 내시경 검사를 늘 고려해야 한다. 또한 위 MALT 림프종은 종양이 다발성으로 분포할 가능성이 있고 그 중 고등급 림프종이 혼재해 있을 가능성이 있기 때문에 육안적으로 비정상적인 점막뿐만 아니라 정상적인 점막에서도 다수의 생검을 시행해야 하며, 때로는 침습적인 생검이 필요할 때도 있다. 특수한 생검 방법으로는 비후된 주름이나 용종 같은 종괴에 대해서는 올가미를 이용한 조직 생검(snare biopsy), 편평하거나 단단한 병변의 경우 식염수를 주입하여 점막을 절제하는 방법(saline-assisted endoscopic mucosal resection, EMR), 점막 깊이 위치한 병변의 경우 점보 생검(jumbo biopsy)을 하는 방법이 있다. 특히 EMR은 일반적인조직 생검으로 진단되지 않는 경우 큰 조직을 얻을 수 있어 조직 진단을 향상시킬 수 있다. 또한 H. pylori 제균 치료에 반응이 없거나 H. pylori 음성인 점막국한 병변은 EMR로 치료될 수 있다[2,12]. 일단 조직학적 진단이 되면 병변의 모양과 분포(gastric mapping)를 파악하기 위해 두 번째 내시경을 시행하여 의심되는 병변에서 8-12개의 조직 생검을 하고 H. pylori 유무를 확인하는 조직 생검을 포함, 추가로 육안적으로 의심되지 않은 전정부, 체부, 기저부에서 각각 생검을 시행한다[13-15].
H. pylori 진단은 MALT 림프종에서 H. pylori는 병변점막에 불규칙적인 분포를 보이므로 검사법에 따라 진단율의 차이를 보인다. 일부 연구에서 H. pylori 음성 MALT 림프종에서 제균을 시행하면 MALT 림프종의 관해를 보고하고 있어 MALT 림프종 진단 시 H. pylori에 대한 적극적인 진단이 요구되며 침습적인 검사법인 신속요소분해검사나 조직학적 H. pylori 진단 외 비침습적 검사인 혈청항체검사나 C13 요소호기 검사를 동시에 시행하여 감염여부를 진단하여야 한다. MALT 림프종이 진행될 수록 헬리코박터 진단율이 감소함은 다양한 연구에서 보고되었으며, 최근 보고된 메타분석에서 MALT 림프종에서 H. pylori의 감염은 저등급 MALT 림프종에서는 약 90% 이상에서 진단되지만 점막하 침윤이 있는 경우는 74%, 고등급의 MALT 림프종은 환자의 44%에서만 헬리코박터가 진단되어 침윤정도에 비례하여 진단율이 감소됨을 보여주었다[16]. 이러한 헬리코박터 감염률의 차이는 헬리코박터가 MALT 림프종 발생의 초기에만 관여하고 MALT 림프종이 진행되면서 자연 소실되었다는 가능성을 시사한다[17].
저등급 위 MALT 림프종은 조직학적으로 (1) 림프상피 병변(lymphoepithelial lesion)을 이루는 상피내 중심구 유사세포(centrocyte-like cell) (2) 점막 및 점막하 조직내 반응성 림프소절(reactive lymphoid follicle) (3) 소림프구 및 중심세포양 세포의 반점형(patchy) 침윤으로 인한 외투층(mantlezone)의 다양한 폐색(obliteration) (4) 형질세포의 현저한 침윤 등의 특징을 보인다[3,18]. 진행된 병변의 경우, 큰 중심모세포(centroblast) 양 세포가 드물게 관찰될 수 있으며, 이들이 군집을 이루거나 판상 증식을 보이는 경우는 고등급 미만성 거대 B세포 림프종으로 진단한다. 조직학적 진단은 만성위염과 위 MALT 림프종의 구별이 어려울 때가 있어 1993년 Wotherspoon 등이 제시한 기준이 널리 쓰이고 있다(Table 1)[5,19].
내시경 초음파 검사(endoscopic ultrasonography, EUS)
위 MALT 림프종이 진단되면 림프종의 병기 설정이 필요하다. 병기는 신체 검사(말초 림프절과 Waldeyer's ring), 혈액검사(complete blood count, lactate dehydrogenase [LDH], β-2-microglobulin levels, serum protein immunofixation, HIV, hepatitis C virus [HCV]와 hepaptitis B virus [HBV] 혈청 검사)와 복부, 골반, 가슴 CT 스캔을 포함해야 한다. 내시경 초음파는 위 MALT 림프종의 위벽내 침윤을 진단하는 가장 정확한 검사이다. 그 외 대장내시경을 고려해 볼 수 있고, 골수검사는 H. pylori 제균 후 림프종의 관해에 실패한 경우와 항암제 치료를 시작하기 전에 시행한다[20].
최근 내시경 초음파(EUS)는 위 MALT 림프종 환자의 진단 및 치료 방침을 결정하는 데 유용한 검사로 침윤 깊이나 국소 림프절 전이 여부를 파악할 수 있으며 민감도는 80-95%로 알려져 있다. 그 밖에도 치료 후 관해의 판정에도 유용하고 일반적인 내시경 조직검사로 적절한 조직을 얻지 못하는 경우 내시경 초음파 유도하 조직 생검으로 조직을 얻을 수 있다[2].
EUS 검사에 기초하여 위 림프종은 다음과 같이 네 가지 형태로 나눌 수 있다: 1) 표재성 병변(superficially spreading), 2) 미만 침윤형(diffusely infiltrating), 3) 종괴 형성(mass forming) 병변, 4) 혼합형 병변, 표재성 병변과 미만침윤형 병변은 저등급 MALT 림프종에서 주로 볼 수 있고, 고등급 MALT 림프종에서는 위벽전층의 침범과 림프절 증식의 특징을 보인다[2]. Extranodal 림프종의 병기체계인 Ann Arbor system은 위장관 림프종에 적용하기에는 한계가 있었다. 이에 Musshoff과 Radaszkiewicz는 1997년 Ann Arbor system을 수정하여 주위 림프절(neighbouring lymph nodes)을 침범하는 IIE 림프종과 원거리 림프절(distant lymph nodes)을 침범하는 II2E로, 1992년에는 mucosa와 submucosa (I1E)와 muscularis propria에서 serosa를 침범하는 I2E로 분류하였다. 1994년에는 Blackledge 병기체계를 수정한 ‘Lugano staging system’이 영상학적 소견에 기초하여 제안되었다. 하지만 이러한 분류체계는 내시경 초음파가 도입되기 전에 만들어진 것으로 H. pylori 제균 치료 후 MALT 림프종의 반응을 예측할 수 있는 지표인 위벽의 침윤 정도를 반영할 수는 없었다. 이후 2003년 제안된 Paris staging system (TNMB)은 적절하게 (1) depth of lymphoma infiltration, (2) lymph node infiltration and (3) lymphoma spread의 특징을 반영하고 있으며(Table 1) [4,15,20]. 내시경 초음파를 통해 I1E, I2E, II1E 또는 T1-4, N0/1과 같은 병기로 세분하여 MALT 림프종의 진단과 H. pylori 제균 치료 후 MALT 림프종의 치료반응을 예측하는 데 도움이 된다[2,18]. 하지만 MALT 림프종의 치료 후 추적관찰 시 EUS의 필요성에 대해서는 논란이 있다. 이는 비후된 위벽의 정상화가 조직학적 관해 이후에 천천히 일어나고, 또 한편으로는 조직학적으로 병변이 남아있음에도 불구하고 EUS에서는 정상화를 보이는 경우가 드물게 있기 때문이다[2,15].
치료 및 추적관찰
저 등급 위 MALT 림프종에서는 H. pylori 제균 요법이 우선적인 치료방법이다[4]. 대부분의 연구에서 국소적인 병변을 가진 경우 제균 치료 후 완전 관해율이 60-90% 정도로 알려져 있으며, 제균 치료 후 완전 관해에 이르는 기간은 평균 4-6개월 정도로 알려져 있다. 헬리코박터 음성인 MALT 림프종의 경우도 먼저 H. pylori 제균 치료를 권고하는 데 이는 헬리코박터 감염을 진단 당시 놓쳤을 가능성과 그 밖에 다른 헬리코박터 균종 H. heilmannii과 같은 다른 균종이 있을 수 있기 때문이다. 제균 후에도 10% 내외의 환자에서 재발을 경험하는데 이는 아마도 H. pylori 재감염과 관련있을 것으로 보인다.
항생제 치료에 반응하지 않는 경우는 H. pylori에 음성, t (11;18)(q21;q21)양성, 림프절 침범을 들 수 있다[20,21]. 이렇게 제균 치료에 반응하지 않거나 내시경에서 병변이 지속되는 경우, 병변이 진행하는 경우에는 방사선 치료 단독, rituximab 또는 항암치료와 같은 치료가 필요하다[4,22].
위 MALT 림프종에서 H. pylori 제균치료의 효과가 알려지기 이전에는 수술이 주요 치료였고, 국소적인 병변을 가질 경우에는 장기간 생존율은 75-97%로 좋은 결과를 보였다. 하지만 병소의 위치가 다발성일 가능성이 있어 위 전절제술을 시행해야 하고 이로 인해 지속적인 영양상태나 대사에 영향을 줄 수 있는 제한점이 있다. 최근 위절제술은 천공이나 출혈과 같은 드문 합병증이 있는 경우에만 제한적으로 시행하고 있다.
H. pylori 제균 요법 후에 적어도 4주 이후에 요소호기 검사나 대변 항원 검사로 H. pylori 제균 여부를 확인하는 것이 필요하다. 그리고 정기적인 내시경적 추적관리가 권고되는데, 림프종 관해 여부에 대한 첫 검사는 치료 후 3-6개월에 시행한다. 이후 임상적 그리고 조직학적으로 완전 관해를 보일 때까지 매 4-6개월마다 추적관찰을 한다. 완전 관해가 되면 내시경으로 관찰 시 대개 백색 또는 퇴색상의 점막변화와 위축을 보이는데 병변이 육안적으로 완전 관해에 이루었더라도 조직검사에서 잔존 종양이 남아 있거나, PCR 검사에서 잔존 종양이 확인되는 경우가 있으므로 반드시 다수의 조직 검사(mapping)를 시행하여야 한다[8,11,18,23]. 치료 후 조직검사는 이전 생검을 검토하는 맥락에서 이루어져야 하며 cellular infiltrate, lymphoepithelial lesions와 stromal changes에 대한 평가가 필요하다. 처음 진단 시에는 Wotherspoon's score가 유용하나 추적관찰 시에는 GELA (Groupe d'Etude des Lymphomes de l'Adult)에서 제안된 분류체계가 추천된다. 이 분류체계에서는 complete histological response (CR), probable minimal residual disease (pMRD), responding residual disease (rRD) and no change (NC)로 4개의 형태학적 분류를 하고있다[20].
H. pylori 제균 후 완전 관해는 주로 6-12개월 내에 이루어지지만 드물게 24-72개월까지 걸리는 경우도 있다. 완전 관해는 두 번의 연속된 추적관찰에서 확인되어야 하는데 이는 조직 생검 시 샘플링 에러의 가능성이 있기 때문이다. 부분 관해를 보이는 경우 환자 개개인의 특성에 따라 치료한다. 위 MALT 림프종은 원거리 전이나 조직학적 변형은 적은 편이나, 일시적인 조직학적 재발이 가능할 수 있는데, 특히 H. pylori 재감염이 없는 경우에는 저절로 호전된다. 따라서 안정적인 잔류 병변이 있거나 원격 전이나 육안적 내시경적 병변이 없이 조직학적으로 미세한 병변이 재발했을 때 추적 관찰하면서 기다려 보는 것(watch and-wait strategy)도 안전하다고 보고되었다[24-26]. 안정 병변을 보일 때에는 육안적으로 병변이 지속되는 경우 다른 이차적인 치료를 하고, 육안적으로는 보이지 않고 조직학적으로 미세한 침윤(rRD와 NC)만 있다면 H. pylori 제균이 이루어 질 때까지 24개월 정도 다른 치료를 연기해 볼 수 있다. 하지만 좀 더 진행된 병기이거나 위 주위 림프절의 침범, 고등급 림프종으로의 변형이 의심되는 경우, H. pylori 감염이 음성, t (11;18)(q21;q21) 양성인 경우에는 H. pylori 제균 요법에 반응하지 않는 경우가 많아 이러한 ‘watch and wait’ 기간은 짧아질 수 있다. 한편, 진행성 병변을 보이는 환자에서는 다른 종양학적 치료를 시행하고, 재발했지만 뚜렷한 내시경적 또는 임상적 징후가 없는 경우에는 추적관찰하면서 기다려보는 ‘watch and wait’전략을 써 볼 수 있다. 그 외 재발의 경우는 종양학적 치료를 시행한다(Fig. 2).
결 론
위 MALT 림프종은 위에서 발생하는 드문 종양이다. 병인은 H. pylori 감염과 밀접한 연관이 있어 저 등급 위 MALT 림프종에서 H. pylori 제균 요법만으로도 대다수에서 관해가 될 수 있다. 환자들의 증상과 내시경 소견이 비특이적이고 다양하여 초기 진단에 어려움이 있으므로 다수의 조직검사가 진단에 필수적이다. 내시경초음파는 위 MALT 림프종의 진단과, 병기 결정에 중요한 검사로 내시경에서 정상 점막으로 보이는 부분의 종양의 침윤 범위와 깊이, 림프절 전이여부, 치료 반응을 예측하는 데 도움이 된다. 하지만 치료 후 관해 여부나 재발 여부를 보기 위한 추적 검사로는 제한점이 있다. 위 MALT 림프종은 H. pylori 제균요법 후 3-6개월에 추적관찰을 시행하고 이후에는 임상적 그리고 조직학적으로 완전 관해를 보일 때까지 매 4-6개월마다 추적관찰을 한다. 완전 관해에 이른 경우에는 6개월 및 이후 1년마다 추적 내시경을 시행하는 것을 추천한다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






