ى„œ ë،
급ى„± Bيک• ê°گى—¼ىک ىگى—°ê²½ê³¼ى—گى„œ ë°”ى´ëں¬ىٹ¤ى—گ ë…¸ى¶œëگœ ي›„ ى‹œê°„ى´ ى§€ë‚کë©´ ي‘œë©´ ي•ى›گى€ ىŒى „ëگکê³ ي‘œë©´ي•ى›گى—گ 대ي•œ ى¤‘ي™”ي•ى²´ê°€ ىƒى„±ëگکëٹ” 것ى´ ى¼ë°کى پى´ë‹¤. ê·¸ëں¬ë‚ک ى¼ë¶€ 급ى„± Bيک• ê°„ى—¼ى—گى„œëٹ” ي‘œë©´ي•ى›گى€ ى†Œى‹¤ëگکى—ˆىœ¼ë‚ک يکˆى•، ëکگëٹ” ê°„ى،°ى§پى—گى„œ HBV DNAê°€ ى €ë†چëڈ„ë،œ ê²€ى¶œëگک기ëڈ„ ي•کëٹ”ëچ°, ى´ë¥¼ ى ى¬ê°گى—¼(occult HBV infection)ى´ë¼ ي•œë‹¤. Bيک• ê°„ى—¼ ë°”ى´ëں¬ىٹ¤ى—گ ىکي•œ ى ى¬ê°گى—¼ى€ 1978ë…„ى—گ ى²کىŒىœ¼ë،œ ى†Œê°œëگکى—ˆىœ¼ë©°, PCR법ىک ë°œى „ىœ¼ë،œ ê·¹ى†Œëں‰ىک HBV DNAëڈ„ ê²€ى¶œي• ىˆک ىˆê²Œ ëگکى–´ ى ى¬ê°گى—¼ىک ى§„단ى´ ىڑ©ى´ي•ک게 ëگکى—ˆë‹¤. ى ى¬ ê°گى—¼ ىگى²´ىک ى„ىƒپى پ ىک미ëٹ” يپ¬ى§€ ى•ٹىœ¼ë‚ک ىˆکيکˆê³¼ ى¥ê¸°ى´ى‹ ê°™ى€ ىƒپي™©ى—گى„œ ê³µى—¬ىگى—گ게 ى „ى—¼ëگ ىˆک ىˆىŒى´ ى•Œë ¤ى،Œë‹¤. ëکگي•œ ي•ى•”ى¹ک료ى™€ ë©´ى— ى–µى œى œ ى‚¬ىڑ©ê³¼ ى—°ê´€ëگکى–´ ë°”ى´ëں¬ىٹ¤ىک ى¬ي™œى„±ي™”ë،œ ى¸ي•´ ى‹¬ê°پي•œ 결과를 ى´ˆëکي• ىˆک ىˆىŒى´ ë³´ê³ ëگکى—ˆë‹¤. ىµœê·¼ى—گëٹ” rituximab 등ىک ىƒë¬¼ي•™ى œى œىک ى‚¬ىڑ©ى´ ë§ژى•„ى§گى—گ ë”°ë¼ ى ى¬ ê°گى—¼ىک ى¬ي™œى„±ي™”ê°€ ى„ىƒپى پىœ¼ë،œ ë§ژى€ 문ى œê°€ ëگکê³ ىˆë‹¤.
Hui 등[1]ى€ ى ى¬ê°گى—¼ىک ى¬ي™œى„±ي™” ê³¼ى •ى€ HBV DNAê°€ ىƒپىٹ¹ëگœ ي›„ ي‘œë©´ ي•ى›گىک ى¬ى–‘ى „ى´ ى´ë£¨ى–´ى§€ê³ ê·¸ 다ىŒى—گ ê°„ى—¼ى´ ىƒê¸°ê²Œ ëگœë‹¤ê³ ë³´ê³ ي•کىک€ë‹¤. ى•„ى§پ까ى§€ ى ى¬ ê°گى—¼ىک ى¬ي™œى„±ي™”ى—گ 대ي•œ يڑچى¼ى پى¸ ى •ىکëٹ” ى—†ى§€ë§Œ, ى¼ë°کى پىœ¼ë،œ ى ى¬ ê°گى—¼ى—گى„œ ى¬ي™œى„±ي™”ëٹ” ALTê°€ ى •ىƒپىƒپي•œى¹کىک 3ë°° ى´ىƒپىœ¼ë،œ ى¦ê°€ي•کë©´ى„œ, HBV DNAىک ىˆکى¹کê°€ ى´ى „보다 10ë°° ى¦ê°€ي•کê±°ë‚ک 105 copies/mL ى´ىƒپى¼ ê²½ىڑ°ë،œ ى •ىکëگœë‹¤[2]. يک„ى¬ê¹Œى§€ ى ى¬ê°گى—¼ى—گى„œ Bيک• ë°”ى´ëں¬ىٹ¤ى—گ ىکي•´ ê°„ى—¼ى´ ىƒê¸´ ى¦ë،€ë“¤ى€ ëھ¨ë‘گ HBV DNAê°€ 105 copies/mL ى´ىƒپى´ى—ˆىœ¼ë©°, ي‘œë©´ ي•ى›گى´ ى¬ى–‘ى „ëگœ 것ىœ¼ë،œ, ى¬ي™œى„±ي™”ى—گ ىکي•œ 것ى´ى—ˆë‹¤. 다만 ي•œ ى¦ë،€ى—گى„œ ي‘œë©´ ي•ى›گى´ ى¬ى–‘ى „ëگکى§€ ى•ٹى•کى§€ë§Œ, ى´ê²ƒى€ ي‘œë©´ ي•ى›گىک ë³€ى´ى—گ ىکي•œ 것ىœ¼ë،œ ى¶”ى •ëگکê³ ىˆë‹¤[3].
ى ى¬ê°گى—¼ ىگى²´ê°€ ê°€ى§€ëٹ” ى„ىƒپى پ ىک미ى—گ 대ي•´ى„œëٹ” ى•Œë ¤ى§„ 바가 ى پ다. ëکگي•œ ي‘œë©´ ي•ى›گىک ى¬ي™œى„±ي™” ى—†ى´ ê°„ى§ˆي™کىک ى§„ي–‰ ëکگëٹ” 급ى„± ê°„ى—¼ى„ ىœ ë°œى‹œي‚¨ ىکˆëٹ” ى „ ى„¸ê³„ى پىœ¼ë،œ ë°œي‘œëگœ ى پى´ ى—†ë‹¤. 본 ى¦ë،€ëٹ” HBsAg ىŒى„±/anti-HBs Abى™€ anti-HBcAb ى–‘ى„±ى¸ 미만ى„± 거대Bى„¸يڈ¬ë¦¼ي”„ى¢… ي™کىگى—گى„œ R-CHOP ى‹œي–‰ ي›„ ى¬ي™œى„±ي™”ى—†ى´ ى ى¬ê°گى—¼ى—گ ىکي•œ Bيک• ê°„ى—¼ 급ى„± ى•…ي™”ë،œ ى¹ک료ي•œ ى¦ë،€ê°€ ىˆê¸°ى—گ ë³´ê³ ي•کëٹ” ë°”ى´ë‹¤.
ى¦ ë،€
56ى„¸ ى—¬ىگë،œ ي•œ 달 ى „부ي„° ى‹œى‘ëگœ ى‹ىڑ•ë¶€ى§„ى„ ى£¼ى†Œë،œ ى™¸ëک 방문ي•کىک€ë‹¤. ي™کىگëٹ” 8ë…„ ى „ 당뇨 ى§„단 ي›„ Nateglinide 360 mg, Metformin 1,500 mg ë³µىڑ© ى¤‘ى´ë©° 2ë…„ ى „ 미만ى„± 거대Bى„¸يڈ¬ë¦¼ي”„ى¢… ى§„단 ي›„ rituximabى„ يڈ¬ي•¨ي•œ cyclophosphamide, doxorubicin, vincristine, prednisoloneىک ي•ى•”ى¹ک료를 8ى°¨ê¹Œى§€ ى‹œي–‰ ي›„ 14ê°œى›” ى „ى—گ ى™„ى „ê´€ي•´ ىƒپيƒœى—گ ى´ë¥´ëں¬ ي•ى•” ى¹ک료 ى—†ى´ يکˆى•،ى¢…ى–‘ ë‚´ê³¼ ى™¸ëک를 ي†µي•´ ى¶”ى پê´€ى°°ي•کëچک ى¤‘ى´ى—ˆë‹¤. 1ê°œى›” ى „부ي„° ى‹ىڑ•ë¶€ى§„ى´ ىˆىœ¼ë©´ى„œ ë‚´ى›گ 3ى¼ ى „부ي„° 구ى—ê°گى´ ىˆى–´ ى‘급ى‹¤ ي†µي•´ ى…ى›گي•کىک€ë‹¤.
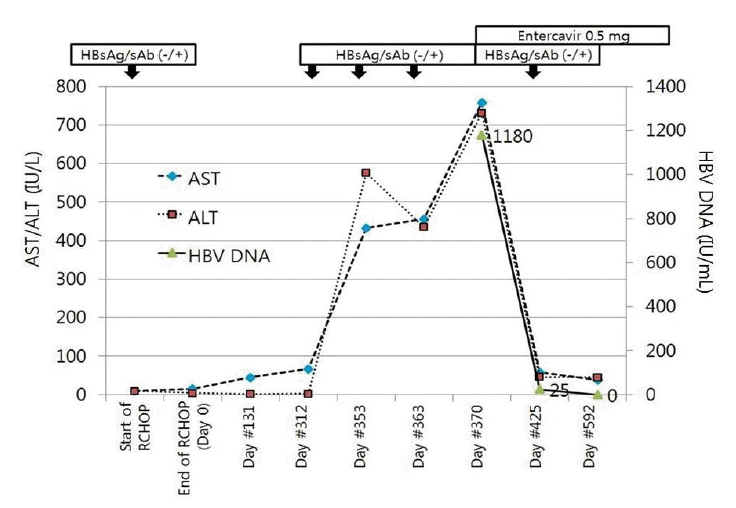
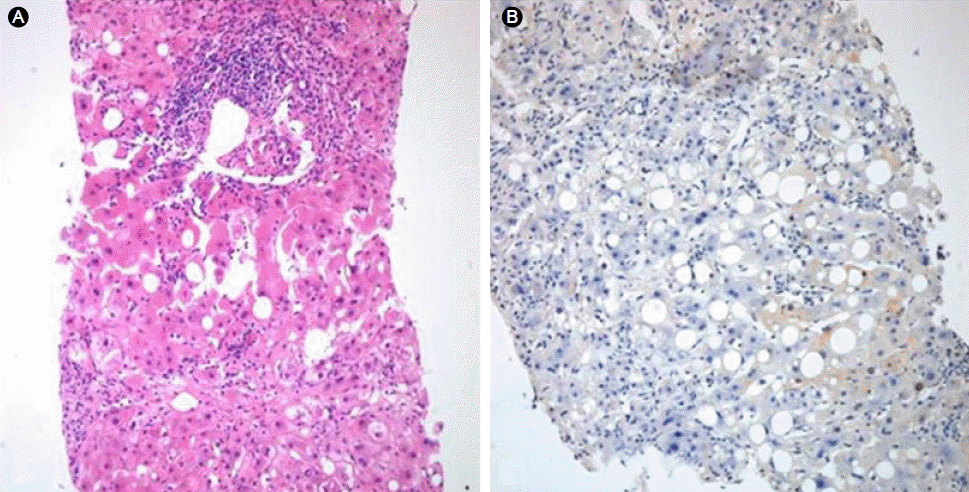
ىŒى£¼ë ¥ى€ ى—†ى—ˆىœ¼ë©° ë‚´ى›گ 3ê°œى›” ى´ë‚´ى—گ ي•œى•½ى´ë‚ک ê±´ê°•ë³´ى،°ى‹ي’ˆ 등 ê°„ى—¼ى¦ ىˆکى¹ک를 ىƒپىٹ¹ى‹œي‚¬ ىˆک ىˆëٹ” ى•½ë¬¼ى„ ë³µىڑ©ي•کى§€ ى•ٹى•ک다. 2009ë…„ 미만ى„± 거대Bى„¸يڈ¬ë¦¼ي”„ى¢… ى§„단 당ى‹œ ي•ى•”ى¹ک료 ي›„ ىƒê¸´ 빈يکˆى„ êµگى •ي•ک기 ىœ„ي•´ ىˆکيکˆي•œ ى´ي›„ë،œ ىˆکيکˆë°›ى§€ ى•ٹى•ک다. ë‚´ى›گ 당ى‹œ ي™œë ¥ى§•ي›„ëٹ” ى •ىƒپى´ى—ˆىœ¼ë©° ى‹ ى²´ê²€ى§„ى—گى„œ ى´ىƒپ ى†Œê²¬ى€ 발견ëگکى§€ ى•ٹى•ک다. ë‚´ى›گ 당ى‹œ ى‹œي–‰ي•œ ىƒي™”ي•™ê²€ى‚¬ى—گى„œ alkaline phosphatase 163 IU/L, AST 433 IU/L, ALT 576 IU/Lë،œ ىƒپىٹ¹ëگکى–´ ىˆى—ˆë‹¤. يکˆى² 빌리루빈ى€ ى •ىƒپى´ê³ ى‹œي–‰ي•œ 복부 ى „ى‚°ي™”단ى¸µى´¬ىکپى€ ى •ىƒپى´ى—ˆë‹¤. Bيک• ê°„ى—¼ى—گ 대ي•œ ê²€ى‚¬ى—گى„œ HBsAg (Rocheى‚¬ىک ى „기ي™”ي•™ë°œê´‘ë©´ى—분ى„법[electrochemiluminescence immunoassay]를 ى‚¬ىڑ©ي•کىک€ê³ 민ê°گëڈ„ 99.9%ى´ë‹¤.) ىŒى„±, HBsAb ى–‘ى„±, IgG-HBcAb ى–‘ى„±ى´ى—ˆë‹¤. HBVى—گ 대ي•œ ê°€ى،±ë ¥ى€ ى—†ى—ˆë‹¤. IgM-HAV ىŒى„±, HCV Ab ىŒى„±, HCV-RNA PCR ىŒى„±ى´ى—ˆë‹¤. ى—،ىٹ¤ي…Œى¸-바바ى´ëں¬ىٹ¤ ë°ڈ 거대ى„¸يڈ¬ë°”ى´ëں¬ىٹ¤ê²€ى‚¬ëڈ„ ëکگي•œ ىŒى„±ى´ى—ˆë‹¤. Anti-Nuclear Antibody 1:40 anti-smooth muscle antibody ىŒى„±, liver kidney microsomal-1 ىŒى„±ىœ¼ë،œ ىگê°€ ë©´ى—ê°„ى—¼ى„ ى‹œى‚¬ي• 만ي•œ ى†Œê²¬ ë³´ى´ى§€ ى•ٹى•ک다. ë³µىڑ©ي•کê³ ىˆëچک 경구 يکˆë‹¹ ê°•ي•کى œى—گ ىکي•œ ëڈ…ى„± ê°„ى—¼ ê°€ëٹ¥ى„±ى„ ê³ ë ¤ي•کى—¬ 경구 يکˆë‹¹ê°•ي™”ى œëڈ„ ëھ¨ë‘گ ى¤‘ى§€ي•کىک€ىœ¼ë‚ک ASTى™€ ALTëٹ” يک¸ى „ëگکى§€ ى•ٹى•ک다. ى›گى¸ 미ىƒپىک ê°„ى—¼ىœ¼ë،œ يکˆى•،ى¢…ى–‘ë‚´ê³¼ى—گ ى…ى›گي•کى—¬ ê°„ ى،°ى§پ ê²€ى‚¬ ى‹œي–‰ي•کىک€ê³ ى¤‘등ëڈ„ ى†Œى—½ي™œى„±ëڈ„ ë°ڈ ى¤‘등ëڈ„ 문맥-문맥ى£¼ىœ„ ي™œى„±ëڈ„ى™€ ى„¸يڈ¬ ى£¼ىœ„ ى„¬ىœ ي™”ى†Œê²¬ى„ ë³´ى´ëٹ” 만ى„± ê°„ى—¼ى†Œê²¬ى„ ë³´ى´ê³ ىˆى—ˆë‹¤(Fig. 2A). ى،°ى§پ ىƒê²€ ى´ي›„ى—گëڈ„ ê°„ ى—¼ى¦ىˆکى¹کëٹ” ىƒپىٹ¹ي•کىک€ىœ¼ë©° ALT 731 U/L, AST 758 U/L, يکˆى² 빌리루빈 0.8 mg/dL, prothrombin time 86%(INR 1.13)ë،œ 다ى‹œ ê°„ ى—¼ى¦ ىˆکى¹کê°€ ىƒپىٹ¹ي•کى—¬ ى†Œي™”기 ë‚´ê³¼ë،œ ى „ê³¼ëگکى—ˆë‹¤.
ى „ê³¼ëگک기 16ê°œى›” ى „, 미만ى„± 거대Bى„¸يڈ¬ ى§„단 당ى‹œى—گëٹ” ASTëٹ” 10 IU/L, ALTëٹ” 10 IU/Lë،œ ى •ىƒپ ë²”ىœ„ىک€ىœ¼ë©° HBsAg ىŒى„±, Anti-HBs ى–‘ى„±(17.6 mIU/mL), IgG anti-HBcAb ى–‘ى„±ىœ¼ë،œ Bيک• ê°„ى—¼ى—گى„œ يڑŒë³µëگœ ىƒپيƒœë¥¼ ë³´ىک€ë‹¤. ى†Œي™”기 ë‚´ê³¼ë،œ ى „ê³¼ëگœ ي›„ 다ى‹œ ى‹œي–‰ي•œ HBsAgى€ ىŒى„±, Anti-HBs ىŒى„±, IgG anti-HBcAb ى–‘ى„±ى´ى—ˆë‹¤.
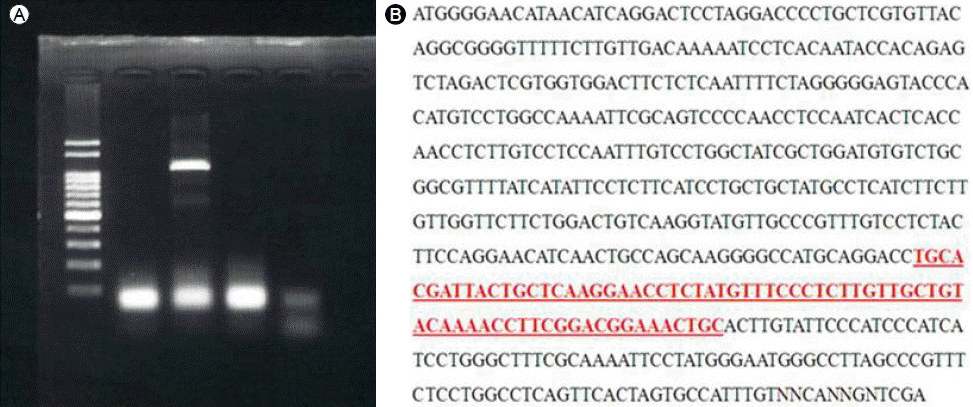
يکˆى² HBV DNAëٹ” 1,180 IU/mLىک€ë‹¤(HBV DNA ê²€ى‚¬ëٹ” COBAS ampliPrep/COBAS taqman HBV test version 2.0ى„ ى‚¬ىڑ©ي•کىک€ë‹¤). ëکگي•œ HBeAgى€ ى–‘ى„±, HBeAbëٹ” ىŒى„±, HBcAb IgM ى–‘ى„±ىœ¼ë،œ ê´€ى°°ëگکى–´ ى ى¬ ê°گى—¼ى—گ ىکي•œ 급ى„± ى•…ي™”ë،œ يŒگ단ي•کê³ ي•ë°”ى´ëں¬ىٹ¤ى œ ى‚¬ىڑ©ى„ ى‹œى‘ي•کىک€ë‹¤. ëکگي•œ Sىœ ى „ىگ ë³€ى´ى—گ ىکي•œ HBsAg ىŒى„± ê°„ى—¼ىک ê°€ëٹ¥ى„±ى„ ë°°ى œي•ک기 ىœ„ي•کى—¬ Sىœ ى „ىگى—گ 대ي•کى—¬ ى§پى ‘ ى—¼ê¸°ى„œى—´ë¶„ى„ى„ ى‹œي–‰ي•کىک€ىœ¼ë‚ک Sىœ ى „ىگىک ى£¼ىڑ” ê²°ى •ê¸° 부ىœ„(major determinant region)ى—گ ë³€ى´ëٹ” ê´€ى°°ëگکى§€ ى•ٹى•کê³ Pre-S 부ىœ„ىک ëڈŒى—°ë³€ى´ëڈ„ ê´€ى°°ëگکى§€ ى•ٹى•ک다(Fig. 3). ê°„ى،°ى§پ ê²€ى‚¬ى—گى„œëٹ” HBeAg ë°ڈ HBcAgى—گ 대ي•œ ى—¼ىƒ‰ى—گ ى•½ى–‘ى„± ë°کى‘ى„ ë³´ىک€ë‹¤. HBV ى ى¬ ê°گى—¼ى¸ ىƒپيƒœى—گى„œ 급ى„± ê°„ى—¼ى´ë¼ ى§„단ي•کىک€ê³ ى—”ي…Œى¹´ë¹„ى–´ 0.5 mg ى¹ک료 ى‹œى‘ي•کىک€ë‹¤. ى¹ک료 ى‹œى‘ ي›„ 2ê°œى›” ي›„ ASTëٹ” 58 IU/L, ALTëٹ” 46 IU/Lë،œ ê°گى†Œëگکى—ˆê³ , HBV DNAëٹ” 25.6 IU/mLىک€ىœ¼ë©° Anti-HBs ى–‘ى„±(32.1 mIU/mL)ى´ëگکى—ˆë‹¤. ى¹ک료 ى‹œى‘ 6ê°œى›” ي›„ AST/ALTëٹ” ى •ىƒپë²”ىœ„ê°€ ëگکى—ˆê³ HBeAgى€ ىŒى„±, HBeAbëٹ” ى–‘ى„±ى´ى—ˆë‹¤. ى‹œي–‰ي•œ HBV DNAëٹ” ى¸،ى • ë²”ىœ„ ى´ي•ک(< 20 IU/mL)ىک€ë‹¤.
ê³ ى°°
ى ى¬ê°گى—¼ىک ى •ىکëٹ” HBsAgى´ ىŒى„±ى´ë©´ى„œ ى پى€ ى–‘ىک HBV DNAê°€ ê°„ى´ë‚ک يکˆى²ى—گى„œ ê²€ى¶œëگکëٹ” 것ى„ ë§گي•œë‹¤. ê·¸ëں¬ë‚ک HBV DNA ىˆکى¹کىک ىƒپي•œى¹کëٹ” ى—°êµ¬ىگ들ى—گ ë”°ë¼ ى´ê²¬ى´ ىˆëٹ” ىƒپي™©ى´ë‹¤. Allain [4]ى€ 104 IU/mL 미만ى„ 기ى¤€ىœ¼ë،œ ى œى‹œي•کىک€ىœ¼ë©°, Raimondo 등[5]ى€ 200 IU/mL 미만ى„ ىƒپي•œى„ ىœ¼ë،œ ى œى•ˆي•کىک€ë‹¤. Allainىک 기ى¤€ى—گ 따르면 본 ى¦ë،€ëٹ” ى ى¬ê°گى—¼ى—گ ي•´ë‹¹ي•کى§€ë§Œ Raimondoىک ى œى•ˆى—گ 따르면 HBV DNAىک ىˆکى¹کê°€ ىƒپي•œى„ ى„ ë„کى–´ى„ 다. ي•کى§€ë§Œ ى•„ى§پ까ى§€ ى´ëں¬ي•œ 기ى¤€ë“¤ى—گ 대ي•œ ى¼ë°کى پى¸ ي•©ىکëٹ” ى—†ëٹ” ى‹¤ى •ى´ë‹¤.
ى—¬ëں¬ ê°€ى§€ ىƒپي™©ى—گى„œىک ى ى¬ê°گى—¼ىک ى„ىƒپى پ ىک미ى—گ 대ي•´ى„œëٹ” ë§ژى´ ى•Œë ¤ى ¸ ىˆى§€ë§Œ, ى ى¬ ê°گى—¼ ىگى²´ىک ى„ىƒپى پ ى¤‘ىڑ”ى„±ى—گ 대ي•´ى„œëٹ” ى—°êµ¬ëگœ 바가 ى پ다. ى ى¬ ê°گى—¼ى´ ىˆëٹ” ي™کىگى—گى„œ ê°„ى„¸يڈ¬ ى•”ىک ë°œىƒى´ ë§ژى•„ى§„다ëٹ” ë³´ê³ ê°€ ىˆى—ˆى§€ë§Œ, ê·¸ 기ى „ى€ ëھ…ي™•ي•کى§€ ى•ٹ다. ى ى¬ê°گى—¼ى—گى„œ ى„ىƒپى پىœ¼ë،œ ê°€ى¥ 문ى œê°€ ëگکëٹ” 부분ى€ ي•ى•”ى¹ک료 ى´ي›„ىک ë°”ى´ëں¬ىٹ¤ىک ى¬ي™œى„±ي™”ë،œ ى¸ي•œ ê°„ى—¼ى´ë‹¤. ىµœê·¼ 들ى–´ rituximabê³¼ ى—°ê´€ëگœ ى¬ي™œى„±ي™”ê°€ ىˆک ى°¨ë،€ ë³´ê³ ëگکê³ ىˆë‹¤. Rituximabى€ ى •ىƒپ ë°ڈ ى•…ى„± B림ي”„구ىک ي‘œë©´ى—گى„œ 발견ëگکëٹ” CD20ي•ى›گى—گ 대ي•œ 단يپ´ë، ي•ى²´ë،œ B림ي”„구ى—گ ىœ„ى¹کي•œ ى†Œىˆکى„± ي•ى›گ CD20ê³¼ يٹ¹ى´ى پىœ¼ë،œ ê²°ي•©ي•کى—¬ ي•ى›گ ى–‘ى„± ى„¸يڈ¬ىک ىڑ©ي•´ë¥¼ ى¼ىœ¼ي‚¨ë‹¤[6]. B림ي”„구ëٹ” ي•ى›گ ى „달 ى„¸يڈ¬ىک ى—ي• ى„ ي•کë©° ى„¸يڈ¬ëڈ…ى„± T림ي”„구를 ى¤€ë¹„ى‹œى¼œ HBVى—گ ê°گى—¼ëگœ ê°„ى„¸يڈ¬ë¥¼ ى£½ى´ëٹ” ëچ° ëڈ„ى›€ى„ ى¤€ë‹¤. Rituximabى€ ë°”ى´ëں¬ىٹ¤ى—گ 대ي•œ ë©´ى— ë°کى‘ى„ ى–µى œى‹œى¼œ ë°”ى´ëں¬ىٹ¤ê°€ ى¦ى‹ى´ ëگکê³ ê·¸ ى´ي›„ى—گ ë©´ى—ë°کى‘ى´ يڑŒë³µëگکë©´ ê°„ى—¼ى´ ë°œىƒي•ک게 ëگœë‹¤. ى ى¬ ê°گى—¼ىک ى¬ي™œى„±ي™”ى—گ ىکي•œ ê°گى—¼ى€ 대부분ى€ ى¹ک료 ى¢…료ى‹œى گى—گى„œ 3-10ê°œى›” ى‚¬ى´ى—گ ë°œىƒي•کىک€ë‹¤. 본 ى¦ë،€ى—گى„œëٹ” ى¹ک료ى¢…료 14ê°œى›”만ى—گ ê°„ى—¼ى´ ىƒê²¼ى§€ë§Œ, rituximabىک ë©´ى—ى–µى œيڑ¨ê³¼ê°€ 9ê°œى›”ى—گى„œ 12ê°œى›”까ى§€ ى§€ى†چëگکë©°[7], HBsAg ى–‘ى„± ë³´ê· ىگى—گى„œىک ى¬ي™œى„±ي™”ê°€ ى¹ک료 ى¢…료 ىˆک년까ى§€ ë³´ê³ ëگکê³ ىˆى–´, rituximabê³¼ ê°„ى—¼ë°œىƒىک ى—°ê´€ى„±ى´ ىˆىŒى„ ى‹œى‚¬ي•کê³ ىˆë‹¤. ي•œيژ¸ Raimondo 등[5]ى€ ë°”ى´ëں¬ىٹ¤ ي•ى›گى—گ 대ي•œ ي•ى²´ê°€ ىˆëٹ” ى‚¬ëŒى´ ë©´ى—ى–µى œى¹ک료를 ë°›ى•کى„ ê²½ىڑ° ىˆکê°œى›”ى—گى„œ ىˆک년까ى§€ ى¶”ى پê´€ى°°ي• 것ى„ 권ىœ ي•کىک€ë‹¤.
يک„ى¬ê¹Œى§€ ë°œي‘œëگœ 다른 ى¦ë،€ë“¤ê³¼ 비êµگي•کى—¬ ë³¼ ë•Œ 본 ى¦ë،€ىک ê°€ى¥ يپ° ى°¨ى´ى گى€ ى ى¬ê°گى—¼ىک ى¬ي™œى„±ي™”ê°€ ى´ë£¨ى–´ى§€ى§€ ى•ٹى•کىŒى—گëڈ„, ى ى¬ ê°گى—¼ ىگى²´ê°€ ê°„ى—¼ى„ ى¼ىœ¼ى¼°ë‹¤ëٹ” 것ى´ë‹¤. ى´ë²ˆ ى¦ë،€ى—گى„œ ى ى¬ê°گى—¼ ىگى²´ ىکي•œ ê°گى—¼ى„ ى‹œى‚¬ي•کëٹ” ëھ‡ ê°œىک 근거가 ىˆë‹¤. ى²« 번ى§¸ë،œ ي™کىگى—گى„œ ى•Œى½”ىک¬ى„±ê°„ى—¼, ëڈ…ى„±ê°„ى—¼, 다른 ë°”ى´ëں¬ىٹ¤ ê°„ى—¼, ىگ가면ى—ê°„ى—¼ 등 다른 ê°„ى—¼ىک ê°€ëٹ¥ى„±ى´ ë°°ى œëگکى—ˆë‹¤. ë‘گ 번ى§¸ë،œ ê°„ى،°ى§پىک HBeAg ë°ڈ HBcAgى—گ ى–‘ى„±ى„ ë³´ى´ëٹ”ëچ°, ى´ëٹ” ê°„ ى„¸يڈ¬ى•ˆى—گى„œ ê°„ى—¼ ë°”ى´ëں¬ىٹ¤ىک ى¦ى‹ى„ ê°„ى ‘ى پىœ¼ë،œ ë³´ى—¬ى¤€ë‹¤. ى„¸ 번ى§¸ë،œ ي•ë°”ى´ëں¬ىٹ¤ى œىک ى‚¬ىڑ© ى´ي›„ HBV DNAê°€ ê°گى†Œي•کىک€ىœ¼ë©°, ى´ى™€ ëڈ™ë°کëگکى–´ AST/ALTê°€ ى •ىƒپي™”ëگکى—ˆë‹¤ëٹ” ى گى´ë‹¤. ى ى¬ê°گى—¼ ىگى²´ىک ê°„ى—¼ى„ ى„¤ëھ…ي• 만ي•œ 기ى „ىœ¼ë،œëٹ” ê°„ ى„¸يڈ¬ë‚´ىک ë°”ى´ëں¬ىٹ¤ ي™œى„±ëڈ„ëٹ” ê°„ى—¼ى„ ى¼ىœ¼ي‚¤ê¸°ى—گ ى¶©ë¶„ي•کى§€ë§Œ HBsAgىک ى„¸يڈ¬ ë°–ىœ¼ë،œىک ë°°ى¶œى´ ىڑ©ى´ي•کى§€ ى•ٹى•„ ىƒê¸¸ ىˆک ىˆë‹¤. ê·¸ ي•œ ىکˆë،œ Bruss 등ى€ pre-S 부분ىک ë³€يک•ى´ ë°”ى´ëں¬ىٹ¤ىک ë°°ى¶œى„ ى œي•œي• ىˆک ىˆىŒى„ ى¦ëھ…ي•کىک€ë‹¤[8].
ى ى¬ê°گى—¼ىک ى¬ي™œى„±ي™”ىک ى¦ë،€ë“¤ى„ ى‚´يژ´ë³´ë©´, HBsAgىک ى¬ى–‘ى „ى´ ëڈ™ë°کëگکى§€ ى•ٹëٹ” ê²½ىڑ°ê°€ ىˆى—ˆëٹ”ëچ°, Sىœ ى „ىگىک ë³€ى´ى—گ ىکي•´ ى¼ë°کى پى¸ HBsAgىک ê²€ى‚¬ë،œëٹ” ى¸،ى •ëگکى§€ ى•ٹëٹ” ى¦ë،€ë“¤ى´ى—ˆë‹¤. ي•œ ى¦ë،€ى—گى„œëٹ” ى¬ي™œى„±ي™” ى‹œê¸°ى—گ HBsAgى´ ىŒى„±ى´ى—ˆى§€ë§Œ, Sىœ ى „ىگى—گ 대ي•œ ê²€ى‚¬ë¥¼ ى‹œي–‰ي•کى§€ ى•ٹى•„ ë³€ى´ ىœ 무를 ي™•ى¸ي•کى§€ ëھ»ي•کىک€ë‹¤. 다만 HBV DNAê°€ 105 copies/mL ى´ىƒپى´ى—ˆëچک ê²½ىڑ°ë،œ Sىœ ى „ىگىک ë³€ى´ê°€ ىˆى—ˆى„ 것ىœ¼ë،œ ى¶”ى •ëگکê³ ىˆë‹¤[3]. 본 ى¦ë،€ى—گى„œëٹ” Sىœ ى „ىگىک ى§پى ‘ى—¼ê¸°ى„œى—´ 분ى„ى„ ى‹œي–‰ي•کىک€ىœ¼ë©° HBsAgىک ى£¼ىڑ”ê²°ى •ê¸° 부ىœ„ىک ë³€ى´ ë°ڈ Pre-S 부ىœ„ىک ê²°ى‹¤ى´ë‚ک ى‚½ى…ê³¼ ê°™ى€ ëڈŒى—°ë³€ى´ëڈ„ ê´€ى°°ëگکى§€ ى•ٹى•ک다. ê·¸ëں¬ë‚ک HBsAgىک ë°œيک„ى€ HBsAgىک ى£¼ىڑ”ê²°ى •ê¸° ë°ڈ Pre-S 부ىœ„ىک ë³€ى´ë؟گ ى•„ë‹ˆë¼ ë‹¤ë¥¸ ë°”ى´ëں¬ىٹ¤ىک ى¤‘ë³µ ê°گى—¼, ي›„ىƒىœ ى „ى پ 변별ي™”(epigenetic modification) ë°ڈ BCP/Precore ىکپى—ىک ë³€ى´ى—گ ىکي•کى—¬ى„œëڈ„ ىکپي–¥ى„ ë°›ى„ ىˆک ىˆى–´ ى´ى—گ 대ي•œ ى¶”ê°€ى پى¸ ê²€ى‚¬ê°€ ي•„ىڑ”ي•کê² ë‹¤[9]. ëکگي•œ 다른 ë°”ى´ëں¬ىٹ¤ ê°„ى—¼ىک ë°°ى œي•ک기 ىœ„ي•کى—¬ 급ى„± Eيک• ê°„ى—¼ 등ى—گ 대ي•œ ى¶”ê°€ى پى¸ ê²€ى‚¬ê°€ ى¼ë¶€ 누ë½ëگœ ى گى€ ى•„ى‰¬ىڑ´ ى گى´ë¼ ي•کê² ë‹¤. ي¥ë¯¸ë،œىڑ´ ى گى€ ي•œêµى¸ ي™کىگى—گى„œ ê²€ى¶œëگکëٹ” Bيک• ê°„ى—¼ë°”ى´ëں¬ىٹ¤ëٹ” 대부분 Cيک• ىœ ى „ىگى´ë©° يکˆى²يک•ى€ adrى´ 대부분ى´ê³ adw, ayr, يک¼ي•©يک• 등ى´ ë³´ê³ ëگکê³ ىˆى§€ë§Œ[10], ى´ ي™کىگىک ê²½ىڑ° ىœ ى „ىگيک•ى€ Cيک•ى´ë©´ى„œ ayw3 يکˆى²يک•ى—گ ي•©ë‹¹ي•œ ى—¼ê¸°ى„œى—´ى„ ê°€ى§€ê³ ىˆى—ˆë‹¤.
ë©´ى—ى–µى œى œ ى‚¬ىڑ© ي›„ ى ى¬ê°گى—¼ىک ى¬ي™œى„±ي™”ë،œ ى¸ي•œ ê°„ى—¼ى€ ى¢…ى¢… ى¹کëھ…ى پى¸ 결과를 낳ىœ¼ë©°, ي•ë°”ى´ëں¬ىٹ¤ى œىک ى‚¬ىڑ©ى´ ي•„ىڑ”ي•ک다. ي•کى§€ë§Œ ى ى¬ê°گى—¼ ىگى²´ê°€ ى¬ي™œى„±ي™” ى—†ى´ ê°„ى—¼ى„ ى¼ىœ¼ي‚¨ ê²½ىڑ°ëٹ” ى§€ê¸ˆê¹Œى§€ ى—†ى—ˆë‹¤. 본 ى¦ë،€ëٹ” ى ى¬ê°گى—¼ى—گى„œ HBsAgىک ى¬ى–‘ى „ى„ ëڈ™ë°کي•œ ى¬ي™œى„±ي™” ê³¼ى •ى´ ى—†ى´ëڈ„ ê°„ى—¼ى´ ë°œىƒي• ىˆک ىˆىŒى„ ى‹œى‚¬ي•œë‹¤. ë”°ë¼ى„œ ى ى¬ ê°گى—¼ ي™کىگى—گى„œ ë©´ى—ى–µى œى œ ى‚¬ىڑ© ي›„ ê°„ى—¼ى´ ë°œىƒي–ˆى„ ê²½ىڑ° HBsAgى´ ىŒى„±ى´ë¼ ي•کëچ”ë¼ëڈ„ 다른 ى›گى¸ى´ ë°°ى œëگکê³ ê°„ى—¼ê³¼ ى ى¬ ê°گى—¼ê³¼ىک ى—°ê´€ى„±ى´ 높ى„ ë•Œ ي•ë°”ى´ëں¬ىٹ¤ى œىک يˆ¬ى—¬ë¥¼ ê³ ë ¤ي•´ ë³¼ ىˆک ىˆê² 다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






