 |
 |
| Korean J Med > Volume 83(4); 2012 > Article |
|
мЪФмХљ
к∞ИмГЙмДЄнПђмҐЕмЭШ нКємІХм†БмЭЄ мЮДмГБм¶ЭмГБмЭД м£ЉмЖМл°Ь лВімЫРнХЬ 53мДЄ мЧђмЮР нЩШмЮРмЧРмДЬ нШИмЮ•к≥Љ 24мЛЬк∞Д мЖМл≥АмЧРмДЬ мГЭнЩФнХЩм†Б к≤АмВђлКФ м†ХмГБмЭімЧИмІАлІМ MIBG мК§мЇФмЭД мЛЬнЦЙнХШмЧђ л≥µлґА CTмЭШ мЬДмєШмЩА л≥Сл≥АмЭі мЭЉмєШнХШлКФ к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ®нХШмШАлЛ§. лґАмЛ†м†БмґЬмИ† мЛЬнЦЙ нЫД м°∞мІБнХЩм†БмЬЉл°Ь к∞ИмГЙмДЄнПђмҐЕмЭД нЩХмІДнЦИмЬЉл©∞ л∞ЬмЮСм†БмЭЄ м¶ЭмГБк≥Љ к≥†нШИмХХмЭА нШЄм†ДлРШмЧИлЛ§. лФ∞лЭЉмДЬ мєінЕМмљЬмХДлѓЉмєШк∞А м†ХмГБмЭілНФлЭЉлПД мЮДмГБм¶ЭмГБмЭі к∞ИмГЙмДЄнПђмҐЕмЧР нХ©лЛєнХШлЛ§л©і нХµмЭШнХЩ мШБмГБк≤АмВђк∞А нХДмЪФнХШлЛ§к≥† лІРнХ† мИШ мЮИлЛ§.
Abstract
A 53-year-old woman had a 1.7 cm left adrenal mass on an abdominal computed tomography (CT) scan. She presented with paroxysmal headache, palpitation, sweating, and hypertension. The patient was highly suspected of having a pheochromocytoma, but measurements of 24-hour urinary metanephrine, catecholamines, and vanillylmandelic acid were normal. Plasma and urine catecholamine levels were within the normal range even during paroxysmal episodes. A scintigraphic study with 131I-metaiodobenzylguanidine(MIBG) revealed selective concentration of the radiotracer, corresponding to the CT mass. The patient underwent a left adrenalectomy and the pathological examination confirmed the diagnosis of pheochromocytoma. In this report, we describe a rare case of a symptomatic pheochromocytoma with normal catecholamine levels. Our case illustrates that routine nuclear scintigraphy, such as 131I-MIBG, should be performed even in cases with normal hormonal testing for all patients with high clinical suspicion of pheochromocytoma. (Korean J Med 2012;83:503-509)
мєінЕМмљЬмХДлѓЉ(catecholamine)мЭі нШИмЮ•к≥Љ мЖМл≥АмЧРмДЬ м†ХмГБмЬЉл°Ь мЄ°м†ХлРЬ к∞ИмГЙмДЄнПђмҐЕ(pheochromocytoma)мЭА мЩЄкµ≠мЧРмДЬ л™З м∞®л°А л≥ік≥†лРЬ м†БмЭі мЮИмЬЉлВШ[1-3], кµ≠лВімЧРмДЬлКФ мХДмІБкєМмІА л≥ік≥†лРЬ м†БмЭі мЧЖлЛ§. к∞ИмГЙмДЄнПђмҐЕ лШРлКФ нБђл°ђмєЬнЩФмДЄнПђмҐЕ(pheochromocytoma)мЭА нБђл°ђмєЬнЩФмД±(chromaffin) мДЄнПђл°Ь кµђмД±лРШл©∞ мєінЕМмљЬмХДлѓЉк≥Љ мЭЉлґА нО©нЛ∞лУЬ нШЄл•іл™ђмЭД нХ©мД±нХШк≥† мЬ†л¶ђнХШлКФ мҐЕмЦСмЭілЛ§. мЭі мІИнЩШмЭА лСРнЖµ, л∞ЬнХЬ, мЛђк≥ДнХ≠мІД кЈЄл¶ђк≥† к≥†нШИмХХмЭШ нКємІХмЭД к∞Цк≥† мЮИмЬЉл©∞, мЮДмГБм†БмЬЉл°Ь мЭШмЛђлРШлКФ к≤љмЪ∞ нШИмЮ• лШРлКФ 24мЛЬк∞Д мЖМл≥АмЧРмДЬ мєінЕМмљЬмХДлѓЉмЭілВШ мєінЕМмљЬмХДлѓЉмЭШ лМАмВђмВ∞лђЉмЭД мЄ°м†ХнХШмЧђ мІДлЛ®мЭД нХШк≤М лРЬлЛ§. мєШл£МлКФ мД±к≥µм†ХмЭЄ мҐЕмЦС м†Ьк±∞л•Љ нЖµнХі мЭіл£®мЦімІАл©∞, мИШмИ† м†Д мҐЕмЦСмЭШ мЬДмєШл•Љ м†ХнЩХнЮИ нЩХмЭЄнХШлКФ к≥Љм†ХмЭі нХДмИШм†БмЭілЛ§. мҐЕмЦСмЭШ мЬДмєШ к≤∞м†ХмЭА міИмЭМнММ(ultrasonography), м†ДмВ∞нЩФлЛ®мЄµміђмШБ(computed tomography, CT), мЮРкЄ∞к≥µл™ЕмШБмГБ(magnetic resonance Imaging, MRI) лУ±мЭШ л∞©л≤ХмЭД мВђмЪ©нХШк≤М лРЬлЛ§[4]. мҐЕмЦСмЭі мЦСмЄ° лґАмЛ†мЭілВШ лґАмЛ† мЭімЩЄмЭШ мЮ•мЖМмЧР л∞ЬмГЭнХШлКФ к≤љмЪ∞, лЛ§л∞ЬмД±мЬЉл°Ь л∞ЬмГЭнХШлКФ к≤љмЪ∞ кЈЄл¶ђк≥† мХЕмД±мЬЉл°Ь лґАмЛ† мЩЄмЭШ нГА мЮ•кЄ∞мЧР м†ДмЭілРЬ к≤љмЪ∞ CTмЩА MRIлІМмЬЉл°Ь мЬДмєШ нЩХмЭЄмЭі мЙљмІА мХКлЛ§. лФ∞лЭЉмДЬ metaiodobenzylguanidine(MIBG)л•Љ мЭімЪ©нХЬ л∞©мВђмД± лПЩмЬДмЫРмЖМ мК§мЇФмЭі лІОмЭі мВђмЪ©лРШк≥† мЮИмЬЉл©∞ нХілґАнХЩм†Б мЬДмєШлњРлІМ мХДлЛИлЭЉ кЄ∞лК•, лЛ§л∞ЬмД± мҐЕмЦСмЭШ мЬДмєШ кЈЄл¶ђк≥† мХЕмД± мҐЕмЦСмЭШ л≤ФмЬДл•Љ нММмХЕнХ† мИШ мЮИлЛ§[5]. нХШмІАлІМ MIBG мК§мЇФмЭА к∞ИмГЙмДЄнПђмҐЕ мІДлЛ®мЧР мЮИмЦімДЬ мШИлѓЉлПДк∞А лВЃк≥† нКємЭілПДк∞А лЖТмХД мД†л≥Дк≤АмВђл°ЬлКФ мВђмЪ©нХШмІА мХКк≥† мІДлЛ®мЭі мХ†лІ§нХЬ к≤љмЪ∞мЧР мЭім∞®м†Б к≤АмВђл°Ь мВђмЪ©лРШк≥† мЮИлЛ§. мЭімЧР м†АмЮРлУ§мЭА л∞ЬмЮС м¶ЭмГБмЭі мЮИлКФ лН∞лПД мГЭнЩФнХЩк≤АмВђлКФ м†ХмГБмЭік≥† мШ§нЮИ놧 131I-MIBG мК§мЇФмЧРмДЬ мД≠мЈ®к∞А м¶Эк∞АлРШмЦі к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ®нХЬ лУЬлђЄ мШИл•Љ к≤љнЧШнХШмШАкЄ∞мЧР кµ≠лВі м≤ШмЭМмЬЉл°Ь л≥ік≥†нХШлКФ л∞ФмЭілЛ§.
нЩШ мЮР: к∞ХгАЗгАЗ, мЧђмЮР, 53мДЄ
м£Љ мЖМ: к∞АмКі лСРкЈЉк±∞л¶Љ
нШДл≥С놕: лВімЫР мИШлЕД м†ДлґАнД∞ к∞ДнЧРм†БмЭЄ лСРнЖµ, к∞АмКі лСРкЈЉк±∞л¶Љ кЈЄл¶ђк≥† мЛЭмЭАлХАмЭі л∞ЬмГЭнЦИлЛ§. м¶ЭмГБмЭА мД†нЦЙ мЫРмЭЄ мЧЖмЭі л∞ЬмЮСмД±мЬЉл°Ь нХЬ лЛђмЧР нХЬ лСРл≤И лєИлПДл°Ь л∞ЬмГЭнЦИмЬЉл©∞ 5лґД мЭілВі мІАмЖНлРЬ нЫД мЮРмЧ∞мЖМмЛ§ лРШлКФ мЦСмГБмЭімЧИлЛ§. мГБкЄ∞ м¶ЭмГБмЬЉл°Ь к∞ЬмЭЄл≥СмЫРмЧРмДЬ лСРнЖµмЧР лМАнХШмЧђ лЗМ MRIл•Љ міђмШБнЦИмЬЉл©∞ нКємЭі мЖМк≤ђ кіАм∞∞лРШмІА мХКмХДмДЬ мХљлђЉ л≥µмЪ©нХШл©імДЬ мІАлГИлЛ§. лВімЫР нХЬлЛђ м†Д к±ік∞Хк≤АмІДнШСнЪМмЧРмДЬ мЛЬнЦЙнХЬ л≥µлґАміИмЭМнММмЧРмДЬ мЛ†мЮ• м£ЉмЬД мҐЕкіік∞А л∞Ьк≤ђлРШмЦі мґФк∞Ам†БмЭЄ л≥µлґА CT міђмШБмЭД нЦИмЬЉл©∞ мҐМмЄ° лґАмЛ†мЪ∞мЧ∞мҐЕмЭі л∞Ьк≤ђлРШмЧИлЛ§. нЩШмЮРлКФ лґАмЛ†мЪ∞мЧ∞мҐЕмЧР лМАнХЬ м†Хл∞Ак≤АмВђл•Љ мЬДнХі м†Ьм£ЉлМАнХЩкµРл≥СмЫР лВілґДлєД-лМАмВђ лВік≥Љл•Љ л∞©лђЄнЦИлЛ§.
к≥Љк±∞놕: 4лЕД м†ДлґАнД∞ м£ЉмЪФмЪ∞мЪЄмЮ•мХ†л°Ь мХљлђЉ л≥µмЪ©мЭД нХШк≥† мЮИмЧИк≥† 3лЕД м†Д мЮРкґБкЈЉмҐЕмЬЉл°Ь л≥µмЛЭ мЮРкґБм†БмґЬмИ†мЭД л∞ЫмХШлЛ§. мЭімЩЄ лЛєлЗ®л≥С, к≥†нШИмХХ, к∞ДмІИнЩШ, к≤∞нХµмЭШ л≥С놕мЭА мЧЖмЧИлЛ§.
мВђнЪМ놕: нЭ°мЧ∞놕мЭА мЧЖмЬЉл©∞, мЭМм£Љл†•мЭА мХљ 30лЕДк∞Д мЖМм£Љ л∞Ш л≥СмФ© мЫФ 1-2нЪМмЭімЧИлЛ§.
мІБмЧЕ놕: нХілЕА
к∞А찱놕: мХДл≤ДмІАмЩА нБ∞мШ§лє†лКФ к∞Дк≤љнЩФл°Ь мєШл£Мл•Љ л∞ЫмХШк≥†, мЧђлПЩмГЭмЭА к∞СмГБмД† мХФмЬЉл°Ь мИШмИ†мЭД л∞ЫмХШлЛ§.
мІДм∞∞ мЖМк≤ђ: лВімЫР лЛємЛЬ нШИмХХмЭА мХЩмЩАмЬДмЧРмДЬ 175/121 mmHg, лІ•л∞ХмИШ 63/лґД, нШЄнЭ°мИШ 20нЪМ/лґД, м≤імШ® 36.5вДГ, м†ДмЛ†мГБнГЬлКФ мЦСнШЄнХШмШАк≥† мЭШмЛЭмЭА л™Ел£МнХШмШАлЛ§. к≤∞лІЙмЭА м∞љл∞±нХШмІА мХКмХШк≥† к≥µлІЙмЧР нЩ©лЛђ мЖМк≤ђмЭА л≥імЭімІА мХКмХШлЛ§. л¶ЉнФДм†И мҐЕлМАлКФ мЧЖмЧИмЬЉл©∞ нШАмЭШ нГИмИШ мЖМк≤ђлПД мЧЖмЧИлЛ§. лШРнХЬ нФЉлґА кЄімЮ•лПДлКФ м†ХмГБмЭімЧИк≥†, к≤∞м†ИлУ±мЭШ нФЉлґА мЭімГБ мЖМк≤ђмЭА мЧЖмЧИлЛ§. нЭЙлґА м≤≠мІДмЧРмДЬ нПРмЭМк≥Љ мЛђмЭМмЭА л™®лСР м†ХмГБмЭімЧИк≥† лєИлІ•мЭілВШ мЛђмЮ•мЮ°мЭМмЭА кіАм∞∞лРШмІА мХКмХШлЛ§. л≥µлґАлКФ лґАлУЬлЯђмЫ†к≥† м†ХмГБ мЮ•мЭМмЭі лУ§л†ЄмЬЉл©∞ мХХнЖµмЭілВШ лІМм†ЄмІАлКФ мҐЕкіілКФ мЧЖмЧИлЛ§.
к≤АмВђмЛ§ мЖМк≤ђ: мЮЕмЫРнХШкЄ∞ м†Д мЩЄлЮШмЧРмДЬ лґАмЛ†мЪ∞мЧ∞мҐЕмЧР лМАнХЬ лВілґДлєД кЄ∞лК•к≤АмВђл•Љ мЛЬнЦЙнЦИмЬЉл©∞, мД†л≥Дк≤АмВђл°Ь мЛЬнЦЙнХЬ л∞§мГИ 1 mg лН±мВђл©ФнГАмЖР(dexamethasone) мЦµм†Ьк≤АмВђмЧРмДЬ нШИмЮ• мљФнЛ∞м°Є(cortisol)мЭА 0.37 ќЉg/dL (8AM) (6.2-19.4 ќЉg/dL)л°Ь мЦµм†ЬлРШмЧИлЛ§. мХЩмЩАмЬДмЧРмДЬ нШИмЮ• мХМлПДмК§нЕМл°†(aldosterone)мЭА 132.02 pg/mL (10.0-160.0 pg/mL), нШИмЮ• л†ИлЛМ нЩЬмД±лПД(plasma renin activity, PRA)лКФ 0.65 ng/mL/hr (0.68-1.36 ng/mL/hr)мЭімЧИлЛ§. 24мЛЬк∞Д мЖМл≥Ак≤АмВђмЧРмДЬ мЧРнФЉлД§нФДл¶∞(epinephrine)мЭА 30.73 ќЉg/day (< 40.00 ќЉg/day), лЕЄл•імЧРнФЉлД§нФДл¶∞(norepinephrine)мЭА 42.06 ќЉg/day (< 80.00 ќЉg/day), л©ФнГАлД§нФДл¶∞(metanephrine)мЭА 0.47 mg/day (0.14-0.78 mg/day), л∞ФлЛРл¶ілІМлНЄмВ∞(vanillylmandelic acid, VMA)мЭА 3.81 mg/day (2-10 mg/day)мЭімЧИлЛ§. мЭілХМ мЖМл≥АмЧРмДЬ мЄ°м†ХнХЬ нБђл†ИмХДнЛ∞лЛМ(creatinine)мЭА 1.1 g/day (0.8-2.0 g/day)мЭімЧИлЛ§(Table 1). мЩЄлЮШмЧРмДЬ мЛЬнЦЙнХЬ мД†л≥Д к≤АмВђлКФ кЄ∞лК•мД± мҐЕкіімЭШ мЖМк≤ђмЭД л≥імЭік≥† мЮИмІА мХКмІАлІМ л∞ЬмЮС м¶ЭмДЄк∞А мІАмЖНлРШк≥† мЮИмЦімДЬ к∞ИмГЙмДЄнПђмҐЕмЭД мЩДм†ДнЮИ л∞∞м†ЬнХ† мИШ мЧЖмЧИлЛ§. лФ∞лЭЉмДЬ 131I-MIBG мК§мЇФ лУ± м†Хл∞А к≤АмВђл•Љ мЛЬнЦЙнХШмЧђ мІДлЛ®нХШкЄ∞л°Ь нЦИлЛ§.
мЮЕмЫР нЫД мЛЬнЦЙнХЬ лІРміИнШИмХ° к≤АмВђмЧРмДЬ л∞±нШИкµђ мИШ 4,600/mm3, нШИмГЙмЖМ 12.3 g/dL, нШИмЖМнМР мИШлКФ 223,000/mm3мЭімЧИк≥†, нШИм≤≠ мГЭнЩФнХЩ к≤АмВђлКФ нКємЭі мВђнХ≠мЭі мЧЖмЧИлЛ§. нШИмХ° мЭСк≥†к≤АмВђмЧРмДЬ prothrombin time (PT) 98%, activated partial thromboplastin time (aPTT) 27міИл°Ь м†ХмГБмЭімЧИлЛ§. мЮЕмЫР к≤љк≥Љ 4мЭЉмЧР мЬ†л∞ЬмЫРмЭЄ мЧЖмЭі к∞АмКі лСРкЈЉк±∞л¶Љ, лСРнЖµ кЈЄл¶ђк≥† мИШмґХкЄ∞ нШИмХХ(systolic blood pressure, SBP)мЭі 254 mmHgл°Ь мГБмКєлРШмЧИк≥† мЮЕмЫРк≤љк≥Љ 6мЭЉк≥Љ 7мЭЉмЧРлПД к∞Бк∞Б л∞ЬмЮСмД± м¶ЭмГБмЭД лПЩл∞ШнХЬ к≥†нШИмХХмЭі л∞ЬмГЭнЦИлЛ§. лЛємЛЬ нШИмХХ к∞ХнХШм†Ьл•Љ л≥µмЪ©нЦИк≥† лЛ§л•Є мєШл£М мЧЖмЭі нШЄм†ДлРШмЧИлЛ§(Fig. 1A). мЮЕмЫР нЫДмЧР мЮђ мЄ°м†ХнХЬ 24мЛЬк∞Д мЖМл≥Ак≤АмВђмЧРмДЬ л©ФнГАлД§нФДл¶∞ л∞∞мД§мЦСмЭА 0.65 mg/day (0.14-0.78 mg/day)к≥Љ VMA л∞∞мД§мЦСмЭА 5.54 mg/day (2-10 mg/day)мЬЉл°Ь м†ХмГБл≤ФмЬДмЭімЧИк≥†, л∞ЬмЮСмД± м¶ЭмГБмЭі мЮИмЧИмЭД лХМ мЄ°м†ХнХЬ 24мЛЬк∞Д мЖМл≥Ак≤АмВђмЧРмДЬлПД мЧРнФЉлД§нФДл¶∞мЭА 31.87 ќЉg/day (< 40.00 ќЉg/day), лЕЄл•імЧРнФЉлД§нФДл¶∞мЭА 79.03 ќЉg/day (< 80.00 ќЉg/day)л°Ь м†ХмГБмШАлЛ§. мЭілХМ мЖМл≥АмЧРмДЬ мЄ°м†ХнХЬ нБђл†ИмХДнЛ∞лЛМмЭА 1.2 g/dayмЭімЧИлЛ§(Table 1). к≤АмВђмЭШ мШ§л•Шл•Љ л∞∞м†ЬнХШкЄ∞ мЬДнХШмЧђ л∞ЬмЮСмД± м¶ЭмГБмЭі л∞ЬмГЭнЦИмЭД лХМ мЄ°м†ХнХЬ нШИм≤≠ мЧРнФЉлД§нФДл¶∞мЭА 24.3 pg/mL (< 120 pg/mL), лЕЄл•імЧРнФЉлД§нФДл¶∞мЭА 63.5 ќЉg/day (< 410 ќЉg/mL)мЬЉл°Ь м†ХмГБл≤ФмЬДмЭімЧИлЛ§(Table 1). мЮђ мЄ°м†ХнХЬ нШИмЮ• мХМлПДмК§нЕМл°†мЭА 57.38 ќЉg/mL (10.0-160.0 pg/mL), PRAлКФ 0.48 ng/mL/hr (0.68-1.36 ng/mL/hr)мЭімЧИлЛ§. лґАмЛ†нФЉмІИмЮРкЈєнШЄл•іл™ђ(adrenocorticotropic hormone, ACTH)мЭА 1.86 pg/mL (7.2-63.3 pg/mL), мљФнЛ∞м°ЄмЭА 2.03 ќЉg/dL (6.2-19.4 ќЉg/dL)мЭімЧИлЛ§. мЪФк≤АмВђмЧРмДЬ albumin (-), glucose (-), ketone (-)мЭімЧИлЛ§. мЛђм†ДлПДмЧРмДЬ V5, V6мЭШ TнММ мЧ≠мЬДмЩА мҐМмЛђмЛ§лєДлМАк∞А кіАм∞∞лРШмЧИк≥†, нЭЙнЖµмЭА мЧЖмЧИмЬЉл©∞ л∞Шл≥µм†ДмЭЄ мЛђм†ДлПДмЧРмДЬ TнММмЭШ мЧ≠мЬДмЩА мҐМмЛђмЛ§лєДлМАк∞А л≥АнЩФмЧЖмЭі кіАм∞∞лРШмЦі мґФк∞Ам†БмЭЄ к≤АмВђлКФ мЛЬнЦЙнХШмІА мХКк≥† к≤љк≥ЉкіАм∞∞нЦИлЛ§.
л∞©мВђмД† мЖМк≤ђ: нЭЙлґА л∞©мВђмД† міђмШБмЧРмДЬ мЛђлєДлМАлКФ кіАм∞∞лРШмІА мХКмХШмЬЉл©∞, л≥µлґА CTмЧРмДЬ мҐМмЄ° лґАмЛ†мЧР м°∞мШБ м¶Эк∞ХмЭД л≥імЭілКФ лєДкЈ†мЭЉнХЬ мЫРнШХмЭШ 1.7 cm мҐЕкіік∞А кіАм∞∞лРШмЧИлЛ§(Fig. 2A and 2B). лШРнХЬ LugolвАЩs solutionмЭД 3мЭЉк∞Д к≤љкµђ л≥µмЪ© нЫД міђмШБнХЬ 131I-MIBG мК§мЇФмЧРмДЬ л≥µлґА CTмЩА лПЩмЭЉнХЬ лґАмЬДмЭЄ мҐМмЄ° лґАмЛ†мЧР мД≠мЈ®к∞А м¶Эк∞АлРЬ мЖМк≤ђмЭД л≥імШАлЛ§(Fig. 2C and 2D). лЛ§л•Є лґАмЬДмЧР мД≠мЈ®к∞А м¶Эк∞АлРЬ мЖМк≤ђмЭА кіАм∞∞лРШмІА мХКмХШлЛ§.
мєШл£М л∞П к≤љк≥Љ: нЩШмЮРлКФ мГЭнЩФнХЩм†Б к≤АмВђмЧРмДЬ мєінЕМмљЬмХДлѓЉ лМАмВђлђЉмЭА м¶Эк∞АлРШмЦі мЮИмІА мХКмХШмІАлІМ л∞ЬмЮСмД± м¶ЭмГБк≥Љ л≥µлґА CTмЧРмДЬ л∞Ьк≤ђлРЬ лґАмЛ† мЪ∞мЧ∞мҐЕ кЈЄл¶ђк≥† к∞ИмГЙмДЄнПђмҐЕмЭі мЭШмЛђлРШмЦі міђмШБнХЬ 131I-MIBG мК§мЇФмЭШ мД≠мЈ®к∞А м¶Эк∞АлРЬ л≥Сл≥АмЭД мҐЕнХ©нХШмЧђ к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ®нХШк≥† кЈЉмєШм†Б мИШмИ†мЭД к≥ДнЪНнЦИлЛ§. мИШмИ†мЭА мҐЕмЦСмЭШ м°∞мЮСмЬЉл°Ь л∞ЬмГЭнХ† мИШ мЮИлКФ мєінЕМмљЬмХДлѓЉ мЭСкЄЙ лУ±мЭШ лґАмЮСмЪ©мЭД лІЙкЄ∞ мЬДнХі 10мЭЉ м†ДлґАнД∞ мШИл∞©м†БмЬЉл°Ь мХМнММм∞®лЛ®м†ЬмЭЄ лПЕмВђм°∞мЛ†(doxazosin) 4 mg/dayмЭД к≤љкµђ л≥µмЪ©нХШмШАк≥†, мИШмИ† лЛємЭЉ мИШмХ°мЪФл≤ХмЭД л≥СнЦЙнХШмЧђ мҐМмЄ° лґАмЛ† м†Им†ЬмИ†мЭД мД±к≥µм†БмЬЉл°Ь мЛЬнЦЙнЦИлЛ§. м†БмґЬнХЬ лґАмЛ†мЭА мЬ°мХИм†БмЬЉл°Ь 3.5 √Ч 2.0 √Ч 0.5 cmмШАк≥†(Fig. 3A), мЭЄм†С мЮ•кЄ∞л°ЬмЭШ мє®л≤ФмЭА кіАм∞∞лРШмІА мХКмХШлЛ§.
л≥Сл¶ђ мЖМк≤ђ: мҐЕмЦСмЭШ м†ИлЛ®л©імЭА нФЉлІЙмЬЉл°Ь лСШлЯђмЛЄмЧђ мІДнХЬ к∞ИмГЙмЭД лЭДк≥† мЮИмЧИлЛ§(Fig. 3B). кіСнХЩнШДлѓЄк≤љмЭШ H&E мЧЉмГЙмЧРмДЬ нШЄмЧЉкЄ∞мД±мЭШ нТНлґАнХЬ мДЄнПђмІИмЭД к∞АмІД мД±мИЩнХЬ мДЄнПђлУ§мЭА нШИкіАмЭі нТНлґАнХЬ к∞ДмІИм°∞мІБмЧР лСШлЯђмЛЄмЧђ мЮСмЭА нПРнПђ л™®мЦСмЭШ мДЄнПђмІСлЛ®мЭД нШХмД±нХШк≥† мЮИлКФ к∞ИмГЙмДЄнПђмҐЕмЭШ м†ДнШХм†БмЭЄ мЖМк≤ђмЭД л≥імЭік≥† мЮИмЧИлЛ§ (Fig. 4A). мЭЉл∞Шм†БмЭЄ к≥БмЛ†к≤љм†ИмҐЕ(paraganglioma)к≥Љ лґАмЛ†мЖНмІИ мҐЕмЦСмДЄнПђлКФ л©імЧ≠м°∞мІБнЩФнХЩк≤АмВђмЧРмДЬ мЛ†к≤љлВілґДлєДмЭШ нСЬмІАмЮРмЭЄ chromogranin, synaptophysin, NSE кЈЄл¶ђк≥† S-100мЧР мЦСмД±мЭД л≥імЭілКФлН∞[6], л≥Є м¶Эл°АмЭШ мҐЕмЦСмДЄнПђмЭШ л©імЧ≠ м°∞мІБнЩФнХЩк≤АмВђмЧРмДЬлПД synaptophysinк≥Љ chromograninмЭА мЦСмД±мЭімЧИк≥†, S-100мЭА мХљмЦСмД±мЭД л≥імШАлЛ§(Fig. 4B, 4C and 4D).
мИШмИ† нЫД мЖМк≤ђ: мИШмИ† л∞ЬмЮСмД± м¶ЭмГБмЭА л∞ЬмГЭнХШмІА мХКмХШк≥†, SBPлКФ 140-160 mmHgл°Ь кіАм∞∞лРШмЦі мИШмИ† м†Д к≥†нШИмХХмЧР лМАнХімДЬ л≥µмЪ©нХШлНШ amlodipine 5 mg, candesartan 8 mg, bisoprolol 5 mgмЭД amlodipine 10 mgк≥Љ bisoprolol 5 mgмЬЉл°Ь м°∞м†ИнХШмЧђ л≥µмЪ©нЦИлЛ§ (Fig. 1A; broad arrow, мИШмИ†мЛЬм†Р). мИШмИ† нЫД лЛ§л•Є нХ©л≥См¶ЭмЭА кіАм∞∞лРШмІА мХКмХДмДЬ нЗімЫРнЦИлЛ§. мЩЄлЮШ мґФм†БкіАм∞∞ м§СмЧР SBPк∞А 140 mmHgмЭінХШл°Ь мЬ†мІАлРШмЦі нХ≠к≥†нШИмХХм†ЬмЭЄ amlodipine 5 mgмЬЉл°Ь к∞РлЯЙнЦИк≥† bisoprololмЭА м§СлЛ®нЦИмЬЉл©∞ л∞ЬмЮСмД± м¶ЭмГБлПД кіАм∞∞лРШмІА мХКмХШлЛ§ (Fig. 1B).
к∞ИмГЙмДЄнПђмҐЕмЭА мєінЕМмљЬмХДлѓЉмЭШ к≥ЉмЮЙмЧР лФ∞л•Є м†ДнШХм†БмЭЄ мЮДмГБм¶ЭмГБ, мІХнЫД, мГЭнЩФнХЩм†БмЭЄ к≤АмВђмЩА мШБмГБк≤∞к≥Љл•Љ мҐЕнХ©нХШмЧђ мІДлЛ®нХ† мИШ мЮИлКФ мІИнЩШмЭілЛ§. кЈЄлЯђлВШ мЭЉлґА нЩШмЮРмЧРмДЬ м†ДнШХм†БмЭЄ мЮДмГБм¶ЭмГБмЭД к∞ЦлНФлЭЉлПД мГЭнЩФнХЩм†БмЭЄ к≤АмВђлВШ мШБмГБ к≤АмВђлІМмЬЉл°Ь мІДлЛ®мЭі мֳ놧мЪЄ мИШ мЮИлЛ§. Sutton лУ±[7]мЭА 54мШИмЭШ мВђм≤і лґАк≤А мЧ∞кµђмЧРмДЬ мГЭм†ДмЧР к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ® к∞АлК•нЦИлНШ мШИк∞А 24%мЧР лґИк≥ЉнЦИмЬЉл©∞, мЛђкЈЉ к≤љмГЙм¶Эк≥Љ лЗМнШИкіА мІИнЩШмЬЉл°Ь мВђлІЭнХШмЧђ мШ§мІДлР† мИШ мЮИмЭМмЭД к∞Хм°∞нЦИлЛ§. нКєнЮИ к∞ИмГЙмДЄнПђмҐЕмЭА 2м∞®мД± к≥†нШИмХХмЭШ мЫРмЭЄ м§СмЧР мєШл£Мк∞А к∞АлК•нХЬ мІИнЩШмЮДмЧРлПД лґИкµђнХШк≥† мІДлЛ®мЭі мІАмЧ∞лРШлКФ к≤љмЪ∞мЧР мєінЕМмљЬмХДлѓЉмЭШ к≥ЉлЛ§ лґДлєДл°Ь мГЭл™ЕмЭД мЬДнШСл∞ЫмЭД мИШ мЮИлЛ§. лФ∞лЭЉмДЬ к∞ИмГЙмДЄнПђмҐЕмЭШ мІДлЛ®мЭі лє†л•ік≥† м†ХнЩХнХШк≤М мЭіл£®мЦім†ЄмХЉ нХШмІАлІМ к∞АмЮ• мШИлѓЉнХЬ к≤АмВђ л∞©л≤ХмЭА мХДмІБкєМмІА нЩХл¶љлРШмІА мХКк≥† мЮИмЬЉл©∞, м£Љл°Ь мГЭнЩФнХЩм†БмЭЄ к≤АмВђл°Ь мІДлЛ®мЭі мЭіл£®мЦімІАк≥† мЮИлЛ§. мГЭнЩФнХЩм†БмЭЄ к≤АмВђ м§СмЧРмДЬ нШИмЮ•мЭШ мЬ†л¶ђ л©ФнГАлД§нФДл¶∞мЭі лЛ§л•Є нХ≠л™©к≥Љ лєДкµРнХШмЧђ мІДлЛ®мЧР м£Љл°Ь мВђмЪ©лРШк≥† мЮИмЬЉлВШ, мЮДмГБм†БмЬЉл°Ь мВђмЪ©нХШкЄ∞мЧР л≥µмЮ°нХШк≥† лєДмЪ©к≥Љ мЛЬк∞ДмЭі лІОмЭі мЖМл™®лРШлКФ лЛ®м†РмЭі мЮИлЛ§. лШРнХЬ м†ДмВ∞нЩФлЛ®мЄµміђмШБк≥Љ к∞ЩмЭА нХілґАнХЩм†Б мШБмГБмЭА л≥Сл≥АмЭШ мЬДмєШл•Љ мЮРмДЄнХШк≤М нММмХЕнХШлКФлН∞ лПДмЫАмЭі лРШмІАлІМ лґАмЛ† мЩЄмЭШ кЄ∞кіАмЧР л∞ЬмГЭнХШк±∞лВШ л≥Сл≥АмЭШ нБђкЄ∞к∞А мЮСмЭА к≤љмЪ∞мЧРлКФ нХЬк≥Дк∞А мЮИлЛ§[8].
л≥Є м¶Эл°АлКФ 131I-MIBGмК§мЇФмЭД мЛЬнЦЙнХШкЄ∞ м†Д lugolвАЩs solutionмЭД л≥µмЪ©нХШкЄ∞ мЬДнХЬ 3мЭЉк∞ДмЭШ мЮЕмЫР кЄ∞к∞Дк≥Љ м†Хл∞Ак≤АмВђл•Љ мЬДнХЬ мґФк∞Ам†БмЭЄ мЮЕмЫР кЄ∞к∞Д лПЩмХИ 3м∞®л°АмЭШ лСРнЖµ, к∞АмКі лСРкЈЉк±∞л¶Љ кЈЄл¶ђк≥† к∞СмЮРкЄ∞ SBPк∞А 170-240 mmHgкєМмІА мГБмКєнХШлКФ л∞ЬмЮС м¶ЭмГБмЭі мЮИмЧИлЛ§. м≤Ђл≤ИмІЄ мГЭнЩФнХЩм†Б к≤АмВђмЧРмДЬ мєінЕМмљЬмХДлѓЉ лМАмВђлђЉмЭі м†ХмГБмЭімЧИкЄ∞ лХМлђЄмЧР лЛ§л•Є мІИнЩШмЭД к∞Рл≥ДнХШкЄ∞ мЬДнХШмЧђ 24мЛЬк∞Д мЛђм†ДлПД мЄ°м†Х, нПРк≤љ нЫД м¶ЭнЫДкµ∞мЧР лМАнХЬ мД±нШЄл•іл™ђк≤АмВђ кЈЄл¶ђк≥† к∞СмГБмД† кЄ∞лК•к≤АмВђ лУ±мЭД мЛЬнЦЙнЦИмЬЉл©∞ к≤∞к≥ЉлКФ м†ХмГБмЭімЧИлЛ§. л∞ЬмЮСмД± м¶ЭмГБмЭі л∞ЬмГЭнЦИмЭД лХМ мЄ°м†ХнХЬ нШИмЮ•к≥Љ мЖМл≥АмЧРмДЬ мГЭнЩФнХЩм†Б к≤АмВђ к≤∞к≥ЉлПД м†ХмГБмЭімЧИлЛ§. мЭінЫД мЛЬнЦЙнХЬ 131I-MIBG мК§мЇФмЧРмДЬ л≥µлґА CTмЩА лПЩмЭЉнХЬ мЬДмєШмЧР MIBG мД≠мЈ® м¶Эк∞Ак∞А нЩХмЭЄлРШмЧИлЛ§, л∞Шл≥µлРЬ мГЭнЩФнХЩм†Б к≤АмВђмЧРмДЬлПД м†ХмГБмЭімЧИмІАлІМ нКємЭілПДк∞А лЖТмЭА 131I-MIBG мК§мЇФмЭА мЦСмД±мЭік≥† л∞ЬмЮСм†БмЭЄ м¶ЭмГБ лУ±мЭД к∞РмХИнХ† лХМ к∞ИмГЙмДЄнПђмҐЕмЬЉл°Ь нМРлЛ®лРШмЦі мИШмИ†мЭД к≤∞м†ХнХШк≤М лРШмЧИлЛ§.
MIBGлКФ лЕЄл•імЧРнФЉлД§нФДл¶∞мЭШ мЬ†мВђм≤іл°Ь, мДЄнПђлІЙмЧР лЕЄл•імЧРнФЉлД§нФДл¶∞ мИШмЖ°м≤іл•Љ л∞ЬнШДнХШлКФ мДЄнПђмЭШ мЛ†к≤љлґДлєДмД± к≥Љл¶љмЧР мІСм†БлРШмЦі лґДлєДлРШлКФ мД±мІИмЭД к∞АмІАк≥† мЮИкЄ∞ лХМлђЄмЧР л∞©мВђмД± лПЩмЬДмЫРмЖМл°Ь MIBGл•Љ нСЬмІАнХШл©і к∞ИмГЙмДЄнПђмҐЕмЭШ кЄ∞лК•м†Б мШБмГБмЭД мЦїлКФ л∞©л≤ХмЬЉл°Ь мІДлЛ®мЧР мВђмЪ©нХ† мИШ мЮИлЛ§. мЭЉлґА мЧ∞кµђмЧРмДЬлКФ міИкЄ∞ мІДлЛ®мЧР мЮИмЦімДЬ MIBG мК§мЇФмЭі мИШмИ†м†Б м≤ШмєШмЭШ к≤∞к≥Љл•Љ л≥АнЩФмЛЬнВ§мІА л™їнХШкЄ∞ лХМлђЄмЧР кЉ≠ нХДмЪФнХЬ к≤ГмЭА мХДлЛИлЭЉк≥† л≥ік≥†нХЬ к≤љмЪ∞лПД мЮИмЧИлЛ§[9]. мЭімЩАлКФ л∞ШлМАл°Ь кµ≠лВі л∞ЬнСЬмЧРмДЬ Moon лУ±[10]мЭА мИШмИ† м†Д міИкЄ∞ мІДлЛ®мЧРмДЬ мГЭнЩФнХЩм†Б к≤АмВђлВШ нХілґАнХЩм†Б мШБмГБ, к∞Бк∞БмЭШ мІДлЛ® л∞©л≤Хк≥Љ мЭі лСР к∞АмІА мІДлЛ® л∞©л≤ХмЭД нХ®кїШ мЭімЪ©нХЬ к≤љмЪ∞ кЈЄл¶ђк≥† MIBG мК§мЇФмЭШ лєДкµР мЧ∞кµђмЧРмДЬ к∞Бк∞БмЭШ мІДлЛ® л∞©л≤ХмЧР лМАнХЬ мШИлѓЉлПД, нКємЭілПД, мЦСмД±мШИ쪰땆, мЭМмД±мШИ쪰땆 кЈЄл¶ђк≥† м†ХнЩХлПДл•Љ лєДкµР л≥ік≥†нЦИлЛ§. к≤∞к≥ЉлКФ 123I/131I-MIBG мК§мЇФмЭД лЛ®лПЕмЬЉл°Ь мВђмЪ©нХЬ к≤љмЪ∞, 88.9%, 92.3%, 88.9%, 92.3%, 90.9%л°Ь м†Дл∞Шм†БмЬЉл°Ь мИШмєШк∞А лЖТмХШлКФлН∞ нКємЭілПДлІМ лЖТмЭА к≤АмВђмЭЉ лњРлІМ мХДлЛИлЭЉ лѓЉк∞РлПДмЭШ мИШмєШлПД мҐЛмЭА к≤∞к≥Љл•Љ л≥ік≥†нЦИлЛ§.
л∞ЬмЮС м¶ЭмГБмЭі мЮИмЭД лХМ мєінЕМмљЬмХДлѓЉмЭі мГБмКєлР† к≤ГмЬЉл°Ь мґФм†ХлРШмІАлІМ л≥Є м¶Эл°АмЧРмДЬм≤ШлЯЉ лґАмЛ†мИШмІИнШЄл•іл™ђмЭі м†ХмГБмЬЉл°Ь л≥імШАлНШ мЭімЬ†лКФ мХДмІБкєМмІА л∞ЭнШАмІАмІА мХКмХШлЛ§. мґФмЄ°нХі л≥Љ мИШ мЮИлКФ к∞АмД§мЭА м≤Ђл≤ИмІЄ, мєінЕМмљЬмХДлѓЉ лМАмВђ к≥Љм†ХмЧРмДЬ нЛ∞л°ЬмЛ†(tyrosine)мЭі лФФнЮИлУЬл°ЭмЛЬнОШлЛРмХМлЭЉлЛМ(Dihydroxyphenylalanin, DOPA), лЕЄл•імЧР нФЉлД§нФДл¶∞, мЧРнФЉлД§нФДл¶∞мЬЉл°Ь л≥АнЩШлРШлКФ лЛ®к≥ДмЧРмДЬ нЪ®мЖМ к≤∞нХНмЬЉл°Ь мєінЕМмљЬмХДлѓЉмЭА м¶Эк∞АлРШмЦі мЮИмІАлІМ мЛ§м†Ьл°Ь мЄ°м†ХлРШлКФ нШЄл•іл™ђмЭА м†ХмГБмЬЉл°Ь нЩХмЭЄлР† мИШ мЮИлЛ§[1,3]. лСРл≤ИмІЄ, мєінЕМмљЬмХДлѓЉмЭШ мЦСк≥Љ м¶ЭмГБмЭШ кіАк≥Дк∞А м†БкЄ∞ лХМлђЄмЧР мЦСмЭі м†БмЦімДЬ м†ХмГБмЬЉл°Ь мЄ°м†ХлР† мИШ мЮИлЛ§[3]. мДЄл≤ИмІЄ мГЭнЩФм†БмЭЄ к≤АмВђк≤∞к≥Љк∞А к∞ДнЧРм†БмЭік±∞лВШ л∞ЬмЮСмД±мЭШ мєінЕМмљЬмХДлѓЉ лґДлєДл°Ь мЭЄнХі мЬДмЭМмД±мЭШ к≤∞к≥Љл•Љ л≥імШАк±∞лВШ мЭім†ДмЧР л≥µмЪ©нХШмШАлНШ нХ≠мЪ∞мЪЄм†Ьл°Ь мЭЄнХЬ мГБнШЄмЮСмЪ©мЬЉл°Ь мєінЕМмљЬмХДлѓЉмЭі м†ХмГБмЬЉл°Ь мЄ°м†ХлР† мИШ мЮИлЛ§к≥† нХЬлЛ§[3]. мДЄл≤ИмІЄ к∞АмД§мЭА 2л≤ИмЭШ 24мЛЬк∞Д мЖМл≥АлВі мєінЕМмљЬмХДлѓЉ лМАмВђлђЉ к≤АмВђмЩА л∞ЬмЮСмД± м¶ЭмГБмЭі лПЩл∞ШлР† лХМ мЄ°м†ХнХЬ нШИмЮ•лВі мєінЕМмљЬмХДлѓЉ к≤АмВђл•Љ мЛЬнЦЙнЦИкЄ∞ лХМлђЄмЧР к∞АлК•мД±мЭА м†БмЬЉл©∞ нШДмЮђ нХ≠мЪ∞мЪЄм†ЬмЩА мєінЕМмљЬмХДлѓЉ лМАмВђк≥Љм†ХмЭШ мГБнШЄмЮСмЪ©мЭА л∞ЭнШАмІД л∞Фк∞А мЧЖлЛ§.
л≥Є м†АмЮРлКФ мГЭнЩФнХЩм†БмЭЄ к≤АмВђмЧРлІМ мЭШм°інХШк≤М лРШл©і мІДлЛ®мЭі мЧ∞кЄ∞лРШк≥† к≤АмВђ к≤∞к≥Љл•Љ нЩХмЭЄнХШлКФ мЛЬк∞ДмЭі мШ§лЮШ к±Єл¶ђкЄ∞ лХМлђЄмЧР к∞ИмГЙмДЄнПђмҐЕмЭі мЭШмЛђлРЬлЛ§л©і м°∞кЄ∞мЧР MIBG мК§мЇФмЭД мЛЬнЦЙнХімХЉ нХ† к≤ГмЭД мґФм≤ЬнХЬлЛ§. лђЄнЧМ к≤АмГЙмЧРмДЬ мІДлЛ®м†БмЭЄ к≤АмВђ л∞©л≤ХмЭД мЬДнХЬ лєДкµР мЧ∞кµђмЧРмДЬ 131I-MIBG мК§мЇФмЭі мІДлЛ®м†БмЬЉл°Ь міИкЄ∞мЧР мВђмЪ©нХ† мИШ мЮИлЛ§лЭЉлКФ л≥ік≥†лКФ мЮИмІАлІМ л≥Є м¶Эл°Ам≤ШлЯЉ м†ХмГБ мєінЕМмљЬмХДлѓЉ лМАмВђлђЉмЭШ к≤∞к≥Љл•Љ к∞АмІД нЩШмЮРмЧРмДЬ 131I-MIBG мК§мЇФмЬЉл°Ь мІДлЛ®нХЬ к≤љмЪ∞лКФ кµ≠лВімЧРмДЬ мµЬміИ л≥ік≥†мЭілЛ§. мЩЄкµ≠мЭШ к≤љмЪ∞ 2004лЕД мЭЄлПДмЧРмДЬ Zianni лУ±[3]мЭі л≥Є м¶Эл°АмЩА мЬ†мВђнХЬ к≤љмЪ∞л•Љ л≥ік≥† нЦИлКФлН∞, л∞ЬмЮС м¶ЭмГБмЭі мЮИк≥† нХілґАнХЩм†Б мШБмГБмЧРмДЬ лґАмЛ†мЭШ мҐЕкіік∞А нЩХмЭЄлРШмЧИмІАлІМ 24мЛЬк∞Д мЖМл≥АмЭШ мГЭнЩФнХЩм†БмЭЄ к≤АмВђлКФ м†ХмГБмЭімЧИлЛ§. мЭілУ§мЭА мЮДмГБ м¶ЭмГБмЭі нХ©лЛєнХШк≥† MIBG мК§мЇФмЧРмДЬ CTл≥Сл≥Ак≥Љ лПЩмЭЉнХЬ лґАмЬД мД≠мЈ®к∞А м¶Эк∞АлРШмЦі мЮИмЦі к∞ИмГЙмДЄнПђмҐЕмЬЉл°Ь нМРлЛ®нЦИлЛ§. л≥Є м¶Эл°АмЩА м∞®мЭім†РмЭА мЮЕмЫР кЄ∞к∞Д лПЩмХИ нШИмЮ•мЭШ мєінЕМмљЬмХДлѓЉ к≤АмВђ мЄ°м†ХмЭД нХШмІА мХКмХДмДЬ л∞ЬмЮСмД± мГБнГЬмЧРмДЬ нШЄл•іл™ђ лґДлєДмЦСмГБмЭД нЩХмЭЄнХ† мИШ мЧЖмЧИлЛ§. мИШмИ† нЫД л∞ЬмЮСм¶ЭмГБк≥Љ нШИмХХмЭА мГБмКєлРШмІА мХКмХШмЧИк≥† 3к∞ЬмЫФ нЫД 131I-MIBG мК§мЇФмЧРмДЬ мЮђл∞ЬлРЬ л≥Сл≥АмЭА кіАм∞∞лРШмІА мХКмХШлЛ§. кЈЄлЯђлВШ нЩШмЮРлКФ л∞ЬмЮС м¶ЭмГБмЭі лЛ§мЛЬ л∞ЬмГЭлРШмЦі нХ≠к≥†нШИмХХмХљм†ЬмЩА нХ≠мЪ∞мЪЄм†Ьл•Љ л≥µмЪ©нХШмШАлЛ§. 1995лЕД Maurea лУ±[2]мЭА лђім¶ЭмГБмЭШ лґАмЛ†мЪ∞мЧ∞мҐЕмЧРмДЬ 24мЛЬк∞Д мЖМл≥АмЭШ мГЭнЩФнХЩм†БмЭЄ к≤АмВђлКФ м†ХмГБмЭімЧИмІАлІМ 123I-MIBG мК§мЇФмЧРмДЬ CTмЭШ л≥Сл≥Ак≥Љ мЭЉмєШнХШлКФ лґАмЬДмЧРмДЬ мД≠мЈ®к∞А м¶Эк∞АлРЬ л≥Сл≥АмЭД нЩХмЭЄнХШмЧђ к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ®нЦИлЛ§. 1993лЕД Mannelli лУ±[1]мЭА 25мДЄмЭШ мЧђмД±мЭі лВЬмЖМ лђЉнШємЧР лМАнХЬ к≤АмВђл•Љ нХШлНШ м§СмЧР мЪ∞мЧ∞нЮИ мЪ∞мЄ° лґАмЛ†мЧР мҐЕкііл•Љ л∞Ьк≤ђнХШк≤М лРШмЧИк≥† к≥†нШИмХХмЭД лПЩл∞ШнХШмІА мХКмЭА к∞АмКі лСРкЈЉк±∞л¶Љ, л∞ЬнХЬ, лСРнЖµ кЈЄл¶ђк≥† лґИмХИк∞Р м¶ЭмГБмЭі лПЩл∞ШлРШмЦі мЮИмЧИлЛ§. мЖМл≥АмЭШ мГЭнЩФнХЩм†Б к≤АмВђмЧРмДЬ м†ХмГБмЭімЧИмІАлІМ 131I-MIBG мК§мЇФмЧРмДЬ л≥Сл≥АмЭі нЩХмЭЄлРШмЦі к∞ИмГЙмДЄнПђмҐЕмЭД мІДлЛ®нЦИлЛ§. 2лЕД лПЩмХИ мЩЄлЮШ к≤љк≥ЉкіАм∞∞ м§СмЧР л∞ЬмЮСм¶ЭмГБмЭА мЧЖмЧИмІАлІМ мИШмИ†м†БмЭЄ м†Ьк±∞л•Љ нЦИлЛ§. мЬДмЧР мДЬмИ†нХЬ мЩЄкµ≠мЭШ 3к∞ЬмЭШ м¶Эл°АмЩА лєДкµРнХШмЧђ л≥Є м¶Эл°АлКФ мєінЕМмљЬмХДлѓЉмєШк∞А м†ХмГБмЭЄ к∞ИмГЙмДЄнПђмҐЕмЧРмДЬ мИШмИ† нЫД л∞ЬмЮСм¶ЭмДЄмЩА к≥†нШИмХХмЭі нШЄм†ДлРРкЄ∞ лХМлђЄмЧР мЩЄкµ≠ м¶Эл°АлУ§л≥ілЛ§ м†ДнШХм†БмЭЄ к≤љмЪ∞лЭЉк≥† нХ† мИШ мЮИлЛ§. кµ≠лВілКФ мЭімЩА к∞ЩмЭА мЬ†мВђ м¶Эл°Ак∞А мЭЉм∞НмЭі мЧЖмЧИлЛ§. к≤∞л°†м†БмЬЉл°Ь мЮДмГБ м¶ЭмГБмЭі к∞ИмГЙмДЄнПђмҐЕмЭД мЛЬмВђнХШк≥† лґАмЛ†мҐЕкіік∞А кіАм∞∞лРЬлЛ§л©і мЖМл≥Ак≥Љ нШИмЮ•мЭШ мєінЕМмљЬмХДлѓЉмєШк∞А м†ХмГБмЭілНФлЭЉлПД 131I-MIBG мК§мЇФмЭД мЛЬнЦЙнХімХЉ нХЬлЛ§к≥† лІРнХ† мИШ мЮИлЛ§.
REFERENCES
1. Mannelli M, Pupilli C, Lanzillotti R, et al. A nonsecreting pheochromocytoma presenting as an incidental adrenal mass: report on a case. J Endocrinol Invest 1993;16:817вАУ822.


2. Maurea S, Lastoria S, Cuocolo A, Celentano L, Salvatore M. The diagnosis of nonfunctioning pheochromocytoma: the role of I-123 MIBG imaging. Clin Nucl Med 1995;20:22вАУ24.


3. Zianni D, Tzanela M, Klimopoulos S, Thalassinos NC. Symptomatic pheochromocytoma with normal urinary catecholamine metabolites. Hormones (Athens) 2004;3:132вАУ137.


4. Ahn SK, Ahn KJ, Lee EJ, et al. Clinical review of pheochromocytoma. J Korean Soc Endocrinol 1991;6:245вАУ253.
5. Sisson JC, Frager MS, Valk TW, et al. Scintigraphic localization of pheochromocytoma. N Engl J Med 1981;305:12вАУ17.


6. TatiƒЗ S, Havelka M, PaunoviƒЗ I, et al. Pheochromocytoma: pathohistologic and immunohistochemical aspects. Srp Arh Celok Lek 2002;130(Suppl 2):S7вАУS13.

7. Sutton MG, Sheps SG, Lie JT. Prevalence of clinically unsuspected pheochromocytoma: review of a 50-year autopsy series. Mayo Clin Proc 1981;56:354вАУ360.


8. Bomanji J, Levison DA, Flatman WD, et al. Uptake of iodine-123 MIBG by pheochromocytomas, paragangliomas, and neuroblastomas: a histopathological comparison. J Nucl Med 1987;28:973вАУ978.

9. Greenblatt DY, Shenker Y, Chen H. The utility of metaiodobenzylguanidine (MIBG) scintigraphy in patients with pheochromocytoma. Ann Surg Oncol 2008;15:900вАУ905.


10. Moon EH, Lim ST, Jeong YJ, Kim DW, Jeong HJ, Sohn MH. Efficacy of I-123/I-131 metaiodobenzylguanidine scan as a single initial diagnostic modality in pheochromocytoma: comparison with biochemical test and anatomic imaging. Nucl Med Mol Imaging 2009;43:436вАУ442.
Blood pressure changes during admission. (A) The patient showed severely fluctuating blood pressure; arrows indicate the development of paroxysmal symptoms; broad arrow indicates the day that the pheochromocytoma was removed. (B) The patient was stable after tumour resection. Wk, weeks; Mo, months.
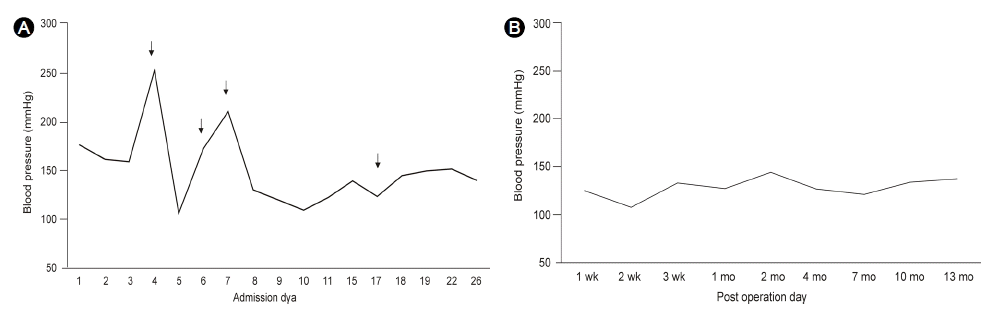
Figure 1.
(A) Contrast-enhanced abdominal computed tomography (CT) scan demonstrating a 1.7 cm mass at the upper pole of the left kidney (arrow, mass), axial view. (B) Coronal view; no definite abnormalities of the adjacent pancreas, left and right kidney, right adrenal, or liver were noted. (C) Abdominal 131I-metaiodobenzylguanidine (131I-MIBG) scintigraphy demonstrated selective concentration of the radiotracer anatomically corresponding to the CT mass on the 24-hr images. (D) Whole body, posterior view.
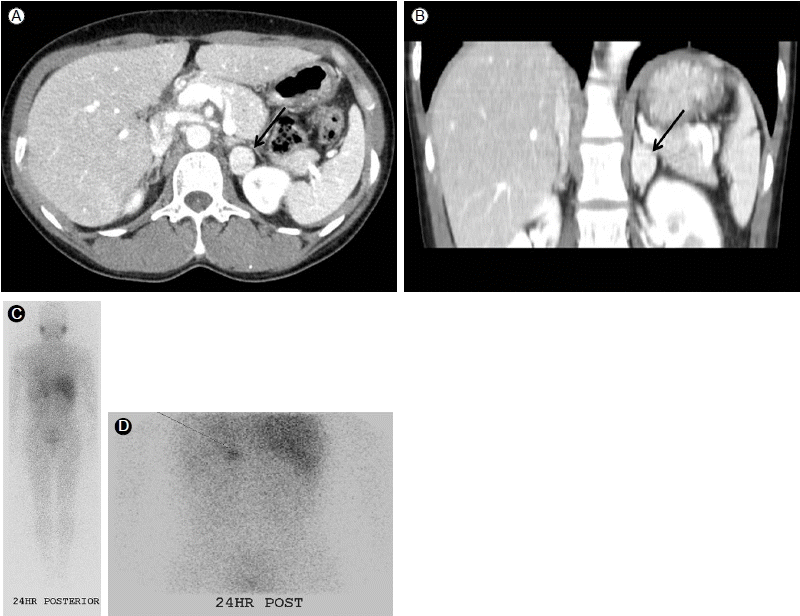
Figure 2.
Gross inspection of the resected adrenal gland. (A) The left adrenal gland was 3.5 √Ч 2.0 √Ч 0.5 cm. (B) The cut surface of the oval mass shows a well-circumscribed, diffuse, dark brownish to tan coloured tumour enclosed within an attenuated yellowish cortex (2.3 cm √Ч 2.2 cm in cross-section).
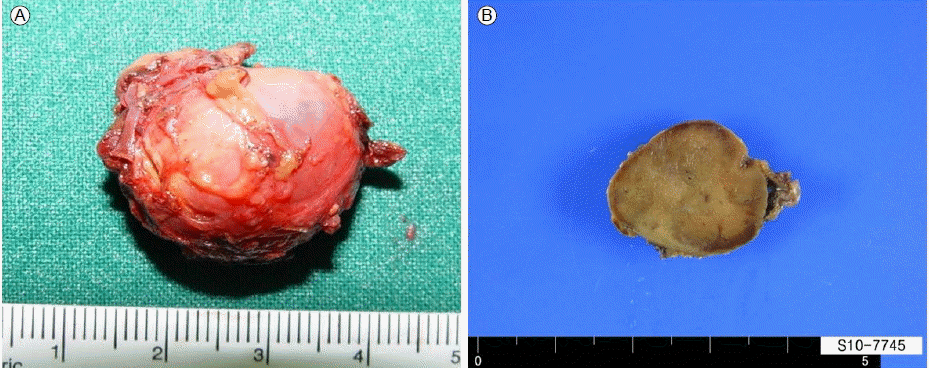
Figure 3.
Histopathology of pheochromocytoma in the left adrenal gland. (A) The tumour cells in the pheochromocytoma were arranged in an alveolar pattern (haematoxylin and eosin, √Ч 200). (B) Immunohistochemical synaptophysin staining was positive (√Ч 200). (C) Immunohistochemical chromogranin staining was positive (√Ч 200). (D) Immunohistochemical S-100 staining was less positive (√Ч 200).
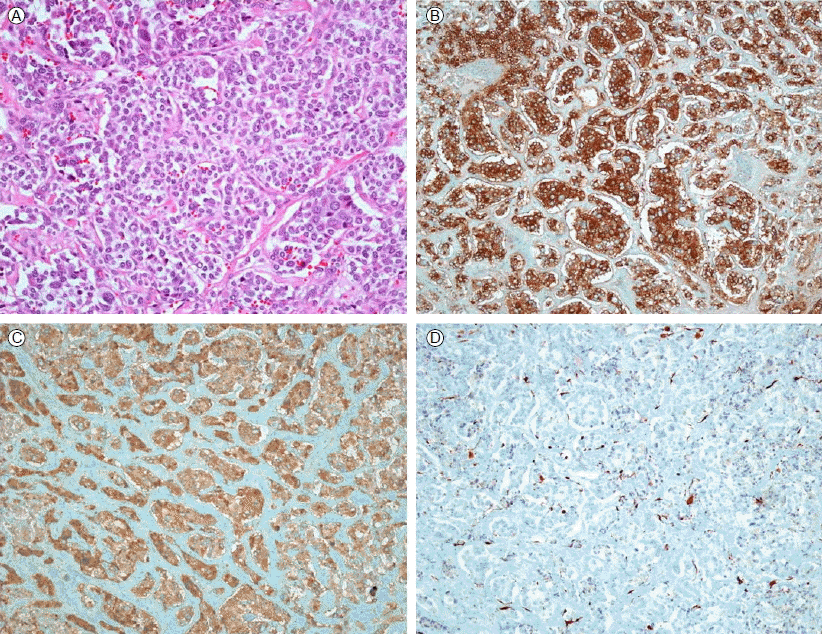
Figure 4.
Table 1.
Twenty-four-hour urine and plasma levels of catecholamines and their metabolites
| Variables |
Paroxysmal symptom |
Reference ranges | ||
|---|---|---|---|---|
| Noa | Yesb | Yesc | ||
| 24-hour urine | ||||
| вАГEpinephrine, ќЉg/day | 30.73 | 31.87 | < 40.00 | |
| вАГNorepinephrine, ќЉg/day | 42.06 | 79.03 | < 80.00 | |
| вАГMetanephrine, mg/day | 0.47 | 0.65 | 0.14-0.78 | |
| вАГVMA, mg/day | 3.81 | 5.54 | 2-10 | |
| вАГCreatinine, g/day | 1.1 | 1.2 | 0.8-2.0 | |
| Plasma | ||||
| вАГEpinephrine, pg/mL | 24.3 | < 120 | ||
| вАГNorepinephrine, pg/mL | 63.5 | < 410 | ||



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




