 |
 |
| Korean J Med > Volume 83(4); 2012 > Article |
|
ěě˝
몊ě :
결íľěą ěŹëěź ě§ë¨ě ěŹëěĄě ę˛ěŹě íľí´ ę°í¸íęł ě ěŠíę˛ ě§ë¨ě ëěě ë°ě ě ěë ěííě ě§íëĄ ADAę° ě´ěŠëęł ěë¤. ꡸ëŹë ěŹëěĄ ADAëĄ ę˛°íľěą ěŹëěźęłź ꡸ ě¸ ë¤ëĽ¸ ěŹëěźě ę°ëłí´ë´ę¸°ę° ě´ë ¤ě´ 경ě°ë ěë¤. ě´ě ěŹëěĄ ADA ę°ě´ 결íľěą ěŹëěź ě§ë¨ě ě°¸ęł ë ě ěë ěŹëěĄ ěíí ę˛ěŹ ě 돴뼟 íě¸íęł ě íěë¤.
ë°Šë˛:
ě¸ě°ěëŁěŹë¨ ě 댰ëłěěě 2004ë
6ě 19ěźëśí° 2011ë
11ě 23ěźęšě§ 42ëŞ
ě ěŹëě˛ěě ěí í ěííę˛ěŹę° ę˛°íľ ě§ë¨ ě 돴ě ę´ë ¨ ěëě§ëĽź ëśěíěë¤. ě§ë¨ę¸°ě¤ě ě íěŹ ě´ě í´ëšëěě ëě 결íľęľ°, í´ëšëě§ ěěëě ëšę˛°íľęľ°ěźëĄ ëśëĽíěë¤. ëśěě ROC 곥ě , ęľě°¨ëśě, ë¨ě ë° ë¤ě¤ ëĄě§ě¤íą íęˇëśě, ë¨ěěę´ëśěě ěííěë¤.
결곟:
ROC 곥ě ěí 결곟 ěŹëěĄ ADAě %Lymph (p)/ Glucose (p) (ěŹëěĄëŚźí꾏-íŹëëšëš: ěŹëěĄ ë°ąí꾏 ě¤ ëŚźí꾏 ë°ąëśě¨ě ěŹëěĄ íŹëëš ěěšëĄ ëë ę°; ë¨ě: %ădL/mg)ě ě íěšëĽź ę°ę° 48.5 IU/L (믟ę°ë 90.0%, íšě´ë 87.5%, ě ěíëĽ < 0.001)ě 0.678%ădL/mg (믟ę°ë 90.0%, íšě´ë 71.9%, ě ěíëĽ = 0.006)ëĄ ě íěë¤. ë¤ě¤ ëĄě§ě¤íą íęˇëśě결곟 ěŹëěĄ ADA ⼠48.5 IU/L (ęľě°¨ëš 44.24; 95% ě ë˘°ęľŹę° 2.85- 686.97; ě ěíëĽ = 0.07)ě´ěęł , ěŹëěĄ ëŚźí꾏-íŹëëšëš ⼠0.678%ădL/mg (ęľě°¨ëš 20.39; 95% ě ë˘°ęľŹę° 1.06-392.93; ě ěíëĽ = 0.046)ë íľęłě ě ěěąě´ ěěë¤. %Lymph (p)/ Glucose (p) ⼠0.678%ădL/mgęłź ADA (p) ⼠48.5 IU/L뼟 ëłíŠ(PPV 80.0% Sp 93.8%)íěě ë %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë¨ë
(PPV 47.4% Sp 68.8%), ADA (p) ⼠48.5 IU/L (PPV 69.2% Sp 87.5%) ë¨ë
ěź ëëł´ë¤ ěěąě츥ë, íšě´ëę° ěëě ěźëĄ ëěë¤.
ę˛°ëĄ :
íĽíě ëęˇëި ě°ęľŹěěë ëěźí ę˛°ęłźę° ëě¨ë¤ëŠ´ ěŹëěĄ ëŚźí꾏-íŹëëš ëšëĽź ěŹëěĄ ADAě ëłíŠíěŹ ě ěŠíë ę˛ě´ ë¨ěź 기ě¤(ěŹëěĄ ADA, ěŹëěĄ ëŚźí꾏-íŹëëšëš)ěź ëëł´ë¤ ëšę˛°íľěą ěŹëěź(NTPE, non-tuberculous pericarditis)ě ë°°ě íë ë° ë ëěě´ ëë¤.
Abstract
Background/Aims:
Adenosine deaminase (ADA) is a valuable biochemical marker for pericardial effusion (PE) and may be usefulfor diagnosing tuberculous pericarditis (TPE) in patients with PE. However, no definite cut-off or borderline values for ADAcurrently exist to distinguish TPE from other PE etiologies. In this study, we identified other useful parameters and characterizedtheir relationship with ADA as a method for diagnosing TPE.
Methods:
From June 2004 to November 2011, 42 patients underwent pericardiocentesis due to moderate or severe PE, asconfirmed by echocardiography or chest computed tomography (CT). Patients were subdivided into TPE and non-TPE (NTPE)groups. We analyzed ADA (p) (the pericardial ADA) and %Lymph (p)/Glucose (p) (the ratio between the percentage oflymphocytes and glucose levels in PE).
Results:
We defined the cut-off value of ADA (p) as 48.5 IU/L, and that of %Lymph (p)/Glucose (p) as 0.678%ădL/mg. In amultivariate logistic regression analysis, an odds ratio (OR) of 44.24 and a 95% confidence interval (CI) of 2.85-686.97 wereobserved in patients with an ADA (p) ⼠48.5 IU/L (p = 0.023). An OR of 20.39 and a 95% CI of 1.06-392.93 were observed inpatients with a %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg (p = 0.046). The combination of ADA (p) and %Lymph (p)/Glucose(p) had a higher positive predictive value (PPV, 80.0%) and specificity (Sp, 93.8%) than either ADA (p) (PPV, 47.4%; Sp, 68.8%)or %Lymph (p)/Glucose (p) (PPV, 69.2%; Sp, 87.5%) alone.
결íľěą ěŹëěź(tuberculous pericarditis, TPE)ě ě°ëŚŹëëźěě íí ě í ě ěë ě§íěźëĄ ęľë´ ëł´ęł ě ë°ëĽ´ëŠ´ ěŹëěźě¤ 결íľěąě¸ 경ě°ě ëšëę° 20-51.2%ëĄ ęľě¸ ëł´ęł ëł´ë¤ ěëší ëě í¸ě´ë¤[1-4]. ě§ë¨ě ěŹëě˛ěěě ěťě ěŹëěĄěě ę˛°íľ ě¸íŹě§ ę˛ěŹě ěŹë ěę˛ěźëĄ íě§í ě ěě§ë§, ě´ěě ë°Šë˛ě íľí´ íě§íě§ ëŞťí ę˛˝ě° ěŹëěĄě ěííě ę˛ěŹę° ę˛°íľ ě§ë¨ě 보쥰ě ë°Šë˛ě´ ë ě ěë¤. íěŹ ě ěŠí ěŹëěĄ ěííě ę˛ěŹëĄ ADA (adenosine deaminase)ę° ë댏 ě´ěŠëęł ěë¤. ě´ë ę˛ěŹë°Šë˛ě´ ëšęľě ěŠě´íęł ëě ě§ë¨ě ę°ěěąęłź íšě´ěąě ę°ě§ęł ěěźëŠ°[2,5,6], ëí ěŹëŹ ě°ęľŹěě 결íľěą ěŹëěźě ě§ë¨ě ě ěí ADA ě íěš(cut-off value)ë 40-60 IU/LěźëĄ ëł´ęł íęł ěë¤[1,6].
꡸ëŹë ADAěšë ëŽě§ë§(25.6 IU/L) ěŹë ěę˛ěě ë§ěą ěĄěě˘
ěą ëłëłě´ ë°ę˛Źëě´ ę˛°íľěą ěŹëěźěźëĄ ě§ë¨ë 경ě°ë ěęł [1], ADAę° 40 IU/LěźëĄ 결íľěą ěŹëěźěśëĄ ěěŹëěě§ë§ ěŹë ě¤íźě˘
(malignant pericardial mesothelioma)ě´ ě§ë¨ë 경ě°ë ěě´[7], ě ě ěźëĄ ADA ěěšë§ěźëĄ 결íľěą ěŹëěźě ě§ë¨íë ë°ë ě íě´ ěě ę˛ěźëĄ íë¨ëë¤[1,5].
ě
ěą ěŹëěĄ(malignant effusion)ęłź ę°ěě 기ëĽě íěŚ(hypothyroidism)ěě ë¨íľęľŹ(monocyte) ë°ąëśě¨ě´, ëĽë§í°ě¤ ěŹëěĄęłź ě¸ęˇ ěą ěŹëěĄěěë í¸ě¤ęľŹ ë°ąí꾏(neutrophil leukocyte) ë°ąëśě¨ě´ ëě ę˛[5]ęłź ëŹëŚŹ 결íľěą ěŹëěźěěë ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ě´ ëěë¤[8,9].
íë§ěĄ(pleural effusion)ě ę˛ěŹěě íŹëëš ěěšę° ëŽěěëĄ ę˛°íľěą íë§ěĄ ę°ëĽěąě´ ëěë¤ęł ëł´ęł íěë¤[10]. 결íľěą ěŹëěźě ěŹëěĄě 쥰ěŹěěë íŹëëš ěěšë íľęłíě ě ěěąě ěěěźë, ë¤ëĽ¸ ęľ°ě ëšíěŹ ę°ěĽ ëŽěë¤ęł ëł´ęł ëěë¤[1].
결íľěą ěŹëěźě ë¤ ę°ě§ ëłëŚŹíě ë¨ęł ě¤ ě´ę¸°ěë 곟댽밹í꾏 ěŚę°ěŚ(polymorphonuclear leukocytosis)ě´ ë°ěë늰 [8] ě´ě ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ě ě§ë¨ě ę°ěšę° ę°ěë ě ěě´, 댟í꾏 ë°ąëśě¨ ë¨ë
ëł´ë¤ë ěŹëěĄě ë¤ëĽ¸ 기본ě ěíí ę˛ěŹ(ě뼟 ë¤ě´ íŹëëš ěěš)ěě 쥰íŠě ęł ë ¤í ě ěë¤.
ě´ě ě ěë¤ě ěŹëě˛ě뼟 ěííěŹ ěŹëěĄě ěťě ě ěěë íě뼟 ëěěźëĄ 결íľěą ěŹëěź ě§ë¨ě 돴ě ë°ëź 결íľěą ěŹëěźęľ°(Tuberculous Pericarditis group)ęłź ëš ę˛°íľěą ěŹëěźęľ°(Non-tuberculous Pericarditis group) ë ęľ°ěźëĄ ëśëĽíęł , 결íľěą ěŹëěź ě§ë¨ě ěě´ ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ě íŹí¨í 기본 ěŹëěĄ ěíí(basic pericardial biochemical) ę˛ěŹ ě§í (parameter)ě ě§ë¨ ę°ěš ě 돴뼟 íě
íęł , ěŹëěĄěě 댟í꾏 ë°ąëśě¨ęłź íŹëëš ěěšëĽź 쥰íŠí ěëĄě´ ě§í뼟 ě ěíęł ě íë¤.
본 ě°ęľŹë 2004ë
6ě 19ěźëśí° 2011ë
11ě 23ěźęšě§ 본ěě ë´ěíěŹ ěěěŚě, íëś X-ě ę˛ěŹ, ěŹě ë ě겏 ëąěě ěŹëěĄě´ ěěŹëě´ ěíí ěŹěĽě´ěí ę˛ěŹ ëë íëśě ě°í ë¨ě¸ľě´Źěěěě ě¤ëąë ě´ěě ěŹëěĄ ě겏ě ëł´ě´ęą°ë ěëě´ëźë í¸íĄęł¤ë ě
íëě´ ěŹëě˛ě(pericardiocentesis)뼟 ěíí íě 49ëŞ
ě¤ěě ě í¨í ěŹëěĄě ěííě ę˛ěŹëĽź ěííě§ ěë 7ëŞ
ě ě ě¸íęł , 42ëŞ
ě íě뼟 ëěěźëĄ ě돴기ëĄě íľí´ ííĽě ěźëĄ 쥰ěŹíěë¤.
ěŹëěĄě ěŹěĽě´ěíě ě´ěŠíěŹ í골 íě° ë° ěŹě˛¨ëśěě ěŹë ě˛ě뼟 ěííěŹ ěťěęł ěŹë ěźěśě ěě¸ě 2004ë
ESC (European Society of Cardiology) ě§ěš¨ě ë°ëź ëśëĽíěěźëŠ°[5], 결íľěą ěŹëěźě ě§ë¨ě ěŹëěĄ ëë ꡸ ě´ě¸ě ę˛ě˛´(ě뼟 ë¤ě´ íě)ěě 결íľęˇ (Mycobacterium tuberculosis, MTB)ě 쥴ěŹę° ě
ěŚ(Definite diagnosis)ëęą°ë[5,11], ěě¸ëśëŞ
ě´ë ěěě ěźëĄ ěěŹëě´ íŹěŹë í결íľě ě ě§ěě ě¸ ěěí¸ě ě´ ěë 경ě°(Probable diagnosis)뼟 결íľěą ěŹëěĄěźëĄ ě§ë¨íěë¤[8,11-13]. ěŹëěĄěě 결íľęˇ ě 쥴ěŹę° ě
ěŚë 경ě°ę° 2ëŞ
, 경íě í결íľě ěšëŁě ë°ěě´ ěë 경ě°ę° 8ëŞ
ě´ěë¤. ě´ě ë°ëź 결íľěą ěŹëěźěźëĄ ě§ë¨ë ęľ°(Tbc., Tuberculous Pericarditis group)ęłź ě§ë¨ëě§ ěě ęľ°(Non-Tbc., Non-Tuberculous Pericarditis group)ěźëĄ ëëěë¤.
ë ęľ°ěě ADA (p) (ěŹëěĄ ADA, ë¨ě: IU/L)ě í¨ęť %Lymph (p) (ěŹëěĄ ëŚźí꾏 ë°ąëśě¨: ěŹëěĄ ë°ąí꾏 ě¤ ëŚźí꾏 ë°ąëśě¨), ë°ąí꾏, ě í꾏, íŹëëš, ě´ ë¨ë°ąě§, ěëśëŻź, ě ě° íěěí¨ě(LDH, Lactate Dehydrogenase), ěěě´ě¨ëëě§ě(pH)ě 기본ě ě¸ ěííę˛ěŹě ě§ë¨ě ę°ěš ě 돴뼟 íę°íęł , ě´ëĄëśí° ëěśë %Lymph (p)/Glucose (p) (ěŹëěĄ ëŚźí꾏-íŹëëš ëš: ěŹëěĄ ë°ąí꾏 ě¤ ëŚźí꾏 ë°ąëśě¨ě ěŹëěĄ íŹëëš ěěšëĄ ëë ę°, ë¨ě: %ădL/mg)ě ëí íľęłě ě°¨ě´ëĽź ëśěíęł ę°ëłě§ë¨ě ěŹěŠë ě ěë ě§íëĄ ě´ěŠë ě ěëě§ ěŹëśëĽź ę˛ě íěë¤.
모ë 결곟ě íľęł ě˛ëŚŹë SPSS (ver18.0K for Windows, SPSS Inc, Chicago, IL, USA)뼟 ě´ěŠíěŹ ëśěíěë¤. ě°ěëłěë íęˇ Âą íě¤í¸ě°¨(mean Âą SD)ëĄ, ë˛ěŁźíëłěë ë°ąëśě¨(percent, %)ëĄ íěíěë¤. ë ęľ° ę°ě 기본ě íšě§, ěŹëěĄ ěííě ę˛ěŹę˛°ęłźëĽź ëšęľíěŹ ě°ěëłěë Mann-Whitney test, ë˛ěŁźíëłěë Chi-squared test뼟 ěííěë¤. í본ě ěę° ěśŠëśí ë§ě ę˛˝ě° Pearson ěš´ě´ě ęłą ě¤ěě ě ꡟ ě ěíëĽ (ě쪽 ę˛ě ) ę°ě ě ííěęł , 5ëł´ë¤ ěě 기ëëšëę° ěě 경ě°ěë Fisherě âě íí ę˛ě â ëąě ě§ě íëĽ ë˛ě ě´ěŠíěë¤[14]. ë ęľ° ę°ě ěŹëěĄ ę¸°ëł¸ ěííě ę˛ěŹë ROC(receiver operation characteristics) 곥ě ě ěííěŹ ě§ë¨ě ę°ěšę° ěë ě§í뼟 ěśěśí´ë´ě´, ę°ę°ě ëí ě íěš(cut-off value)뼟 ě íěęł , ęľě°¨ëśě(Crosstab)ě ěííěë¤. ADA (p)ě ëí %Lymph (p)/Glucose (p), Glucose (p)ě ë¨ěěę´ëśě(Bivariate correlation analysis)ě ě¤ěíěë¤. ë ęľ° ę°ě ë¨ě ëĄě§ě¤íą íęˇëśě(simple logistic regression analysis)ěě íľęłě ěźëĄ ě ěí ě§í(parameter)ě¸ ADA (p), %Lymph (p)/ Glucose (p), ě
ěąęłźęą°ë Ľě 돴ě ëíěŹ ë¤ě¤ ëĄě§ě¤íą íęˇëśě(multiple logistic regression analysis)ě ěííěŹ ě¸ ę°ě§ ëłěę° ěëĄěę˛ ěŁźë ěíĽě ę°ěíěë¤. ěě ě¸ę¸íěë ROC 곥ě ëśě결곟ě ë°ëź %Lymph (p)/Glucose (p)ě ADA (p) ě íěš(cut-off value)뼟 모ë ë§ěĄąíëě§ ě 돴ě ëí ë¨ě ëĄě§ě¤íą íęˇëśě(simple logistic regression analysis)ě ěííěë¤. %Lymph (p)/Glucose (p), ADA (p), %Lymph (p)/Glucose (p) & ADA (p) (ě기 ë ě§í뼟 ëłíŠíěŹ ě ěŠ)ëłěě ëí Sp (Specificity, íšě´ë), Se (Sensitivity, 믟ę°ë), PPV (positive predictive value, ěěąě츥ë), NPV (negative predictive value, ěěąě츥ë)뼟 꾏íěŹ ěëĄ ëšęľíěë¤. pë 0.05 ě´í뼟 íľęłě ěźëĄ ě ěí ę˛ěźëĄ ě ěíěë¤.
ëě íěě ě°ë šëśíŹë 14ě¸ěě 87ě¸, íęˇ ě°ë šě 68.7 Âą 15.6ě¸ěęł ěąëłě ë¨ě 23ëŞ
(54.8%)ęłź ěŹě 19ëŞ
(45.2%)ě´ěë¤. ë´ěě íěě 기ě ě§íě í 1ęłź ę°ë¤(Table 1). 결íľě´ ě§ë¨ë ęľ°(Tbc.)ęłź 결íľě´ ě§ë¨ëě§ ěě ęľ°(Non-Tbc.)ěŹě´ě 기본 íšěą ëšęľěě ě
ěąě˘
ě ęłźęą°ë Ľ ě 돴(p = 0.031)ě´ě¸ě ëě´, ěąëł, ě°ë š, ęłźęą°ě§í, ěŹíë Ľě ë°ëĽ¸ íľęłíě ěźëĄ ě미 ěë ě°¨ě´ë ěěë¤(Table 1).
ěŹëěĄě ěě¸ěźëĄë ě 체 42ëŞ
ě¤ ě
ěąě˘
ě 12ëŞ
(28.6%), 결íľěą ěŹëěź 10ëŞ
(23.8%), ěě¸ëŻ¸ě 10ëŞ
(23.8%) ëąě´ěë¤(Table 2). ěě¸ëŻ¸ěě ëí ěśě ě§íě ě
ěąě˘
ě 3ëŞ
(30.0%), ę¸ěą ë°ě´ëŹě¤ěą ěŹëěź 1ëŞ
(10.0%), ë°ŠěŹě ěĄ°ěŹ 1ëŞ
(10.0%), ě¸ě 1ëŞ
(10.0%), ěě¸ëśëŞ
4ëŞ
(40.0%)ě´ěë¤.
íěěě ě ěŠëë Lightâs criteriaëĄ ëśëĽí늴 ěźěśěĄ(exudate)ě ëł´ě¸ 40ëŞ
(95.2%), ěŹěśěĄ(transudate) 2ëŞ
(4.8%)ě´ěë¤. 결íľě´ ě§ë¨ë ęľ°(Tbc.)ěěë %Lymph (p)ę° 76.6 Âą 18.9%ěźëĄ 결íľěą ěŹëěźě´ ě§ë¨ëě§ ěě ęľ°(Non-Tbc.) 55.2 Âą 25.5%ëł´ë¤ ëěęł (p = 0.013), ADA (p)ë 96.3 Âą 54.1 IU/L, 27.8 Âą 22.0 IU/L (p < 0.001)ëĄ ę˛°íľěą ěŹëěźěźëĄ íě§ë ęľ°(Tbc.)ěě ě미 ěę˛ ëěë¤(Table 3).
ë ęľ°ě ëí ë¨ě ëĄě§ě¤íą íęˇëśě(OR 0.11; 95% CI 0.01-0.98; p = 0.048)ěěë íľęłě ě ěěąě´ ěěěźë, ë¤ě¤ ëĄě§ě¤íą íęˇëśě(OR 0.10; 95% CI 0.00-2.27; p = 0.147)ěěë ěěë¤(Table 5).
ë ęľ°ě ëí ë¨ě ëĄě§ě¤íą ëśě 결곟 íľęłě ě ěěąě´ ěěë¤(p = 0.219), íę˛°íľ ęłźęą°ë Ľ ě 돴ě ëí ěííę˛ěŹě Mann-Whiteny ę˛ě 결곟 %Lymph (p)ěěë§ í결íľęłźęą°ë Ľě´ ěë ę˛˝ě° 84.5 Âą 9.5%, í결íľęłźęą°ë Ľě´ ěë ę˛˝ě° 57.8 Âą 25.5%ëĄ íľęłíě ě ěí ě°¨ě´ëĽź ëł´ěë¤(p = 0.022).
ADA (p)ě ě íěš(cut-off value)뼟 48.5 IU/LëĄ ě íěě ë ROC curveěě AUC (area under curve)ë 0.89 (p < 0.001), 믟ę°ë(Se)ë 90.0%, íšě´ë(Sp)ë 87.5%ě´ěęł (Fig. 1), ADA (p) ⼠48.5 IU/Lë ë ęľ° ę°ě ë¨ě ëĄě§ě¤íą íęˇëśě(OR 63.00; 95% CI 6.21-638.78; p < 0.001)ěěë íľęłě ě ěěąě´ ěěë¤.
%Lymph (p)ě ě íěš(cut-off value)뼟 73.5%ëĄ ě íěěë ROC curveěě AUCë 0.76 (p = 0.015), 믟ę°ë(Se)ë 70.0%, íšě´ë(Sp)ë 71.9%ě´ěë¤(Fig. 1).
ě기 ě íěšě ëí %Lymph (p) ⼠73.5%ë ë ęľ° ę°ě ë¨ě ëĄě§ě¤íą íęˇëśě(OR 5.96; 95% CI 1.26-28.28; p = 0.025)ěěë íľęłě ě ěěąě´ ěěěźë, ë¤ě¤ ëĄě§ě¤íą íęˇëśě(OR 4.02; 95% CI 0.45-35.90; p = 0.212)ěěë ěěë¤(Table 4).
Glucose (p)ë 결íľęľ°(Tbc.), ëšę˛°íľęľ°(Non-Tbc.) ę°ę°ěě 91.9 Âą 35.5 mg/dL, 114.5 Âą 50.1 mg/dL (p = 0.122)ëĄ, ROC curve ëśě결곟 AUC (Area Under Curve) = 0.336, p = 0.121ëĄ íľęłě ě¸ ě ěěąě´ ěěë¤.
ADA (p)ě ëí ë¨ěěę´ëśě(ě´ëłë ěę´ęłě, Personâs correlation coefficient) 결곟 r = -0.370, p = 0.016ěźëĄ ěě ě íę´ęłëĽź ëł´ěë¤(Fig. 2).
%Lymph (p)/Glucose (p)ě ë ęľ° ę°ěě ę°ę° 1.6 Âą 2.5%, 1.0 Âą 2.7% (p = 0.006)ëĄ íľęłě ě¸ ě ěěąě´ ěěęł (Table 1), ROC curve ëśě 결곟 %Lymph (p)/Glucose (p)ě ě íěš(cut-off value)뼟 0.678%ădL/mgëĄ ě íěě ë AUC 0.79(p = 0.006), Se 90.0%, Sp 71.9%ëĄ íľęłě ě¸ ě ěěąě´ ěěë¤.
ě기 ě íěšě ëí %Lymph (p)/Glucose (p) ⼠0.678 %ădL/mgë ë ęľ° ę°ě ë¨ě ëĄě§ě¤íą íęˇëśě 결곟 OR 19.80, 95% CI 2.20-178.17, p = 0.008, ë¤ě¤ ëĄě§ě¤íą íęˇëśě 결곟 OR 20.39, 95% CI 1.06-392.93, p = 0.046ëĄ íľęłě ě¸ ě ěěąě´ ěěë¤(Table 5).
ě 체 42ëŞ
ě ëěěźëĄ ADA (p)ě ëí %Lymph (p)/Glucose (p)ě ë¨ěěę´ëśě 결곟 ěę´ęłě r = 0.412 (p = 0.007)ëĄ ěě ě íę´ęł(positive correlation)ě ëł´ěë¤(Fig. 3).
ADA (p) ⼠48.5 IU/L, %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë ě§í뼟 ëěě ë§ěĄąíëě§ ě 돴ě ëí ęľě°¨ëśě결곟 OR 60.00; 95% CI 7.28-494.61; p < 0.001ëĄ íľęłíě ě ěěąě´ ěěë¤.
ěěąě츥ë(PPV), íšě´ë(Sp)ë %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë¨ë
, ADA (p) ⼠48.5 IU/L ë¨ë
, %Lymph (p)/Glucose (p) ⼠0.678%ădL/mgęłź ADA (p) ⼠48.5 IU/L뼟 ëłíŠíěě ë ę°ę° PPV 47.4% Sp 68.8%, PPV 69.2% Sp 87.5%, PPV 80.0% Sp 93.8%ěë¤(Table 6).
결íľěą ěŹëěź(tuberculous pericarditis, TPE)ě ě꾏ěěë 0-2%ëĄ ë돸 ě§íě´ë[4], ě°ëŚŹëëźěěë ěëě ěźëĄ íí ě§íě´ë¤[1-4]. 본ěě 밊돸íěŹ ę˛°íľěą ěŹëěźěźëĄ ě§ë¨íęł ěšëŁí íěë 23.8%ëĄ ęľë´ě ë¤ëĽ¸ ëł´ęł ë¤ęłź ëšěˇíěë¤.
ESC guidelineě ë°ëĽ´ëŠ´ 결íľěą ěŹëěź(TPE)ě´ ěěŹëë ę˛˝ě° ě§ë¨ě ěí´ íě°ěą ěźě(acid fast staining), 결íľęˇ ë°°ě(mycobacterial culture) ëë íę´ ěąěĽ ę°ě§(radiometric growth detection), ADA (adenosine deaminase), ě¸í°íëĄ ę°ë§(interferongamma), ěŹë 댏ěěě(pericardial lysozyme), ě¤íŠí¨ěě°ěë°ě(PCR) ëśě ëąě í ě ěë¤ęł íë¤[5,13]. Levy ëą[15]ě ëšę˛°íľěą ěŹëěź ę°ëłě ěíěŹ ë°ě´ëŹě¤ ë° ě¸ęˇ ě¤íŠí¨ěě°ěë°ě뼟 ěííěŹ ě´ 106ëŞ
ě ěŹëěź íěěě 7ëŞ
ě ë°ě´ëŹě¤ěą ěŹëěź, 4ëŞ
ě ě¸ęˇ ěą ěŹëěźě ě§ë¨íěë¤. Park ëą[16]ě 결íľěą ěŹëěź(TPE)ě ę˛˝ě° ě¤ě ěŹë ěźěśěĄěěě 결íľęˇ ë°°ěëĽ ë ëŽě ěŹë§ ěĄ°ě§ ę˛ěŹ(pericardial biopsy)ě ě´ěŠíěŹ ě§ë¨ě¨ě ëěź ě ěëě§ëĽź ëšęľíěěźë ěŹëěĄěźëĄ ěíí ë¤ëĽ¸ ě¤íě¤ ę˛ěŹëł´ë¤ ěŹë§ 쥰ě§ę˛ěŹ(pericardial biopsy)ě ě°ěěąě ě¸ę¸í기 ě´ë ľë¤ęł íěë¤. Kim ëą[1]ě ëë§ ę˛ěŹě ë°°ě ę˛ěŹě 믟ę°ëę° ëŽě íě¤ěě ěŹëěĄ ADA뼟 기ě¤ěźëĄ í 결íľěą ěŹëěźě ě§ë¨ě ë§¤ě° ě ěŠí ë°Šë˛ěźëĄ ěŹëŁëë¤ęł íěë¤[6]. ě ěë¤ě 경ě°ë 결íľěą ěŹëěź(TPE) ě§ë¨ě ěŹëěĄ ě¸í°íëĄ ę°ë§, ěŹë댏ěěě(pericardial lysozyme), ěŹë§ ěĄ°ě§ ę˛ěŹë ěííě§ ëŞťíěěźë, ěŹëěĄ ADA뼟 ě§ë¨ě ě ěŠí ě§íëĄ ěŹěŠíěë¤. 결íľęˇ íľě°ěŚíę˛ěŹ(TB-PCR)ë ěźëś íěë¤ě ëíěŹ ěíëěęł , ěěąěë ěěë¤. ë°ě´ëŹě¤ ë° ě¸ęˇ ěą ěŹëěź ę°ëłě ěí ë°ě´ëŹě¤ ë° ě¸ęˇ ě¤íŠí¨ě ě°ěë°ěě ěííě§ ëŞťíěěźë, ě¸ęˇ ë°°ě ę˛ěŹë ěíëěęł ěěąěë ěěë¤.
Adenosine deaminase (ADA)ë í¨ëŚ° ëěŹ(purine metabolism)ě ę´ěŹíë í¨ěëĄ ěŁźëĄ Těí꾏ěě ę˛ěśë늰 í ě°ęľŹě ë°ëĽ´ëŠ´ 결íľěą ěŹëěź(TPE)ě ě˝ 10-303 IU/L ě ëě ëë뼟 ëł´ě¸ë¤ęł ëł´ęł íěë¤[11,13]. ě°ęľŹě ë°ëź ě íěšë 40-60 IU/LëĄ ë¤ěíë¤[1,6,13]. 본 ě°ęľŹ 42ëŞ
ě ëěěźëĄ ěíí ROC 곥ě 결곟 ěŹëěĄ ADA ě íěšë 48.5 IU/LëĄ ëŻźę°ë 90.0%, íšě´ë 87.5%ě´ëŠ° p ę°ě 0.001 미ë§ěźëĄ ě´ě ě°ęľŹ[1,6,13] 결곟ë¤ęłź ě ěŹíěë¤. 결íľěą ěŹëěźęľ°(Tbc.)ěě ěŹëěĄ ADAě íęˇ ě 96.3 IU/L, íě¤í¸ě°¨ë Âą 54.1 IU/LëĄ 10-303 IU/L뼟 ë˛ě´ëě§ ěěë¤[11,13].
꡸ëŹë 결íľěą ěŹëěź(TPE)ęłź ę´ęłěě´ íšě ě§í(ě, 댟íě˘
)ě ADA ěěšě´ ëíë기ë íëë°[6], ě´ë ADAěšę° T-ěí꾏ě íěąě ě쥴íëŻëĄ 늴ě ě í ěíë 늴ě ěꡚěíě ë°ëź ëęą°ë ëŽę˛ ëěŹ ě ě기 ë돸ě´ë¤[1]. ě´ëĄ ě¸í´ ě ě ěźëĄ ěŹëěĄ ADAěšë§ěźëĄ 결íľěą ěŹëěź(TPE)ě ě§ë¨íë ë°ë ě íě´ ěě ę˛ěźëĄ ěŹę˛¨ě§ë¤[1]. ADAěšě ëí ě¸ę° 늴ě ěľě ë°ě´ëŹě¤(HIV, human immunodeficiency virus)ě ěíĽě ëí´ě ë
źëě´ ěě§ë§[12], 본 ě°ęľŹěě ě´ě ëí ęł ë ¤ëĽź íě§ ëŞťíěë¤.
Reuter ëą[12]ě 결íľěą ěŹëěźęľ°(Tbc., n = 142)ęłź ëšę˛°íľěą ěŹëěźęľ°(Non-Tbc., n = 61)ě ëšęľíěŹ ę˛°íľěą ěŹëěźęľ°(Tbc.)ěě ěëě ěźëĄ ěŹë ë¨ë°ąě§(pericardial protein), ěŹë 댟í꾏 ë°ąëśě¨(percentage of lymphocyte in pericardial fluid)ě´ íľęłě ěźëĄ ě ěíę˛ ëë¤ęł íěë¤. 본 ě°ęľŹěě Mann-Whitney test 결곟 결íľěą ěŹëěźęľ°(Tbc.)ěě ěëě ěźëĄ ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ ěěšę° íľęłíě ěźëĄ ëěěźë(p = 0.013), ë ęľ° ę°ě ěŹëěĄ ë¨ë°ąě§ ěěšě ě°¨ě´ë ěěë¤(p = 0.475)(Table 3). ROC 곥ě ěí 결곟 ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ě ě íěšë 73.5%ëĄ ëŻźę°ë 70.0%, íšě´ë 71.8%ěë¤. ë¨ě ëĄě§ě¤íą íęˇëśě 결곟 ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ ⼠73.5% (OR 5.96; 95% CI 1.26-28.28; p = 0.025)ë íľęłě ě ěí ě°ę´ěąě´ ěěë¤. ë¤ě¤ ëĄě§ě¤íą íęˇëśě 결곟 ěŹëěĄ ëŚźí꾏 ë°ąëśě¨ ⼠73.5% (OR 4.02; 95% CI 0.45-35.90; p = 0.212)ě íľęłě ě ěěąě´ ěěë¤(Table 4).
íě(pleural effusion)ě ííě ę˛ěŹěěë íě íŹëëš ěěšę° ëŽěěëĄ ěě¸ě´ ę˛°íľ ę°ëĽěąě´ ëë¤ęł ëł´ęł íěěźë[10], ěŹëěĄě íŹëëš ěěšě ę´í´ěë ě¸ę¸ě´ ěěë¤. 본ě 42ëŞ
ě ëěěźëĄ í ěŹëěĄ íŹëëš ěěšë ROC 곥ě , ęľě°¨ëśěěě íľęłě ěźëĄ ěëŻ¸ę° ěěë¤.
ěŹëěĄ ëŚźí꾏 ë°ąëśě¨(%)ě ëśěëĄ, ěŹëěĄ íŹëëš(mg/dL)ě ëśëŞ¨ëĄ í ěëĄě´ ě§í %Lymph (p)/Glucose (p) (ěŹëěĄëŚźí꾏-íŹëëš ëš, ěŹëěĄ ë°ąí꾏 ě¤ ëŚźí꾏 ë°ąëśě¨ě ěŹëěĄ íŹëëš ěěšëĄ ëë ę°; ë¨ě, %ădL/mg)ě ëíěŹ ëśěí´ëł´ěë¤. ë¨ě ëĄě§ě¤íą íęˇëśě 결곟 %Lymph (p)/Glucose (p) ⼠0.678%ădL/mgě OR 19.80, p = 0.008ëĄ(Table 5) %Lymph (p)ě OR 5.96, p = 0.025ëł´ë¤ ěëě ě¸ íľęłě ě ěěąě´ ëěë¤(Table 4). ěŹëěĄ ADA (Table 3), ě
ěąě˘
ě ęłźęą°ë Ľ ě 돴(Table 1)뼟 íŹí¨í ë¤ě¤ ëĄě§ě¤íą íęˇëśě 결곟 %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg (OR 20.39; 95% CI 1.06-392.93; p = 0.046), ADA (p) ⼠48.5 IU/L (OR 44.24; 95% CI 2.85-686.97; p = 0.007) ë ě§íę° íľęłíě ě ěíę˛ ě§ë¨ě ę°ěšëĽź ę°ě§ë ę˛ěźëĄ ëíëŹë¤(Table 5). ě¤ě ëĄ ADA (p) ⼠48.5 IU/L, %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë ě§í뼟 ëěě ë§ěĄąíëě§ ě 돴ě ëí ęľě°¨ëśě 결곟 íľęłě ěźëĄ ě ěíěë¤. ěěąě츥ë(PPV), íšě´ë(Sp)ë %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë¨ë
, ADA (p) ⼠48.5 IU/L ë¨ë
ěźëĄ ě ěŠíěě ëëł´ë¤ ë ě§í뼟 ëłíŠíěŹ ě ěŠíěě ë ę°ěĽ ëěë¤(Table 6). %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ęˇ¸ëŚŹęł ADA (p) ⼠48.5 IU/Lě¸ íě 10ëŞ
ě¤ 8ëŞ
ě´ ę˛°íľěą ěŹëěź(TPE)ěźëĄ ADA (p) ⼠48.5 IU/L ë¨ë
, %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë¨ë
ě¸ ę˛˝ě° ę°ę° 13ëŞ
ě¤ 9ëŞ
, 19ëŞ
ě¤ 9ëŞ
ëł´ë¤ ę˛°íľěą ěŹëěź(TPE) ě§ë¨ëšě¨ě´ ëěë¤. ëšę˛°íľęľ°(Non-Tbc.) 32ëŞ
ě ëíěŹ %Lymph (p)/Glucose (p) < 0.678%ădL/mg ëë ADA (p) < 48.5 IU/Lě¸ 30ëŞ
ě´ ëšę˛°íľěą ěŹëěź(NTPE, Non-Tuberculous Pericarditis)ěźëĄ ADA (p) ⼠48.5 IU/L ë¨ë
, %Lymph (p)/Glucose (p) ⼠0.678%ădL/mg ë¨ë
ě¸ ę˛˝ě° ę°ę° 28ëŞ
, 22ëŞ
ëł´ë¤ ëšę˛°íľěą ěŹëěź(NTPE) ě§ë¨ ëšě¨ě´ ëěë¤. ě´ě ę°ě´ ë 기ě¤ě ę°ě´ ěŹěŠíěě ëę° ë¨ěź 기ě¤(ěŹëěĄ ADA)ěź ëëł´ë¤ ę˛ěŹ ěěąě 결íľěą ěŹëěź(TPE) ę°ëĽěą, ëšę˛°íľěą ěŹëěźě ę˛ěŹ ěěąěź ę°ëĽěąě´ ëěë¤.
ěľęˇź ěŹëěĄ LDH (lactate dehydrogenase)ě íě˛ LDHęłźě ëšě¨(P/S LDH ratio)ě ě§ë¨ě ę°ěšę° ě¸ę¸ëěěźë[17], 본ě íěë¤ě ěŹëěĄ LDHě íě˛ LDHě 츥ě ěę¸°ę° 24ěę° ě´ě ě°¨ě´ ěë 경ě°ę° ë§ě ëśěě ěíí ě ěěë¤. ꡸ëŹë ěŹëěĄ LDH ěěšě 결íľě§ë¨ě 돴ě ëí ęľě°¨ëśěě ěííěë¤. 결곟ë p = 0.118ëĄ íľęłíě ě미ë ěěë¤.
본 ě°ęľŹë 본ěě 밊돸íěŹ ěŹë ě˛ěě ě ë°ě 경ě°ëĄ ě ííě기 ë돸ě ěŹëěĄ íě 모ë뼟 ëíí ěë ěë¤. 결íľěą ěŹëěź(TPE)ě íěěę° 10ëŞ
ěźëĄ íľęłíě ěëŻ¸ę° ě˝í´ě§ ě ěë¤. ëí 결íľěą ěŹëěź(TPE)ęłź ëšę˛°íľěą ěŹëěź(NTPE)ě 꾏ëśí기 ěí ę˛ěŹę° 윊ëśí ě´ëŁ¨ě´ě§ě§ ěě ě ëł´í¸ę˛Ź(information bias)ě ë°ěě ěę°í ěë ěë¤[18]. ADA (p)ě ëí Glucose (p), %Lymph (p)/Glucose (p)ě ěę´ę´ęłěě ę° ëśěë§ë¤ 1-2ëŞ
ě ëë¨ě´ě§ ěěšë¤ëĄ ě¸í´ 결곟ę°ě´ ě곥ëěě ę°ëĽěąë ë°°ě í ě ěë¤(Figs. 2 and 3).
ë¨ëłëëśě결곟ě ë°ëź ë¤ëłëëśě ě 결곟ě ěíĽě ëŻ¸ěš ě ěë ADA (p), %Lymph (p)/Glucose (p), ě
ěąęłźęą°ë Ľě 돴 ě´ě¸ě ë¤ëĽ¸ ěě¸ë¤ě ęł ë ¤íě§ ěěë¤. ëě´, ěąëł, ě
ěą ęłźęą°ë Ľě 돴 ě´ě¸ě 기ě ě§íě ë¨ëłëëśě 결곟 íľęłě ěźëĄ ě ěíě§ ěěë¤(Table 1).
본ěěěë 결íľěą ěŹëěź ě§ë¨ę¸°ě¤ě ěě ěëĄ ěě ě¸ę¸íěë ěŹëě˛ěěě ěťě ěŹëěĄě ę˛°íľ ě¸íŹě§ ę˛ěŹëĽź íŹí¨íěěźë, 본ěěě ě´ëŁ¨ě´ě§ě§ ěě ěŹë ěę˛ě ě ě¸íěęł , íě§(definite diagnosis)뼟 ěí 윊ëśí ę˛ěŹë ě´ëŁ¨ě´ě§ě§ ěěë¤[5,13,15]. Mayosi ëą[8]ě ěŹëěĄěě 결íľęˇ (mycobacterium tuberculosis, MTB)ě 쥴ěŹę° ě
ěŚëë ę˛˝ě° íě§(definite tuberculous pericarditis)ě´ëź ě íěęł , ꡸ ě´ě¸ě ę˛ě˛´(ě뼟 ë¤ě´ íě)ěě 결íľęˇ ě 쥴ěŹíęą°ë ěěě ěźëĄ ěěŹëě´ íŹěŹë í결íľě ě ě§ěě ě¸ ěěí¸ě ě´ ěë ę˛˝ě° ę˛°íľěą ěŹëěź(TPE) ę°ëĽěąě´ ěě´(probable tuberculous pericarditis) ě§ë¨ę¸°ě¤ě íŹí¨ěěź°ěë¤. ꡸ ě´ě¸ě ë
źëŹ¸ěěë ěěě íë¨íě íŹěŹë í결íľě ě ě§ěě ě¸ ěěí¸ě ě´ ěě 경ě°ëĽź 결íľěą ěŹëěź(TPE)ěźëĄ ě§ë¨íěë¤[11-13,19]. Park ëą[16]ě ě°ęľŹěě 쥰ě§íě ěźëĄ 결íľě´ íě§ë 15ě ě¤ 10ě(66.7%)ěě íęˇ 23ę°ěę° ěśě ę˛ěŹě ěěěŚěě í¸ě ęłź íëś ë°ŠěŹě ě´Źěě´ë ěŹě´ěíëě ěŹëěźěśě ěí´ëĽź ëłź ě ěěęł , ěĄ°ě§ ę˛ěŹě 결íľě´ íě§ëě§ë ěěěźë 경íě ěźëĄ í결íľěëłě ěíí 경ě°ëĽź ě´í´ 보늴 ěĄ°ě§ ę˛ěŹě ë§ěą ěźěŚě겏ě ëł´ěë 19ěě ěŹě í ě겏ě ëł´ěë 7ěě 26ě ě¤ 18ě(69.2%)ěě ěí´ëĽź ëł´ěŹ ě¤ě ě ěźëĄ 결íľě íě§íęł ëě ěšëŁëĽź í ę˛ęłź ꡸ë ě§ ěě 경ě°ëĽź ëšęľíě ë ꡸ 경곟ě ěě´ě ëłë¤ëĽ¸ ě°¨ě´ę° ěěě ě ě ěë¤ęł íěë¤.
í ě°ęľŹěě ěŹëěĄ LDHě ě§ë¨ě ę°ěš[17]뼟 ě¸ę¸í ę˛ęłź ę°ě´ 본 ë
źëŹ¸ě 결íľěą ěŹëěź(TPE) ě§ë¨ě ěě´ ěŹëěĄëŚźí꾏-íŹëëš ëšëźë ěëĄě´ ě§í뼟 ě ěíěë¤ë ë°ě ěëŻ¸ę° ěě ę˛ěźëĄ ěŹëŁëë¤. ë°ëźě 결íľěą ěŹëěź(TPE)ě ě§ë¨ě 결ě íë ë° ěě´, ě´ ěŹëěĄ ëŚźí꾏-íŹëëš ëšëźë ě§íę° ëěě´ ëëě§ ě 돴뼟 ěŹíę°í´ěź íë¤. íĽíě ëęˇëި ě°ęľŹěěë ěŹëěĄ ADA, ěŹëěĄ ëŚźí꾏-íŹëëš ëšëĽź ëłíŠíěŹ ě ěŠíěě ëę° ę°ę° ë¨ë
ěźëĄ ěŹěŠíěě ëëł´ë¤ ěëě ěźëĄ ëě ěěąě츥ë, íšě´ë뼟 ëł´ě´ęł íľęłě ě ěěąě´ ěë¤ëŠ´ í결íľě˝ě íŹěŹ ě 결íľěą ěŹëěźě íě¸íëë° ěŹëěĄ ëŚźí꾏-íŹëëš ëšę° ě°¸ęł ë ě ěë¤.
REFERENCES
1. Kim DY, Park JH, Shin JD, et al. Long-term follow-up results and clinical manifestations of patients with a moderate to large amount of pericardial effusion. Korean J Med 2008;74:154â161.
2. Park KS, Kim CH, Min BC, Choe KH. Diagnostic value of adenosine deaminase activity in tuberculous pericardial effusion. Korean Circ J 1990;20:141â147.

3. Eo WK, Lee SK, Choi CJ, et al. Clinical studies on the etiology and clinical course of pericardial effusions. Korean Circ J 1990;20:211â219.

4. SagristĂ -Sauleda J, MercĂŠ AS, Soler-Soler J. Diagnosis and management of pericardial effusion. World J Cardiol 2011;26:135â143.

5. Maisch B, SeferoviÄ PM, RistiÄ AD, et al. Guidelines on the diagnosis and management of pericardial diseases executive summary; the Task Force on the diagnosis and management of pericardial diseases of the European society of cardiology. Eur Heart J 2004;25:587â610.


6. Tuon FF, Litvoc MN, Lopes MI. Adenosine deaminase and tuberculous pericarditis: a systematic review with metaanalysis. Acta Trop 2006;99:67â74.


7. Cho I, Chun EJ, Jeon KH, et al. A case of malignant pericardial mesothelioma misdiagnosed as tuberculosis pericarditis. Korean J Med 2009;76(Suppl 1):S81âS85.
9. Augustin P, Desmard M, Mordant P, et al. Clinical review: intrapericardial fibrinolysis in management of purulent pericarditis. Crit Care 2011;15:220.



10. Barber LM, Mazzadi L, Deakins DD, Reese CN, Rogers WL. Glucose level in pleural fluid as a diagnostic aid. Dis Chest 1957;31:680â687.


11. Cherian G. Diagnosis of tuberculous aetiology in pericardial effusions. Postgrad Med J 2004;80:262â266.



12. Reuter H, Burgess L, van Vuuren W, Doubell A. Diagnosing tuberculous pericarditis. QJM 2006;99:827â839.


13. Burgess LJ, Reuter H, Carstens ME, Taljaard JJ, Doubell AF. The use of adenosine deaminase and interferon-gamma as diagnostic tools for tuberculous pericarditis. Chest 2002;122:900â905.


14. Ahn JO. Statistical Analysis of Biomedical Data Using SPSS 18.0. 1st ed. rev. 3Seoul: Hannarae Publishing Co, 2011.
15. Levy PY, Fournier PE, Charrel R, Metras D, Habib G, Raoult D. Molecular analysis of pericardial fluid: a 7-year experience. Eur Heart J 2006;27:1942â1946.


16. Park SY, Kim KS, Bae JH, Kim YH. The usefulness of pericardial biopsy to evaluate the causes of pericardial disease. Korean Circ J 1999;29:517â522.

17. Kim SE, Park DG. Diagnostic value of lactate dehydrogenase in pericardial effusions in patients undergoing pericardiocentesis. Korean J Med 2012;82:194â199.

The ROC curves for discriminating the Tbc from the Non-Tbc groups using cut-off levels for ADA (p), %Lymph (p)/Glucose (p), and %Lymph (p). ADA (p), pericardial ADA; %Lymph (p)/Glucose (p), ratio between the percentage of lymphocytes and glucose levels in pericardial fluid; ROC, receiver operating characteristic; AUC, area under the curve; Tbc, tuberculous group; Non-Tbc, non- tuberculous group.

Figure 1.
Correlation between Glucose (p) and ADA (p). (p), pericardial; Glucose (p), the level of glucose in the pericardial fluid. The correlation was analyzed by Pearsonâs correlation analysis (r = -0.370, p = 0.016).
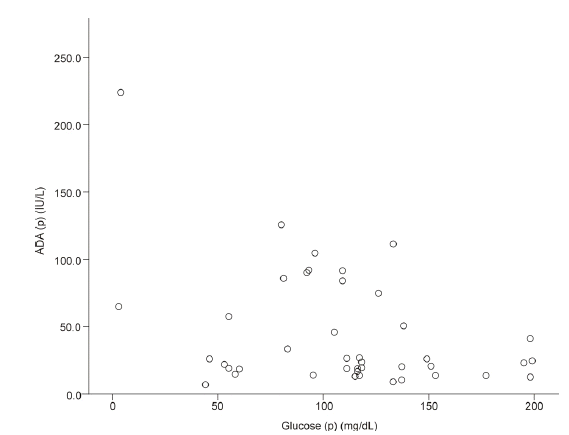
Figure 2.
The correlation between %Lymph (p)/Glucose (p) and ADA (p). (p), pericardial; %Lymph (p)/Glucose (p), ratio between the percentage of lymphocytes and glucose levels in pericardial fluid. The correlation was analyzed by Pearsonâs correlation analysis (r = 0.412, p = 0.007).
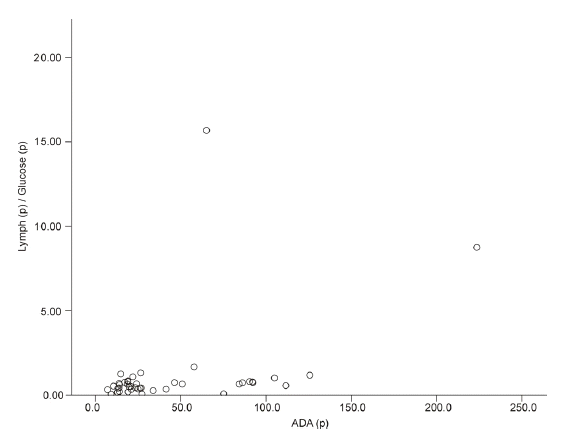
Figure 3.
Table 1.
Baseline characteristics between the two groups
| Etiology | Total (n = 42) |
Subgroup |
p | ||
|---|---|---|---|---|---|
| Parameters | Tbc (n = 10) | Non-Tbc (n = 32) | |||
| Age, yr | 68.7 Âą 15.6 | 74.0 Âą 5.6 | 67.0 Âą 17.4 | 0.315 | |
| Sex, M/F | 23/19 (54.8/45.2) | 5/5 (50.0/50.0) | 18/14 (56.3/43.8) | 0.729 | |
| Underlying disease | |||||
| âHTN | 20 (47.6) | 5 (50.0) | 17 (53.1) | 0.863 | |
| âDM | 10 (23.8) | 0 (0.0) | 10 (31.2) | 0.084 | |
| âPul. Tbc | 4 (9.5) | 2 (20.0) | 2 (6.3) | 0.236 | |
| âIHD | 4 (9.5) | 0 (0.0) | 4 (12.5) | 0.557 | |
| âCHF | 5 (11.9) | 0 (0.0) | 5 (15.6) | 0.315 | |
| âA. fib | 6 (14.3) | 3 (30.0) | 3 (9.4) | 0.135 | |
| âHypothyroidism | 3 (7.1) | 0 (0.0) | 3 (9.4) | 0.315 | |
| âCKD | 2 (4.8) | 0 (0.0) | 2 (6.3) | > 0.999 | |
| âMalignancya | 17 (40.5) | 1 (10.0) | 16 (50.0) | 0.031 | |
| Social History | |||||
| âAlcohol | 9 (21.4) | 0 (0.0) | 9 (28.1) | 0.086 | |
| âSmoking | 3 (7.1) | 0 (0.0) | 3 (9.4) | > 0.999 | |
Statistical analyses were performed between the tuberculous and non-tuberculous groups. Age was analyzed by the Mann-Whitney U-test. Other parameters were analyzed by chi-square tests. Data are mean Âą standard deviation or n (%).
Table 2.
Cause of pericardial effusion
Table 3.
Blood chemistry findings of patients with pericardial effusion
Table 4.
Logistic model coefficients for %Lymph (p) between the Tbc and Non-Tbc groups
Table 5.
Logistic model coefficients for %Lymph (p)/Glucose (p) between the Tbc and non-Tbc groups
Table 6.
Diagnostic properties of %Lymph (p)/Glucose (p), ADA (p), and %Lymph (p)/Glucose (p) & ADA (p) between the Tbc and Non-Tbc groups
| Sensitivity | Specificity | PPV | NPV | |
|---|---|---|---|---|
| %Lymph (p)/Glucose (p) | 90.0% | 68.8% | 47.4% | 95.7% |
| ADA (p) | 90.0% | 87.5% | 69.2% | 96.6% |
| %Lymph (p)/Glucose (p) & ADA (p) | 80.0% | 93.8% | 80.0% | 93.8% |
(p), pericardial; %Lymph (p)/Glucose (p), ratio between the percentage of lymphocytes and glucose levels in pericardial fluid; %Lymph (p)/Glucose (p) & ADA (p), the combination of %Lymph (p)/Glucose (p) and ADA (p); PPV, positive predictive value; NPV, negative predictive value; Tbc, tuberculous group; Non-Tbc, non-tuberculous group.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




