 |
 |
| Korean J Med > Volume 83(3); 2012 > Article |
|
žöĒžēĹ
žĶúÍ∑ľ ÍįÄžĚīŽďúŽĚľžĚłžĚĄ Ž≥īŽ©ī PTUžĚė ÍįĄŽŹÖžĄĪ Ž∂ÄžěĎžö©Í≥ľ ÍīÄŽ†®Ūēėžó¨ ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ě žĻėŽ£ĆŽ°ú Ž©ĒŪčįŽßąž°łžĚĄ žā¨žö©ŪēėŽŹĄŽ°Ě Í∂Ćžě•ŪēėÍ≥† žěąŽč§. Í∑łŽü¨Žāė Žß§žöį ŽďúŽ¨ľžßÄŽßĆ Ž©ĒŪčįŽßąž°łžóź žĚėŪēīžĄú ÍįĄŽŹÖžĄĪžĚī ŽįúžÉĚŪē† žąė žěąÍ≥†, Ž≥ł ž¶ĚŽ°Äž≤ėŽüľ ÍįĄžĚīžčĚžĚī ŪēĄžöĒŪē† ž†ēŽŹĄŽ°ú žč¨ÍįĀŪēú ÍįĄŽ∂Äž†ĄžĚĄ žĚľžúľŪā¨ žąėŽŹĄ žěąŽč§. ž†ÄžěźŽď§žĚÄ 60žĄł Žā®žěź ŪôėžěźÍįÄ Ž©ĒŪčįŽßąž°łžĚĄ Ž≥Ķžö©Ūēú ŪõĄ ÍįĄŽ∂Äž†ĄžĚī ŽįúžÉĚŪēėžó¨ ÍįĄžĚīžč̞̥ žčúŪĖČŪēú ž¶ĚŽ°ÄŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź Ž¨łŪóĆÍ≥†žįįÍ≥ľ Ūē®ÍĽė Ž≥īÍ≥†ŪēėžėÄŽč§.
Abstract
Antithyroid drugs inhibit the synthesis and excretion of thyroid hormone from the thyroid gland. Propylthiouracil (PTU) and methimazole are well known as antithyroid drugs. In 2011, the American Thyroid Association and American Association of Clinical Endocrinologists published management guidelines for hyperthyroidism and other causes of thyrotoxicosis, and recommended methimazole as the first-choice antithyroid drug for the treatment of hyperthyroidism. Lower hepatotoxicity is an advantage of methimazole. Fulminant hepatitis rarely occurs in methimazole users, and spontaneous recovery is expected even if it does occur. We describe a rare case of acute liver failure after methimazole intake in a 60-year-old man who underwent liver transplantation. (Korean J Med 2012;83:363-368)
ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶ĚžĚė žĻėŽ£Ćž†úŽ°úŽäĒ ŪĀ¨Í≤Ć thiomidazole (carbimazole, methimazole)Í≥ľ propylthiouracil (PTU)žĚī žā¨žö©ŽźėŽ©į žĚī ž§Ď carbimazoležĚÄ ž≤īŽāīžóź ŪĚ°žąėŽźėžĖī Ž©ĒŪčįŽßąž°ł(methimazole)Ž°ú ŽĻ†Ž•īÍ≤Ć ŽĆÄžā¨ŽźėžĖī žěĎžö©žĚĄ ŽāėŪÉÄŽāłŽč§. žĚīŽü¨Ūēú Ūē≠ÍįĎžÉĀžĄ†ž†úžĚė žĻėŽ£Ć ž§Ď ŽįúžÉĚŪē† žąė žěąŽäĒ Ž∂ÄžěĎžö©žúľŽ°úŽäĒ ŽĎźŽďúŽü¨ÍłįŽāė ŽįúžßĄ, ÍīÄž†ąžóľ, žÜĆŪôĒŽ∂ąŽüČžĚī žěąžúľŽ©į, ŽďúŽ¨ľÍ≤Ć žĻėŽ™Öž†ĀžĚł Ž∂ÄžěĎžö©žúľŽ°ú Ž¨īÍ≥ľŽ¶ĹÍĶ¨ž¶ĚžĚīŽāė ŽŹÖžĄĪÍįĄžóľžĚī ŽįúžÉĚŪē† žąė žěąŽč§[1]. žĶúÍ∑ľ ŽĮłÍĶ≠ ÍįĎžÉĀžĄ†ŪēôŪöĆ ŽįŹ ŽĮłÍĶ≠ žěĄžÉĀŽāīŽ∂ĄŽĻĄžĚėžā¨ŪöĆ(American Thyroid Association and American Association of Clinical Endocrinologist)žóźžĄú 2011ŽÖĄ žÉąŽ°úžöī ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ě žĻėŽ£Ć ÍįÄžĚīŽďúŽĚľžĚłžĚĄ ž†úžčúŪēėžėÄŽč§. Í∑ł ÍįÄžĚīŽďúŽĚľžĚłžóź ŽĒįŽ•īŽ©ī PTUžĚė žč¨ÍįĀŪēú ÍįĄŽŹÖžĄĪ Ž∂ÄžěĎžö©Í≥ľ ÍīÄŽ†®Ūēī ŪäĻžąėŪēú ŽĎź ÍįÄžßÄ Í≤Ĺžöį, ž¶Č žěĄžč† žīąÍłį(first trimester of pregnancy)Žāė ÍįĎžÉĀžĄ† ž§ĎŽŹÖŽįúžěĎ(thyroid storm)žĚė Í≤ĹžöįŽ•ľ ž†úžôłŪēėÍ≥†ŽäĒ Ž©ĒŪčįŽßąž°łžĚĄ ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ě žĻėŽ£Ćž†úŽ°ú žā¨žö©ŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėÍ≥† žěąŽč§[2]. ŪēėžßÄŽßĆ Ž©ĒŪčįŽßąž°łžóź žĚėŪēú ÍįĄžÜźžÉĀŽŹĄ ÍĶ≠Žāīžôł Ž¨łŪóƞ̥ Í≥†žįįŪēī Ž≥ł Í≤įÍ≥ľ žßÄÍłąÍĻĆžßÄ žīĚ 30žó¨ÍįúžĚė ž¶ĚŽ°Ä(ÍĶ≠ŽāīžóźžĄú 10žėą(Table 1), ŪēīžôłžóźžĄú 20žó¨ÍįúžĚė ž¶ĚŽ°Ä)ÍįÄ Ž≥īÍ≥†ŽźėÍ≥† žěąŽäĒŽćį, žĚī ž§Ď žĄł ž¶ĚŽ°ÄŽ•ľ ž†úžôłŪēėÍ≥†ŽäĒ Ž©ĒŪčįŽßąž°ł Ūą¨žēŞ̥ ž§ĎžßÄŪēú ŪõĄ ÍįĄ ÍłįŽä•žĚī ŪöĆŽ≥ĶŽźėžóąŽćė ž¶ĚŽ°ÄŽď§žĚīžóąŽč§. žĄł ž¶ĚŽ°Ä(ÍĶ≠Žāī 1žėą, ÍĶ≠žôł 2žėą)žóźžĄúŽßĆ žĻėŽ™Öž†ĀžĚł ÍįĄŽŹÖžĄĪžĚĄ žīąŽěėŪēėžėÄŽäĒŽćį, ÍĶ≠Žāī ž¶ĚŽ°Ä[3]ŽäĒ žĚīŽĮł BŪėē ŽįĒžĚīŽü¨žä§ ÍįĄžóľžóź žĚėŪēú ÍįĄÍ≤ĹŪôĒŽ•ľ Íłįž†ÄžßąŪôėžúľŽ°ú ÍįÄžßÄÍ≥† žěąžóąŽćė ŪôėžěźžėÄŽč§. ÍĶ≠žôłžĚė Ūēú ž¶ĚŽ°Ä[4]ŽäĒ ŽŹÖžĄĪÍįĄžóľÍ≥ľ ŽŹôŽįėŪēú Íįźžóľž¶ĚžúľŽ°ú žěÖžõź 18žĚľžßł žā¨ŽßĚŪēėžėÄŽćė ž¶ĚŽ°ÄžėÄÍ≥†, Žč§Ž•ł ž¶ĚŽ°Ä[5]ŽäĒ ÍįĄžĚīžčĚÍĻĆžßÄ žčúŪĖČŽįõžēėžúľŽāė žúĄžě•ÍīÄ ž∂úŪėąŽ°ú žā¨ŽßĚŪēėžėÄŽćė ž¶ĚŽ°ÄŽ°ú ž≤ėžĚĆ žčúŪĖČŪēú žīąžĚĆŪĆƞ󟞥ú ÍįĄ žúĄž∂ēžĚī ÍīÄžįįŽźėžĖī Žč§Ž•ł Íłįž†Ä ÍįĄžßąŪôėžĚī žěąžóąžĚĄ ÍįÄŽä•žĄĪžĚī žěąŽäĒ ŪôėžěźžėÄŽč§. ŪäĻŪ칎āė Ž©ĒŪčįŽßąž°łžóź žĚėŪēú ÍįĄŽ∂Äž†ĄžúľŽ°ú, ÍįĄžĚīžč̞̥ žčúŪĖČŪēú žėąŽäĒ žßÄÍłąÍĻĆžßÄ žēěžóźžĄú žĖłÍłČŪēú ž¶ĚŽ°Ä žôłžóźŽäĒ Ž≥īÍ≥†Žźú ŽįĒÍįÄ žóÜŽč§.
ž†ÄžěźŽäĒ Žč§Ž•ł Íłįž†ÄžßąŪôėžĚī žóÜŽćė 60žĄłžĚė Ūēú Žā®žĄĪžĚī Í∑łŽ†ąžĚīŽłĆžä§Ž≥Ϟ̥ žßĄŽč®ŽįõÍ≥† Ž©ĒŪčįŽßąž°łžĚĄ Ž≥Ķžö© Ūēú ŪõĄ, ÍįĄŽ∂Äž†ĄžĚī ŽįúžÉĚŪēėžó¨ ÍįĄžĚīžčĚÍĻĆžßÄ žčúŪĖČ ŽįõžĚÄ ž¶ĚŽ°ÄŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź Ž¨łŪóĆÍ≥†žįįÍ≥ľ Ūē®ÍĽė Ž≥īÍ≥†ŪēėÍ≥†žěź ŪēúŽč§.
Ūôė žěź: 60žĄł, Žā®žěź
ž£ľ žÜĆ: Žāīžõź ŪēúŽč¨ ž†ĄŽ∂ÄŪĄį ŽįúžÉĚŪēú Ūô©Žč¨
ŪėĄŽ≥ĎŽ†•: ž†ēŪôēŪěą žĖłž†úŽ∂ÄŪĄįžĚłžßÄ Ž™®Ž•īŽäĒ 6 kgžĚė Ž™łŽ¨īÍ≤Ć ÍįźžÜĆ, žÜź ŽĖ®Ž¶ľ, žčĚžĚÄŽēÄžĚī ŪĚźŽ•īŽäĒ ž¶ĚžÉĀžĚī žěąžóąŽćė ŪôėžěźžĚīŽč§. Žāīžõź 2ÍįúžõĒ ž†Ą ŪöĆž†ĄÍ∑ľÍįú žÜźžÉĀžúľŽ°ú ÍįúžĚłŽ≥ĎžõźžóźžĄú žąėžą†žĚĄ ž§ÄŽĻĄŪēėŽ©į, žÉĀÍłį ž¶ĚžÉĀžóź ŽĆÄŪēī Ūėąžē°Í≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄÍ≥† ÍįĎžÉĀžĄ†žěźÍ∑ĻŪėłŽ•īŽ™¨ (TSH) 0.01 mIU/L ŽĮłŽßĆ(ž†ēžÉĀ, 0.4-5.0), žú†Ž¶¨ T4 3.2 ng/dL (ž†ēžÉĀ, 0.8-1.9), Ūē≠ÍįĎžÉĀžĄ†Í≥ľžāįŪôĒŪö®žÜĆŪē≠ž≤ī(anti-thyroid peroxidase antibody)ÍįÄ 1,849 U/mL (ž†ēžÉĀ, 0-60)Ž°ú žĖĎžĄĪžĚīžóąŽč§. ÍįĎžÉĀžĄ†žīąžĚĆŪĆĆÍ≤Äžā¨žóźžĄú ÍįĎžÉĀžĄ†žóź Í≤įž†ąžĚÄ žóÜžúľŽāė ŽĮłŽßĆžĄĪžúľŽ°ú ÍįĎžÉĀžĄ†žĚī žĽ§ž†ł žěąžóąŽč§. Í∑łŽ†ąžĚīŽłĆžä§Ž≥ĎžúľŽ°ú žßĄŽč®ŽįõÍ≥†, Ž≤†ŪÉÄžį®Žč®ž†úžôÄ Ž©ĒŪčįŽßąž°ł 10 mgžĚĄ ŪēėŽ£® ŽĎź Ž≤ąžĒ© Ž≥Ķžö©ŪēėÍłį žčúžěĎŪēėžėÄŽč§. ŽčĻžčú žčúŪĖČŪēú Ūėąžē°Í≤Äžā¨žóźžĄú aspartate aminotransferase (AST) 23 IU/L, alanine transferase (ALT) 29 IU/L, žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 1.2 mg/dLŽ°ú ÍįĄÍłįŽä• Í≤Äžā¨žóźžĄú ŪäĻžĚīžÜĆÍ≤¨žĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§. Ž©ĒŪčįŽßąž°łžĚĄ ŪēėŽ£® ŽĎź Ž≤ą 10 mgžĒ© 15žĚľÍįĄ Ž≥Ķžö©ŪēėŽč§ÍįÄ žĚīŪõĄ ŪēėŽ£® žĄł Ž≤ą 15 mgžúľŽ°ú ž¶ĚŽüČŪēėžó¨ 8žĚľÍįĄ ŽćĒ Ž≥Ķžö©ŪēėžėÄžúľŽāė, ž†Ąžč† žá†žēĹÍįźÍ≥ľ Ūô©Žč¨ ž¶ĚžĄłÍįÄ žěąžĖī žôłŽ∂ÄŽ≥ĎžõźžĚĄ Žį©Ž¨łŪēėžėÄŽč§. Ž©ĒŪčįŽßąž°ł Ž≥Ķžö©žĚĄ ž§ĎŽč®ŪēėÍ≥† Ūēú Žč¨ÍįĄ Í≤ĹÍ≥ľÍīÄžįįŪēėžėÄžúľŽāė Ūô©Žč¨ ž¶ĚžĄłÍįÄ Ūėłž†ĄŽźėžßÄ žēäžēĄ Ž≥łžõźžúľŽ°ú ž†ĄžõźŽźėžóąŽč§. ŪēúžēĹžĚīŽāė Žč§Ž•ł žēĹŽ¨ľžĚė Ž≥Ķžö©Ž†•žĚÄ žóÜžóąŽč§.
Í≥ľÍĪįŽ†• ŽįŹ ÍįÄž°ĪŽ†•: ŪäĻžĚī žÜĆÍ≤¨ žóÜžóąŽč§.
žĚīŪēôž†Ā žÜĆÍ≤¨: Žāīžõź ŽčĻžčú ŽßĆžĄĪ Ž≥ĎžÉȞ̥ Ž≥īžėÄžúľŽ©į ŪôúŽ†•ž¶ĚŪõĄŽäĒ Ūėąžēē 106/64 mmHg, Žß•Žįē 100ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąė 16ŪöĆ/Ž∂Ą, ž≤īžė®žĚÄ 36.5‚ĄÉžėÄŽč§. žĚėžčĚžĚÄ Ž™ÖŽ£ĆŪĖąÍ≥†, Í≥ĶŽßČžĚė Ūô©Žč¨ žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąžúľŽāė žēąÍĶ¨ŽŹĆž∂úžĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§. Í≤ĹŽ∂Ğ󟞥ú ž†ÄŽ™ÖŪēú ÍįĎžÉĀžĄ† ŽĻĄŽĆÄŽāė žēēŪÜĶžĚÄ žóÜžóąžúľŽ©į, ŽßĆž†łžßÄŽäĒ Í≤ĹŽ∂Ä Ž¶ľŪĒĄž†ąŽŹĄ žóÜžóąŽč§. ŪėłŪĚ°žĚĆÍ≥ľ žč¨žĚƞ󟞥ú ŪäĻžĚīžÜĆÍ≤¨ ÍīÄžįįŽźėžßÄ žēäžēėÍ≥†, Ž≥ĶŽ∂ÄÍ≤Äžā¨žóźžĄú žöįžÉĀŽ≥ĶŽ∂Äžóź ÍįĄŽĻĄŽĆÄŽāė žēēŪÜĶžĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: ž†Ąžõź ŽčĻžčú Ž≥łžõźžóźžĄú žčúŪĖČŪēú ÍįĎžÉĀžĄ† ÍłįŽä• Í≤Äžā¨žÉĀ ÍįĎžÉĀžĄ†žěźÍ∑ĻŪėłŽ•īŽ™¨ 0.05 mIU/L ŽĮłŽßĆ, žú†Ž¶¨ T4 3.9 ng/dL, ÍįĎžÉĀžĄ†žěźÍ∑ĻŪėłŽ•īŽ™¨Í≤įŪē©žĖĶž†úŽ©īžó≠ͳĎ°úŽ∂ąŽ¶į(Thyrotropin Binding Inhibiting Immunoglobulin, TBII) 19.2 IU/L (ž†ēžÉĀ, 0-2), Ūē≠ÍįĎžÉĀžĄ†Í≥ľžāįŪôĒŪö®žÜĆŪē≠ž≤ī 860 U/mL, Ūē≠ÍįĎžÉĀžĄ†ÍłÄŽ°úŽ∂ąŽ¶įŪē≠ž≤ī(antithyroglobulin antibody)ŽäĒ 19.2 U/mL (ž†ēžÉĀ, 0-60)žėÄÍ≥†, ÍįĎžÉĀžĄ† žä§žļĒžĚÄ žčúŪĖČŪēėžßÄ žēäžēėŽč§.
ÍįĄÍłįŽä• Í≤Äžā¨žÉĀ AST 90 IU/L, ALT 81 IU/L, alkaline phosphatase 211 IU/L žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 41.4 mg/dL, žßĀž†ĎŽĻĆŽ¶¨Ž£®ŽĻą 24.3 mg/dL, žēĆŽ∂ÄŽĮľ 2.5 g/dL, ŪĒĄŽ°úŪ䳎°¨ŽĻą žčúÍįĄ 11.9žīą(INR 1.03žīą)žėÄŽč§. ÍįĄžóľ ŪĎúžßÄžěź Í≤Äžā¨žóźžĄú HAV IgM Ab žĚĆžĄĪ, HBsAg žĚĆžĄĪ, anti-HBsAg žĖĎžĄĪ, anti-HCV žĚĆžĄĪžúľŽ°ú ŪôēžĚłŽźėžóąÍ≥†, EBVžôÄ CMV PCRŽŹĄ žĚĆžĄĪžĚīžóąŽč§. Ž©īžó≠ Ūėąž≤≠ Í≤Äžā¨žóźžĄú anti-nuclear antibody (ANA), anti-mitochondrial antibody (AMA), anti-smooth muscle antibody (ASMA) Ž™®ŽĎź žĚĆžĄĪžĚīžóąŽč§.
Žį©žā¨žĄ†Ūēôž†Ā žÜĆÍ≤¨: Žč®žąú ŪĚČŽ∂Äžī¨žėĀžÜĆÍ≤¨žĚÄ ž†ēžÉĀžĚīžóąÍ≥†, Ž≥ĶŽ∂Ä ŽįŹ Í≥®Žįė ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžą†(computed tomography, CT)žóźžĄú ŽčīŽŹĄ Ūôēžě• žÜĆÍ≤¨žĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
žĻėŽ£Ć ŽįŹ Í≤ĹÍ≥ľ: žěĄžÉĀž†ĀžúľŽ°ú Ž©ĒŪčįŽßąž°łžóź žĚėŪēú ŽŹÖžĄĪÍįĄžóľžĚī žĚėžč¨ŽźėžóąžúľŽāė Žč§Ž•ł žõźžĚłŽď§žĚĄ Žįįž†úŪēėÍłį žúĄŪēī ÍįĄ ž°įžßĀÍ≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄŽč§. ž°įžßĀÍ≤Äžā¨ Í≤įÍ≥ľ Žčīž¶ôžöłŪėąžĄĪ ÍįĄžóľ žÜĆÍ≤¨žĚī(Fig. 1) ŪôēžĚłŽźėžĖī Ž©ĒŪčįŽßąž°łžóź žĚėŪēú ŽŹÖžĄĪÍįĄžóľžúľŽ°ú žßĄŽč®ŪēėžėÄŽč§. žĚīŪõĄ ursodesoxycholic acid (UDCA)žôÄ Ž≤†ŪÉÄžį®Žč®ž†úŽ•ľ Ž≥Ķžö©ŪēėŽ©īžĄú, Ž£®Í≥®žö©žē°žĚĄ 8Žį©žöłžĒ© ŪēėŽ£® žĄł Ž≤ą Ūą¨žó¨ŪēėžėÄŽč§. Ūą¨žēĹ 2ž£ľžßł, ÍįĎžÉĀžĄ† ÍłįŽä• Í≤Äžā¨žóźžĄú žú†Ž¶¨ T4 1.6 ng/dLŽ°ú ž†ēžÉĀ Ž≤ĒžúĄŽ°ú Ūėłž†ĄŽźėžóąžúľŽāė, ÍįĄÍłįŽä• Í≤Äžā¨žóźžĄúŽäĒ AST 92 IU/L, ALT 103 IU/L, alkaline phosphatase 168 IU/L žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 52.4 mg/dL, žßĀž†Ď ŽĻĆŽ¶¨Ž£®ŽĻą 30.5 mg/dLŽ°ú žēÖŪôĒŽźú žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąŽč§. žĚīŪõĄ ŪôėžěźŽäĒ ÍįĄžĄĪŪėľžąėžôÄ ÍįĄžč†ž¶ĚŪõĄÍĶįžĚī ŽįúžÉĚŪēėŽ©īžĄú žĚėžčĚžĚė ž†ÄŪēėŽ•ľ Ž≥īžĚīŽ©į ŪėľŽĮł(stupor)Ūēīž°ĆÍ≥†, žßąžÜĆŪėąž¶Ě(azotemia)ŽŹĄ žßÄžÜ枆ĀžúľŽ°ú žēÖŪôĒŽźėŽäĒ žÜĆÍ≤¨žĚĄ Ž≥īžó¨ ÍłįŽŹĄ žāĹÍīÄ ŽįŹ Ūėąžē°Ūą¨žĄĚžĚĄ žčúŪĖČŪēėžėÄŽč§. UDCA, N-acetylcysteine, Ž£®Í≥®žö©žē°, Ž≤†ŪÉÄžį®Žč®ž†úŽŹĄ žßÄžÜ枆ĀžúľŽ°ú Ūą¨žó¨ŪēėžėÄŽč§. ÍłįŽŹĄ žāĹÍīÄ ŪõĄ 10žĚľžßł, žßÄžÜ枆ĀžúľŽ°ú ÍįĄÍłįŽä•žĚė žēÖŪôĒŽ°ú ŽáĆžā¨žěź ÍįĄžĚīžč̞̥ žčúŪĖČŪēėžėÄŽč§(Fig. 2). žąėžą† ŪõĄ žĚėžčĚ, ÍįĄÍłįŽä•žĚī Ž™®ŽĎź ŪöĆŽ≥ĶŽźėžóąžúľŽ©į, žąėžą† ŪõĄ 39žĚľžßł ŪáīžõźŪēėžėÄŽč§. Ūáīžõź žčúÍĻĆžßÄ Ž£®Í≥®žö©žē°žĚĄ žßÄžÜ枆ĀžúľŽ°ú Ūą¨žó¨ŪēėžėÄÍ≥†, Ūáīžõź ŽčĻžčúžĚė ÍįĎžÉĀžĄ† ÍłįŽä• Í≤Äžā¨ŽäĒ TSH 0.97 őľIU/mL, žú†Ž¶¨ T4 0.39 ng/dLŽ°ú ž†ēžÉĀŽ≤ĒžúĄŽ•ľ žú†žßÄŪēėžėÄŽč§. žĚīŪõĄ ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ěžóź ŽĆÄŪēīžĄú Ž£®Í≥®žö©žē°žĚĄ Ž≥Ķžö©ŪēėŽč§ÍįÄ žĚľž£ľžĚľÍįĄ ž§ĎŽč® ŪõĄ 15 mCi Žį©žā¨žĄĪžöĒžė§ŽďúŽ•ľ Ūą¨žó¨ŪēėžėÄŽč§. ŪėĄžě¨ ž†ēžÉĀ ÍįĎžÉĀžĄ† ŪėłŽ•īŽ™¨ žąėžĻėŽ•ľ žú†žßÄŪēėŽ©į žôłŽěė ž∂Ēž†ĀÍīÄžįį ž§ĎžĚīŽč§(Table 2).
žĶúÍ∑ľ ŽĮłÍĶ≠ ŽāīŽ∂ĄŽĻĄŪēôŪöĆ ŽįŹ ŽĮłÍĶ≠ žěĄžÉĀŽāīŽ∂ĄŽĻĄžĚėžā¨ŪöĆ(American Thyroid Association and American Association of Clinical Endocrinologist)žóźžĄú ŪäĻžąėŪēú Í≤ĹžöįŽ•ľ ž†úžôłŪēėÍ≥†, ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ě žĻėŽ£Ćž†úŽ°ú Ž©ĒŪčįŽßąž°łžĚĄ žā¨žö©ŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėžėÄŽč§. žĚīŽäĒ žĶúÍ∑ľ PTUžā¨žö© ŪõĄ žč¨ÍįĀŪēú ÍįĄžÜźžÉĀžĚĄ žěÖžóąŽćė 32ÍĪī(žĄĪžĚł 22ÍĪī, žÜĆžēĄ 10ÍĪī)žĚė ž¶ĚŽ°ÄžôÄ ÍīÄŽ†®Ūēī FDA (Food and Drug Administration)žóźžĄú žĚīžäąŪôĒŪēėžėÄŽćė PTUžĚė žč¨ÍįĀŪēú ÍįĄŽŹÖžĄĪžóź ŽĆÄŪēú Í∂ĆÍ≥†Ž•ľ ŽįõžēĄŽď§žėÄÍłį ŽēĆŽ¨łžĚīŽč§[2]. ŽĮłÍĶ≠ žě•ÍłįžĚīžčĚžĄľŪĄįžĚė ŽćįžĚīŪĄįŽ≤†žĚīžä§žóź ŽĒįŽ•īŽ©ī, 1990ŽÖĄŽ∂ÄŪĄį 2002ŽÖĄÍĻĆžßÄ ŽĮłÍĶ≠žóźžĄú ÍįĄžĚīžč̞̥ ŽįõžĚÄ 51,741Ž™ÖžĚė Ūôėžěź ž§Ď 15%ÍįÄ žēĹŽ¨ľÍ≥ľ ÍīÄŽ†®Ūēú ÍįĄŽŹÖžĄĪžúľŽ°ú žĚīžč̞̥ ŽįõžēėŽäĒŽćį, Í∑ł žõźžĚł žēĹŽ¨ľ ž§Ď PTUÍįÄ žĄł Ž≤ąžßłŽ°ú ŪĚĒŪēú žõźžĚł žēĹŽ¨ľžĚīžóąŽč§. Í∑łŽü¨Žāė Ž©ĒŪčįŽßąž°ł Ž≥Ķžö©žóź žĚėŪēī ÍįĄžĚīžč̞̥ žčúŪĖČ ŽįõžēėŽćė Í≤ĹžöįŽäĒ žóÜžóąŽč§[6]. žĚīž≤ėŽüľ Ž©ĒŪčįŽßąž°łžóź žĚėŪēú žĻėŽ™Öž†ĀžĚł ÍįĄžÜźžÉĀžĚÄ Í∑ĻŪěą ŽďúŽ¨ł Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§.
Mikhail ŽďĪ[7]žĚī Ž©ĒŪčįŽßąž°łžĚĄ žā¨žö© ŪõĄ ÍįĄŽŹÖžĄĪžĚī ŽįúžÉĚŪēėžėÄŽćė 20ÍįúžĚė ž¶ĚŽ°ÄŽď§žĚĄ žāīŪéīŽ≥ł Í≤įÍ≥ľ, ÍįÄžě• ŪĚĒŪēú ž¶ĚžÉĀžĚÄ Ūô©Žč¨žĚīžóąÍ≥†, Žč§žĚĆžúľŽ°ú ÍįĄžßÄŽüľž¶Ě, žĖīŽĎźžöī žÜĆŽ≥ÄžÉČ, žßĄŪĚô žÉČÍĻĒžĚė Ž≥Ä žąúžúľŽ°ú Ž™®ŽĎź Í≥†ŽĻĆŽ¶¨Ž£®ŽĻąŪėąž¶ĚÍ≥ľ ÍīÄŽ†®Žźú ž¶ĚžÉĀŽď§žĚīžóąŽč§. Ž©ĒŪčįŽßąž°łžóź ŽÖłž∂úŽźú ŪõĄ Ūô©Žč¨žĚī ŽįúžÉĚŪēėÍłįÍĻĆžßÄžĚė ÍłįÍįĄžĚÄ 2žĚľžóźžĄú 3ÍįúžõĒÍĻĆžßÄ Žč§žĖĎŪēú ŪäĻžßēžĚĄ ŽāėŪÉÄŽāīžóąŽč§.
PTUžóź žĚėŪēú ÍįĄžÜźžÉĀžĚÄ ž£ľŽ°ú žĄłŪŹ¨ŽŹÖžĄĪžóź žĚėŪēī ÍįĄžĄłŪŹ¨ Íīīžā¨ŪėēŪÉúŽ°ú ŽāėŪÉÄŽāėÍ≥†, Ž©ĒŪčįŽßąž°łžóź žĚėŪēú ÍįĄžÜźžÉĀžĚÄ ž£ľŽ°ú ŽčĶž¶ôžöłŪėąžĄĪ Ūô©Žč¨Ž°ú ŽāėŪÉÄŽāúŽč§[2]. Í∑ł Íłįž†ĄžĚÄ žēĄžßĀ Ž™ÖŪôēŪēėžßÄ žēäžßÄŽßĆ Í≥ľŽĮľŽįėžĚϞ̥ žčúžā¨ŪēėŽäĒ žÜĆÍ≤¨žĚī ŽßéŽč§. ž¶ĚžÉĀžĚī ŽĆÄÍįú Ž™á ž£ľ žĚīŽāīŽ°ú ŽįúžÉĚŪēėžėÄŽč§ÍįÄ ž§ĎŽč®ŪēėŽ©ī Ūėłž†ĄžĚĄ Ž≥īžĚłŽč§ŽäĒ ž†ź, Žč§žčú Ūą¨žēĹŪēėžėĞ̥ ŽēĆ žĖľŽßą žßÄŽāėžßÄ žēäžēĄ ž¶ĚžÉĀžĚī Žč§žčú ŽįúŪėĄŽźėŽäĒ ž†ź, žēĹŽ¨ľžĚė žö©ŽüČÍ≥ľ ÍīÄÍ≥ĄžóÜžĚī ŽįúžÉĚŪēėŽäĒ ž†ź, Í∑łŽ¶¨Í≥† žēĹŽ¨ľ Í≥ľŽĮľŽįėžĚĎžĚė žßÄŪĎúžĚł Ž¶ľŪĒĄÍĶ¨ ž†ĄžĚīÍ≤Äžā¨(lymphocyte transformation test)žóźžĄú žĖĎžĄĪžĚĄ Ž≥īžĚłŽč§ŽäĒ ž†ź ŽďĪžĚĄ žĘÖŪē©Ūēī Ž≥ľ ŽēĆ Í≥ľŽĮľŽįėžĚϞ̾ ÍįÄŽä•žĄĪžĚī ŽÜíÍ≤†Žč§[8].
Ūē≠ÍįĎžÉĀžĄ†ž†úžóź žĚėŪēú ÍįĄŽŹÖžĄĪžĚÄ ŪĚĒŪēėžßÄ žēäÍłį ŽēĆŽ¨łžóź žēĹŽ¨ľŽ≥Ķžö©žĚĄ žčúžěĎŪēėÍłį ž†ĄžĚė ÍįĄ ÍłįŽä•Í≤Äžā¨ŽäĒ Í∂Ćžě•ŽźėŽāė, žēĹŽ¨ľ Ž≥Ķžö© ž§Ďžóź ž†ēÍłįž†ĀžĚł ÍįĄ ÍłįŽä• Í≤Äžā¨ŽäĒ ž∂Ēž≤úŽźėžßÄ žēäŽäĒŽč§[2]. Í∑łŽü¨ŽĮÄŽ°ú žē장ú žĖłÍłČŪēėžėÄŽćė Í≥†ŽĻĆŽ¶¨Ž£®ŽĻąŪėąž¶Ě ž¶ĚžÉĀžĚī ŽįúŪėĄŽźėŽäĒ Í≤ĹžöįžóźŽäĒ ž¶Čžčú Ž≥ĎžõźžĚĄ Žį©Ž¨łŪēėŽŹĄŽ°Ě ÍĶźžú°ŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėÍ≥†, ÍįĎžÉĀžĄ†ÍłįŽä•Ūē≠žßĄž¶Ěžóź ŽĆÄŪēīžĄúŽäĒ žēĹŽ¨ľŪą¨žēŞ̥ ž§ĎŽč® ŪõĄ Žį©žā¨žĄĪ žöĒžė§Žďú žĻėŽ£ĆŽāė žąėžą†Ž°úžĄú žĻėŽ£ĆŪēėŽŹĄŽ°Ě Í∂ĆÍ≥†ŪēėÍ≥† žěąŽč§[2]. Žį©žā¨žĄĪžöĒžė§Žďú žĻėŽ£ĆŽāė žąėžą† žĻėŽ£Ć ž†ĄÍĻĆžßÄŽäĒ Ž≥ł ž¶ĚŽ°Äž≤ėŽüľ Ž£®Í≥®žö©žē°žĚĄ žā¨žö©Ūēėžó¨ ÍįĎžÉĀžĄ† ÍłįŽä•žĚĄ ž†ēžÉĀžúľŽ°ú žú†žßÄŪē† žąė žěąÍ≤†Žč§. ÍįĄÍłįŽä• ŪöĆŽ≥Ķžóź ŽĆÄŪēīžĄúŽäĒ steroidÍįÄ ŽŹĄžõÄžĚī ŽźúŽč§ŽäĒ Ž™áŽ™á Ž≥īÍ≥†ÍįÄ žěąžóąžúľŽāė[9], žēĄžßĀÍĻĆžßÄŽäĒ ŽÖľŽěÄžĚī žěąŽč§.
Í≤įŽ°†ž†ĀžúľŽ°ú Ž©ĒŪčįŽßąž°łžĚÄ ŽįúžÉĚŽĻąŽŹĄŽäĒ Í∑ĻŪěą ŽďúŽ¨ľžßÄŽßĆ ÍįĄŽŹÖžĄĪžĚĄ žĚľžúľŪā¨ žąė žěąÍ≥†, žĻėŽ™Öž†ĀžĚł ÍįĄŽ∂Äž†ĄÍĻĆžßÄŽŹĄ žĚľžúľŪā¨ žąė žěąžúľŽĮÄŽ°ú, žĻėŽ£Ć žčúžěĎ Ž™á ÍįúžõĒÍįĄžĚÄ ž£ľžĚė ÍĻäžĚÄ ž∂Ēž†ĀÍīÄžįįžĚī ŪēĄžöĒŪēėÍ≤†Žč§.
REFERENCES
1. Gallelli L, Staltari O, Palleria C, De Sarro G, Ferraro M. Hepatotoxicity induced by methimazole in a previously healthy patient. Curr Drug Saf 2009;4:204‚Äď206.


2. Bahn Chair RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011;21:593‚Äď646.


3. Kang H, Choi JD, Jung IG, et al. A case of methimazoleinduced acute hepatic failure in a patient with chronic hepatitis B carrier. Korean J Intern Med 1990;5:69‚Äď73.


4. Baker B, Shapiro B, Fig LM, Woodbury D, Sisson JC, Beierwaltes WH. Unusual complications of antithyroid drug therapy: four case reports and review of literature. Thyroidology 1989;1:17‚Äď26.

5. Epeirier JM, Pageaux GP, Coste V, et al. Fulminant hepatitis after carbimazole and propranolol administration. Eur J Gastroenterol Hepatol 1996;8:287‚Äď288.


6. Russo MW, Galanko JA, Shrestha R, Fried MW, Watkins P. Liver transplantation for acute liver failure from drug induced liver injury in the United States. Liver Transpl 2004;10:1018‚Äď1023.


8. Blom H, Stolk J, Schreuder HB, von Blomberg-van der Flier M. A case of carbimazole-induced intrahepatic cholestasis: an immune-mediated reaction? Arch Intern Med 1985;145:1513‚Äď1515.


9. Zhang M, Zhou H, He R, Di F, Yang L, Yang T. Steroids for the treatment of methimazole-induced severe cholestatic jaundice in a 74-year-old woman with type 2 diabetes. Endocrine 2010;37:241‚Äď243.


10. Lee KY, Lee YJ, Hong SH, et al. Hepatic injury during treatment with antithyroid drugs in patients with hyperthyroidism. J Korean Soc Endocrinol 2000;15:554‚Äď560.
11. Lee SO, Choi JK, Kim HS, Seo JS, Ahn DS. A case of similar pattern of hepatotoxicity after propylthiouracil and methimazole. Korean J Hepatol 1999;5:136‚Äď141.
12. Kim WS, Kim JH, Yoon BO, et al. A case of methimazoleinduced cholestatic jaundice with steroid therapy. J Korean Soc Endocrinol 1999;14:592‚Äď598.
13. Kang SG, Bae JO, Lee EY, et al. A case of methimazoleinduced cholestatic jaundice with agranulocytosis. J Korean Soc Endocrinol 2005;20:519‚Äď523.

14. Shong YK, Chang YH, Lee KY, Min YI, Lee MH. Prolonged Jaundice after Methimazole administration. J Korean Soc Endocrinol 1990;5:145‚Äď148.
15. Kim DS, Lim TJ, Lee JS, et al. A case of methimzoleinduced cholestatic jaundice. J Korean Soc Endocrinol 1987;2:209‚Äď213.
High magnification images show inspissated bile in bile canaliculi, which is predominant in zones 2 and 3, consistent with cholestatic hepatitis (√ó√ó 400).
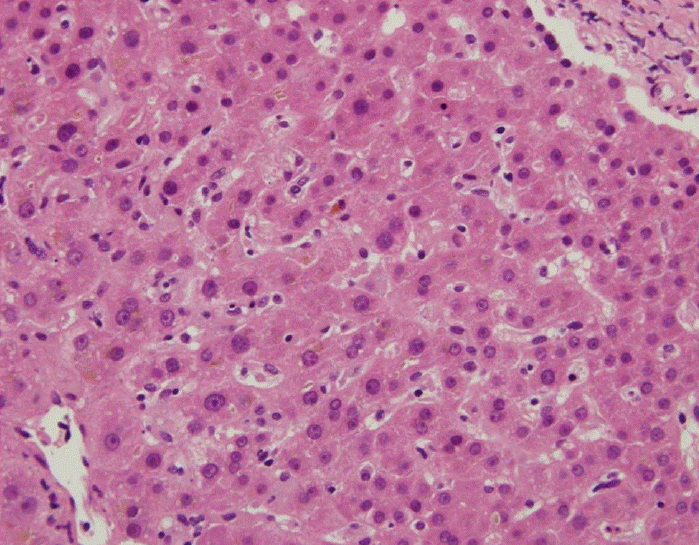
Figure 1.
(A) Gross photography of an explanted liver showed diffuse dark brown discoloration without cirrhotic change. (B) The explanted liver showed severe cholestasis with perivenular fibrosis ( √ó 400).
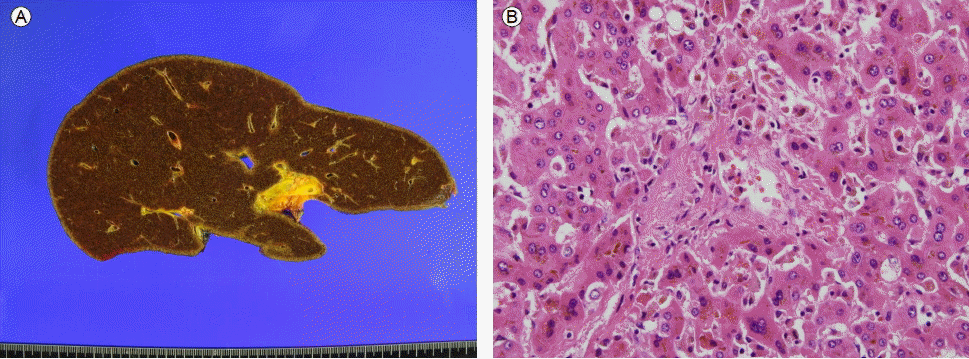
Figure 2.
Table 1.
Hepatic injury after methimazole intake (domestic cases)
| Authors [reference] | Age/Sex | Dose (mg/day) | Duration of injury (day) | Peak total bilirubin AST/ALT/ALP | Liver pathology | Treatment of toxic hepatitis | Treatment of hyperthroidism | Comment |
|---|---|---|---|---|---|---|---|---|
| Kang et al. [3] | 43/M | 30 | 119 | 50/950/1100/- | Micronodular cirrhosis inflammatory cell infiltration | Expired | Unknown | HBV LC (+) |
| Lee et al. [10] | 59/F | 20 | 29 | 19.4/2547/138/224 | - | Spontaneous remission | RAI | |
| Lee et al. [10] | 35/F | 30 | 21 | 4.4/126/60/67 | - | Spontaneous remission | Spontaneous remission | |
| Lee et al. [10] | 55/F | 30 | 27 | 24.2/438/59/44 | - | Spontaneous remission | RAI | |
| Lee et al. [10] | 36/M | 30 | 46 | 32/445/38/37 | Cholestasis | Spontaneous remission | Spontaneous remission | |
| Lee et al. [11] | 46/M | 30 | 70 | 24.6/643/77/119 | Cholestasis | Remission PD 15 mg used | Spontaneous remission | PD 15 mg |
| Kim et al. [12] | 27/M | 30 | 7 | 30/120/100/- | Cholestasis | Remission PD 30 mg used | RAI | PD 30 mg |
| Kang et al. [13] | 54/F | 30 | 30 | 15.6/26/40/1026 | Cholestasis | Spontaneous remission | RAI | |
| Shong et al. [14] | 17/F | 30 | 210 | 9.2/13/13/207 | Pericentral vein fibrosis no cholestasis | Spontaneous remission | Spontaneous remission | - |
| Kim et al. [15] | 36/M | 45 | 36 | 32/38/37/445 | Portal infiltration no cholestasis | Spontaneous remission | Spontaneous remission | - |
Table 2.
Biochemical marker changes before and after discontinuation of methimazole
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :



-
METRICS

-
- 1 Crossref
- 0 Scopus
- 9,661 View
- 78 Download




