Culotte 스텐팅 기법으로 치료한 좌주간지 침범 자발성 관상동맥 박리증
Treatment of a Spontaneous Coronary Artery Dissection Involving the Left Main Coronary Artery Using the Culotte Stent Technique
Article information
Abstract
좌주간지를 침범하는 자발성 관상동맥 박리증은 일반적으로 관상동맥 우회수술로 치료하는 것으로 알려져 있다. 본증례는 좌주간지 침범 자발성 관상동맥 박리증을 수술하지않고 culotte 스텐팅 기법을 이용하여 경피적 중재시술로 성공적으로 치료한 예이다.
Trans Abstract
Spontaneous coronary artery dissection (SCAD) is an extremely rare clinical manifestation of ischemic heart disease. A 43-year-old female was admitted to our hospital for non-ST elevation myocardial infarction. She had no cardiac risk factors except smoking. Coronary angiography showed moderate stenosis of the proximal left circumflex artery (LCX) with intraluminal haziness and a spastic appearance from the culprit lesion in the left main coronary artery (LM). Subsequent analysis by intravascular ultrasound (IVUS) revealed a clear dissection flap from the LCX to the LM. Generally, SCAD of the LM or multivessel involvement requires primary surgical management. The present case was treated percutaneously using the culotte stent technique. (Korean J Med 2012;83:352-356)
서 론
자발성 관상동맥 박리증은 관상동맥 조영술을 시행받는 환자의 약 0.1%에서 1.1%까지 발견된다고 보고되고 있으며 매우 드문 질환이다[1]. 무증상에서부터 안정형 협심증, 급성관상동맥 증후군까지 다양한 허혈성 심질환의 임상양상으로 나타날 수 있다. 최근 관상동맥 조영술의 시행이 증가하고 있으며 혈관내 초음파를 통하여 혈관층에 대한 상세한 정보를 획득할 수 있어 자발성 관상동맥 박리증의 진단이 증가하고 있다. 스텐트 삽입술, 관상동맥 우회수술, 약물치료 등 다양한 치료법이 있지만 아직까지 치료가이드라인은 확립되지 않고 있다[2]. 저자 등은 좌주간지를 침범한 자발성 관상동맥 박리증을 culotte stent 기법으로 성공적으로 치료한 1예를 보고하는 바이다.
증 례
환 자: 여자 43세
주 소: 약 12시간 정도 지속되는 전흉부 통증
과거력: 6명 출산력 외 특이 과거력 없음.
사회력: 10갑년의 흡연력
현병력: 평소 운동 시 흉통이나 호흡곤란을 호소하지 않았던 환자로 내원 12시간 전 전흉부에 짓누르는 듯한 양상의 안정시 통증(resting pain)이 발생하였다. 지역병원 내원하여 시행한 검사상 심근효소의 상승이 있어 이에 대한 진단적 검사 및 치료 위해 전원되었으며 당시 심전도는 정상소견 보였다.
이학적 소견: 내원 당시 혈압은 110/60 mmHg, 맥박 90회/분, 호흡수 19회/분, 체온은 36.5℃였고, 다른 신체검사상 특이소견은 없었다.
검사실 소견: 내원 당시 creatine kinase (CK) 1517 U/L, CKMB는 192.8 ug/L, troponin T (TnT)는 1.090 ng/mL로 상승해 있었다. ALT 66 U/L, AST 146 U/L로 상승해 있었고 그 밖에 말초혈액검사, 전해질검사, 혈청 생화학검사, 지질검사, 요검사에서 이상소견은 없었다.
심전도 및 흉부 X-선 검사 소견: 내원 당시 심전도는 동율동이었고 ST 분절 상승이나 T 파역 위 등 허혈성 변화소견 보이지 않았으며(Fig. 1) 흉부 X-선 검사소견은 정상이었다.
심장초음파 및 관상동맥 조영술, 중재시술 소견: 심장초음파 검사에서 좌심실 구혈률은 50%였으며 좌회선지 관류 영역부위의 국소적인 벽운동 장애가 관찰되었다. 관상동맥 조영술에서 좌회선지 근위부에 중등도의 협착이 관찰되었으며 좌주간지 개구부(ostium)에서부터 좌회선지 근위부까지 미만성 협착병변이 관찰되었다(Fig. 2). 좌주간지 병변 및 좌회선지 병변의 해부학적 연관관계 및 치료전략을 결정하기 위하여 혈관내 초음파를 시행하였다. 혈관내 초음파 검사에서 좌회선지 근위부에서 좌주간지 근위부까지 광범위한 내막박리(dissection)가 관찰되었고 이로 인하여 진내강(true lumen)의 허탈(collapse)소견이 보였다(Fig. 2). 내막박리 병변의 근위부와 원위부에 두께 3 mm 미만의 내막비후(pathologic intimal thickening)가 관찰되었으나 병변주위에 죽상반(atheromatous plaque)은 없었다. 좌회선지 근위부에서 내막 파열(intimal tear) 위치를 확인하였으나 좌주간지 근위부에서는 내막 파열을 발견하지 못했다. 자발성 관상동맥 박리증이 좌주간지를 침범하였기 때문에 관상동맥 우회수술을 계획하였으나 환자가 수술적 치료 거부하여 중재시술을 진행하였다. 중재시술은 최대한 단순하게 진행하기 위하여 좌회선지 병변부터 좌주간지 개구부까지 좌전하행지를 가로질러(cross- over) 약물방출 스텐트(Biomatrix® 3.5/28 mm, Biosensors Interventional Technologies Pte Ltd., Singapore)를 삽입하였다. 스텐트 삽입 직후 좌전하행지 개구부에 새로 발생한 협착이 관찰되었으며 혈관내 초음파검사에서 좌주간지부터 좌전하행지 근위부까지 내막박리가 진행한 소견이 관찰되어 culotte 스텐팅을 계획하였다(Figs. 3 and 4). 내막박리가 원위부로 더 진행하는 것을 막기 위하여 Culotte 스텐팅을 시행하기 전에 좌전하행지 원위부에 정상 혈관구역을 포함하여 약물방출스텐트(Biomatrix® 3.0/28 mm)를 먼저 삽입하였다. 그 후 좌주간지에서부터 좌전하행지 근위부까지 culotte 스텐팅 기법으로 약물방출 스텐트(Biomatrix® 3.5/28 mm)를 삽입하였고 (Figs. 3 and 4), 마지막으로 kissing balloon을 시행하였다. 최종 관상동맥 조영술에서 내막박리나 혈류감소는 모두 소실되었다.
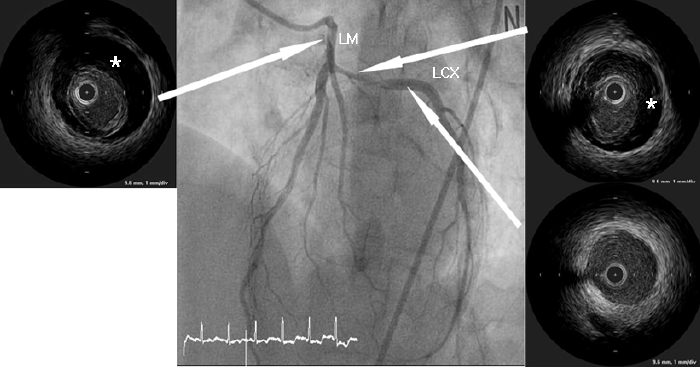
Initial angiogram showing moderate stenosis of the proximal left circumflex artery (LCX) with intraluminal haziness and a spastic appearance from the culprit lesion to the left main coronary artery (LM). Intravascular ultrasound (IVUS) revealed a false lumen (*) from the LCX to the LM, which caused collapse of the true lumen, suggesting coronary artery dissection.
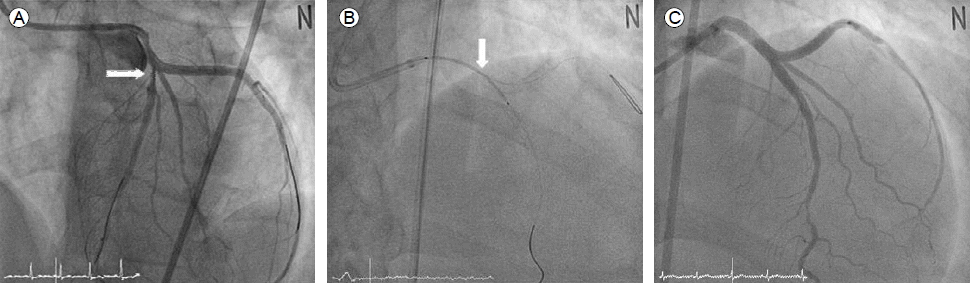
(A) Angiogram after left circumflex artery (LCX) stenting showing moderate compromise of the left anterior descending artery ostium (arrow), which was defined as a progression of the dissection through subsequent intravascular ultrasound (IVUS) analysis. (B) Culotte stenting from the left main coronary artery (LM) to the proximal left anterior descending artery was performed (arrow). (C) Final angiogram showing excellent results.
고 찰
관상동맥 박리증은 자발적으로 일어나거나 의인성으로 관상동맥 조영술이나 중재술의 합병증으로 발생할 수 있다.자발성 관상동맥 박리증은 급성관상동맥증후군의 매우 드문 원인 중 하나이며 원인은 잘 알려져 있지 않지만 동맥경화가 가장 큰 원인일 것으로 추정된다[2]. 출산과 관련하여 주산기에 호르몬의 변화로 젊은 여자에게 호발한다고 하며 Malfan 증후군에서 대동맥 박리와 연관하여 발생하기도 한다고 알려져 있다[3]. 결체조직질환이나 혈관염과 관련하여 발생하기도 하지만 대부분 특발성으로 되어 있다. 자발적 관상동맥 박리증은 약 2:1의 비율로 여성에서 호발하며 본 증례에서처럼 여성에서는 주로 좌주간지 및 좌전하행지에 발생하고 남성에서는 우관상동맥에서 더 흔하다고 보고되고있다[4]. 본 증례에서 6명 출산의 산과력이 있었지만 마지막 출산이 내원 5년 전으로 자발성 관상동맥 박리증과의 관련성은 떨어질 것으로 생각되었다. 그 외 다른 결체조직질환을 의심할만한 증상이나 이학적 소견 보이지 않아 추가적인 검사는 시행하지 않았다. 본 증례에서 카테터에 의한 의인성 관상동맥 박리증 가능성을 배제한 이유는 다음과 같다. 첫째, 조영술 시행 전에 이미 좌회선지 영역에 국소 벽운동 장애와 심근효소 상승이 있었고 둘째, 혈관내 초음파에서 혈관 박리가 발생한 좌주간지와 좌회선지 주위에 죽상반이 거의 존재하지 않았으며 셋째, 내막 파열(intimal tear)이 좌회선지에서만 발견되고 좌주간지에서는 발견되지 않았다. 따라서 혈관 박리가 좌회선지 근위부에서 자발적으로 발생하여 좌주간지 방향으로 진행한 것으로 판단하였다.
아직 자발적 관상동맥 박리증의 치료원칙은 확립되어 있지 않으며 임상양상과 영상소견에 근거하여 치료방침을 결정해야 한다. 생체징후가 안정적이고 허혈이 진행하지 않는다면 항혈소판제로 약물치료를 시도할 수 있다[5]. 혈전용해제는 박리가 진행할 수 있어 추천되지 않는다[6]. 심근허혈이 진행한다면 중재시술을 고려할 수 있는데 스텐트 삽입은 강력한 물리적인 안정을 줄 수 있지만 시술관련하여 관상동맥파열, 내막막리의 진행, 가성내강(false lumen)으로의 스텐트삽입 등의 합병증위험이 있을 수 있다[7]. 다혈관 병변이나 좌주간지 병변에 대해서는 관상동맥 우회수술이 우선적으로 고려될 수 있다[8].
본 증례에서 좌주간지를 침범한 자발성 관상동맥 박리증으로 관상동맥우회수술을 우선적으로 고려하였으나 환자가 수술적 치료를 거부하여 경피적 중재시술을 시행하였다. 자발성 관상동맥 박리증에서 스텐트 삽입 후 합병증으로 가성내강 및 혈관벽내 혈종이 병변의 근위부 및 원위부로 확장될 수 있다[7]. 본 증례에서도 좌회선지 스텐트 시술 후 내막 박리 및 혈관벽내 혈종이 좌전하행지 개구부로 확장하였다. 내막박리가 원위부로 더 확장되는 것을 방지하기 위하여 병변의 원위부를 지나 정상혈관부위를 포함하여 스텐트를 삽입하여 성공적으로 혈종 및 박리진행을 치료할 수 있었다.좌주간지 병변에 두 개 스텐트를 사용한 시술은 재협착, 스텐트 혈전증(very late stent thrombosis), 심근경색, 사망 등의위험을 내포한다고 알려져 있어 개별 환자에 따라 선택적으로 시행되어야 한다. 자발성 관상동맥 박리증의 중재시술에 있어서 혈관박리가 시작된 부위에 국한하여 스텐트를 시술한 뒤 혈종이 흡수되기 기다리는 전략을 반드시 고려하여야하는데, 이 방법은 스텐트 사용 개수를 줄일 수 있는 장점이 있으나 본 증례와 같이 좌주간지를 침범하거나 병변이 불안정한 경우에는 고려하기 어렵다.
Culotte 스텐팅 기법은 Chevalier 등이 BMS (bare metal stent)를 사용하여 처음 소개하였는데 분지(bifurcation)병변의 곁가지(side branch)에 먼저 스텐트 시술 후 곁가지의 스텐트를 통과하여 주가지(main vessel)에 스텐트를 시술하는 방법이다. 본 증례에서는 좌회선지만 스텐트를 시술할 계획이었으나 좌전하행지 개구부로 혈종이 확장되어 culotte 스텐팅을 시행하였다. BMS를 이용한 culotte 스텐팅 기법은 기술적 복잡성, 시술관련 합병증, 높은 재협착률로 인하여 널리 사용되지 않았으나 DES (drug eluting stent) 시대에는 여러 연구에서 성공적인 결과를 보여주었고 최근 발표된 ARTS II 연구에서 분지 병변의 스텐팅이 비분지 병변 스텐팅과 비교하여 중요한 심장 뇌혈관 관련사건(Major Adverse Cardiac Cerebrovascular Event) 발생에 있어 유의한 차이가 없었다(13.3% vs. 11.0%, p= 0.46) [9].
Biomatrix®는 생체분해성(biodegradable) 중합체(polymer)로 코팅된 biolimus 방출 스텐트로, 지속성(durable) 중합체 코팅스텐트에 비하여 중합체에 의한 염증반응 및 재상피화지연이 감소하여 후기 재협착률이 낮을것으로 기대되고 있다. LEADERS 연구에 따르면 생체분해성 중합체 코팅 biolimus 방출 스텐트가 지속성 중합체 코팅 sirolimus 방출 스텐트에 비하여 안정성 및 효과가 열등하지 않다고 보고되었다[10]. 장기합병증 발생에 있어서 Biomatrix®가 더 우월한지는 아직 더 연구되어야 하겠지만 본 증례에서는 좌주간지 포함한 복잡한(complex) 스텐팅을 시행하였기에 장기합병증 발생률이 감소할 것으로 기대하고 Biomatrix®를 사용하였다.
결론적으로 좌주간지를 침범하는 자발성 관상동맥 박리증의 경우에도 중재시술을 통하여 성공적으로 치료할 수 있었으며, 중재시술은 관상동맥우회수술 이외의 좋은 치료대안이 될 수 있을 것으로 생각된다.