žĄú Ž°†
ŽĻĄÍ≤įŪēĶ Ūē≠žāįÍ∑†(nontuberculous mycobacteria, NTM)žĚÄ Ū܆žĖĎÍ≥ľ Ž¨ľ ŽďĪžóź ž°īžě¨ŪēėÍ≥† žěąžĖī žěĄžÉĀÍ≤Äž≤īžóźžĄú Ž∂ĄŽ¶¨ŽźėžóąžĚĄ ŽēĆ ŽĆÄŽ∂ÄŽ∂Ą žė§žóľÍ∑†žĚīŽāė žßĎŽĚĹÍ∑†žúľŽ°ú ÍįĄž£ľŽźėžóąŽč§[1,2]. Í∑łŽü¨Žāė Ž©īžó≠ ÍłįŽä• ž†ÄŪēė ŪôėžěźŽŅźŽßĆ žēĄŽčąŽĚľ Ž≥ĎžõźÍįźžóľžĚīŽāė Ž©īžó≠ÍłįŽä•žĚī ž†ēžÉĀžĚł žā¨Žěƞ󟞥úŽŹĄ ÍįźžóľžĚĄ žú†ŽįúŪē† žąė žěąžĚĆžĚī žēĆŽ†§ž†ł NTMžĚė žěĄžÉĀž†Ā ž§ĎžöĒžĄĪžóź ŽĆÄŪēú žĚłžčĚžĚī ŽÜížēĄžßÄŽ©īžĄú ž†Ą žĄłÍ≥Ąž†ĀžúľŽ°ú NTMžĚė Ž∂ĄŽ¶¨žú® ŽįŹ NTMžóź žĚėŪēú žßąŪôė ŽįúÍ≤¨žĚī ž†źžį® ž¶ĚÍįÄŽźėÍ≥† žěąŽč§[1,3]. M. massilienseŽäĒ žĻėŽ£Ć ŽāīžĄĪžĚĄ Ž≥īžĚīŽäĒ M. abscessusžóźžĄú ž≤ėžĚĆžúľŽ°ú ÍĶ¨Ž≥ĄŽźėžóąÍ≥†[4], žĶúÍ∑ľžóź PCR Žį©Ž≤ēžĚĄ žĚīžö©Ūēėžó¨ žč†žÜć Žįúžú° Ūē≠žāįÍ∑†(rapid growing nontuberculous mycobacterium, RGM)žúľŽ°ú žÉąŽ°≠Í≤Ć Ž∂ĄŽ•ėŽźú Í∑†žĚīŽč§[3,5]. žĘÖžĘÖ ŪĒľŽ∂Ä ÍįźžóľžĚĄ ŽĻĄŽ°ĮŪēú žąėžą†žįĹžÉĀ ÍįźžóľžĚĄ žĚľžúľŪā§ŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąžúľŽāė[1,2,6] žēĄžßĀ ž†ēŪôēŪēú Íįźžóľ Í≤ĹŽ°ú ŽįŹ žúĄŪóėžĚłžěź ŽďĪžóź ŽĆÄŪēī žēĆŽ†§žßĄ ŽįĒÍįÄ žóÜžúľŽ©į[1,3] žĻėŽ£Ć žēĹž°įŪē©žĚī ž≤īÍ≥ĄŪôĒŽźėžĖī žěąžßÄ žēäŽč§. Ž≥ł ž†ÄžěźŽď§žĚÄ žáľÍ∑łŽ†Ćž¶ĚŪõĄÍĶįžĚĄ žßĄŽč®ŽįõžĚÄ ŪôėžěźžóźžĄú 3ŽÖĄ ŽŹôžēą žě¨ŽįúžĄĪ ŪŹźŽ†īžĚī ŽįėŽ≥ĶŽźėžóąŽćė ŪôėžěźÍįÄ M. massiliensežĚī ŽŹôž†ēŽźú ŪõĄ ž†Āž†ąŪēú žēĹŽ¨ľžĻėŽ£Ć ŪõĄ ŪŹźžėĀžÉĀ žÜĆÍ≤¨Í≥ľ žěĄžÉĀ ž¶ĚžÉĀžĚī Ūėłž†ĄŽźú ž¶ĚŽ°ÄŽ•ľ Í≤ĹŪóėŪēėžó¨ Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
ž¶Ě Ž°Ä
Ūôė žěź: žěĄ„Äá„Äá, žó¨žěź, 37žĄł
ž£ľ žÜĆ: Žįúžóī, ÍįÄŽěėŽ•ľ ŽŹôŽįėŪēú ÍłįžĻ®, ŪėłŪĚ° Í≥§ŽěÄ
ŪėĄŽ≥ĎŽ†•: 2007ŽÖĄ, 2008ŽÖĄ, 2010ŽÖĄžóź žīĚ 3ŪöĆžóź ÍĪłž≥ź ŪŹźŽ†īžúľŽ°ú žěÖžõźŪēú ž†ĀžĚī žěąžóąŽč§. ŪŹźŽ†ī žĻėŽ£Ć ŪõĄžóźŽŹĄ ÍłįžĻ®, ÍįÄŽěėÍįÄ ÍįĄŪ󟞆ĀžúľŽ°ú ŽįėŽ≥ĶŽźėŽćė ž§Ď Žāīžõź 3ž£ľ ž†ĄŽ∂ÄŪĄį žóīÍ≥ľ ŪėłŪĚ°Í≥§ŽěÄžĚī ŽŹôŽįėŽźėžĖī ŽāīžõźŪēėžėÄŽč§.
Í≥ľÍĪįŽ†•: žēĹ 15ŽÖĄ ž†ĄŽ∂ÄŪĄį žēąÍĶ¨ÍĪīž°įž¶ĚžúľŽ°ú žĻėŽ£ĆŽįõŽćė ž§Ď 8ŽÖĄž†Ąžóź žĻ®Ž∂ĄŽĻĄ ž†ÄŪēė, žĖĎž™ĹžĚė žÜźŽįú Ž∂ÄžĘÖ ŽįŹ ž†ÄŽ¶ľ, Ž†ąžĚīŽÖłžĚīŽďú ž¶ĚŪõĄÍĶįžĚė ž¶ĚžÉĀžúľŽ°ú žĚľžį®žĄĪ žáľÍ∑łŽ†Ć ž¶ĚŪõĄÍĶįžĚĄ žßĄŽč®ŽįõÍ≥† Prednisolone(PRS) 5 mg, Pilocarpine 15 mg, Haloxin 400 mgžĚĄ Ž≥Ķžö© ž§ĎžúľŽ°ú PRSŽäĒ žĶúÍ∑ľ ÍįźŽüČ ž§ĎžĚīžóąŽč§. žĚīžôłžóź Žč§Ž•ł ÍłįžôēŽ†•žĚÄ žóÜžóąŽč§.
žßĀžóÖŽ†• ŽįŹ ÍįÄž°ĪŽ†•: žĚľŽįė žā¨Ž¨īžßĀžúľŽ°ú ÍįÄž°ĪŽ†•žĚÄ ŪäĻžĚī žÜĆÍ≤¨žóÜžóąŽč§.
ŪĚ°žóįŽ†•: ŪĚ°žóįŽ†•žĚÄ žóÜžóąŽč§.
Ž¨łžßĄ žÜĆÍ≤¨: Žįúžóī, žė§Ūēú, ÍłįžĻ®, ÍįÄŽěė, ŪėłŪĚ°Í≥§ŽěĞ̥ ŪėłžÜĆŪēėžėÄžúľŽ©į žĚėžčĚ žÉĀŪÉúŽäĒ Ž™ÖŽ£ĆŪēėžėÄŽč§.
žßĄžįį žÜĆÍ≤¨: ŪėąžēēžĚÄ 100/60 mmHg, Žß•ŽįēžĚÄ 104ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąėŽäĒ 24ŪöĆ/Ž∂Ą, ž≤īžė®žĚÄ 38.5‚ĄÉžėÄžúľŽ©į, žė§Ž•łž™Ĺ ŪŹźžĚė ŪõĄ žÉĀŽ∂Ğ󟞥ú žąėŪŹ¨žĚĆžĚī ž≤≠žßĄŽźėžóąŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: žěÖžõź ŽčĻžčú ŽßźžīąŪėąžē°Í≤Äžā¨žóźžĄú ŽįĪŪėąÍĶ¨ 11,000/mm3(Ūėłž§ĎÍĶ¨ 84.7%, Ž¶ľŪĒĄÍĶ¨ 8.3%), ŪėąžÉČžÜĆ 11.9 g/dL, ŪėąžÜĆŪĆź 190,000/mm3, Ūėąž≤≠žÉĚŪôĒŪēô Í≤Äžā¨žóźžĄú Ūėąž≤≠ žīĚ Žč®ŽįĪ 9.0 g/dL, žēĆŽ∂ÄŽĮľ4.2 g/dL, AST/ALT 27/16 U/L, žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 0.64 mg/dL, Ūėąžē°žöĒžÜĆžßąžÜĆ 11.9 mg/dL, Cr 0.6 mg/dL, Na/K 137/3.8 mEq/L, LDH 323 U/L, CRP 10.23 mg/dL, ESR 120 mm/hr, D-dimer 206 ng/mL, CA 19-9 164 U/mL, Í≥ĶŽ≥ĶŪėąŽčĻ 77 mg/dL, HIV Ūē≠ž≤īŽäĒ žĚĆžĄĪžĚīžóąŽč§. ŽŹôŽß•ŪėąÍįÄžä§ Ž∂ĄžĄĚžÉĀ pH 7.34, PCO2 25.1 mmHg, PO2 79.6 mmHg, SO2 95.9%, HCO3 16.4 mmol/LžĚīžóąŽč§. Mycoplasma Ab IgM 0.6, Cold-agglutinin 1:8, TB skin test 0 mm, gamma IFN test žĚĆžĄĪ, Pneumococci Ag (urine) žĚĆžĄĪžĚīžóąŽč§. žÜĆŽ≥Ä Í≤Äžā¨žÉĀ ŪäĻžĚī žÜĆÍ≤¨žĚÄ žóÜžóąŽč§.
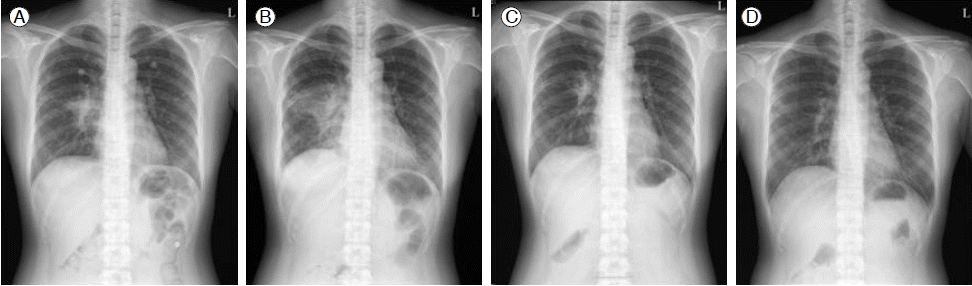
Žį©žā¨žĄ† žÜĆÍ≤¨: Žč®žąú ŪĚČŽ∂Ä Žį©žā¨žĄ† žā¨žßĄ(Fig. 1A) ŽįŹ ŪĚČŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀ(Fig. 2A)žóźžĄú žė§Ž•łž™Ĺ žÉĀžóĹžĚė ŪŹźžēľžĚė ŪŹź žĻ®žú§žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąŽč§.
ŽĮłžÉĚŽ¨ľ ŽįŹ ž°įžßĀ žÜĆÍ≤¨: ŽįúžóīžĚī žěąžĖī Ūėąžē°ŽįįžĖϞ̥ BACTEC9240(Becton Dickinson, Sparks, Md.,USA) žčúžä§ŪÖúžúľŽ°ú 3žĆć žčúŪĖČŪēėžėÄžúľŽ©į, ÍįÄŽěėŽäĒ 3žĚľ žóįžÜćžúľŽ°ú Gram stain, AFB stain ŽįŹ AFB cultureŽ•ľ žčúŪĖČŪēėžėÄŽč§. Ūėąžē°ŽįįžĖĎžĚÄ žĚīžÉĀ žÜĆÍ≤¨ žóÜžóąŽč§. žīĚ 3ŪöĆžĚė ÍįÄŽěė Í≤Äžā¨žÉĀ AFB stain žĖĎžĄĪ, AFB culture (žē°ž≤ī ŽįįžßÄ) ŽįŹ AFB culture (Í≥†ž≤ī ŽįįžßÄ)žÉĀ Ž™®ŽĎź NTM žĖĎžĄĪžĚī ŪôēžĚłŽźėžóąŽč§. žěÖžõźžĚľŽ°úŽ∂ÄŪĄį 5ž£ľžßłžóź M. massilienseÍįÄ žĶúžĘÖž†ĀžúľŽ°ú ŽŹôž†ēŽźėžóąŽč§. ŽĆÄŪēúÍ≤įŪēĶŪėĎŪöĆ Í≤įŪēĶžóįÍĶ¨žõźžóźžĄú Clinical and Laboratory Standards Institute Íłįž§Äžóź ŽĒįŽĚľ žč§žčúŪēú Ūē≠Í∑†ž†úžóź ŽĆÄŪēú žĶúžÜĆžĖĶž†úŽÜ掏Ą ŽįŹ ÍįźžąėžĄĪ Í≤įÍ≥ľÍįÄ žěÖžõźžĚľŽ°úŽ∂ÄŪĄį 6ž£ľ ŪõĄžóź ŪôēžĚłŽźėžóąŽč§(Table 1).
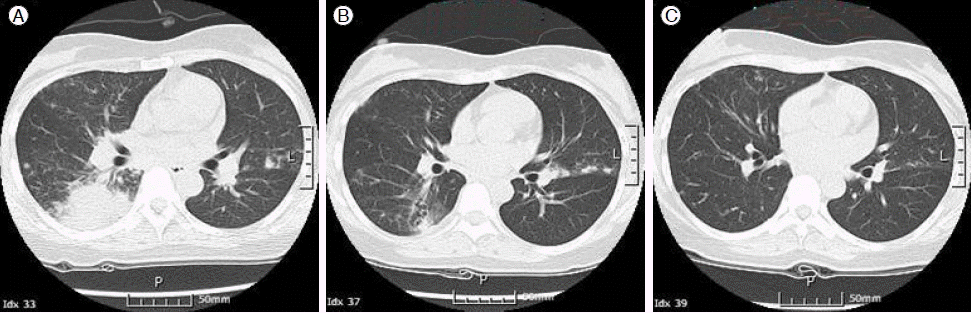
žěĄžÉĀÍ≤ĹÍ≥ľ ŽįŹ žĻėŽ£Ć: ŪôėžěźŽäĒ 3ŽÖĄ ž†ĄŽ∂ÄŪĄį žßÄžÜ枆ĀžúľŽ°ú ŽįėŽ≥ĶŽźėŽäĒ ŪŹźŽ†īžúľŽ°ú žīĚ 3ŪöĆžóź ÍĪłž≥ź žěÖžõźŪēú Ž≥ĎŽ†•žĚī žěąžóąŽč§. ŽčĻžčúžóźŽŹĄ NTM ÍįźžóľžĚī žĚėžč¨ŽźėžóąžúľŽāė ÍįÄŽěė ŽįįžĖĎ Í≤Äžā¨ ŽįŹ ÍłįÍīÄžßÄ ŽāīžčúÍ≤Ş̥ ŪÜĶŪēú ÍįÄŽěė ŽįįžĖĎ Í≤Äžā¨žÉĀ ŪäĻžĚī žÜĆÍ≤¨ ÍīÄžįįŽźėžßÄ žēäžēėÍ≥†, NTM ÍįźžóľžĚė žßĄŽč® Íłįž§Äžóź ž∂©ž°ĪŽźėžßÄ žēäžēĄ žßĄŽč®ŽźėžßÄ Ž™ĽŪēėÍ≥†, Í≤ĹŪóėž†Ā Ūē≠žÉĚž†úŽ°ú cefoperazone/sulbactam, amikacin, clarithromycinžĚĄ Ūą¨žó¨Ūēėžó¨ Ūėłž†ĄŽźú ŪõĄ Í≤ĹÍ≥ľÍīÄžįį ž§ĎžĚīžóąŽč§. ŽĒįŽĚľžĄú žĚīŽ≤ą žěÖžõź ŽčĻžčúŽ∂ÄŪĄį NTM, atypical pneumoniažĚė ÍįÄŽä•žĄĪžĚĄ žóľŽĎźŪēėÍ≥† ÍįÄŽěė ŽįįžĖĎ Í≤Äžā¨Ž•ľ žóĄŽįÄŪěą žčúŪĖČŪēėžėÄŽč§. ŪôėžěźŽäĒ žě•ÍłįÍįĄ ŽŹôžēą PRSŽ•ľ Ž≥Ķžö©ŪēėžėÄÍ≥†, Íłįž†ÄŽ°ú ÍłįÍīÄžßÄ Ūôēžě•ž¶ĚžĚĄ ŽŹôŽįėŪēėžó¨ Pseudomonas aeroginosažĚė Íįźžóľ ÍįÄŽä•žĄĪžĚĄ Í≥†Ž†§Ūēėžó¨ žöįžĄ† Í≤ĹŪóėž†Ā Ūē≠žÉĚž†ú žĻėŽ£ĆŽ•ľ žčúžěĎŪēėžėÄŽč§. žěÖžõź 3žĚľžßłžóź sputum AFBstain žĖĎžĄĪžúľŽ°ú ŪôēžĚłŽźėžĖī INH, RIF, EMB, PZAžúľŽ°ú Ūē≠Í≤įŪēĶ žĻėŽ£ĆŽ•ľ žčúžěĎŪēėžėÄŽč§. žěÖžõź 5žĚľžßłžóź ŪĚČŽ∂Ä X-rayžÉĀ ÍįĎžěϞ䧎ü¨žöī žēÖŪôĒÍįÄ ÍīÄžįįŽźėÍ≥†(Fig. 1B), ŪĆ®ŪėąžĄĪ žáľŪĀ¨ÍįÄ ŽįúžÉĚŪēėžėÄŽč§. žīĚ 3ŪöĆžĚė AFB sputum culturežÉĀ NTMžĚī ŪôēžĚłŽźėžĖī žöįŽ¶¨ŽāėŽĚľžóźžĄú ŽįúŽ≥Ď ŽĻąŽŹĄÍįÄ ŽÜížĚÄ M. avium, M. abscessusŽ•ľ Í≥†Ž†§Ūēėžó¨ clarithomycin 1,000 mgŽ•ľ ž∂ĒÍįÄŪēėžėÄŽč§. žĚīŪõĄ žÜĆŪôĒÍłį Ž∂ÄžěĎžö© ŽįŹ ÍįĄžąėžĻė žÉĀžäĻžúľŽ°ú PZAžôÄ INHŽ•ľ ž§ĎžßÄŪēėÍ≥†, RIF, EMB ŽįŹ clarithromycin, amikacinžúľŽ°ú 2ž£ľÍįĄ Ūą¨žó¨ŪēėŽ©īžĄú žěĄžÉĀ ž¶ĚžÉĀÍ≥ľ chest X-rayžĚė Ūėłž†ĄžĚī ÍīÄžįįŽźėžóąŽč§. ŪôėžěźŽäĒ ÍįúžĚł žā¨ž†ēžÉĀ žěÖžõźžĚĄ žßÄžÜćŪē† žąė žóÜžĖī NTMžĚė žĶúžĘÖ ŽŹôž†ēÍ∑†žĚĄ ŪôēžĚłŪēėžßÄ Ž™ĽŪēú žĪĄ RIF, EMB, clarithromycinžĚė Í≤ĹÍĶ¨žö© ž†úžě¨Ž°ú žēĹŽ¨ľžĚĄ ž°įž†ąŪēėžó¨ žěÖžõź 30žĚľžßłžóź ŪáīžõźŪēėžėÄŽč§. Ūáīžõź ŪõĄ žôłŽěėžóźžĄú M. massilienseŽĚľŽäĒ žĶúžĘÖ ŽŹôž†ēÍ∑† ŽįŹ žēĹž†ú ÍįźžąėžĄĪ Í≤Äžā¨ Í≤įÍ≥ľÍįÄ(Table 1) ÍįĀÍįĀ žěÖžõź 32žĚľžßł, žěÖžõź 45žĚľžßłžóź ŪôēžĚłŽźėžóąÍ≥†, Í∑łžóź ŽĒįŽĚľ RIF ŽįŹ EMBŽäĒ ž§ĎžßÄŪēėžėÄŽč§. Clarithromycin 1,000 mg Í≤ĹÍĶ¨ž†úŽ•ľ Žč®ŽŹÖ Ūą¨žó¨ žčú ŽĮłžóīžĚī žßÄžÜ掟ėÍ≥† ÍįÄŽěė žĖĎžĚī ž¶ĚÍįÄŪēėžó¨ ž†ēž£ľžö© amikacin 500 mgžĚĄ 24žčúÍįĄ ÍįĄÍ≤©žúľŽ°ú ž∂ĒÍįÄŪēėžó¨ žĚī ŽĎź ÍįÄžßÄ žēĹž†úŽ•ľ 4ÍįúžõĒÍįĄ žú†žßÄŪēú ŪõĄ ŪėĄžě¨ŽäĒ Í≤ĹÍĶ¨žö© clarithromycin 1000 mgŽßĆ Ūą¨žó¨ ž§ĎžĚīŽč§. Ūáīžõź ŪõĄ 1ÍįúžõĒ ŽįŹ 2ÍįúžõĒžßłžóź ÍįĀÍįĀ žčúŪĖČŪēú sputum AFB stain ŽįŹ sputum AFB culturežóźžĄú Í∑†žĚĆž†ĄžĚĄ ŪôēžĚłŪēėžėÄÍ≥†, chest CT (Fig. 2) ŽįŹ žěĄžÉĀ ž¶ĚžÉĀžĚī Ūėłž†ĄŽźú žÉĀŪÉúŽ°ú žĻėŽ£Ć žčúžěĎ ŪõĄ ŪėĄžě¨ÍĻĆžßÄ žīĚ 6ÍįúžõĒÍįĄ Í≤ĹÍ≥ľÍīÄžįį ž§ĎžĚīŽč§.
Í≥† žįį
ŽĻĄÍ≤įŪēĶžĄĪ ŽßąžĚīžĹĒŽįēŪÖĆŽ¶¨žēĄ(nontuberculous mycobacteria, NTM)žĚÄ Í≤įŪēĶÍ∑†(M. tuberculosis)Í≥ľ ŽāėŽ≥ĎÍ∑†(M. leprae)žĚĄ ž†úžôłŪēú ŽßąžĚīžĹĒŽįēŪÖĆŽ¶¨žēĄŽ•ľ ŽßźŪēúŽč§[1,2]. žěźžóįÍ≥Ąžóź ÍįźžóľŽ≥īžú†žąôž£ľÍįÄ žóÜŽäĒ Í≤įŪēĶÍ∑†Í≥ľ Žč¨Ž¶¨ NTMžĚÄ Ū܆žĖĎÍ≥ľ Ūēėž≤ú ŽďĪ žěźžóįŪôėÍ≤Ĺžóź ž†ēžÉĀž†ĀžúľŽ°ú Ž∂ĄŪŹ¨ŪēėÍ≥† žěąžĖī žěĄžÉĀÍ≤Äž≤īžóźžĄú Ž∂ĄŽ¶¨ŽźėžóąžĚĄ ŽēĆ ŽĆÄŽ∂ÄŽ∂Ą žė§žóľÍ∑†žĚīŽāė žßĎŽĚĹÍ∑†žúľŽ°ú ÍįĄž£ľŽźėžĖī žôĒŽč§[1]. žĶúÍ∑ľ Í≤įŪēĶžĚė žú†Ž≥ĎŽ•†žĚī ž¶ĚÍįÄŪēėÍ≥†, DNA genežĚė žóľÍłį žĄúžóīžĚĄ žĚīžö©Ūēú žÉąŽ°úžöī Ž∂ĄŽ•ė ÍłįŽ≤ēžĚė ŽįúŽč¨Ž°ú NTMžĚė Ž∂ĄŽ¶¨žú® ŽįŹ ÍīÄŽ†® žßąŪôėžú®žĚī ž¶ĚÍįÄŪēėŽ©īžĄú žěĄžÉĀž†Ā ž§ĎžöĒžĄĪžĚī ž¶ĚÍįÄŪēėÍ≥† žěąŽč§[1-3]. žĚłž≤īžóź žßąŪôėžĚĄ žú†ŽįúŪēúŽč§Í≥† žēĆŽ†§žßĄ NTMžĚÄ žßÄÍłąÍĻĆžßÄ 100žó¨ žĘÖžúľŽ°ú žēĆŽ†§ž†ł žěąžúľŽ©į, žõźžĚłÍ∑†žĚÄ ŽāėŽĚľžôÄ žßÄžó≠žóź„ÄÄŽĒįŽĚľ ŽßéžĚÄ žį®žĚīÍįÄ žěąŽč§[1-3,7].
M. massilienseŽäĒ ŪėēŪÉúŪēôž†Ā, žÉĚŪôĒŪēôž†Ā, žú†ž†Ąž†Ā žł°Ž©īžóźžĄú M. abscessusžôÄ žú†žā¨Ūēėžó¨ žĚīž†ĄžóźŽäĒ M. abscessusŽ°ú Ž∂ĄŽ•ėŽźėžóąžúľŽāė, 16S rRNA, rpoB, hsp65 genežĚĄ žĚīžö©Ūēú PCR-RFLP(polymerase chain reaction restriction fragment length polymorphism) Žį©Ž≤ēžúľŽ°ú 2009ŽÖĄ žĚīŪõĄŽ∂ÄŪĄį M. abscessusžóźžĄú Ž∂ĄŽ¶¨ŽźėžĖī M. fortuitumÍ≥ľ ŽćĒŽ∂ąžĖī žÉąŽ°≠Í≤Ć RGMžúľŽ°ú Ž∂ĄŽ•ėŽźėžóąŽč§[3,4]. ÍįźžóľÍ≤ĹŽ°ú ŽįŹ žěĄžÉĀžĖĎžÉĀžóź ŽĆÄŪēīžĄúŽäĒ ž†ēŪôēŪěą žēĆŽ†§žßÄžßÄ žēäžēėžúľŽāė žĘÖžĘÖ ŪĒľŽ∂ÄÍįźžóľžĚĄ ŽĻĄŽ°ĮŪēėžó¨ žąėžą† žįĹžÉĀ ÍįźžóľžĚĄ žĚľžúľŪā§ŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§[6,8]. žĚľŽ≥łžóźžĄúŽäĒ žė®ž≤úžąėŽ•ľ ŪÜĶŪēú ŪĒľŽ∂ÄÍįźžóľ, ŽłĆŽĚľžßąžóźžĄúŽäĒ žĄĪŪėēžąėžą†Í≥ľ ÍīÄŽ†®Žźú ŪĒľŽ∂Ä ÍįźžóľžĚī Ž≥īÍ≥†Žźú ž†ĀžĚī žěąÍ≥†, žöįŽ¶¨ŽāėŽĚľžóźžĄúŽäĒ ŪĒľŽāī ž£ľžā¨ ŪõĄžĚė ŪĒľŽ∂Ä Íįźžóľ[6], ÍįźžóľÍ≤ĹŽ°úÍįÄ Ž∂ąŪôēžč§Ūēú ŪŹźŽ†īžĚī[5] Ž≥īÍ≥†ŽźėžóąŽč§. Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽäĒ žěÖžõźŽčĻžčúžóźŽäĒ ŪĒľŽ∂Ä ÍįźžóľžĚÄ ŪôēžĚłŽźėžßÄ žēäžēėŽćė ž†źžóźžĄú ŪĒľŽ∂Ä ÍįźžóľžĚīžôłžĚė Žč§Ž•ł Íįźžóľ Í≤ĹŽ°úžóź ŽĆÄŪēīžĄúŽŹĄ ž∂ĒŪõĄ ŽćĒ ŽßéžĚÄ žóįÍĶ¨ÍįÄ žöĒŪē† Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§.
ÍįźžóľžĚė žúĄŪóėžĚłžěźŽ°úŽäĒ HIVžĚė Íįźžóľ(ŪäĻŪěą T-lymphocytežĚė žąėÍįÄ CD4+50 /uL žĚīŪēėŽ°ú ž†ÄŪēėŽźú Í≤Ĺžöį), ŪŹźÍ≤įŪēĶ, žßĄŪŹźž¶Ě, COPD, žēĆžĹĒžė¨ ž§ĎŽŹÖ, ÍłįÍīÄžßÄ Ūôēžě•ž¶Ě, Ž•ėŽßąŪ܆žĚīŽďú ŪŹźžßąŪôė, Í≤įž†ą ŽįŹ Í≥ĶŽŹôžĄĪ ŪŹźžßąŪôėžĚī žēĆŽ†§ž†ł žěąŽč§[1,3]. ŪäĻŪěą Í≤įž†ąžĄĪ ŪŹźžßąŪôėžĚĄ ŽŹôŽįėŪēú ŪŹźÍ≤Ĺ ŪõĄžĚė žó¨žĄĪžóźžĄúŽäĒ ŽąĄŽĎźŪĚČ, ž≤ôž∂Ē žł°ŽßĆž¶Ě, žäĻŽ™®ŪĆźŪÉąž∂úž¶Ě, ÍīÄž†ą Í≥ľžöīŽŹôžĄĪÍ≥ľ ÍįôžĚÄ ŪäĻŽ≥ĄŪēú žč†ž≤īŪėēžóźžĄú ÍįźžóľŽ•†žĚī ŽÜížĚÄŽćį, žĚīÍ≤ÉžĚÄ ÍłįŽŹĄ Ž∂ĄŽĻĄŽ¨ľžĚė Žįįž∂úŽä•žĚė ž†ÄŪēėžôÄ ÍīÄŽ†®Ūēú Í≤ÉžúľŽ°ú žĄ§Ž™ÖŽźėÍ≥† žěąŽč§[1]. Ž©īžó≠ ž†ÄŪēėžěźžóźžĄú ŽįúŽ≥ĎŽ•†žĚī ŽÜížĚÄ žĚīžú†Ž•ľ žĄ§Ž™ÖŪēėŽäĒ Ž≥ĎŽ¶¨ Íłįž†ĄžóźŽäĒ mycobacterial resistancežóź žěąžĖīžĄú T-cellžĚė Ūē©žĄĪ ŽįŹ ŪôúžĄĪŽŹĄžôÄžĚė ÍīÄŽ†®žĄĪ, interferon (IFN)-ržôÄ interleukin(IL)-12žĚė Ūē©žĄĪÍ≥ľ ŽįėžĚĎ pathwayžóźžĄúžĚė žó¨Žü¨ žĚłžěźžĚė Ž≥ÄžĚī(žėą, IFNrR1, IFNrR2, IL12RB1, IL12p40, STAT1, NEMO), TNF-a žĖĶž†úž†ú(žėą, infliximab, adalimumab)žôÄ monocyte/macrophagesžĚė ÍīÄŽ†®žĄĪžĚī ž†úžčúŽźėÍ≥† žěąžúľŽāė[1] Ž™ÖŪôēŪěą žēĆŽ†§žßĄ ŽįĒŽäĒ žóÜÍ≥†, ž∂ĒŪõĄ žßÄžÜ枆ĀžĚł žóįÍĶ¨ÍįÄ žöĒÍĶ¨ŽźėÍ≥† žěąŽč§. Ž≥ł ž¶ĚŽ°ÄžĚė Í≤ĹžöįŽäĒ ÍłįÍīÄžßÄ Ūôēžě•ž¶ĚÍ≥ľ Í≥ĶŽŹôžĄĪ ŪŹźžßąŪôėžĚė žĄ†ŪĖČ žßąŪôėžĚī žěąžóąžúľŽ©į, Žį©žā¨žĄ† žÜĆÍ≤¨žóźžĄú Í≤įž†ąŪėē ŪĆ®ŪĄīžĚĄ Ž≥īžėÄŽč§. ŽėźŪēú Ž≥ł ž¶ĚŽ°ÄŽäĒ žáľÍ∑łŽ†Ć ž¶ĚŪõĄÍĶįžĚė Í≤ĹžöįŽ°ú žáľÍ∑łŽ†Ć ž¶ĚŪõĄÍĶįžĚī IL-1Ra (interleukin 1 receptor antagonist)Í≥ľ IL-1žĚė žĚīžÉĀ ž°įž†ąžóź žĚėŪēėŽ©į[1], IL-1ŽäĒ ŽĆÄžčĚžĄłŪŹ¨, žĄ¨žú†žēĄžĄłŪŹ¨, žóįÍ≥®žĄłŪŹ¨ ŽďĪ ÍĪįžĚė Ž™®Žď† žĄłŪŹ¨žóź žėĀŪĖ•žĚĄ ŽĀľžĻėŽäĒ ÍįēŽ†•Ūēú žóľž¶ĚžĄĪ žčúŪ܆žĻīžĚłžúľŽ°ú IFN-r, TNF-ažĚė ŪôúžĄĪŪôĒžóź žėĀŪĖ•žĚĄ ŽĮłžĻėÍ≤Ć ŽźėžĖī NTM ÍįźžóľžĚī ŽįúžÉĚŪēėÍ≤Ć ŽźėžóąžĚĄ ÍįÄŽä•žĄĪžóź ŽĆÄŪēīžĄú ž∂Ēž†ēŪēī Ž≥ľ žąė žěąŽäĒŽćį, žĚīžóź ŽĆÄŪēú žóįÍĶ¨ÍįÄ ŽćĒžöĪ ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú žā¨Ž£ĆŽźúŽč§.
NTM ÍįźžóľžĚÄ ŪŹźžßąŪôė, Ž¶ľŪĒĄž†ąžóľ, ŪĒľŽ∂Ä žßąŪôė, ŪĆĆžĘÖžĄĪ žßąŪôė ŽďĪ ŽĄ§ ÍįÄžßÄ ŪäĻžßēž†ĀžĚł žěĄžÉĀ ž¶ĚŪõĄÍĶįžĚĄ ŽāėŪÉÄŽāīŽ©į žĚī ž§Ď ŪŹźžßąŪôėžĚÄ NTM Íįźžóľž¶ĚžĚė 90% žĚīžÉĀžĚĄ žį®žßÄŪēėŽäĒ ÍįÄžě• ŪĚĒŪēú ŪėēŪÉúžĚīŽč§[1]. NTMžĚė ŪŹźžßąŪôėžúľŽ°ú ŽāėŪÉÄŽāėŽäĒ ž¶ĚžÉĀžĚÄ ŽßĆžĄĪ ÍłįžĻ®, ÍįÄŽěė, ŪėłŪĚ°Í≥§ŽěÄ, ŪĒľŽ°ú, Í∑ľžú°ŪÜĶ, žóī, ÍįĚŪėą, ŪĚČŪÜĶ ŽďĪžúľŽ°ú Žč§Ž•ł ŪėłŪĚ°ÍłįÍįźžóľžĚė ž¶ĚžÉĀÍ≥ľ ŪĀ¨Í≤Ć Žč§Ž•īžßÄ žēäŽč§[1,2]. ŪėłŪĚ°ÍłįžĚė NTM ÍįźžóľžĚĄ žßĄŽč®ŪēėŽäĒ Íłįž§ÄžĚÄ ž£ľŽ°ú ŽĮłÍĶ≠ ŪĚČŽ∂ÄŪēôŪöĆ(American Thoracic Society, ATS)žôÄ žėĀÍĶ≠ŪĚČŽ∂ÄŪēôŪöĆ (British Thoracic Society, BTS)žĚė žßĄŽč® Íłįž§ÄžĚī ÍįÄžě• ŽĄźŽ¶¨ žā¨žö©ŽźėÍ≥† žěąŽäĒŽćį[1,2], NTM Í∑†ŽįįžĖĎ žĖĎžĄĪžĚĄ ŪēĄžąėž°įÍĪīžúľŽ°ú Ūēėžó¨ žěĄžÉĀžÜĆÍ≤¨, Žį©žā¨žĄ† žÜĆÍ≤¨(žĻ®žú§, Í≤įž†ą, Í≥ĶŽŹôžĄĪŽ≥ĎŽ≥Ä, ÍłįÍīÄžßÄ Ūôēžě•ž¶Ě ŽďĪ)Í≥ľ ž†Āž†ąŪēú ŽĮłžÉĚŽ¨ľŪēôž†Ā Íłįž§ÄžĚĄ ž∂©ž°ĪžčúŪā¨ ŽēĆ žßĄŽč®žĚĄ ŽāīŽ¶ī žąė žěąŽč§[1,2]. ÍĶ≠ŽāīžĚė Í≤įŪēĶžóįÍĶ¨žõźžóźžĄúŽäĒ ž£ľŽ°ú ŽĮłÍĶ≠ ŪĚČŽ∂ÄŪēôŪöĆžĚė Í∑úž†ēžĚĄ ŽĒįŽ•īÍ≥† žěąŽč§. ŽĮłÍĶ≠ ŪĚČŽ∂ÄŪēôŪöĆžĚė Í∑úž†ēžĚÄ 2007ŽÖĄžóź žÉąŽ°ú Íįúž†ēŽźėŽ©īžĄú žěĄžÉĀž†Ā, Žį©žā¨žĄ†Ūēôž†Ā Íłįž§ÄžĚÄ ŽŹôžĚľŪēėŽāė, ŽĮłžÉĚŽ¨ľŪēôž†Ā Íłįž§ÄžĚÄ Žč§žÜĆ žôĄŪôĒŽźėžóąŽč§.
NTM Íįźžóľž¶ĚžĚė žĻėŽ£ĆŽäĒ ŽŹôž†ēŽźú Í∑†žĘÖÍ≥ľ ÍįźžóľŽ∂ÄžúĄžóź ŽĒįŽĚľ Žč¨ŽĚľžßÄÍ≤Ć ŽźúŽč§[1]. NTMžóź žĚėŪēú ŪŹźžßąŪôėžĚÄ žěĄžÉĀžĖĎžÉĀžĚī Í≤įŪēĶÍ≥ľ ÍįźŽ≥ĄŪēėÍłį ŪěėŽď§Í≥†, žĻėŽ£ĆŽįėžĚĎžĚī žĘčžßÄ žēäÍ≥†, žě¨ŽįúŽ•†žĚī ŽÜížēĄ žēĹž†úŽ≥ĎŪē©žöĒŽ≤ēžúľŽ°ú žĶúžÜĆ 12-18ÍįúžõĒ žĚīžÉĀ žě•ÍłįÍįĄ ŽŹôžēą žĻėŽ£ĆŪēīžēľŪēúŽč§[1,7]. ŽćĒÍĶ¨Žāė Í∑†žĘÖžóź ŽĒįŽĚľ žēĹž†úŽāīžĄĪžĚī Žč¨ŽĚľ žĻėŽ£Ćžóź ž†ÄŪē≠žĄĪžĚĄ ŽāėŪÉÄŽāľ žąė žěąžĖī žĻėŽ£ĆÍįÄ žĖīŽ†ĶŽč§[1,3,7,9,10]. ŽĒįŽĚľžĄú žě•ÍłįÍįĄžĚė Žč§ž†ú Ž≥ĶŪē© žēĹŽ¨ľ žĻėŽ£ĆžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† žĻėŽ£Ć žč§ŪĆ® ŽįŹ žě¨ŽįúŽ•†žĚī ŽÜížēĄ Ž≥ĎŽ≥ÄžĚī ÍĶ≠ŪēúŽźėžĖī žěąžĚĄ Í≤ĹžöįŽäĒ ŪŹźž†ąž†úžą†žĚĄ žčúŪĖČŪēėÍłįŽŹĄ ŪēúŽč§[1,8].
ŪėĄžě¨ÍĻĆžßÄ MAC, M. abscessus, M. KansasiiŽ•ľ ž†úžôłŪēėÍ≥†ŽäĒ ÍĶ¨ž≤īž†ĀžúľŽ°ú žēĹž°įŪē©žĚī ž≤īÍ≥ĄŪôĒŽźėžĖī žěąžßÄ žēäžúľŽ©į, M. massiliensežóź ŽĆÄŪēú žēĹ ž°įŪē©žóź ŽĆÄŪēīžĄúŽäĒ ž†ēŪôēŪěą žēĆŽ†§žßĄ ŽįĒÍįÄ žóÜŽč§. ŽĮłÍĶ≠ ŪĚČŽ∂Ä ŪēôŪöĆžĚė žßĄŽ£Ć žßÄžĻ®žóźžĄúŽäĒ RGMžĚė žĻėŽ£ĆžóźžĄú clarithromycin ŪėĻžĚÄ azithromycinžĚĄ amikacin, cefoxitin, imipenemÍ≥ľ Ž≥ĎŪē©ŪēėŽŹĄŽ°Ě Í∂Ćžě•ŪēėÍ≥† žěąžúľŽ©į[1], 2005ŽÖĄ ŽĆÄŪēú Í≤įŪēĶ ŽįŹ ŪėłŪĚ°ÍłįŪēôŪöĆžĚė žßĄŽ£Ć žßÄžĻ® ŽįŹ 2011ŽÖĄ Í≤įŪēĶ žßĄŽ£ĆžßÄžĻ® ÍįúŽįúžúĄžõźŪöĆ ŽįŹ žßąŽ≥ĎÍīÄŽ¶¨Ž≥łŽ∂Ğ󟞥ú ŽįúŪĎúŪēú Í≤įŪēĶ žßĄŽ£Ć žßÄžĻ®žóźžĄúŽŹĄ žĚīŽäĒ Í∑łŽĆÄŽ°ú ž†Āžö©ŽźėžóąŽč§. M. massilienseŽäĒ RGMžĚė Ūēú žĘÖŽ•ėŽ°úžĄú M. abscessus ŽįŹ M. chelonaežôÄ žú†žā¨ŪēėŽāė Ūē≠žÉĚž†ú ÍįźžąėžĄĪžóźŽäĒ žį®žĚīÍįÄ žěąŽč§[3,4,9]. M. massilienseŽäĒM. abscessusžôÄ Žč¨Ž¶¨ doxycyclinežóź ÍįźžąėžĄĪžĚī žěąžúľŽāė, žĶúÍ∑ľžóźŽäĒ doxycyclinežóź ŽĆÄŪēú ŽāīžĄĪžĚī ž†źžį®Ž°ú ŪôēžĚłŽźėÍ≥†, rpoB region V sequence Ž∂ÄŽ∂ĄžóźžĄú žú†ž†Ąž†ĀžúľŽ°ú žóľÍłįžĄúžóīžĚī Žč§Ž•ł M. massiliensežĚė Žč§žĖĎŪēú Í∑†ž£ľÍįÄ ŪôēžĚłŽźėŽ©īžĄú[3,9,10] RGMžĚė žĻėŽ£Ć žßÄžĻ®žĚĄ ÍłįŽįėžúľŽ°ú Ūēėžó¨ Ūē≠žÉĚž†ú ÍįźžąėžĄĪ Í≤įÍ≥ľžóź ŽĒįŽĚľ žĄ†ŪÉĚŪēėžó¨žēľ ŪēúŽč§.
žöįŽ¶¨ŽāėŽĚľžóźžĄúŽäĒ M. massiliensežĚė ŽŹôž†ēŽ≤ēÍ≥ľ ÍīÄŽ†®ŪēīžĄúŽäĒ Ž™á ÍĪīžĚė Ž≥īÍ≥†ÍįÄ žěąžóąžúľŽāė žěĄžÉĀž†ĀžĚł žĻėŽ£ĆžôÄ ÍīÄŽ†®ŪēīžĄúŽäĒ žīĚ 2žėąžĚė Ž≥īÍ≥†ÍįÄ žěąžóąŽč§. Í∑łž§Ď 1žėąŽäĒ ŪĒľŽ∂Ä ÍįźžóľžóźžĄú clarithromycin, doxicycline, amikacin ŽįŹ cefoxitinžĚĄ žīĚ 6ÍįúžõĒ Ūą¨žó¨Ūēėžó¨ Ūėłž†ĄŽźú Í≤ĹžöįžĚīÍ≥†[6], ŽāėŽ®łžßÄ 1žėąŽäĒ ŪŹźŽ†īžóźžĄú ŪĎúž§Ä Ūē≠žÉĚž†ú žĻėŽ£ĆžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† Ūėłž†ĄŽźėžßÄ žēäžēĄžĄú ŪŹźž†ąž†úžą† ŪõĄ clarithromycin, amikin, moxifloxacin, imipenemžĚĄ Ūą¨žó¨Ūēú Í≤ĹžöįžĚīŽč§[8]. ž†ĄžěźžĚė žėąžóźžĄúŽäĒ RGMžĚė žĻėŽ£ĆžóźžĄú Í∂Ćžě•ŪēėŽäĒ Ūē≠žÉĚž†úžĚł clarithromycin, doxicycline, amikacin ŽįŹ cefoxitinžĚė Ž™®ŽĎźžóźžĄú Ūē≠žÉĚž†ú ÍįźžąėžĄĪžĚī žěąžóąžúľŽāė, Ž≥ł ž¶ĚŽ°ÄžĚė Í≤ĹžöįžóźŽäĒ doxicyclinežóź ŽāīžĄĪžĚī žěąžóąÍ≥†, cefoxitinžĚÄ leucopenia ŽįŹ LFT žÉĀžäĻžúľŽ°ú Ūą¨žó¨ŪēėžßÄ Ž™ĽŪēú Í≤ĹžöįŽ°ú žį®žĚīÍįÄ žěąžóąŽč§. Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽäĒ Ūē≠žÉĚž†ú ÍįźžąėžĄĪ ŽāīžĄĪ Í≤Äžā¨ Í≤įÍ≥ľŽ•ľ ŽįĒŪÉēžúľŽ°ú Ūēėžó¨ clarithromycin (1,000 mg/day, ž£ľ 7ŪöĆ, PO)Í≥ľ amikacin (500 mg/day, ž£ľ 5ŪöĆ, IV)žĚĄ 4ÍįúžõĒÍįĄ Ž≥ĎŪē© Ūą¨žó¨ ŪõĄ amikacinžĚÄ ž§ĎŽč®ŪēėÍ≥† ŪėĄžě¨ŽäĒ 1ÍįúžõĒžßł clarithromycin (1,000 mg/day, ž£ľ 7ŪöĆ, PO)ŽßĆ Ūą¨žó¨ŪēėŽ©īžĄú žąėžą†ž†Ā ž†ąž†ú žóÜžĚī Ūē≠žÉĚž†úŽßĆžúľŽ°ú žĻėŽ£ĆŪēú Í≤ĹžöįŽ°úžĄú žĚėžĚėÍįÄ žěąŽč§Í≥† Ūē† žąė žěąÍ≤†Žč§.
M. massilienseŽäĒ Í∑†žĚī ŽŹôž†ēŽźėžĖī žßĄŽč®ŽźėÍłįÍĻĆžßÄ 3-4ž£ľ žĚīžÉĀžĚė ŽßéžĚÄ žčúÍįĄÍ≥ľ ŽĻĄžö©žĚī Žď§žĖī žßĄŽč®žĚī žĖīŽ†ĶŽč§[1-3]. ŽćĒžöĪžĚī NTMžĚė žßĄŽč®Íłįž§ÄžĚĄ ž∂©ž°ĪžčúŪā§Íłį žĖīŽ†§žõĆ žĚėžč¨žĚÄ ŽźėžßÄŽßĆ ŪôēžßĄžĚĄ Ūē† žąė žóÜŽäĒ Í≤ĹžöįŽŹĄ ŽßéŽč§[1,7]. ŪäĻŪěą Í≤įŪēĶ ŽįúŽ≥ĎŽ•†žĚī ŽÜížĚÄ žöįŽ¶¨ŽāėŽĚľžóźžĄúŽäĒ AFB culture Í≤įÍ≥ľÍįÄ ŪôēžĚłŽźėÍłį ž†Ąžóź AFB stainžóźžĄú žĖĎžĄĪžúľŽ°ú ŪôēžĚłŽźėŽ©ī Ūē≠Í≤įŪēĶ žĻėŽ£ĆŽ•ľ žöįžĄ† žčúžěĎŪēėŽäĒŽćį, Í≤įŪēĶžúľŽ°ú ÍįĄž£ľŪēėÍ≥† AFB cultureŽ•ľ žóįžÜ枆ĀžúľŽ°ú žčúŪĖČŪēėžßÄ žēäžĚĄ Í≤Ĺžöįžóź NTM žßĄŽč® Íłįž§ÄžĚĄ ž∂©ž°ĪžčúŪā§Íłį žĖīŽ†§žõĆ M. massiliensežĚė žßĄŽč®žĚī ÍįĄÍ≥ľŽź† žąė žěąžúľŽĮÄŽ°ú[1,3,7] ÍįźžóľžĚė žĄ†ŪĖČ žöĒžĚłžĚī žěąžĚĄ Í≤ĹžöįžóźŽäĒ Ūēú Ž≤ąžĮ§ žĚėžč¨ŪēėÍ≥† ŽįįžĖĎ Í≤Äžā¨žóź ž£ľžĚėŽ•ľ žöĒŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėÍ≤†Žč§. žĶúÍ∑ľ žĄĪŪėē ŽįŹ ŪĒľŽ∂Ä žčúžą†, ŽÖłžĚł žĚłÍĶ¨žĚė ž¶ĚÍįÄžóź žĚėŪēú ÍīÄž†ą ž£ľžā¨ ŽįŹ žĻ®žą†žĚė žčúŪĖČ, Ž©īžó≠ žĖĶž†úž†ú žĻėŽ£Ć ŽįŹ Í≤įŪēĶ, ŽßĆžĄĪŪŹźžáĄžĄĪ ŪŹźžßąŪôėžĚė ŽįúŽ≥ĎŽ•† ŽďĪžĚī ž¶ĚÍįÄŪēėŽäĒ žÉĀŪô©žĚĄ Í≥†Ž†§Ūē† ŽēĆ M. massiliensežĚė ÍįźžóľžĚė ÍįÄŽä•žĄĪ ŽįŹ Í∑łžóź ŽĒįŽ•ł žěĄžÉĀž†Ā ž§ĎžöĒžĄĪžĚī ž¶ĚÍįÄŪē† Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§. žßĄŽč®, žĻėŽ£Ć ÍłįÍįĄ, Í∑† žĚĆž†ĄžĚė ŪôēžĚłžčúÍłįžôÄ ŪôēžĚłŽ≤ē ŽďĪžóź ŽĆÄŪēīžĄúŽŹĄ žßÄžÜ枆ĀžĚł ŽÖľžĚėÍįÄ ŪēĄžöĒŪēėŽč§[1,3]. ŪäĻŪěą žöįŽ¶¨ŽāėŽĚľŽäĒ H. pyroižĚė ž†úÍ∑† žöĒŽ≤ēÍ≥ľ ÍīÄŽ†®Ūēėžó¨ žĶúÍ∑ľ clarithromycinžĚė ŽāīžĄĪŽ•†žĚī ž¶ĚÍįÄŪēėÍ≥† žěąŽäĒ žÉĀŪô©žóźžĄú žě•ÍłįÍįĄ žĻėŽ£Ć ž§Ď ŽįúžÉĚŪēėŽäĒ clarithromycin ŽįŹ amikacinžĚė ŽāīžĄĪ žčúžĚė žĻėŽ£ĆŽ≤ēžóź ŽĆÄŪēīžĄúŽŹĄ ŽćĒžöĪ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§[1,3,10].



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






