당뇨병성 케톤산증 환자에서 발생한 급성식도괴사 1예
A Case of Acute Esophageal Necrosis in a Patient with Diabetic Ketoacidosis
Article information
Abstract
저자들은 39세 환자에서 발생한 당뇨병성 케톤산증에 동반된 급성식도괴사의 드문 증례를 경험하였다. 급성식도괴사는 치명적인 합병증을 가져 올 수 있는 질환으로 당뇨병성 케톤산증 환자에서 토혈이나 가슴통증이 있는 경우 이의 가능성을 고려해야 하겠다. 또한 진단 후에는 금식, proton pump inhibitor 등으로 대증적 치료를 하며 식도파열, 협착 및 종격동염 등의 심각한 합병증 발병 여부에 유의해야겠다.
Trans Abstract
Acute esophageal necrosis is a rare clinical entity characterized by the endoscopic finding of extensive black discoloration of the esophageal mucosa. Acute esophageal necrosis in a patient with diabetic ketoacidosis has rarely been reported. We report a case of acute esophageal necrosis in a patient with diabetic ketoacidosis. The patient had coffee ground emesis and, after an esophagogastroduodenoscopy with mucosal biopsy, acute esophageal necrosis was diagnosed. The patient was treated conservatively with an intravenous proton pump inhibitor and oral sucralfate without any complications. (Korean J Med 2012;83:117-121)
서 론
급성식도괴사(acute esophageal necrosis)는 내시경상 식도 내강을 둘러싸는 점막이 대칭적으로 검게 괴사되는 질환으로 Gurvits syndrome, Black esophagus, acute necrotizing esophagitis, esophageal infarction으로 불리기도 한다. 내시경이 보편화되면서 증례보고가 늘고 있으며 매우 드문 질환이지만 식도의 천공 및 협착, 패혈증 등 심한 합병증을 동반할 수 있어 주의가 필요하다. 신장기능부전, 패혈증, 허혈성질환 등에 동반되어 올 수 있고 환자의 90% 정도에서 토혈을 보이며 그 외 흑색변, 복통, 구토, 미열 등의 증상이 나타날 수 있다[1,2]. 급성식도괴사가 당뇨병성 케톤산증과 동반하여 발생한 경우는 보고된 바가 드물어 39세 환자에서 발생한 당뇨병성 케톤산증에 동반된 급성식도괴사 1예를 보고하는 바이다.
증 례
환 자: 남자, 39세
주 소: 내원 전일부터의 빈호흡
현병력: 6년 전에 당뇨병을 진단 받고 인슐린으로 치료중이었고 내원 3일 전부터 환자의 개인사정으로 집에 들어가지 못하면서 인슐린 주사를 맞지 못하였다. 내원 2일 전부터는 커피색의 토혈을 하였고 내원 전일부터 숨이 가빠서 응급실을 방문하였다.
과거력: B형 간염 보균자였으며 6년 전 당뇨병을 진단받은 후 insulin glargine 10 IU, insulin aspart를 매 식전 10 IU씩 사용 중이었다. 가족력상 특이 소견은 없었다.
사회력: 15갑년의 흡연력, 주 1회 소주 1병의 음주력이 있었다.
문진 소견: 기침, 가래는 없었으나 약간의 숨참을 호소하였으며 흉통과 가슴 쪽의 답답한 느낌을 호소하였다. 복통은 없었으나 약간의 울렁거림과 수 차례의 커피색 토혈이 있었다. 설사나 혈변, 흑색변은 없었다.
신체 검사 소견: 혈압 115/72 mmHg, 맥박 98회, 호흡수 40회, 체온 36.5℃였고 급성병색을 보이고 있었다. 의식은 명료하였고 청색증은 없었으나 가쁘게 숨을 쉬고 있었으며 피부의 탄력은 떨어져 있었고, 탈수되어 입술과 혀가 건조한 소견을 보였다. 폐음과 장음은 정상이었고 복부에 만져지는 덩이나 압통은 없었다.
검사실 소견: 백혈구 14,130/μL (호중구 78%), 헤모글로빈 14.3 g/dL, 혈소판 184,000/μL, 혈당 1,086 mg/dL, 혈청 케톤 양성, 소변케톤 2+이었고 동맥혈가스검사에서 pH 7.05, PaCO2 11 mmHg, PaO2 153 mmHg, HCO3 3 mmol/L, SaO2 99%, anion gap 44 mEq/L로 당뇨병성 케톤산증에 합당한 소견을 보였다. BUN/Cr 81/2.86 mg/dL, 혈청삼투압 341 mosm/kg으로 심한 탈수 상태를 보였고, AST/ALT 62/36 mg/dL, 칼슘/인 8.1/11.2 mg/dL, 요산 13.3 mg/dL, Na/K/Cl 104/6.3/57 mEq/L, 소변삼투압 408 mosm/kg, 당화혈색소는 10.2%였다.
입원 후 다량의 수액치료와 경정맥 인슐린 치료를 받았으며 제 2병일에는 혈당 230 mg/dL, 동맥혈가스분석 pH 7.45, PaCO2 29 mmHg, PaO2 107 mmHg, HCO3 21 mmol/L, SaO2 99%로 호전되었다.
방사선학적 소견 및 기타검사: 단순 흉부촬영상 폐결핵으로 의심되는 우상엽의 덩이가 관찰되었고 항산균도말검사 양성 소견 및 배양 검사에서 결핵균이 확인되어 활동성 폐결핵으로 진단하였다. 심전도는 정상동성리듬 소견을 보였다.
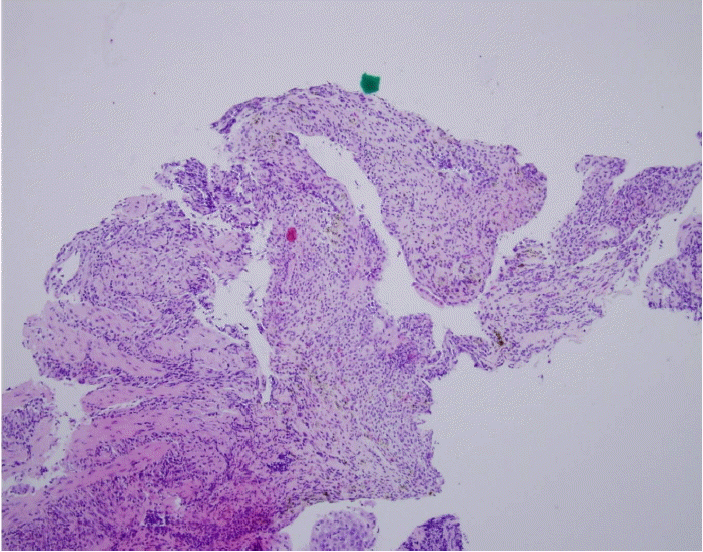
내시경 및 조직검사: 내원 전일부터 호소하던 토혈이 있어 상부위장관 내시경을 시행하였다. 검사상 위식도접합부부터 상방 20 cm까지 식도 벽 전반에 걸친 검게 괴사된 소견이 관찰되었고 괴사된 병변과 위식도 경계부 간의 경계는 명확하게 구분되었다(Fig. 1). 검게 괴사된 부위에서 시행한 조직검사에서는 상피세포의 탈락과 함께 점막에 괴사조직 침착과 염증세포 침윤이 관찰되었다(Fig. 2). 감염에 의한 괴사를 배제하기 위해 시행한 혈액배양 검사나 식도조직의 특수염색에서 병원체는 발견되지 않았다.
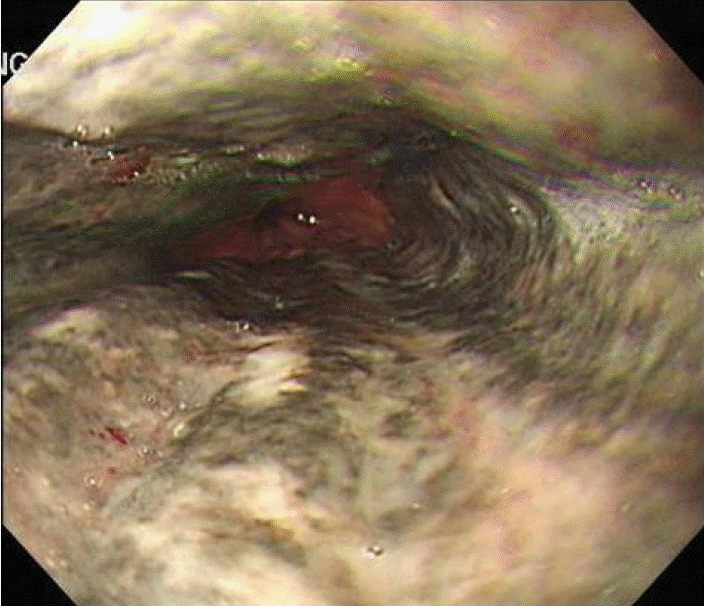
An initial gastroendoscopy shows black pigmentation, hyperemic mucosa, and ulceration of the esophagus. “Black esophagus” begins from the gastro-esophageal junction to 20 cm above, and abruptly stops at the gastro-esophageal junction.
The initial hematoxylin-eosin stain of the endoscopic esophageal biopsy shows necroinflammatory debri without epithelial cells (× 100).
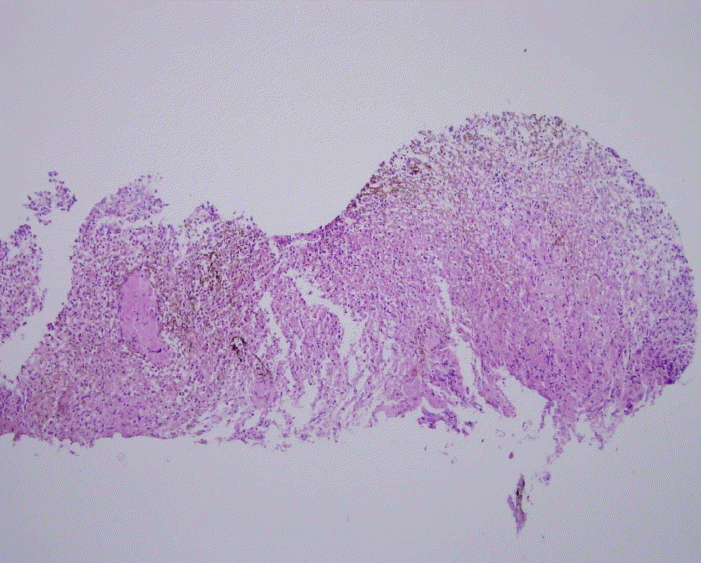
경과 및 치료: 급성식도괴사로 진단하여 금식을 유지하며 proton pump inhibitor와 sucralfate를 사용하였다. 병변의 호전여부 및 식도천공, 협착의 합병증 확인을 위해 1주일 뒤 상부위장관 내시경을 재시행하였고 식도점막의 검게 괴사된 부분이 호전됨이 관찰되었으며 천공이나 협착의 합병증은 관찰되지 않았다(Fig. 3). 재시행한 조직검사에서 식도상피세포 재생 소견과 괴사조직 및 염증세포의 감소 소견이 관찰되어(Fig. 4) 연식으로 식사를 시작하였으며 이후 증상이 호전되어 퇴원하였다. 이후 외래에서 항결핵 약제 및 인슐린 다회 주사요법을 유지하며 추적관찰 중이다.
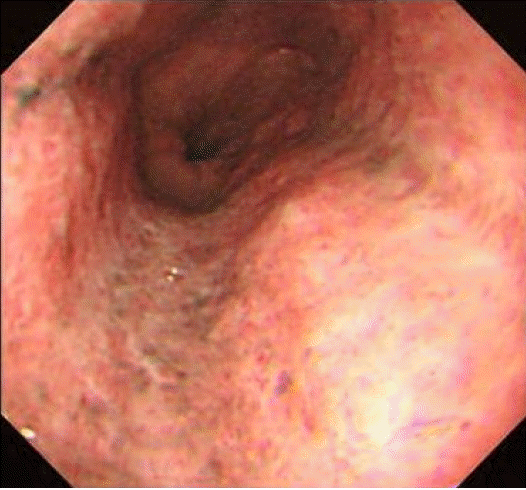
After 1week, follow-up gastroendoscopy shows improvement of esophageal pigmentation, mucosal edema, and ulceration.
고 찰
급성식도괴사(acute esophageal necrosis)는 “black esophagus”, “acute necrotizing esophagitis”로 불리기도 하며 이는 내시경상에서의 특징적인 식도의 검게 괴사됨을 특징으로 한다. 이는 매우 드문 질환으로 내시경에 의해 발견될 가능성은 0.01-0.02%로 보고된다[1,2]. 주로 호소하는 증상은 토혈이며 이외의 상복부 통증, 구토, 소화 불량, 울렁거림, 미열 등은 동반된 다른 질환의 증상과 혼동되는 경우가 많다. Grudell이 1963년에서 2003년까지 문헌에서 보고된 46 증례를 분석한 결과 남자에서의 유병률이 여자에 비해 4~5배 높았는데 이는 음주, 혈전 위험성, 기저질환의 발병율과 관계가 있을 것으로 생각된다. 60대에서 발병율이 높으며 동반된 질환으로는 당뇨병(27%), 종양(20%), 고혈압(20%), 과음(10%), 심혈관 질환(9%) 등이 있다[3].
발병기전은 아직 명확히 밝혀지지는 않았으나 크게 허혈과 방어기전의 파괴가 원인으로 생각된다. 허혈은 혈관병증, 체액량부족, 심박출 이상, 혈전 등으로 생길 수 있으며 혈관병증은 당뇨병, 동맥경화, 신부전 등과 연관이 있다. 체액량 부족이 발생할 수 있는 경우로는 패혈증, 췌장염, 급성 혈액 손실, 당뇨병성 케톤산증 등이 있으며 부정맥, 심부전이나 응고장애, 종양 등에 의해 생긴 혈전도 혈류량 감소를 일으킬 수 있다[4]. 다른 장기의 허혈과 동반되지 않고 단독으로 발생하는 경우도 흔한데 이는 식도의 혈관 분포와 관계가 있다. 식도의 하부 1/3 지점은 식도동맥과 좌위동맥의 문합지점으로 허혈에 취약할 것으로 생각된다[5].
방어벽의 파괴도 급성식도괴사의 중요한 기전이며 과음, 독성물질의 삼킴, 심한 구토 등에 의한 손상 등이 원인으로 고려된다. 위식도역류가 급성식도괴사 증례의 18%에서 관찰되었고 이는 수술 후나 십이지장의 부종으로 인한 위출구의 막힘, 음주로 인한 구토와 연관 있었다. 이로 인해 역류한 위산, 담즙, 트립신 등이 식도점막에 직접적인 손상을 줄 수 있다[4]. 수술이나 십이지장궤양 등에 의한 부종 외에도 위식도 괄약근을 손상시키는 알코올 중독, 수술 후 위장관 운동저하의 경우 등이 위식도역류에 의한 급성식도괴사를 일으킬 수 있으며 또한 당뇨병도 당뇨병성 위장애와 그에 따른 위식도역류증도 동반되어 식도점막에 손상을 줄 수 있다[6]. 감염도 위험 요인이 될 수 있으며 Klebsiella pneu moniae and cytomegalovirus, herpes simplex virus, Penicillium chrysogenum, Candida와 기타 진균이 언급되고 있다[7].
합병증으로는 천공이 7% 이하에서 보고되며, 천공 시에는 종격동염, 종격동 농양, 농흉, 패혈증까지 진행될 수 있어 주의가 필요하다. 괴사 후의 식도 협착이 10% 이상에서 보고되고 있어 추적검사로 위내시경이 필요하며 괴사부위의 감염이 동반될 수 있다[8].
치료로는 저혈류량을 교정하기 위한 충분한 수액치료와 필요시 수혈 등이 고려된다. 위장관 튜브의 경우는 식도천공의 위험성 있어 금기이다. proton pump inhibitor 또는 H2 blocker와 sucralfate를 사용하며 감염이 동반된 경우나 천공이 있는 경우에는 즉각적인 항생제의 사용이 중요하다. 또한 천공이 있을 때는 수술적 처치를 고려해야 하며 천공이 없더라도 합병되는 협착의 유무를 확인하기 위해 추적 위내시경 검사가 필요하다.
예후는 일반적으로 나쁜 것으로 알려져 있으며 치사율은 6%에 이른다. 이는 식도 천공, 협착, 종격동염과 같은 심각한 합병증과도 연관이 있지만 오히려 많은 경우의 급성 식도괴사에 심각한 기저질환 동반되어 있는 것이 예후에 큰 영향을 주는 것으로 해석된다[4].
당뇨병성 케톤산증에 의한 급성식도괴사의 기전으로 여러 가지가 제시되고 있다. 방어벽 파괴가 중요한 기전으로 고려되는데, 당뇨병성 케톤산증에서 상부위장관출혈에 대해 분석한 Faigel 등[6]에 의하면 당뇨병성 케톤산증 환자에서 13%가 30개월 안에 상부위장관출혈이 있었고 그 중 20%에서 식도 궤양 또는 식도 미란이 관찰되었다. 당뇨병성 케톤산증이 식도 점막에 손상을 미치는 기전으로는 신경병증과 고혈당으로 인한 위배출시간지연(당뇨병성 위장애), 위식도 괄약근의 압력 저하, 식도이행시간 지연이 제시되었다. 또한 오랜 당뇨병 이환 기간으로 인한 혈관병증, 고혈당으로 인한 혈액점도 증가가 허혈을 일으키는 기전으로 제시되고있으며[4] 당뇨병성 케톤산증의 체액량부족 상태도 영향을 줄 수 있을 것으로 생각되나 이 기전에 대한 명확한 보고는 없었다.
본 증례의 경우 입원 한달 내에 과음이나 독성물질의 과거력이 없었고, 구토가 심하지 않았던 점 등을 고려할 때 식도 방어벽 파괴 외의 다른 기전이 동반되었을 가능성을 고려할 수 있는데 당뇨병성 케톤산증에서 체내유효순환량이 부족했던 점(탈수된 전신상태, 혈청 BUN/Cr, 요산, 인의 높은 수치), 혈당이 높아 고삼투상태였던 점 등이 제1형 당뇨병 환자에 동반되어 있던 혈관병증에 혈류가 감소되어 허혈상태가 초래되었을 가능성이 있다. 또한 본 증례의 당뇨병, 결핵으로 인한 좋지 못한 환자 전신상태 역시 영향을 주었을 것으로 생각된다.
당뇨병성 케톤산증과 급성 식도괴사와 연관된 증례보고는 매우 드물고 국내에서는 1예가 보고되었다[9]. 김 등의 증례에서는 당뇨병성 케톤산증 외에도 식도캔디다증이 동반되어 있어 당뇨병성 케톤산증 단독으로 급성식도괴사를 일으켰는지는 명확하지 않았다. 당뇨병성 케톤산증의 증례는 김등의 보고 외에 국외에 3개의 문헌보고만 있어 다른 원인에 의한 급성 식도괴사와의 증상 차이를 알기는 어려웠으나 공통적으로 높은 혈당으로 인한 고삼투성 상태, 저혈압 또는 유효순환량 부족이 공통적으로 기술되었다.
본 증례는 39세 환자에서 당뇨병성 케톤산증에 급성식도 괴사가 동반된 예로 천공 등의 합병증 없이 대증적 치료 후 호전되었다. 급성 식도 괴사는 치명적인 합병증을 가져올 수 있는 질환으로 당뇨병성 케톤산증에서 토혈이나 가슴통증을 호소하였을 때 급성식도괴사를 감별 질환으로 고려하고 진단되는 경우 적절하게 대처하는 것이 필요하겠다.
Acknowledgements
This work was supported by an INHA University Research Grant (INHA-40886).