ņä£ ļĪĀ
ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöļŖö 1898ļģäļČĆĒä░ ĻĖ░ņłĀļÉśņŚłņ£╝ļ®░ ļ│┤ĒåĄ ļźśļ¦łĒŗ░ņŖżņä▒ ĒīÉļ¦ē ņ¦łĒÖśĻ│╝ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŗż[1,2]. ļō£ļ¼╝ņ¦Ćļ¦ī ņŗ¼ĒĢ£ ĒśĢĒā£ļĪ£ ņŗ¼ļ░®ņØś ļČĆņåŹĻĖ░(atrial appendage), ņóīņŗ¼ļ░® ļ▓Į, ņŖ╣ļ¬©ĒīÉņŚÉ ņäØĒÜīĒÖöĻ░Ć ņ¦äĒ¢ēĒĢśļ®░, ņØ┤ļ¤░ ņŗ¼ĒĢ£ ņäØĒÜīĒÖöļź╝ ŌĆ£ļÅäņ×¼ ņŗ¼ļ░®(porcelain atrium)ŌĆØ Ēś╣ņØĆ ŌĆ£ņĮöņĮöļäø ņŗ¼ļ░®(coconut atrium)ŌĆØņØ┤ļØ╝Ļ│Ā ĒĢ£ļŗż[3]. ņóīņŗ¼ļ░® ļ▓ĮņØś ņäØĒÜīĒÖöļŖö ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀņØä ņŗ£Ē¢ē ļ░øņØĆ ĒÖśņ×ÉņŚÉņä£ ņל ļ░£Ļ▓¼ļÉśļ®░, ļīĆļČĆļČä ĒÅÉļÅÖļ¦ź Ļ│ĀĒśłņĢĢņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ļŗż. ņŗ¼ĒĢ£ ņóīņŗ¼ļ░® ņŗ¼ļé┤ļ¦ēņØś ņäØĒÜīĒÖöņÖĆ ĒśłņĀä ĒśĢņä▒ņØĆ ņĢäņŻ╝ ļō£ļ¼╝Ļ▓ī ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[3,4]. ņŗ¼ļ░® ĒśłņĀä ņāØņä▒ņØś ņøÉņØĖņ£╝ļĪ£ Ēśäņ×¼Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ Ļ▓āņØĆ ņŗ¼ļ░® ņäĖļÅÖ, ņŖ╣ļ¬©ĒīÉ Ēśæņ░®ņ”Ø, ļ╣äĒøä ļÉ£ ņÜ░ņŗ¼ļ░®, ņä£ļ¦ź, ļ░ĢņČ£ļ¤ēņØś Ļ░Éņåī, Ļ│╝ņØæĻ│Ā ņāüĒā£ ļō▒ņØ┤ ņ׳ļŗż[5]. ņŖ╣ļ¬©ĒīÉ Ēśæņ░®ņ”Ø[6,7], ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ[8], ņżæņ”ØņØś ļīĆļÅÖļ¦ź ņŚŁļźśņ”Ø[9] ļō▒ņØ┤ ņóīņŗ¼ļ░® ļé┤ Ēśłļźś ņĀĢņ▓┤ļź╝ ņØ╝ņ£╝ņ╝£ ĒśłņĀäņØä ņāØņä▒ĒĢśļ®░ ļśÉĒĢ£ ņóīņŗ¼ņŗż, ņóīņŗ¼ļ░®ņØś ņłśņČĢĻĖ░, ĒÖĢņןĻĖ░ ņןņĢĀļŖö ņØ┤ņ░©ņĀüņ£╝ļĪ£ ņóīņŗ¼ļ░®ņØś ĒśłņĢĪĒĢÖņĀü ļ│ĆĒÖö ļō▒ņØä ņ£Āļ░£ĒĢ©ņ£╝ļĪ£ņŹ© ĒśłņĀäņØä ņ┤łļלĒĢĀ ņłś ņ׳ļŗż[10].
ņĀĆņ×ÉļōżņØĆ Ļ│╝Ļ▒░ņŚÉ ņŖ╣ļ¬©ĒīÉ Ēśæņ░®ņ”Ø ļ░Å ņóīņŗ¼ļ░® ĒśłņĀäņ£╝ļĪ£ ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀĻ│╝ ĒĢ©Ļ╗ś ĒśłņĀä ņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢ£ Ēøä ņ¦äĒ¢ēĒĢśļŖö ņŗ¼ĒĢ£ ņóīņŗ¼ļ░® ņŗ¼ļé┤ļ¦ē ņäØĒÜīĒÖöņÖĆ ņ×¼ļ░£ļÉ£ ņóīņŗ¼ļ░®ņØś ĒśłņĀä, ņÖĖņāüņØś ļ│æļĀźņØ┤ ņŚåņØ┤ ĒĢŁņØæĻ│ĀņĀ£ Ēł¼ņĢĮņŚÉ ļö░ļźĖ ņóīņĖĪ ņĢĪņÖĆļČĆņØś ĒśłņóģņØä ļÅÖļ░śĒĢ£ ĒĢ®ļ│æņ”ØņØä Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ņ”Ø ļĪĆ
ĒÖś ņ×É: 67ņäĖ, ļé©ņ×É
ņŻ╝ ņåī: ņĢĪņÖĆļČĆņØś ņóģĻ┤┤
Ēśäļ│æļĀź: ĒÖśņ×ÉļŖö 30ļģä ņĀäņŚÉ ļźśļ¦łĒŗ░ņŖżņä▒ ņŖ╣ļ¬©ĒīÉ Ēśæņ░®ņ”ØņØä ņ¦äļŗ©ņØä ļ░øĻ│Ā ņĢĮļ¼╝ņ╣śļŻī ņżæ ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ ļÅÖļ░śļÉśņ¢┤ 23ļģä ņĀä ĻĖ░Ļ│ä ĒīÉļ¦ēņØä ņØ┤ņÜ®ĒĢ£ ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ ļ░Å ņóīņŗ¼ļ░® ĒśłņĀä ņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ 4ļģä ļÆżņŚÉ ļ░£ņ×æņä▒ ņĢ╝Ļ░ä ĒśĖĒØĪĻ│żļ×Ćņ£╝ļĪ£ ņŗ¼ĒĢ£ ņé╝ņ▓©ĒīÉ ĒÅÉņćäļČĆņĀä ņ¦äļŗ©ņØä ļ░øĻ│Ā ņé╝ņ▓©ĒīÉ ņä▒ĒśĢņłĀņØä ļŗżņŗ£ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤Ēøä ņÖĆĒīīļ”░ņØä ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ēł¼ņŚ¼ ļ░øņĢä ņśżļŹś ņżæ, ņóīņĖĪ ņĢĪņÖĆļČĆņØś ņóģĻ┤┤ ļ░Å ĒåĄņ”Øņ£╝ļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņĄ£ĻĘ╝ ņÖĖņāüņØś ļ│æļĀźņØĆ ņŚåņŚłļŗżĻ│Ā ĒĢ£ļŗż.
Ļ░ĆņĪ▒ļĀź, ņé¼ĒÜīļĀź: ĒŖ╣ņØ┤ņåīĻ▓¼ ņŚåņØī.
ņØ┤ĒĢÖņĀü ņåīĻ▓¼: ņØśņŗØņØĆ ļ¬ģļŻīĒĢśņśĆĻ│Ā, ĒśłņĢĢņØĆ 80/40 mmHg, ļ¦źļ░ĢņØĆ ļČäļŗ╣ 60ĒÜīļĪ£ ļČłĻĘ£ņ╣ÖņĀüņØ┤ņŚłņ£╝ļ®░, ĒśĖĒØĪņłśļŖö ļČäļŗ╣ 20ĒÜīņśĆļŗż. Ļ▓░ļ¦ēņØĆ ņ░Įļ░▒ĒĢśņśĆĻ│Ā, Ļ│Ąļ¦ēņØś ĒÖ®ļŗ¼ ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. Ļ▓ĮļČĆņĀĢļ¦źņØś ĒÖĢņן ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĒśĖĒØĪņØīņØĆ ņ▓Łļ¬ģĒĢśņśĆĻ│Ā ņłśĒżņØī, ņ▓£ļ¬ģņØīņØĆ ļōżļ”¼ņ¦Ć ņĢŖņĢśļŗż. ņŗ¼ņØīņØĆ ļČłĻĘ£ņ╣ÖņĀüņØ┤ņŚłņ£╝ļ®░, ņØĖĻ│ĄĒīÉļ¦ēņŚÉ ņØśĒĢ£ Ēü┤ļ”Ł ņ×ĪņØīņØ┤ ļōżļĀĖļŗż.
Ļ▓Ćņé¼ņŗż ņåīĻ▓¼: ļ¦Éņ┤łĒśłņĢĪ ņåīĻ▓¼ņāü Ēśłņāēņåī 9.0 g/dL, ĒŚżļ¦łĒåĀĒü¼ļ”¼ĒŖĖ 26.3%, ļ░▒ĒśłĻĄ¼ 5,400/uL, ĒśłņåīĒīÉ 167,000/uLņØ┤ņŚłĻ│Ā, Ēśłņ▓Ł ņĀäĒĢ┤ņ¦ł Ļ▓Ćņé¼ņāü ļéśĒŖĖļź© 135 mEq/L, ņ╣╝ļź© 3.4 mEq/L, ņŚ╝ĒÖöļ¼╝ 96 mEq/L, ņ╣╝ņŖś 8.5 mg/dL, ņØĖ 2.7 mg/dLņśĆļŗż. Ēśłņ▓Ł ĒÖöĒĢÖ Ļ▓Ćņé¼ņāü ņÜöņåīņ¦łņåī(blood urea nitrogen) 29 mg/dL, Ēü¼ļĀłņĢäĒŗ░ļŗī 1.5 mg/dL, ņ┤Ø ļŗ©ļ░▒ 6.9 g/dL, ņĢīļČĆļ»╝ 4.4 g/dL, ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖ ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī(aspartate aminotransferase, AST) 28 IU/L, ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī(alanine aminotransferase, ALT) 15 U/L, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł 1.8 mg/dLņØ┤ņŚłļŗż. Ēśłņ▓Łņ£Āņé░ĒāłņłśņåīĒÜ©ņåī(lactic acid dehydrogenase, LDH) 510 IU/LņØ┤ņŚłņ£╝ļ®░ ĒöäļĪ£ĒŖĖļĪ¼ļ╣ł ņŗ£Ļ░ä ĻĄŁņĀ£ Ēæ£ņżĆ ļŗ©ņ£ä(Prothrombin time International Normalized Ratio, PT INR)ļŖö 2.9ņØ┤ņŚłņ£╝ļ®░, ņÖĖļלņŚÉņä£ 2-3ņĀĢļÅäļĪ£ ņ£Āņ¦ĆļÉśĻ│Ā ņ׳ņŚłļŗż.
ņŗ¼ņĀäļÅä: ļČäļŗ╣ 60-70ĒÜī ņĀĢļÅäņØś ņŗ¼ļ░® ņäĖļÅÖ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż.
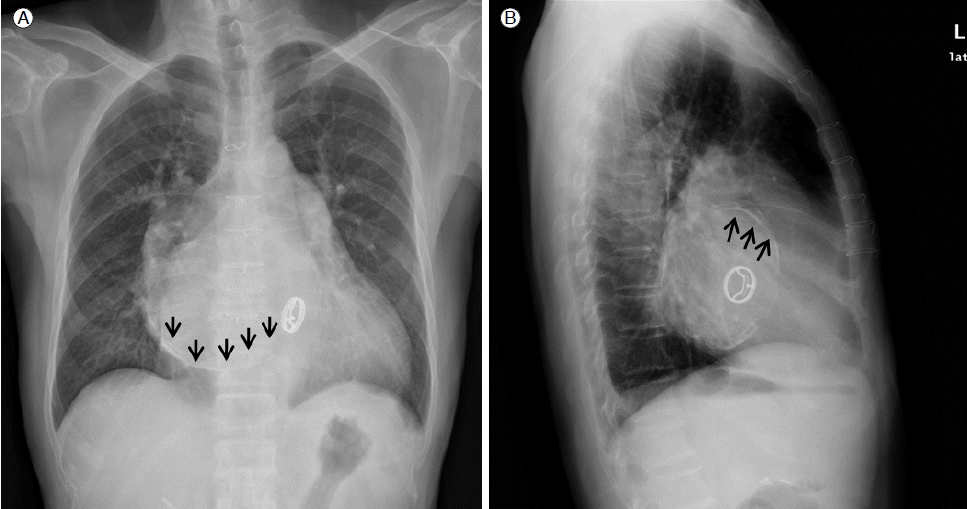
ĒØēļČĆ ņé¼ņ¦ä: ņŗ¼ĒĢ£ ņŗ¼ļ╣äļīĆ ņåīĻ▓¼Ļ│╝ ĒÅÉļČĆņóģ ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻ│Ā, ņóīņŗ¼ļ░®ņØä ļö░ļØ╝ņä£ ņäĀņāüņØś ņäØĒÜīĒÖö ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1).
ņŗ¼ņ┤łņØīĒīī: Ļ▓ĮĒØēļČĆ ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ņāü ņ╣śĒÖśļÉ£ ņØĖĻ│Ą ņŖ╣ļ¬© ĒīÉļ¦ēņØś ĻĖ░ļŖźņØĆ ņĀĢņāüņØ┤ņŚłĻ│Ā, ņóīņŗ¼ļ░®ņØś ņŗ¼ĒĢ£ ĒÖĢņןņØä ļ│┤ņśĆļŗż. ņżæļō▒ļÅäņØś ļīĆļÅÖļ¦źĒīÉļ¦ēņØś Ēśæņ░®Ļ│╝ ņżæļō▒ļÅäņØś ĒÅÉļÅÖļ¦ź Ļ│ĀĒśłņĢĢņØ┤ ņ׳ņŚłņ£╝ļ®░, ņżæņ”ØļÅäņØś ņóīņŗ¼ņŗż ņłśņČĢļČĆņĀä(ņóīņŗ¼ņŗż ĻĄ¼ĒśłļźĀ 45%)ņØ┤ ņ׳ņŚłļŗż. Ļ▓ĮĒØēļČĆ ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ņāü ņóīņŗ¼ļ░®ņØś ĒśłņĀäņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż.
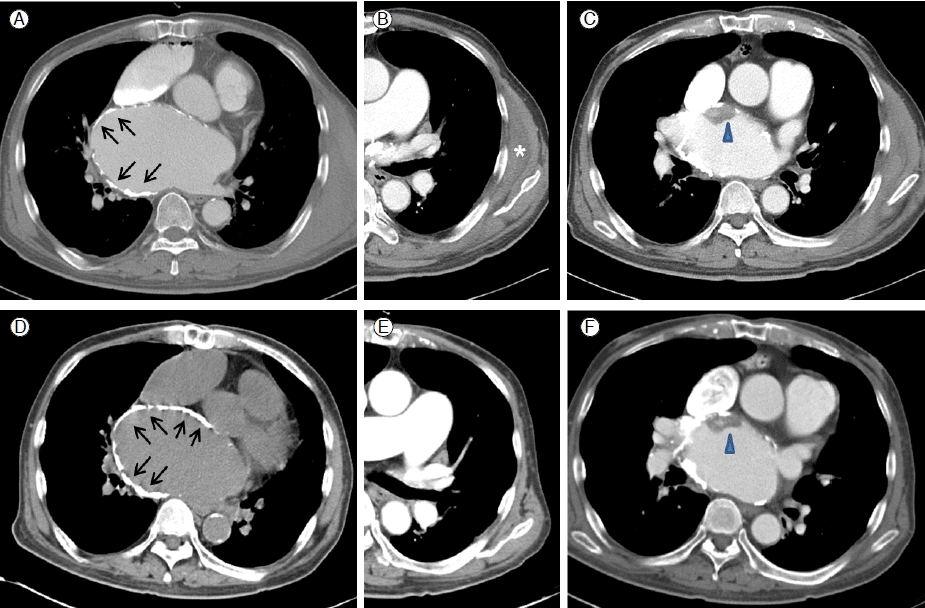
ĒØēļČĆ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśü: ĒØēļČĆ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśüņāü ņóīņŗ¼ļ░® ņŗ¼ļé┤ļ¦ēņØä ļæśļ¤¼ņŗ╝ ņŗ¼ĒĢ£ ņäØĒÜīĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░(Fig. 2A) ņóīņĢĪņÖĆļČĆņŚÉņä£ ĒØēĻ░Ģ ņĖĪļ▓ĮņØä ļö░ļØ╝ņä£ ņĀäĻ▒░ĻĘ╝(serratus anterior muscle) ļé┤ņĖĪņ£╝ļĪ£ ņĪ░ņśüņ”ØĻ░ĢņĀä ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśü ņØ┤ļ»Ėņ¦ĆņŚÉņä£ ļåÆņØĆ Ļ░ÉņćĀņØś ņ▓┤ņĢĪ ņĀĆļźś ņåīĻ▓¼(Ļ╣ŖņØ┤: 4 cm)ņØ┤ ņ׳ņ£╝ļ®░, ņØ┤ļŖö ņĢĪĒÖöĻ░Ć ļÉśņ¦Ć ņĢŖņØĆ ĒśłņóģņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆņĢśļŗż(Fig. 2B). ņĪ░ņśü ņ┤¼ņśüņŚÉņä£ ņóīņŗ¼ļ░®ņØś ĒśłņĀäņ£╝ļĪ£ ņāØĻ░üļÉśļŖö ņóģĻ┤┤Ļ░Ć ņóīņŗ¼ļ░®ņØś ņĀäļ▓ĮļČĆ ņ£äņ¬Įņ£╝ļĪ£ ņĢĮ 1.5 ├Ś 2.7 cm Ēü¼ĻĖ░ņØś ļé«ņØĆ Ļ░ÉņćĀņØś ņČ®ļ¦ī Ļ▓░ņåÉņ£╝ļĪ£ ļ│┤ņśĆļŗż(Fig. 2C).
Ļ▓Į Ļ│╝: ņ×ģņøÉ 1ļ│æņØ╝ņ¦Ė ņĢĪņÖĆļČĆņŚÉ ņ┤łņØīĒīīļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ņØ┤ĒŗĆ ņĀäņŚÉ ņŗ£Ē¢ēĒĢ£ ĒØēļČĆ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśü ļĢīļ│┤ļŗż ĒśłņóģņØś Ēü¼ĻĖ░Ļ░Ć ņżäņŚłļŗż(Ļ╣ŖņØ┤: 2.5 cm). ņ×¼ļ░£ĒĢ£ ņóīņŗ¼ļ░®ņØś ĒśłņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņāēņĀäņØś ņ£äĒŚśņä▒Ļ│╝ ņżæļō▒ļÅäņØś ļīĆļÅÖļ¦źĒīÉļ¦ē Ēśæņ░®ņ”Øņ£╝ļĪ£ Ļ░£ĒØēņłśņłĀņØä Ļ│ĀļĀżĒĢśņśĆņ£╝ļéś ņŗ¼ĒĢ£ ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöņÖĆ ņØ┤ļ»Ė ļæÉ ņ░©ļĪĆ ļ░śļ│ĄĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ Ļ░£ĒØēņłśņłĀļĪ£ ĒØēĻ░Ģļé┤ ņ£Āņ░®ņ£╝ļĪ£ ņØĖĒĢ£ ņłśņłĀņØś ņ¢┤ļĀżņøĆ, ņĀäļ░śņĀüņØĖ ņóīņŗ¼ļ░® ņäØĒÜīĒÖöļĪ£ ņØĖĒĢ┤ņä£ endoatriectomy ņŗ£ ļåÆņØĆ ņČ£ĒśłņØś ņ£äĒŚś, ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ ņłśņłĀ ĒøäņŚÉļÅä ņ×¼ļ░£ĒĢĀ Ļ░ĆļŖźņä▒ņ£╝ļĪ£ ņłśņłĀņØä ĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ĒĢśĻĖ░ļĪ£ ĒĢśņśĆļŗż. ņÖĆĒīīļ”░ņ£╝ļĪ£ ĒöäļĪ£ĒŖĖļĪ¼ļ╣ł ņŗ£Ļ░ä ĻĄŁņĀ£ Ēæ£ņżĆ ļŗ©ņ£ä 2-3ņØä ņ£Āņ¦ĆĒĢśļ®┤ņä£ ņĢĪņÖĆļČĆ ĒśłņóģņØś Ēü¼ĻĖ░Ļ░Ć Ļ░ÉņåīĒĢśĻ│Ā ĒåĄņ”ØņØ┤ ņżäņ¢┤ņä£ ņ×ģņøÉ ļ│æņØ╝ 7ņØ╝ņ¦Ė Ēć┤ņøÉĒĢśņśĆļŗż. 3ļģä ĒøäņŚÉ ņÖĖļלņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņĢĪņÖĆļČĆņØś ĒśłņóģņØĆ ņåīņŗżļÉśņŚłņ¦Ćļ¦ī ņŗ¼ĒĢ£ ņäØĒÜīĒÖöļź╝ ļÅÖļ░śĒĢ£ ņóīņŗ¼ļ░®Ļ│╝ ņóīņŗ¼ļ░®ņØś ĒśłņĀäņØĆ ņŚ¼ņĀäĒ׳ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 2D, 2E, and 2F). ĻĘĖļ¤¼ļéś ņ▓śņØī ņóīņŗ¼ļ░® ĒśłņĀäņ”Ø ļ░£Ļ▓¼ ĒøäļČĆĒä░ 5ļģä Ļ▓ĮĻ│╝Ļ┤Ćņ░░ ļÅÖņĢł ņóīņŗ¼ļ░® ĒśłņĀäņØś ņāēņĀäņ”Øņ£╝ļĪ£ ņØĖĒĢ£ ņ×äņāüņĀüņØĖ ņŻ╝ņÜö ĒĢ®ļ│æņ”ØņØĆ ņŚåņŚłļŗż.
Ļ│Ā ņ░░
ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöņŚÉņä£ ņŗ¼ĒĢ£ ņäØĒÜīĒÖöļŖö ņŚ¼ņä▒ņŚÉņä£ ĒØöĒĢśļ®░, ļīĆļČĆļČä ļźśļ¦łĒŗ░ņŖżņä▒ ņŖ╣ļ¬©ĒīÉ ĒÅÉņćäļČĆņĀäņŚÉņä£ ļ░£ņāØĒĢ£ļŗż[11]. ņ¦äļŗ© ņŗ£ ļīĆļČĆļČäņØś ĒÖśņ×ÉļŖö ĒÅēĻĘĀ 17-20ņäĖņŚÉ ņ”ØņāüņØä ļŖÉļü╝ļ®░, ļīĆļČĆļČä ņŗ¼ļ░® ņäĖļÅÖņØ┤ ņ׳ļŗż. ņäØĒÜīĒÖöĻ░Ć ņāØĻĖ░ļŖö ĻĖ░ņĀäņØĆ ļźśļ¦łĒŗ░ņŖżņä▒ ņŗ¼ļé┤ļ¦ēĻ│╝ ĻČżņ¢æ ļČĆņ£äņŚÉ ĒśĢņä▒ļÉ£ ĻĄŁņåī ņäØĒÜīĒÖöņØś ņ¦äĒ¢ēĻ│╝ ņŗ¼ļé┤ļ¦ēĒĢś ņ╣╝ņŖśĒīÉņØś ļ¦īņä▒ņĀüņØĖ ņä¼ņ£ĀĒÖöņØś ņ¦äĒ¢ēņŚÉ ņØśĒĢ£ Ļ▓░Ļ│╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ļ░£ņāØ ļ╣łļÅäļŖö ļźśļ¦łĒŗ░ņŖżņä▒ ņŗ¼ņ¦łĒÖśņØś ņŚ¼ļČĆņÖĆ ĒīÉļ¦ēņåÉņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[12].
ņäØĒÜīĒÖöņØś ņ¦äļŗ©ņØĆ ņ┤łņØīĒīī, ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśüņ£╝ļĪ£ Ļ░ĆļŖźĒĢśļŗż. Ļ▓ĮņŗØļÅä ņ┤łņØīĒīīļŖö ņŗ¼ļ░®Ļ│╝ ņŗØļÅäņØś ĒĢ┤ļČĆĒĢÖņĀü ņ£äņ╣śļĪ£ ņØĖĒĢ┤ ņóīņŗ¼ļ░®ņØä ņל Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņżæĻ▓®ņØä ņĀ£ņÖĖĒĢ£ ļŗżļźĖ ņŗ¼ļ░®ņØś ņäØĒÜīĒÖö ļ░Å ĒśłņĀäņØś ņ£Āļ¼┤ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż[3]. ņ×ÉĻĖ░Ļ│Ąļ¬ģņ┤¼ņśüņØĆ ĒśłņĀäņØś ņ£Āļ¼┤ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī, ņäØĒÜīĒÖö ņ£Āļ¼┤ļŖö ĒÖĢņØĖĒĢśĻĖ░Ļ░Ć Ēלļōżļŗż. ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ļŗ©ņĖĄņ┤¼ņśüņØĆ ņ╣╝ņŖś ļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢĀ ņłś ņ׳ņ£╝ļéś ņżæĻ▓®ņØä ĒÅēĻ░ĆĒĢśĻĖ░ļŖö ņ¢┤ļĀĄļŗż[13].
ņäØĒÜīĒÖöņØś ņ×äņāüņĀü ņØśņØśļŖö ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ļŗż. So ļō▒[13]ņØś ļ│┤Ļ│ĀņŚÉ ņØśĒĢśļ®┤ ĻĄŁļé┤ņŚÉņä£ ņŖ╣ļ¬©ĒīÉ ņłśņłĀ ĒøäņŚÉ ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśüņØä ĒĢśņśĆļŹś ņ”ØļĪĆļź╝ ļ¬©ņĢäņä£ ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░, ņóīņŗ¼ļ░® ņäØĒÜīĒÖöļŖö ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśüņØä ĒĢśņśĆļŹś 36ļ¬ģ ņżæ 15ļ¬ģ(41.6%)ņŚÉņä£ ļ░£Ļ▓¼ļÉśĻ│Ā, 15ļ¬ģ ņżæ 12ļ¬ģņØĆ ĻĄŁņåīņĀüņ£╝ļĪ£ ņäØĒÜīĒÖöĻ░Ć ņ׳ņŚłļŹś ļ░śļ®┤ 3ļ¬ģņŚÉņä£ļ¦ī 1/4ņØ┤ņāü ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöĻ░Ć ņ¦äĒ¢ēļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ņØ┤ļōż ņżæ 2ļ¬ģņŚÉņä£ ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ņ¢┤ņä£ ņ×äņāüņĀüņ£╝ļĪ£ ņóīņŗ¼ļ░® ņäØĒÜīĒÖöņÖĆ ĒśłņĀäņØ┤ Ļ┤ĆļĀ©ļÉśņ¢┤ ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņ”ØļĪĆņØś Ļ▓ĮņÜ░ ņóīņŗ¼ļ░®ņØś 1/4ļ│┤ļŗż Ēø©ņö¼ ļŹö ļ¦ÄņØĆ 2/3 ņØ┤ņāüņØś ņäØĒÜīĒÖöĻ░Ć ņĀäļ░śņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉ£ ļÅäņ×¼ ņŗ¼ļ░®ņ£╝ļĪ£ ņóīņŗ¼ļ░®ņØś ĒśłņĀäņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ņŚłļŗż. So ļō▒[13]ņØĆ ņóīņŗ¼ļ░®ņØś ņäØĒÜīņÖĆļŖö ĒÅÉļÅÖļ¦ź Ļ│ĀĒśłņĢĢĻ│╝ļÅä ļ░ĆņĀæĒĢśĻ▓ī Ļ┤ĆļĀ©ļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░, ļ│Ė ņ”ØļĪĆņØś Ļ▓ĮņÜ░ļÅä 23ļģä ņĀä ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ, 19ļģä ņĀä ĒÅÉļÅÖļ¦źĻ│ĀĒśłņĢĢņ£╝ļĪ£ ņØĖĒĢ£ ņé╝ņ▓©ĒīÉ ĒÅÉņćäļČĆņĀäņŚÉ ļö░ļźĖ ņé╝ņ▓©ĒīÉ ņä▒ĒśĢņłĀņØĆ ņØ┤ļ»Ė ņŗ¼ļ░®ņäĖļÅÖļ┐É ņĢäļŗłļØ╝ ĒÅÉļÅÖļ¦ź Ļ│ĀĒśłņĢĢņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ׳ņŚłĻ│Ā ņØ┤ņŚÉ ļö░ļźĖ ņóīņŗ¼ļ░®ņØś ņäØĒÜīĒÖöņÖĆ ĒśłņĀä ĒśĢņä▒ņ×äņØä ņĢī ņłś ņ׳ļŗż. ņóīņŗ¼ļ░® ņäØĒÜīĒÖöņÖĆ ĒśłņĀäņØĆ ņāēņĀäņØś ņ£äĒŚś ļĢīļ¼ĖņŚÉ ņłśņłĀņĀüņØĖ ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢśĻ│Ā, ņŗ¼ņן ņłśņłĀ ņŗ£ ņŗ¼ņןņØś ĻĖ░ņĀĆļČĆļź╝ Ļ░ĆļÅÖĒÖö(mobilization) ņŗ£ĒéżĻ▒░ļéś ļ┤ēĒĢ®ņØä ĒĢĀ ļĢī Ēלļō£ļ»ĆļĪ£ ļ░śļō£ņŗ£ ņŗ¼ņן ņłśņłĀņØä ņŗ£Ē¢ēĒĢśļŖö ĒÖśņ×ÉņŚÉņä£ ņŗ¼ļ░®ņØś ņäØĒÜīĒÖö ņ£Āļ¼┤ļź╝ ņłśņłĀ ņĀäņŚÉ ņØĖņ¦ĆĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļ®░[14], ĒĢäņÜöĒĢśļŗżļ®┤ ņäØĒÜīĒÖöļÉ£ Ēö╝ņ¦łņØä ņĀ£Ļ▒░ĒĢśļŖö endoatriectomyļź╝ ņŗ£Ē¢ē ĒĢĀ ņłś ņ׳ļŗż[11]. Kim ļō▒[15]ņØĆ ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ Ēøä ļÅäņ×¼ ņŗ¼ļ░®ņØ┤ ņ׳ņŚłļŹś ņśłņŚÉņä£ ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ ļ░£Ļ▓¼ļÉśņ¢┤ ņóīņŗ¼ļ░® ĒśłņĀä ņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŖöļŹ░ ņłśņłĀ 15ņØ╝ Ēøä ņóīņŗ¼ļ░® ļé┤ ĒśłņĀäņØ┤ ņ×¼ļ░£ĒĢśņŚ¼ ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ĒĢśņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĒśłņĀäņØä ļģ╣ņØ┤ĻĖ░ ņ£äĒĢ£ Ļ░ĢļÅä ļåÆņØĆ ĒĢŁņØæĻ│Ā ņÜöļ▓ĢņØĆ ļ│Ė ņ”ØļĪĆņØś Ļ▓ĮņÜ░ņ▓śļ¤╝ ņÖĖņāüņØś ļ│æļĀźņØ┤ ņŚåņØ┤ ņĢĪņÖĆļČĆ ĒśłņóģņØ┤ ņāØĻĖ░ļŖö ĒĢ®ļ│æņ”Ø ļō▒ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤╝ņŚÉļÅä ļ│Ė ņ”ØļĪĆļŖö ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ņĪ░ņĀłĒĢśņŚ¼ 5ļģä ņ×äņāü Ļ▓ĮĻ│╝Ļ┤Ćņ░░ ļÅÖņĢł ņŻ╝ņÜö ņāēņĀäņØś ĒĢ®ļ│æņ”ØņØ┤ ņŚåņØ┤ ņČöņĀüĻ┤Ćņ░░ ņżæņØ┤ļŗż. ļö░ļØ╝ņä£ ņŖ╣ļ¬©ĒīÉ ņ╣śĒÖśņłĀ Ēøä ņóīņŗ¼ļ░® ĒśłņĀäņØ┤ ņ׳ņ£╝ļ®┤ņä£ ņØ╝ļČĆ ņäØĒÜīĒÖöĻ░Ć ņĢäļŗī ļÅäņ×¼ ņŗ¼ļ░®Ļ│╝ Ļ░ÖņØ┤ ņŗ¼ĒĢ£ ņäØĒÜīĒÖöĻ░Ć ļÅÖļ░śļÉśņŚłņØä ļĢī ņóīņŗ¼ļ░®ĒśłņĀä ņĀ£Ļ▒░ņłĀ Ēś╣ņØĆ ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ Ļ░ĢļÅä ļåÆĻ▓ī ĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢ£ņ¦ĆļŖö ņóĆ ļŹö ļ¦ÄņØĆ ņ”ØļĪĆļź╝ ĒåĄĒĢ┤ņä£ Ļ│Āņ░░ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






