žĄú Ž°†
Í≥†ŪėēžēĒžóźžĄú Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚÄ ŽďúŽ¨ł Í≤ÉžúľŽ°ú ž∑Ćžě•žēĒ[1], ŽāúžÜĆžēĒ[2], Í≤įžě•žēĒ[3], ŪĚČžĄ†žĘÖ[4], žú†Žį©žēĒ[5] ŽďĪžĚī Ž≥īÍ≥†ŽźėÍ≥† žěąžúľŽ©į, ŪŹźžēĒžĚė Í≤Ĺžöį 1951ŽÖĄžóź Weissžóź žĚėŪēī ž≤ėžĚĆ Ž≥īÍ≥†ŽźėžóąŽč§[6-8]. ž†Ąž≤ī ŪŹźžēĒžĚė 1-3%ÍįÄ žēĄŽįÄŽĚľž†úŽ•ľ žÉĚžĄĪŪēėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąžúľŽ©į[7,9] ŽĆÄŽ∂ÄŽ∂ĄžĚī žĻ®žÉėŪėēžĚė žēĄŽįÄŽĚľž†úŽ°ú Ž≥īÍ≥†ŽźėžĖī žěąžúľŽāė[6,7] žú†Žį©žēĒžóźžĄúŽäĒ ž∑Ćžě•ŪėēžĚė žēĄŽįÄŽĚľž†úÍįÄ Ž≥īÍ≥†ŽźėžĖī žěąŽč§[5]. Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚī ŽŹôŽįėŽźú žõźŽįúžĄĪ ŪŹźžĘÖžĖĎžĚÄ ŽĆÄŽ∂ÄŽ∂ĄžĚė Í≤ĹžöįžóźžĄú Í∑ł ž°įžßĀŪėēžĚī Ž∂ĄŪôĒŽŹĄ ž§ĎŽďĪŽŹĄ žĚīžÉĀžĚė žĄ†žēĒžĚīŽ©į, žĚľŽ∂Ä žÜĆžĄłŪŹ¨ŪŹźžēĒžĚī žĚľŽ≥łžóźžĄú 10žó¨ žėąÍįÄ Ž≥īÍ≥†ŽźėžóąžúľŽ©į, ÍĶ≠ŽāīžóźžĄúŽŹĄ Ž∂ÄžĘÖžĖĎž¶ĚŪõĄÍĶįžúľŽ°ú Ž≥īÍ≥†Žźú žÜĆžĄłŪŹ¨žēĒ 1žėą[6], ŪéłŪŹČžÉĀŪĒľžĄłŪŹ¨ŪŹźžēĒ 1žėą Ž≥īÍ≥†ÍįÄ žěąŽč§[7]. Í∑łŽü¨Žāė ŽĻĄžÜĆžĄłŪŹ¨ŪŹźžēĒ ž§Ď žĄ†žēĒÍ≥ľ ÍīÄŽ†®Žźú Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚī ÍĶ≠ŽāīžóźžĄú Ž≥īÍ≥†Žźú ŽįĒŽäĒ žóÜžúľŽĮÄŽ°ú žĚīŽ•ľ Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
ž¶Ě Ž°Ä
Ūôė žěź: 64žĄł žó¨žěź
ž£ľ žÜĆ: Žāīžõź 6žĚľ ž†ĄŽ∂ÄŪĄį žčúžěĎŽźú žÉĀŽ≥ĶŽ∂Ä ŪÜĶž¶ĚÍ≥ľ žĄ§žā¨
Í≥ľÍĪįŽ†• ŽįŹ ŪėĄŽ≥ĎŽ†•: ŪôėžěźŽäĒ ž†ĄžĚīžĄĪ ŪŹźžĄ†žēĒ(T4N2M1a)žóź ŽĆÄŪēėžó¨ Í≥†žčĚž†Ā ŪôĒŪēôžöĒŽ≤ēžúľŽ°úžć® paclitaxel Žč®žĚľžöĒŽ≤ē(175 mg/m2/žĚľ, 3ž£ľ ÍįĄÍ≤© ž†ēŽß•ž£ľžā¨)žĚĄ 4ŪöĆ žčúŪĖČ ŪõĄ Ž∂ÄŽ∂ĄŽįėžĚϞ̥ Ž≥īžėÄžúľŽāė žēĹ 4ÍįúžõĒ žĚīŪõĄ žßĄŪĖČžĄĪ Ž≥ĎŽ≥ÄžúľŽ°ú ŪĎúž†ĀžĻėŽ£Ćž†úžĚł erlotinib (150 mg)žĚĄ Í≤ĹÍĶ¨Ūą¨žó¨ ŪēėžėÄŽč§. 4ÍįúžõĒ ŪõĄžóź ŪĚČŽ∂Ä ž†ĄžāįŪôĒ Žč®žłĶžī¨žėĀžóźžĄú žßĄŪĖČžĄĪ Ž≥ĎŽ≥Ğ̥ Ž≥īžėÄŽč§. žĚīŪõĄ žěźÍłįžąėŪĖČŽä•Ž†•žĚÄ ECOG 2Ž°úžĄú Žč§Ž•ł Ūē≠žēĒžöĒŽ≤ēžĚĄ Í≥†Ž†§ŪēėÍ≥† žěąŽćė ž§Ďžóź Žāīžõź 6žĚľ ž†ĄŽ∂ÄŪĄį ŽįúžÉĚŪēú žÉĀŽ≥ĶŽ∂Ä ŪÜĶž¶ĚÍ≥ľ žĄ§žā¨Ž•ľ ž£ľžÜĆŽ°ú žĚĎͳȞ觎°ú ŽāīžõźŪēėžėÄŽč§.
ÍįÄž°ĪŽ†• ŽįŹ žā¨ŪöĆŽ†•: ŪĚ°žóįŽ†•žĚÄ 7ÍįĎŽÖĄ, žĚĆž£ľŽ†•žĚÄ 20ŽÖĄÍįĄ 1ž£ľžóź žÜĆž£ľ Žįė Ž≥ĎžĚīžóąŽč§.
žĚīŪēôž†Ā žÜĆÍ≤¨: Žāīžõź ŽčĻžčú ŪôėžěźŽäĒ ͳȞĄĪ Ž≥ĎžÉȞ̥ Ž≥īžėÄžúľŽāė žĚėžčĚžÉĀŪÉúŽäĒ Ž™ÖŽ£ĆŪĖąÍ≥† ŪėąžēēžĚÄ 133/76 mmHg, Žß•ŽįēžĚÄ 103ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąėŽäĒ 20ŪöĆ/Ž∂Ą, ž≤īžė®žĚÄ 36.4‚ĄÉžėÄŽč§. žĚīŪēôž†Ā Í≤Äžā¨žóźžĄú žĚīŪēėžĄ†žóľ ŽįŹ žĻ®žÉėžóľ ŽďĪžĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§. ŪĚČŽ∂Ä ž≤≠žßĄžčú ž†ĄŪŹźžēľžóźžĄú ÍĪįžĻú ŪėłŪĚ°žĚĆžĚī Žď§Ž†łŽč§. Ž≥ĶŽ∂Äžóź ÍįĄÍ≥ľ ŽĻĄžě•žĘÖŽĆÄŽäĒ žóÜžóąžúľŽ©į, Ž≥ĶŽ∂Ä ž≤≠žßĄžóźžĄú Ūē≠žßĄŽźú žě•žĚĆžĚī Žď§Ž†łÍ≥† žīȞߥ žčú žēēŪÜĶžĚÄ žóÜžóąŽč§. ŪēėžßÄžĚė Ūē®žöĒ Ž∂ÄžĘÖžĚÄ žóÜžóąžúľŽ©į žč†Í≤ĹŪēôž†Ā žĚīžÉĀžÜĆÍ≤¨ŽŹĄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: žÉĀŽ≥ĶŽ∂Ä ŪÜĶž¶ĚžĚĄ ŪėłžÜĆŪēėŽ©į ŽāīžõźŪēėžėĞ̥ ŽčĻžčúžóź ŽßźžīąŪėąžē°Í≤Äžā¨žóźžĄú ŪėąžÉČžÜĆ 15.4 g/dL, ŽįĪŪėąÍĶ¨ 10,110/mm3 (Ūėłž§ĎÍĶ¨ 75.3%), ŪėąžÜĆŪĆź 326,000/mm3žĚīžóąžúľŽ©į, Ūėąž≤≠ žÉĚŪôĒŪēô Í≤Äžā¨ Í≤įÍ≥ľ Ūėąž§ĎžöĒžÜĆžßąžÜĆ 25.6 mg/dL, ŪĀ¨Ž†ąžēĄŪčįŽčĆ 0.95 mg/dL, AST 19 IU/L, ALT 14 IU/L, žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 0.8 mg/dL, ŪėąŽčĻ 138 mg/dL, žēĄŽįÄŽĚľž†ú 227 IU/L (ž†ēžÉĀŽ≤ĒžúĄ 45-160 IU/L)Ž°ú ž¶ĚÍįÄŽźėžĖī žěąžóąžúľŽ©į Ž¶¨ŪĆĆžēĄž†ú 18.5 IU/L (7-60 IU/L)Ž°ú ž†ēžÉĀŽ≤ĒžúĄžóź žěąžóąŽč§. Ūėąž≤≠ žēĄŽįÄŽĚľž†ú ŽŹôžĘÖŪö®žÜĆ Í≤Äžā¨ Í≤įÍ≥ľ žĻ®žÉėŪėēžĚī 81.7% (ž†ēžÉĀžĻė: 35-79%), ž∑Ćžě•ŪėēžĚī 18.3% (ž†ēžÉĀžĻė: 21-65%)žėÄŽč§(Fig. 1).
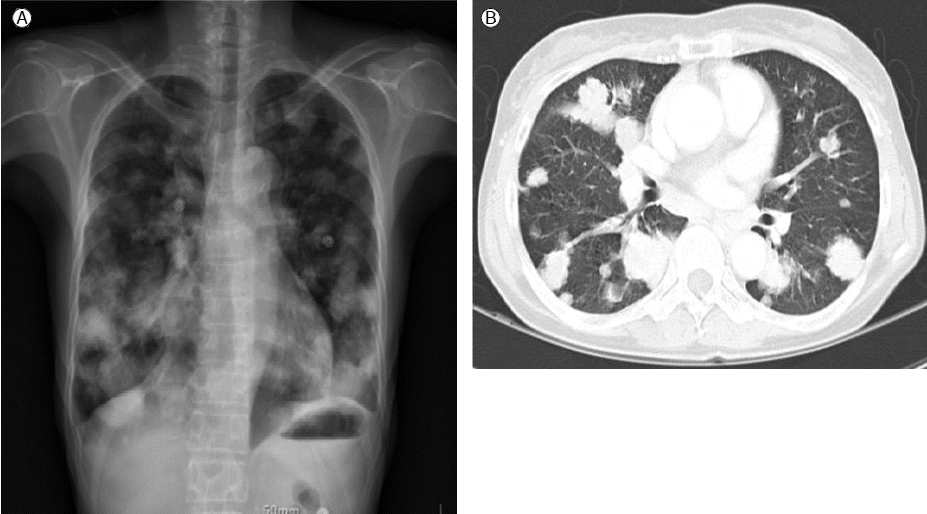
ŽāīžčúÍ≤Ĺ ŽįŹ Žį©žā¨žĄ†Ūēôž†Ā žÜĆÍ≤¨: ŪĚČŽ∂Ä Žč®žąú žī¨žėĀ Í≤įÍ≥ľ Í≤ĹÍ≥ĄÍįÄ Ž∂ĄŽ™ÖŪēú Žč§žĖĎŪēú ŪĀ¨ÍłįžĚė žó¨Žü¨ ÍįúžĚė žĘÖÍīīŽď§žĚī ž†ĄŪŹźžēľžóź žěąžóąŽč§(Fig. 2A). Ž≥ĶŽ∂Ä žĽīŪď®ŪĄįŽč®žłĶžī¨žėĀžóźžĄú ž∑Ćžě• ŽįŹ Žč§Ž•ł žě•Íłįžóź ŪäĻžĚī žÜĆÍ≤¨žĚÄ Ž≥īžĚīžßÄ žēäžēėžúľŽ©į, ŪĚČŽ∂Ä žĽīŪď®ŪĄį Žč®žłĶžī¨žėĀžóźžĄú ž†ĄŪŹźžēľžóź Ž∂ĄŪŹ¨Žźú Žč§žĖĎŪēú ŪĀ¨ÍłįžĚė Žč§ŽįúžĄĪ žĘÖÍīīŽď§žĚī Ž≥īžėÄÍ≥† žĚīž†ĄÍ≥ľ ŽĻĄÍĶźŪēėžó¨ žßĄŪĖČžĄĪ Ž≥ĎŽ≥Ğ̥ Ž≥īžėÄŽč§(Fig. 2B).
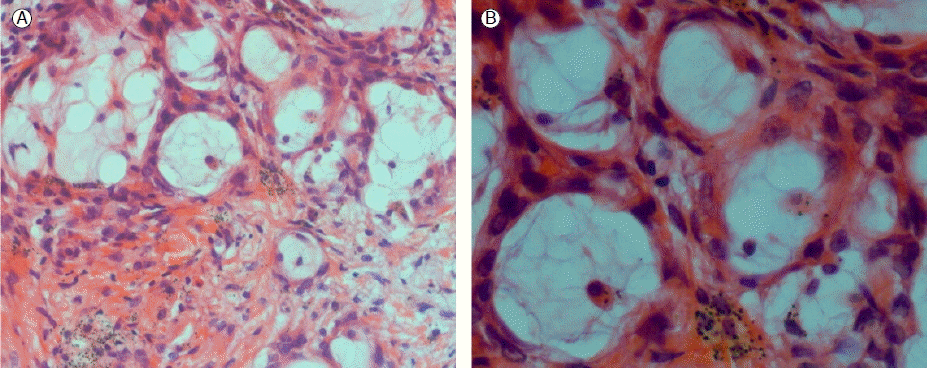
Ž≥ĎŽ¶¨ž°įžßĀŪēôž†Ā žÜĆÍ≤¨: žßĄŽč® ŽčĻžčúžóź žčúŪĖČŪēú žĽīŪď®ŪĄįŽč®žłĶžī¨žėĀ žú†ŽŹĄŪēė Í≤ÄžĻ®ŪĚ°žĚłžĚĄ žĚīžö©Ūēú Í≤ĹŪĒľž†Ā ŪŹź žÉĚÍ≤Ğ󟞥ú ž§ĎŽďĪŽŹĄ Ž∂ĄŪôĒŽ•ľ Ž≥īžĚīŽäĒ ŪŹźžĄ†žēĒ(ž†źžē° žÉėžēĒžĘÖ)žúľŽ°ú žßĄŽč®ŽźėžóąŽč§(Fig. 3). ŪäĻžąėŽ©īžó≠žóľžÉČ Í≤įÍ≥ľžóźžĄúŽäĒ CK7 (+), CK20 (-), TTF-1 (+), ALK-1 (-), PAS (+)Ž•ľ Ž≥īžėÄžúľŽ©į EGFR žú†ž†Ąžěź Ž∂ĄžĄĚžóźžĄú exon 18, 19, 20, 21žĚė ŽŹĆžóįŽ≥ÄžĚīŽäĒ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
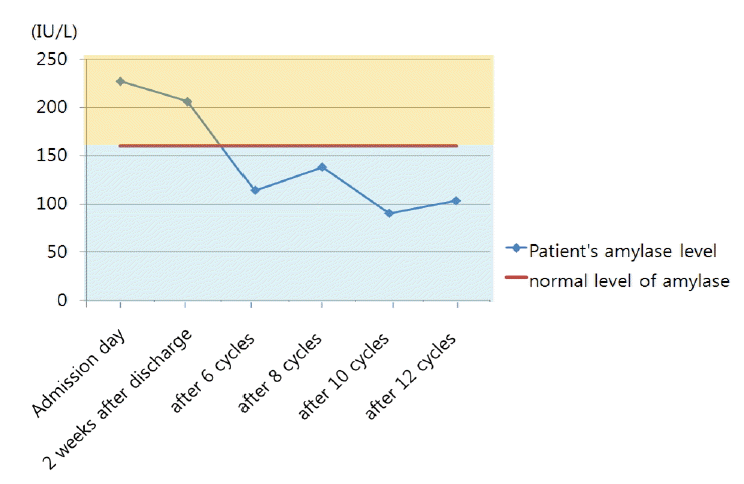
žěĄžÉĀÍ≤ĹÍ≥ľ ŽįŹ žĻėŽ£Ć: Žāīžõź ŽčĻžčú žÉĀŽ≥ĶŽ∂Ä ŪÜĶž¶ĚžĚĄ ŪėłžÜĆŪēėžó¨ žčúŪĖČŪēú žÉĀŽ∂ÄžúĄžě•ÍīÄ ŽāīžčúÍ≤Ş󟞥ú žó≠Ž•ėžĄĪ žčĚŽŹĄžóľ, ŽĮłŽěÄžúĄžóľ, žč≠žĚīžßÄžě•Í∂§žĖĎ žÜĆÍ≤¨žĚĄ Ž≥īžėÄŽč§. žąėžē°žĻėŽ£Ć ŽďĪžĚė Ž≥īž°īž†Ā žĻėŽ£ĆŪēėŽ©į žĄ§žā¨ ŽįŹ žÉĀŽ≥ĶŽ∂Ä ŪÜĶž¶ĚžĚė Ūėłž†ĄžĚĄ Ž≥īžĚīŽ©īžĄú ž†Ąžč†žÉĀŪÉúÍįÄ Ūėłž†ĄŽźėžóąŽč§. Ūáīžõź 2ž£ľ Ží§ žôłŽěėžóźžĄú žł°ž†ēŪēú amylase žąėžĻėŽäĒ 206 IU/LŽ°ú ž†ēžÉĀŽ≥īŽč§ žÉĀžäĻŽźėžĖī žěąŽäĒ žąėžĻėžėÄÍ≥†, žßĄŪĖČžĄĪ ŪŹźžēĒžóź ŽĆÄŪēėžó¨ pemetrexed (500 mg/m2/žĚľ, 3ž£ľ ÍįĄÍ≤© ž†ēŽß•ž£ľžā¨) Žč®žĚľ Ūē≠žēĒ ŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪēėžėÄŽč§. 6ž£ľÍłį žčúŪĖČ ŪõĄ Ž∂ÄŽ∂ĄŽįėžĚϞ̥ Ž≥īžėÄžúľŽ©į Ūėąž≤≠ žēĄŽįÄŽĚľž†úŽäĒ ž†ēžÉĀŽ≤ĒžúĄžĚł 114 IU/LŽ°ú žł°ž†ēŽźėžóąŽč§. ŪėĄžě¨ žú†žßÄ žöĒŽ≤ēžúľŽ°ú pemetrexed Žč®žĚľ Ūē≠žēĒŪôĒŪēôžöĒŽ≤ēžĚĄ žčúŪĖČŪē®žóź ŽĒįŽĚľ Ž∂ÄŽ∂ĄŽįėžĚϞ̥ žú†žßÄŪēėÍ≥† žěąžúľŽ©į Ūē≠žēĒžöĒŽ≤ēžóź ŽĒįŽ•ł Ž∂ÄžěĎžö©žĚÄ ÍīÄžįįŽźėÍ≥† žěąžßÄ žēäÍ≥† žēĄŽįÄŽĚľž†ú žąėžĻėŽŹĄ ž†ēžÉĀŽ≤ĒžúĄŽ•ľ žú†žßÄŪēėÍ≥† žěąŽč§(Fig. 4).
Í≥† žįį
Ūėąž≤≠ žēĄŽįÄŽĚľž†úŽäĒ ŽÖĻŽßźžĚīŽāė ͳ϶¨žĹĒÍ≤ź, ͳĎ£®žĹĒžä§žĚė ͳĎ̾žĚīžĹĒžā¨žĚīŽďú Í≤įŪē©(glycosidic bonds)žĚĄ ÍįÄžąėŽ∂ĄŪēīŪēėŽäĒ žÜĆŪôĒŪö®žÜĆŽ°ú žĻ®žÉėŪėēÍ≥ľ ž∑Ćžě•ŪėēžĚī žěąŽäĒŽćį ž†ēžÉĀž†ĀžĚł Ūėąž≤≠ žēĄŽįÄŽĚľž†úŽäĒ 50% žĚīžÉĀžĚī žĻ®žÉėŪėēžĚīŽ©į ŪÉúžÉĚ 2-3ÍįúžõĒžóź ž≤ėžĚĆ ŽßƎ吏ĖīžßÄÍłį žčúžěĎŪēėžó¨ žÉĚŪõĄ 1ŽÖĄžóź ž†ēžÉĀ žĄĪžĚłžĚė ŪēėŪēúžĻėŽ•ľ žú†žßÄŪēėÍ≥† ž∑Ćžě•Í≥ľ žĻ®žÉė žĚīžôłžóźŽŹĄ Í∑ľžú°, žßÄŽį© ž°įžßĀ, žč†žě•, ŽáĆ, ŪŹź, žÜĆžě•, ŽĻĄžě•, ŽāúÍīÄ ŽďĪžóźžĄú Í≤Äž∂úŽźúŽč§[6].
Ūėąž≤≠ žēĄŽįÄŽĚľž†úŽäĒ ž∑Ćžě•žßąŪôė, žĻ®žÉėžßąŪôė, žč†Ž∂Äž†Ą, žĘÖžĖĎ, ŽčĻŽá®Ž≥ĎžĄĪ žľÄŪܧŽá®ž¶Ě, ŪôĒžÉĀ, ŽįēŽ¶¨žĄĪ ŽĆÄŽŹôŽß•Ž•ė, ŽßĆžĄĪ ÍįĄžßąŪôė, žěĄžč† ŽįŹ ŪŹźŽ†ī, ŽčīŽŹĄžßąŪôė, žÜĆŪôĒžĄĪ Í∂§žĖĎžĚė ž≤úÍ≥Ķ, žě•ŪŹźžÉČ, Ž≥ĶŽßČžóľ, ͳȞĄĪž∂©žąėŽŹĆÍłįžóľ ŽďĪžóźžĄú žÉĀžäĻŽź† žąė žěąŽč§. ž†ēžÉĀž†ĀžúľŽ°ú 20-30ŽĆÄžĚė žó¨žĄĪžóźžĄú Žā®žĄĪŽ≥īŽč§ ŽÜíÍ≥† ŽÖłžĚłžóźžĄú Žč§Ž•ł žóįŽ†Ļ ÍĶįŽ≥īŽč§ ŽÜíŽč§Í≥† žēĆŽ†§ž†ł žěąŽč§.
ŪŹźžēĒžóźžĄú Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚė ŽįúžÉĚÍłįž†Ąžóź ŽĆÄŪēīžĄúŽäĒ žēĄžßĀ Ž∂ąŽ™ÖŪôēŪēėŽ©į ŪĚČžąė ŽāīžĚė žĘÖžĖĎ žĄłŪŹ¨Ž•ľ ŽįįžĖĎŪēėžó¨ ŽįįžĖĎžē°žĚė žēĄŽįÄŽĚľž†ú ŪôúžĄĪžĚĄ žł°ž†ēŪēú Ž≥īÍ≥†ÍįÄ žěąÍ≥†[7], Ūē≠ žĚłÍįĄžēĄŽįÄŽĚľž†ú Ūē≠ž≤īŽ•ľ žĚīžö©Ūēėžó¨ ŪŹźžēĒž°įžßĀžóź ŽĆÄŪēú Ž©īžó≠ž°įžßĀ ŪôĒŪēôÍ≤Äžā¨Ž•ľ ŪēėÍĪįŽāė žąėžą† ž§Ďžóź žĘÖžĖĎžĄłŪŹ¨žôÄ ÍįÄÍĻĆžöī ŪŹźž†ēŽß•žóźžĄú žßĀž†Ď Ūėąžē°žĚĄ žĪĄž∑®Ūēėžó¨ žēĄŽįÄŽĚľž†úžĚė ŽÜ掏ĄŽ•ľ žł°ž†ēŪēėŽäĒ Žį©Ž≤ē ŽďĪžĚī žěąŽč§[6]. žĚīŽēĆžóźŽäĒ ŪŹźž†ēŽß•žóźžĄú žł°ž†ēŽźú žēĄŽįÄŽĚľž†ú ŽÜ掏ĄŽäĒ žÉĀŽĆÄž†ēŽß•Ž≥īŽč§ 3Žįį ŽćĒ ŽÜížēėŽč§Í≥† Ž≥īÍ≥†ŽźėžĖī žěąŽč§[8]. žēĒŪôėžěźžóźžĄú Ūėąž§Ď, žöĒž§ĎžĚė žēĄŽįÄŽĚľž†ú ŽÜ掏ĄÍįÄ žÉĀžäĻŽźėžĖī žěąŽäĒ Í≤ĹžöįžóźŽäĒ žöįžĄ† žēĄŽįÄŽĚľž†ú ŽŹôžĘÖŪö®žÜĆ Ž∂ĄŪöćžĚĄ Í≤Äžā¨Ūēėžó¨ ž∑Ćžě•ŪėēžĚłžßÄ žĻ®žÉėŪėēžĚłžßÄŽ•ľ ž°įžā¨ŪēėŽäĒ Í≤ÉžĚī ŪēĄžöĒŪēėŽč§.
ŽßĆžĄĪ žě¨ŽįúžĄĪ ž∑Ćžě•žóľ, Ž∂ÄÍįĎžÉĀžĄ† ÍłįŽä• ž†ÄŪēėž¶Ě, žā¨ÍĶ¨ž≤ī žč†žóľ ŽďĪžóźžĄúŽäĒ ž∑Ćžě•Ūėē žēĄŽįÄŽĚľž†úÍįÄ ž¶ĚÍįÄŪēėÍ≥† žĻ®žÉėŪėēžĚÄ ŽßĆžĄĪ ž∑Ćžě•žóľ, žú†ŪĖČžĄĪ žĚīŪēėžĄ†žóľ ŽďĪžĚė žĻ®žÉėžóľ, žáľÍ∑łŽ†Ć ž¶ĚŪõĄÍĶį, ŽčīžĄĚž¶Ě, žīĚŽčīÍīÄ ŪėĎžį©, ͳȞĄĪ žúĄžě•žóľ, ͳȞĄĪ ŪŹźŽ∂Äž†Ą, žēĆžĹĒžė¨ žĄ≠ž∑®, ŽßĆžĄĪžč†Ž∂Äž†Ą, ŪŹźžēĒžĚĄ ŽĻĄŽ°ĮŪēú Žč§Ž•ł žēÖžĄĪžĘÖžĖĎ ŽďĪžóźžĄú žÉĀžäĻŽź† žąė žěąŽč§[9].
Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽäĒ žēĄŽįÄŽĚľž†úžĚė Ž∂ĄŪöćÍ≤Äžā¨žóźžĄú žĻ®žÉėŪėēžĚī žöįžĄłŪēėžėÄÍ≥† žĚīŪēôž†Ā Í≤Äžā¨ ŽįŹ ŪôėžěźžĚė Ž¨łžßĄžóźžĄú žĻ®žÉė ÍīÄŽ†®Ūēú žßąŪôėžĚÄ Žįįž†úŪē† žąė žěąžóąžúľŽ©į Í∑łŽįĖžóź žĚĆž£ľŽ†•, Ūėąžē°Í≤Äžā¨ žÜĆÍ≤¨žÉĀ ž†ēžÉĀžĚė žč†ÍłįŽä• žąėžĻėžôÄ Ž¶¨ŪĆĆžēĄž†ú žąėžĻė Í∑łŽ¶¨Í≥† Ž≥ĶŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžóźžĄú ž∑Ćžě• ŽįŹ Žč§Ž•ł žě•Íłįžóź ŪäĻžĚīŪēú žÜĆÍ≤¨žĚī žóÜžóąžúľŽĮÄŽ°ú žĻ®žÉėŪėē žēĄŽįÄŽĚľž†úÍįÄ žÉĀžäĻŪē† žąė žěąŽäĒ Žč§Ž•ł žßąŪôėŽď§ŽŹĄ Žįįž†úŪē† žąė žěąžóąŽč§. Ž≥ł ž¶ĚŽ°ÄžôÄ ÍįôžĚī žĻ®žÉėŪėēžĚī žöįžúĄžóź žěąŽäĒ Í≤Ĺžöį žĻ®žÉė žßąŪôė ŽįŹ Žč§Ž•ł ÍįźŽ≥Ą žßąŪôėŽď§žĚī Žįįž†úŽźúŽč§Ž©ī žēĄŽįÄŽĚľž†úŽ•ľ žÉĚžĄĪŪēėŽäĒ žĘÖžĖĎ ŽėźŽäĒ Ž∂ÄžĘÖžĖĎ ž¶ĚŪõĄÍĶįžóź žĚėŪēú Í≥†žēĄŽįÄŽĚľž†ú Ūėąž¶ĚžĚė ÍįÄŽä•žĄĪžĚĄ Í≥†Ž†§Ūē† žąė žěąŽč§[7].
žē장ú žĄúŽ°†žóźžĄú žĖłÍłČŪēú Í≤Éž≤ėŽüľ Í≥†žēĄŽįÄŽĚľž†ú Ūėąž¶ĚÍ≥ľ ÍīÄÍ≥ĄŽźėŽäĒ Í≥†ŪėēžēĒžúľŽ°úŽäĒ ŪŹźžēĒžĚĄ ŽĻĄŽ°ĮŪēėžó¨ ž∑Ćžě•žēĒ[1], ŽāúžÜĆžēĒ[2], Í≤įžě•žēĒ[3], ŪĚČžĄ†žĘÖ[4], žú†Žį©žēĒ[5] ŽďĪžĚī Ž≥īÍ≥†ŽźėžĖī žěąŽč§.
Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚĄ Ž≥īžĚīŽäĒ ŪŹźžĚė žĄ†žēĒžóźžĄú ŽāúžĻėžĄĪ ŽĻĄžÜĆžĄłŪŹ¨žēĒžóź žäĻžĚłŽźú ŪĎúž†ĀžĻėŽ£Ćž†úžĚł gefitinib (epidermal growth factor receptor signalingžĚė Í≤ĹÍĶ¨ tyrosine kinase žĖĶž†úž†ú)žúľŽ°ú žĻėŽ£ĆŪēú Ží§ ž∂Ēž†ĀÍīÄžįįŪēėžėĞ̥ ŽēĆ žĘÖžĖĎŪĎúžßĞ쟎°úžĄú žēĄŽįÄŽĚľž†ú žąėžĻėŽ•ľ žł°ž†ēŪēú Í≤įÍ≥ľ ŪŹźžēĒžĚė ŪĀ¨Íłį ÍįźžÜĆžôÄ Ūē®ÍĽė Ūėąž§Ď žēĄŽįÄŽĚľž†ú žąėžĻėžĚė ÍįźžÜĆŽ•ľ Ž≥īžėĎ觎äĒ ž¶ĚŽ°ÄŽ≥īÍ≥†ÍįÄ žěąŽč§. ŽėźŪēú Žč§Ž•ł ž¶ĚŽ°ÄžóźžĄúŽŹĄ Ūē≠žēĒžĻėŽ£ĆŽ•ľ žßĄŪĖČŪēėŽ©į CEA žąėžĻė ŽįŹ žēĄŽįÄŽĚľž†úŽ•ľ žł°ž†ēŪēú Í≤įÍ≥ľ žēĄŽįÄŽĚľž†úÍįÄ Žč§Ž•ł ŪĎúžßÄžěźžĚė žąėžĻėŽ≥īŽč§ ŽćĒ ŽĮľÍįźŪēėÍ≤Ć žĻėŽ£Ć žĄĪž†Āžóź ŽĒįŽĚľ Ž≥ÄŪôĒŪēėŽäĒ Ž™®žäĶžĚĄ Ž≥īžėÄŽč§[10].
žĚīŽď§ Ž≥īÍ≥†žóźžĄúŽäĒ žēĄŽįÄŽĚľž†úŽ•ľ žÉĚžĄĪŪēėŽäĒ žēĒžóźžĄú žēĄŽįÄŽĚľž†úÍįÄ žĘÖžĖĎŪĎúžßĞ쟎°úžĄú žā¨žö©Žź† žąė žěąŽč§Í≥† ŪēėžßÄŽßĆ[8,10] ŪŹźžēĒ ž°įžßĀžóźžĄú žēĄŽįÄŽĚľž†úÍįÄ ÍįēŪēėÍ≤Ć žóľžÉČŽźėŽćĒŽĚľŽŹĄ Í≥†žēĄŽįÄŽĚľž†ú Ūėąž¶ĚÍ≥ľŽäĒ ÍīÄÍ≥ĄÍįÄ žóÜžóąŽč§ŽäĒ Ž≥īÍ≥†ŽŹĄ žěąžúľŽĮÄŽ°ú žĘÖžĖĎŪĎúžßĞ쟎°úžĄú Ūėąž≤≠ žēĄŽįÄŽĚľž†úžĚė žěĄžÉĀž†Ā ÍįÄžĻėŽäĒ žēĄžßĀ Ž∂ąŽ™ÖŪôēŪēėŽč§[11].
Ž≥ł ž¶ĚŽ°ÄŽäĒ ŽĻĄžÜĆžĄłŪŹ¨ ŪŹźžēĒ(žĄ†žēĒ)žúľŽ°ú žĚīŽĮł žßĄŽč®ŽįõžĚÄ ŪôėžěźžóźžĄú Ž≥ĶŪÜĶžĚĄ ž£ľžÜĆŽ°ú ŽāīžõźŪēėžó¨ ͳȞĄĪž∑Ćžě•žóľžĚĄ žĚėžč¨Ūēėžó¨ žēĄŽįÄŽĚľž†úŽ•ľ žł°ž†ēŪēėžėÄÍ≥† žÉĀŽ≥ĶŽ∂ÄŪÜĶž¶ĚžĚī Ūėłž†ĄŽźú ŪõĄžóźŽŹĄ žēĄŽįÄŽĚľž†ú žąėžĻėÍįÄ Ūėłž†ĄŽźėžßÄ žēäžēĄžĄú ŪŹźžēĒÍ≥ľ ÍīÄŽ†®Žźú Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžĚĄ žĚėžč¨ŪēėÍ≤Ć ŽźėžóąžúľŽ©į ŽŹôžĘÖŪö®žÜĆŽ•ľ žł°ž†ēŪēú ŪõĄžóź žĻ®žÉėŪėēžĚė žēĄŽįÄŽĚľž†úžĚė ž¶ĚÍįÄÍįÄ ŪôēžĚłŽźú žėąžĚīŽč§. žĚīŪēôž†Ā Í≤Äžā¨ ŽįŹ Ž¨łžßĄžĚĄ ŪÜĶŪēī žĻ®žÉėŪėēžĚė žēĄŽįÄŽĚľž†úžĚė ž¶ĚÍįÄžóź ŽĆÄŪēú Žč§Ž•ł žõźžĚłžĚĄ Žįįž†ú ŪõĄ ŪŹźžēĒÍ≥ľ ÍīÄŽ†®Žźú Í≥†žēĄŽįÄŽĚľž†úŪėąž¶ĚžúľŽ°ú žßĄŽč®ŪēėžėÄžúľŽ©į ŽĻĄžÜĆžĄłŪŹ¨ŪŹźžēĒžĚė žĄ†žēĒžóź žĚėŪēī ž¶ĚÍįÄŽźú Ūėąž≤≠ žēĄŽįÄŽĚľž†úžóź ŽĆÄŪēú ÍĶ≠Žāī Ž≥īÍ≥†ÍįÄ žóÜžúľŽĮÄŽ°ú ž¶ĚŽ°ÄŽ≥īÍ≥†Ž•ľ ŪēėŽäĒ ŽįĒžĚīŽč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






