수술적 조직 검사로 증명된 미만성 폐포 손상에 의한 폐경색 1예
A Case of Pulmonary Infarction Caused by Diffuse Alveolar Damage Confirmed by Open-Lung Biopsy
Article information
Abstract
이 증례보고는 급성 호흡곤란 증후군을 보인 환자에게서 수술적으로 조직 검사를 하여 미만성 폐포 손상, 폐경색 소견을 확인하고, 흉부 컴퓨터 단층촬영에서 세분절 폐동맥 혈전을 확인하여 미만성 폐포 손상에 유발된 세분절 폐동맥 혈전에 의한 폐경색으로 진단되어 항응고 치료를 받은 후 급격히 호전된 환자에 대한 것이다.
이 증례는 폐경색의 비특이적인 영상학적 소견 중 흔히 보고되지 않았던[2,3] 폐 전엽에 걸친 다발성 경결 소견을 보여주고 있고, 수술적 폐 조직 검사에서는 폐경색의 원인으로 국내에서는 보고 된 적 없는 미만성 폐포 손상을 보여주고 있다.
이 증례에서 보였던 환자의 병색의 급성 악화와 이후 정확한 진단과 적절한 치료를 시작한 후 보였던 빠른 호전의 경과는 임상에서 폐경색의 빠르고 정확한 진단과 치료가 환자의 예후에 미치는 중요성을 시사해 준다.
이 증례의 환자와 같이 비특이적 호흡기 증상과 폐병변을 보일 경우 폐경색의 가능성을 항상 염두에 두고 환자 진료가 이루어져야 하겠다.
Trans Abstract
We report a case of a 63-year-old man with adult respiratory distress syndrome and pulmonary infarction. The patient presented with fever, dyspnea, pleuritic chest pain, and acute respiratory failure, and we applied mechanical ventilation and steroid therapy. Pulmonary infarction and diffuse alveolar damage were confirmed by open-lung biopsy. Diffuse alveolar damage activated the blood coagulation system, resulting in thrombosis in the pulmonary vasculature. After anticoagulation therapy, the patient improved rapidly. We report a rare pulmonary infarction caused by diffuse alveolar damage confirmed by open-lung biopsy. (Korean J Med 2012;82:487-491)
서 론
폐는 해부학적으로 기관동맥 순환과 폐동맥 순환의 폐모세혈관 전단계의 문합을 갖고 있고 기도에서도 산소 공급을 받기 때문에 폐혈전이 있어도 폐경색이 쉽게 발생하지 않는다[1]. 그러나 임상에서 폐경색을 종종 접하게 되는데 환자들은 주로 흉통과 호흡곤란을 호소하며 내원하여 흉부단순방사선 검사에서 부분적인 폐경결, 쇄기모양의 음영, 무기폐 등을 보이고[2] 흉부 컴퓨터 단층촬영이나 폐조직 검사를 하여 진단하게 된다.
폐경색은 폐동맥 혈전색전에 의한 경우가 가장 흔하고 비혈전(non-thrombotic)색전, 감염에 의해서도 발생한다[3]. 드물지만 외국에서는 미만성 폐포 손상(diffuse alveolar damage)이 폐경색의 원인으로 보고된 바가 있으나[3] 아직까지 국내에서는 보고된 적이 없다.
저자들은 이전에 건강하던 60대 남성이 영상 검사에서 폐의 광범위한 다발성 경결 소견을 보이며 급성 호흡곤란 증후군을 보였고, 수술적 조직 검사를 통해 미만성 폐포 손상에 의한 폐 경색이 원인으로 진단되어 항응고제 치료를 받은 후 급격히 호전된 경험을 하였기에 문헌고찰과 함께 증례 보고를 하고자 한다.
증 례
환 자: 남자, 63세
주 소: 3일 전부터 시작된 좌측 흉통을 동반한 호흡곤란
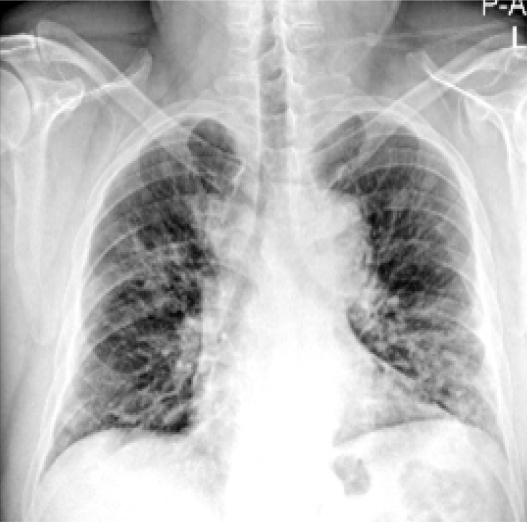
과거력 및 현병력: 기저 질환 없이 건강하던 성인으로, 좌측 흉통과 함께 발열, 호흡곤란 발생하여 타 병원 응급실에 내원하였다. 흉부단순방사선 검사에서 좌하엽에 부분적 경결 소견(Fig. 1)을 보여 폐렴으로 진단하고 Ceftriaxone 2 g q24 hr, Azithromycin 250 mg q24 hr로 2일간 사용하였으나 호흡곤란 악화되고 흉부단순방사선 검사에서 양측 폐엽의 다발성 경화 소견을 보여(Fig. 2) Piperacillin/Tazobactam 4.5 g q6 hr, Ciprofloxacin 400 mg q8 hr으로 항생제를 변경하였다. 이후에도 폐 환기와 흉부단순방사선 소견 악화로 시행한 흉부 컴퓨터 단층검사에서 양쪽 폐엽에 광범위한 부위의 간유리음영과 경결소견을 보였다(Fig. 2). 환자는 추가적인 검사와 치료를 위하여 본원으로 전원되어 중환자실로 입원하였다.
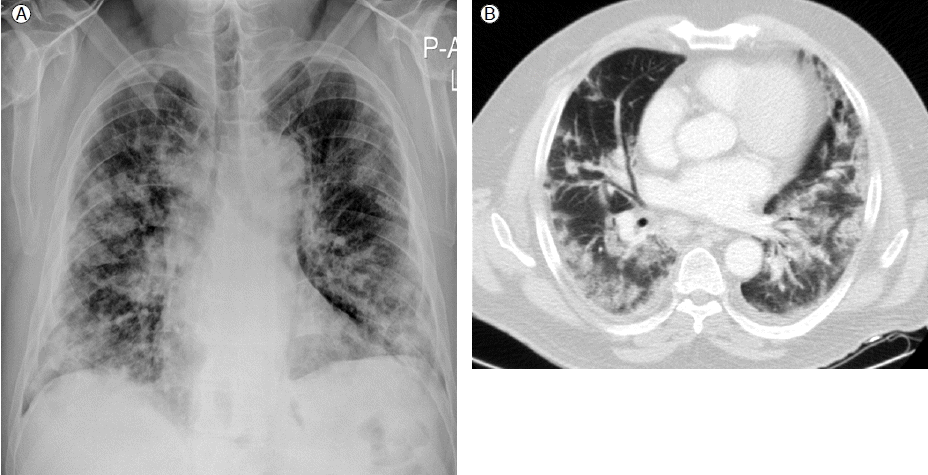
Chest X-ray and CT taken two days later. There was multi-focal extensive consolidation in both lung fields.
가족력: 특이소견 없었다.
사회력: 미국 국적으로 두 달 전 우리나라에 입국하여 경상북도 울산의 중공업 계열사에서 건설현장의 안전 감독하는 일을 하고 있었다.
신체검사 소견: 중환자실 입실 당시 급성 병색이었고 의식은 명료하였다. 생체 활력증후는 혈압 119/83 mmHg, 맥박수 분당 60회, 호흡수 분당 29회, 체온 36.7℃로 빈호흡을 보이고 있었다. 신체 진찰 소견에서는 좌측 폐야에서 기관지 호흡음과 수포음이 청진되었다.
검사 소견: 내원 당시 말초혈액 검사에서 백혈구 15,730/μL, 혈색소 9.0 g/dL, 혈소판 288,000/μL로 백혈구 증가와 혈색소 감소 소견을 보였다. CRP 13 mg/dL로 증가소견 보였고 동맥혈가스 검사에서는 산소마스크로 분당 15 L 산소 주입 상태에서 pH 7.47, PaO2 64.4 mmHg, PaCO2 38.2 mmHg, HCO3 27.7 mEq/L, SaO2 94.3%로 저산소증을 보이고 있었다. 혈액화학 검사에서는 총 빌리루빈 0.5 mg/dL, AST 46 U/L, ALT 53 U/L 보이고 있었고 BUN 18 mg/L, Creatinine 1.2 mg/dL였다. 응고 검사에서 D-dimer 3.74 ug/mL로 증가 소견, PT, aPTT는 정상 소견 보이고 있었다. NT-proBNP 수치가 547.9 pg/mL로 증가되어 있었다.
심전도와 심초음파: 심전도에서 QT 간격의 연장 소견 보였고 심초음파에서는 양심방확대 이외 정상 소견이었다.
영상검사 소견: 흉부단순방사선, 타 병원에서 시행한 흉부 컴퓨터 단층촬영에서 양측 폐엽에 다발성 경결소견과 결절, 좌측 폐용적 감소가 동반되어 있었다(Fig. 2)
치료 및 경과: 환자는 전원과 동시에 심한 저산소증을 보여 기관 삽관 시행한 후 기계 환기를 시작하였다. 기관 삽관한 후 시행한 기관지 폐포 세척, 경기관지 폐조직 검사에서는 미생물학적으로 증명된 것은 없고, 폐포강내 섬유소 삼출(intraaveolar fibrinous exudate), 만성 염증 소견만 보였다.
환자의 폐 환기는 지속적으로 악화되었고 흉부단순방사선 검사에서도 다발성의 경결 소견이 급속도로 악화되어 기관지 삽관한 지 이틀째, 급성 호흡곤란 증후군(acute respiratory distress syndrome)에 준하여 저용량 스테로이드 (Methylprednisolone 1 mg/kg) 정주 치료를 시작하였다.
그리고 당일, 원인 규명을 위하여 비디오 흉강경 수술(video assisted thoracoscopic surgery)을 통한 폐조직 검사를 시행하였다. 조직 검사 소견은 전 폐야에 걸쳐 폐경색과 미만성 폐포 손상, 혈관안의 섬유소 혈전(fibrin thrombi)과 주위의 출혈성 병변들이 있었고(Fig. 3) 종양세포는 관찰되지 않았다.
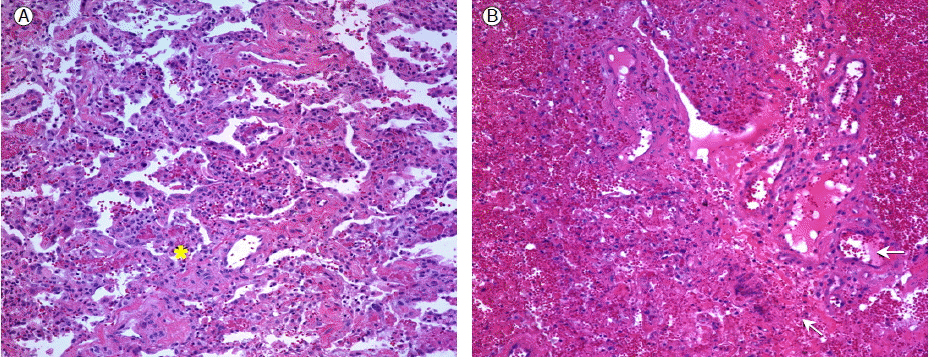
Photomicrograph of wedge resected lung. (A) diffuse alveolar damage with hyaline membranes (*). (B) pulmonary infarction with lung parenchyma undergoing coagulative necrosis (↖) and surrounded by hemorrhage, and a pulmonary artery virtually occluded by an organizing thrombus (←) (H&E, × 200).
이 결과를 확인 후 폐경색의 원인 규명을 위해 본원에서 흉부 컴퓨터 단층촬영(pulmonary thromboembolism protocol CT)을 시행하였고 세분절(subsegmental) 폐동맥 부위의 혈전이 확인되었다(Fig. 4).
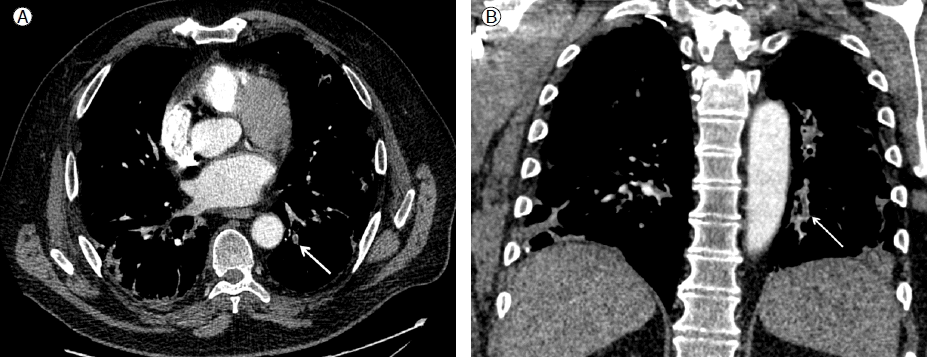
Chest CT after 10 days shows a filling defect in the posterolateral trunk of the left lower lobar artery (↖). Also, note parenchymal opacities.
당시 시행한 하지 초음파 검사에서 심부 정맥 혈전은 없었고 암표지자 검사에서는 CEA 2.4 ng/mL, PSA 1.0 ng/mL, AFP 1 ng/mL, CA 19-9 10 U/mL로 정상 소견임을 확인하였다.
이 소견을 종합하여 환자의 폐 환기 급성 악화가 미만성 폐포 손상, 세분절 폐동맥 혈전에 의한 폐경색에 의한 것으로 여기고 항응고제(Enoxaparin 1 mg/kg q12 hr) 주입을 시작하였다. 환자는 항응고제 사용 다음날부터 폐 환기와 흉부단순방사선 병변의 호전을 보였다. 이후 계속하여 급격한 호전추세 보여 정주 스테로이드 사용 7일째, 항응고제 사용 6일째에 기계 호흡을 제거할 수 있었다.
저자들은 환자의 폐병변의 원인으로 감염을 완전히 배제할 수 없었기에 본원 전원 시부터 기계호흡 제거 시까지 광범위 항생제 Imipenem/Cilastatin 500 mg q6 hr, Vancomycin 1 g q12 hr를 사용하였다.
기계 호흡 제거 후 혈전 생성의 다른 가능한 원인에 대하여 추가적인 검사 시행하려 하였으나 환자의 자국에서 검사하기를 원하여 본원에서 퇴원하여 환자의 자국으로 이송되었다.
고 찰
이 증례의 환자는 흉부 증상과 영상 소견으로 폐렴으로 진단되어 치료 받는 중 급격한 악화 경과를 보이다가 폐경색으로 진단되어 항응고제 사용한 후에야 급격한 호전을 보였다.
폐경색은 여러 원인에 의한 폐동맥 폐색의 결과로 대부분의 경우 적절한 항응고제 치료에 반응을 잘하며 호전 경과를 보이나 그 진단과 치료가 지연되면 폐부전이나 우심부전을 초래하는 악성 경과를 보이기도 하는데[4] 이 증례는 이러한 경과를 잘 보여 주는 경우라 하겠다.
폐경색은 그 원인에 따라 다양한 임상양상으로 나타나기에 정확하게 진단되기가 어려운 질환으로 흉부단순방사선 검사에서도 원인에 따라 다양한 소견을 보인다. 대부분의 경우는 폐동맥 혈전색전증에 의한 것으로 흉부단순방사선 검사에서 부분적인 경결이나 쇄기 모양의 음영을 보인다[2,3].
이 증례의 환자는 처음 진단 당시 부분적인 폐경결 소견을 보여 폐렴으로 진단되었고 폐의 광범위한 부위의 다발성 경결을 보이면서 악화 소견을 보였다. 이는 폐경색의 흉부단순방사선 소견의 전형적이지 않은 소견으로 저자들은 이가 폐경색에 의한 것임을 예측하지 못하였고 수술적 조직 검사 후에야 폐경색임을 알 수 있었다.
수술적 절제로 얻은 이 환자의 폐 조직은 광범위한 부위의 폐경색 소견과 그 사이에 미만성 폐포 손상을 보이고 있었다. 저자들은 이 병리 소견을 미만성 폐포 손상이 폐경색을 일으켰다고 해석하였다.
미만성 폐포 손상으로 폐는 심한 염증상태가 되는데 염증과 응고체계는 밀접한 상관관계를 가지고 있다고 알려져 있다[5-7]. 인체 내에서 염증이 생기게 되면 인터루킨-1, 인터루킨-6, 종양 괴사 인자-α와 같은 사이토카인들이 생성되게 된다. 이러한 사이토카인들은 혈관 내피세포나 단핵구를 자극하여 조직인자(tissue factor)를 분비시켜 혈관내 응고 과정을 촉진하게 된다[5,6]. 또한 염증은 혈관내 항응고 과정을 저해하는데 이는 C-단백(protein C)의 비활성화의 결과이다. C-단백의 활성화에는 트롬빈-트롬보모둘린 합성체(thrombin- thrombomodulin complex)가 필요한데 염증에 의한 혈관벽의 손상으로 트롬보모둘린이 부족하게 되어 혈관내 항응고 작용이 감소하게 된다[6].
이러한 기전을 바탕으로 이 증례의 환자의 경우, 미만성 폐포 손상이 혈관내 응고 체계의 활성화와 항응고 체계의 비활성화를 발생시켜 세분절 폐동맥의 다발성 폐혈전이 발생하였고 이가 폐색전을 일으켜 급성 악화를 보였고 항응고제 사용 후 급격한 호전을 보였다고 결론 지을 수 있었다.
이 증례는 미만성 폐포 손상이 조직학적 소견의 근간이 되는 급성 호흡곤란증후군 환자에게 혈관내 응고가 발생[8]하게 되기에 항응고 요법이 도움이 될 수 있다는 보고[8,9]와 일치하며 C-단백 활성체가 심한 폐혈증 환자에서 혈관내 응고 활성화를 줄여 다발성 장기 손상을 줄임으로써 환자 예후를 향상시킨다는 보고[7]와 의견이 일치한다.
미만성 폐포 손상의 원인으로는 감염이 가장 흔한데[10]이 증례의 환자에서도 미생물학적 원인은 규명되지 않았지만 처음 나타났던 임상 증상을 고려하였을 때 감염이 가장 가능성이 높다 하겠다.
본 증례에서 저자들은 폐경색의 원인을 감염, 미만성 폐포 손상과 관련된 응고 항진으로 발생한 폐혈전으로 여기고 있다. 그러나 본 증례에서는 폐경색의 가능한 다른 원인에 대한 검사로 혈전 생성을 유발하는 응고장애 대한 추가 검사가 없었다. 그리고 폐경색의 원인으로 비교적 흔한 비혈전 색전증에 대하여서는 폐조직 검사상 비전형 세포를 비롯한 종양 세포가 없었다는 점과 혈청 암표지자가 정상이었다는 것은 확인하였지만 다른 숨어있는 악성종양 여부에 대한 추가적인 검사가 적극적으로 이루어지지 못했다는 점을 한계로 여길 수 있겠다.